En los programas de cribado prenatal de aneuploidías el análisis crítico de los resultados del control de calidad, entendido de forma amplia, podría ser una herramienta útil para mejorar la eficacia, sin necesidad de aumentar la complejidad o los costes en dichos programas. En el presente trabajo analizamos nuestros resultados en el periodo 2005-2011 para trisomía 21.
Material y métodoSe valoraron retrospectivamente los siguientes parámetros: cobertura, solicitudes no conformes, imprecisión y sesgo en la medición de BHCG libre y PAPP-A, evolución de las medianas de múltiplos de mediana de BHCG libre, PAPP-A y translucencia nucal, tasa de detección, tasa de falsos positivos y análisis de falsos negativos para trisomía 21. Los parámetros bioquímicos se determinaron mediante quimioluminiscencia. La estimación del riesgo se realizó mediante el software PRISCA V4.0.
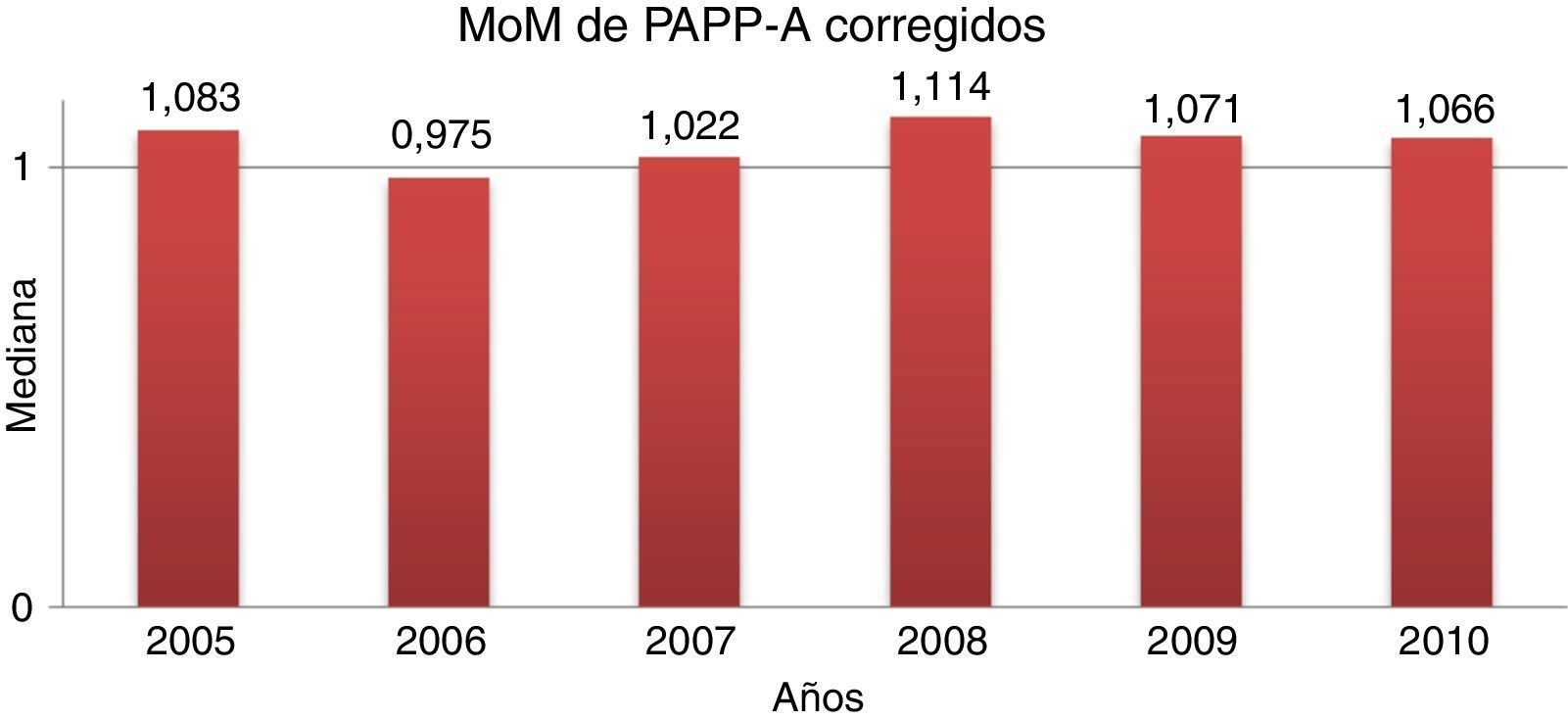
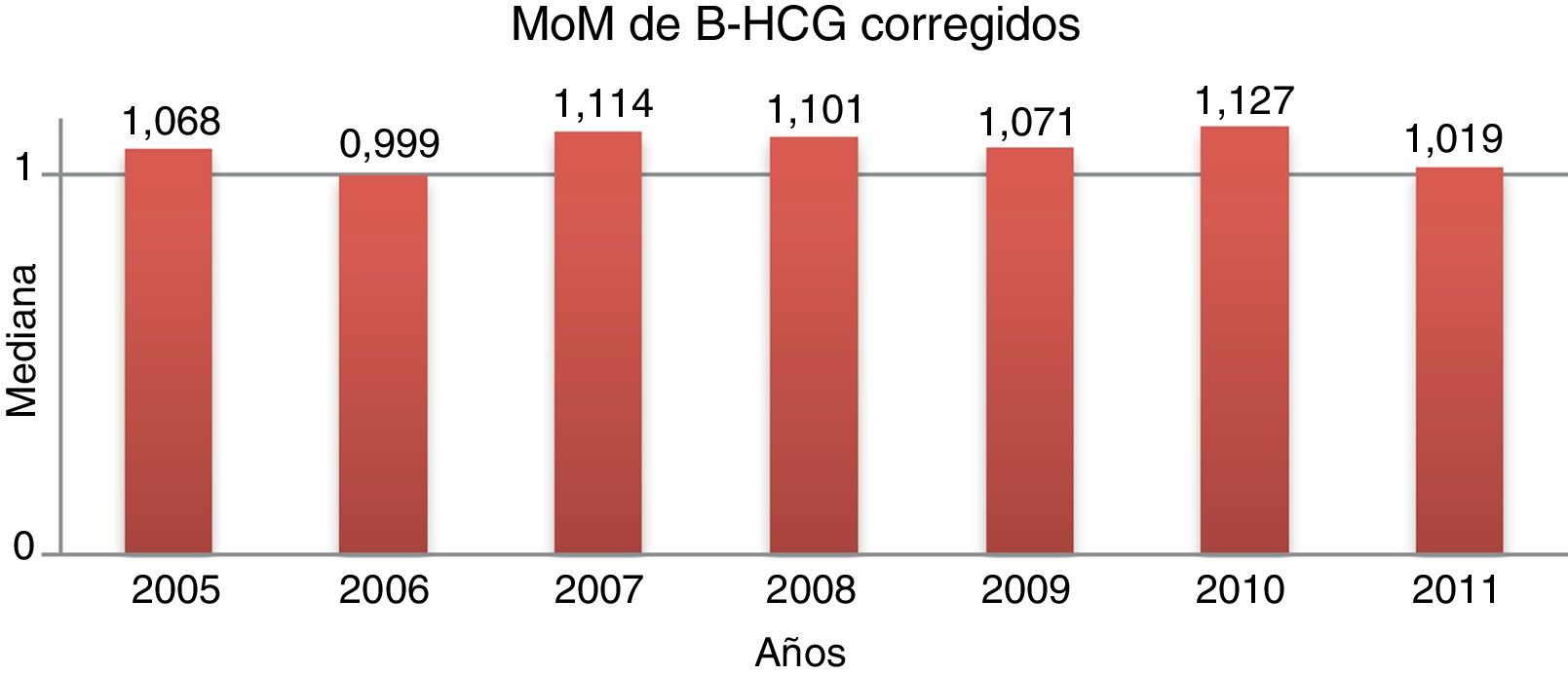
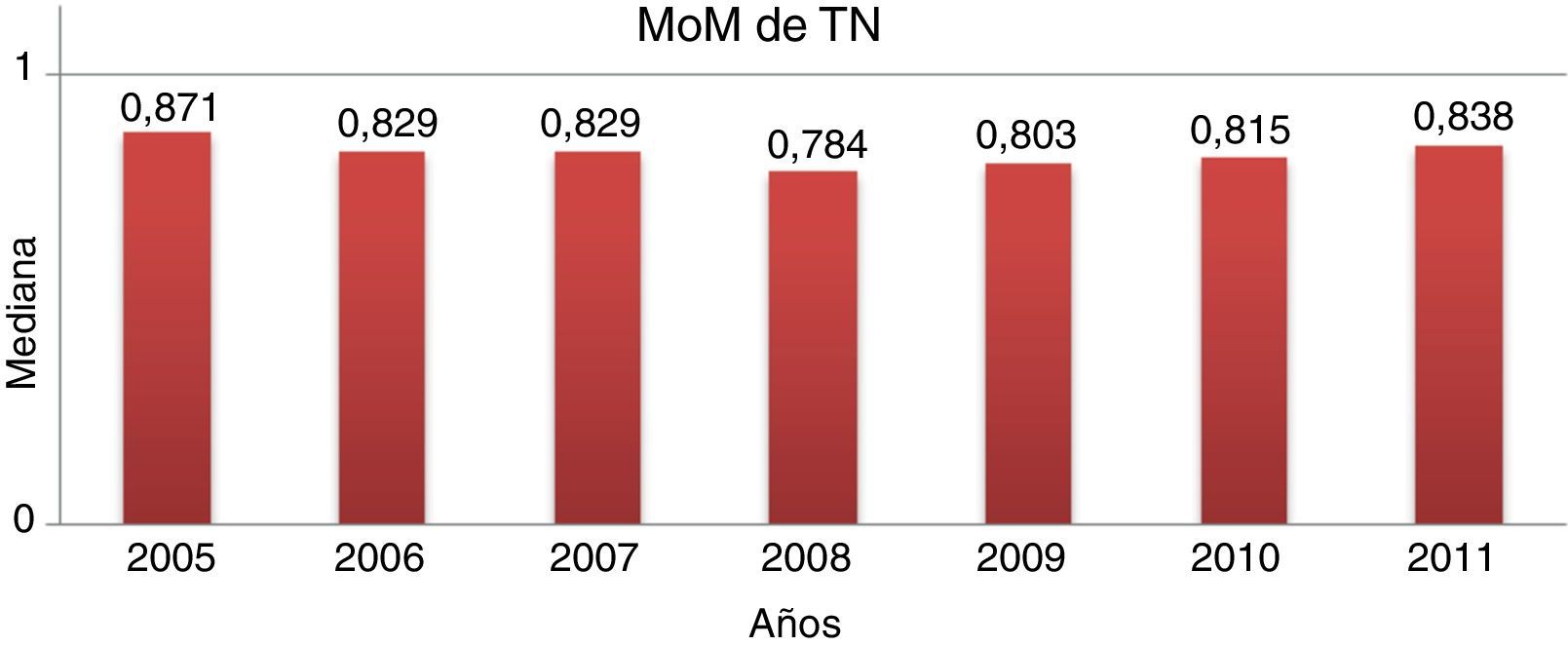
ResultadosSe realizaron 26.363 cribados. Cobertura 95,11%. No conformidades entre 12,2% (2005) y 5,8% (2010). Imprecisión inferior al 5% y sesgo inferior al 20% tanto para PAPP-A como para BHCG libre. Mediana de múltiplos de mediana corregidos de 1,066 (PAPP-A), 1,027 (BHCG libre) y 0,829 (translucencia nucal). Sensibilidad del 80% para cribado combinado de primer trimestre (4,6% falsos positivos) con 13 falsos negativos sobre 66 diagnósticos genéticos de trisomía 21. Para trisomía 18, sensibilidad del 77% (4,3% falsos positivos).
ConclusiónÁreas de mejoras detectadas: universalización del programa, gestión de solicitudes no conformes, control de calidad ecográfico, diseño del software de cálculo y valoración conjunta de los resultados finales en colaboración entre Unidades de Laboratorio y Obstetricia.
Critical analysis of the results of quality control could be a useful tool to improve efficacy without increasing complexity or costs in such programs. We analyzed the results of the prenatal screening program in Valme Hospital in order to, detect and introduce improvement areas.
Material and methodsWe have studied the non-conformities of the application received, the precision and bias in the measurement of B-HCG and PAPP-A, the medians of PAPP-A, BHCG and nuchal translucency multiples of the medians, the sensibility and false positives rate. We have studied the false negatives results. The biochemical parameters were determined by a chemiluminiscence inmunoassay. Risks estimation was performed using PRISCA V4.0 software.
ResultsA total of 26,363 prenatal screening were performed. The program reached a coverage of 95,11%. Non-conformities fell from the 12.2 to 5.8%. Imprecision was less than 5% and bias less than 20% for biochemical markers. The corrected medians for PAPP-A, BHCG and nuchal translucency multiples of the medians were 1.066, 1.027 and 0,829, respectively. The sensibility for the first trimester combined screening was 80% (4,6% false positive) for Down's syndrome for a total 66 chromosomal abnormalities diagnosed. We recorded a total of 13 false negatives for trisomy 21. For trysomy 18 detection rate was 77% (4.3% false positive).
ConclusionAreas for improvement identified were: universalization of the program, non-conformities of the received application management, ultrasound quality control, design of risk calculation software and joint evaluation of the final results in collaboration between laboratory and obstetrics units.
En el área hospitalaria de Valme (Sevilla) está implantado, desde el año 2005, un programa de cribado prenatal de cromosomopatías. El objetivo del presente trabajo es analizar los resultados obtenidos en el período 2005-2011 para el cribado del síndrome de Down como aneuploidía más prevalente y, desde dicho análisis, detectar áreas que permitan la mejora del programa.
Los esfuerzos para mejorar la calidad de los programas de cribado prenatal han consistido, históricamente, en la búsqueda de nuevos marcadores bioquímicos y ecográficos o en la implementación de nuevas estrategias de cribado (integrado, contingente…)1. Esto ha conducido a una complejidad y coste crecientes. En nuestro medio existe un amplio consenso sobre la estrategia de cribado a utilizar, siendo el cribado combinado de primer trimestre el más utilizado2,3. En la situación actual de limitación de recursos disponibles, las oportunidades de mejora deben consistir, según nuestro criterio, en mejorar lo que ya hacemos, para lo cual se dispone de 2 herramientas: optimizar la organización de nuestros programas e implementar, desde el análisis de resultados, mejoras en el control de calidad.
Con respecto a la primera herramienta, cabe señalar que después de unos años en los que la puesta en marcha de los programas se ha efectuado de una manera atomizada y algo autodidacta, en los últimos años se tiende a un modelo centralizado o, cuando menos, a una cierta homogenización en el ámbito de cada comunidad autónoma (unificación del software para el cálculo de riesgo y del equipamiento del laboratorio para la determinación de los marcadores bioquímicos). El papel de los laboratorios clínicos dentro de estos modelos es variado, desde unidades que se limitan a realizar las determinaciones bioquímicas, transfiriendo dichos resultados al software de cálculo de riesgo correspondiente (gestionando el programa como tal desde las unidades de Obstetricia), hasta laboratorios que realizan una gestión integrada de todo el proceso. En el área hospitalaria de Valme la gestión integrada se lleva a cabo desde el laboratorio y el programa de cribado se encuentra en fase de integración en el Programa Andaluz para el Cribado de Anomalías Congénitas (PACAC).
Sobre el segundo elemento (control de calidad), se debe ir más allá de un control de calidad interno y externo para los marcadores bioquímicos y de garantizar lo reflejado en la bibliografía respecto a la tasa de detección y tasa de falsos positivos para los resultados finales del programa4. Se deben introducir nuevos objetivos de calidad en fases preanalítica y posanalítica que afecten a conceptos como el grado de implantación del programa, satisfacción de las usuarias, gestión de incidencias, control de calidad ecográfico, gestión adecuada de los resultados genéticos…
Material y métodosDescripción del programaTest combinado de primer trimestre descentralizado en 2 pasos, realizado bajo consentimiento informado, con determinación de fracción beta libre de la gonadotropina coriónica humana (BHCG) y de proteína plasmática a asociada al embarazo (PAPP-A) entre la semana 8 y 12+6 (datado por fecha de última regla) y ecografía entre las semanas 10+4 y 14+2 para datar la gestación mediante la longitud craneocaudal y medición de la translucencia nucal (TN). En aquellos casos en los que no se pudo aplicar el cribado combinado de 1.er trimestre se efectuó como alternativa un cribado bioquímico de 2.° trimestre entre la semana 14 y 17+6 mediante la determinación de alfafetoproteína y BHCG.
Determinación de marcadores bioquímicosLas muestras de suero proceden de los 23 puntos periféricos de extracción así como del área de extracciones del laboratorio. Todas las determinaciones se realizan en un analizador IMMULITE 2000 (Siemens) mediante un inmunoanálisis quimioluminiscente en fase sólida.
Biometría fetalSe efectúa en 9 centros de salud del área sanitaria que disponen de consulta especializada de Obstetricia, así como en las consultas externas del hospital. La medición de la longitud craneocaudal y TN se realiza según las normas de la Fetal Medicine Foundation5. Los ecografistas responsables de la Unidad de Diagnóstico Prenatal recibieron formación específica mediante cursos organizados por dicha institución. Los ecógrafos utilizados para la valoración ecográfica han sido Toshiba Famio (Toshiba Medical Systems Corporation) y Sonoline Adara (Siemens Medical).
Cálculo de riesgoMediante el software PRISCA V4.0 (TYPOLOG). El punto de corte utilizado es 1/270 para trisomía 21 y 1/100 para la trisomía 18, estos puntos fueron los inicialmente recomendados por el proveedor del software. El programa de cálculo no está diseñado para estimar el riesgo de otras aneuploidías. En nuestro programa no consideramos la edad materna como un criterio independiente para indicar una técnica diagnóstica invasiva.
Análisis de resultadosSe ha considerado el período comprendido entre enero de 2005 y diciembre de 2011. Se calculó la tasa de detección y la tasa de falsos positivos a partir del módulo de estadísticas del PRISCA V4.0, para lo cual se han considerado los diagnósticos genéticos a partir de técnicas invasivas practicadas, así como a partir de los recién nacidos con sospecha clínica de aneuploidía. Dichos estudios genéticos han sido realizados por un laboratorio externo.
Control de calidadEn fase preanalítica se han estudiado todas las no conformidades de las solicitudes recibidas a partir de las incidencias registradas y codificadas en el SIL (Omega 3000 Roche Diagnostics). En la fase analítica se han considerado los resultados del control de calidad interno. Se utilizaron controles comerciales proporcionados por Siemens para PAPP-A y BHCG. Se ha valorado la imprecisión expresada como coeficiente de variación. Como control de calidad externo se recogen los resultados del programa auspiciado por United Kingdom National External Quality Assesment Service (UKNQAS). En el mismo la inexactitud de las medidas se expresa como % de BIAS. Este programa permite comparar los resultados con más de 390 laboratorios tanto para las concentraciones de PAPP-A y BHCG como para los múltiplos de las medianas (MoM) de ambas magnitudes. En fase posanalítica se ha procedido a estudiar medianas globales de los MoM corregidas de PAPP-A y BHCG así como la evolución anual de las mismas. Para el control de calidad de la biometría fetal se ha calculado la mediana de los MoM de las TN anuales. Los cálculos de las medianas de los MoM se han efectuado utilizando el módulo estadístico de PRISCA V4.0.
ResultadosCoberturaEl cribado de cromosomopatías se ofreció al 95,11% de las gestantes. Se realizó un test combinado en el primer trimestre en el 86,85% de gestantes a las que se les ofertó el programa y un cribado bioquímico de segundo trimestre en el 6,72%. El 6,43% de las gestantes no se integraron en el proceso de cribado.
IncidenciasEl porcentaje de solicitudes no conformes evolucionó del 12,2% en el año 2006 al 5,8% en el año 2010. Las causas de las no conformidades fueron: 41% extracción no realizada o muestra no adecuada, 30% analítica o ecografía fuera de plazo, 22% falta de datos esenciales en la solicitud, 7% otros motivos (espécimen no adecuado, muestras duplicadas, petición anulada por el solicitante...).
Control de calidad internoLos coeficientes de variación obtenidos fueron, en el caso de PAPP-A, de 3,14% para el nivel 1 y de 4,44% para el nivel 2. Para BHCG oscilaron entre el 4,13 y el 4,63 según el nivel.
Control de calidad externoDe los 288 datos sobre BIAS remitidos por el organizador del programa, el 93,75% cumplían las especificaciones de calidad (BIAS inferior al 20%). El 6,25% que no cumplían dichas especificaciones se correspondían en todos los casos con la magnitud MoM de PAPP-A. El 100% de los datos para el resto de las magnitudes (concentración de PAPP-A, concentración de BHCG, MoM de BHCG) presentaban un BIAS inferior al 20%.
Control de los múltiplos de medianaLa mediana de MoM corregidos fueron 1,066, 1,027 y 0,829 para PAPP-A, BHCG y TN, respectivamente. La evolución anual en el periodo de estudio se muestra en las figuras 1–3.
Cromosomopatías diagnosticadasSe diagnosticaron 66 trisomías 21 y 17 trisomías 18. Los resultados del programa de cribado (cribado combinado de 1.er trimestre o cribado bioquímico de 2.° trimestre) se resumen en las tablas 1 y 2 respectivamente.
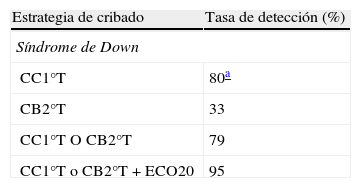
Tasas de detecciónSe efectuaron un total de 26.363 cribados, de los cuales en 24.841 se aplicó cribado combinado de 1.er trimestre y en 1.522, cribado bioquímico de 2.° trimestre. Hemos podido registrar el resultado final de la gestación en el 93% de las mismas. La tasa de detección del test combinado de 1.er trimestre para síndrome de Down fue del 80% con una tasa de falsos positivos del 4,6% (tabla 3). Para trisomía 18 la tasa de detección fue del 77% con una tasa de falsos positivos del 4,3%.
Tasa de detección para síndrome de Down en las distintas estrategias de cribado
| Estrategia de cribado | Tasa de detección (%) |
| Síndrome de Down | |
| CC1°T | 80a |
| CB2°T | 33 |
| CC1°T O CB2°T | 79 |
| CC1°T o CB2°T + ECO20 | 95 |
CB2°T: cribado bioquímico de 2.° trimestre; CC1°T: cribado combinado de 1.er trimestre; ECO20: ecografía morfológica de las 20 semanas.
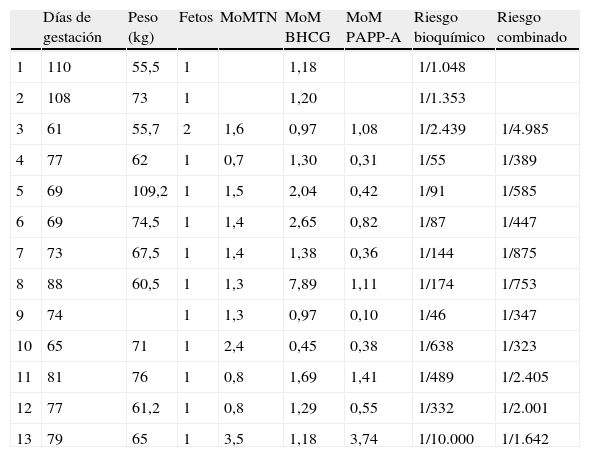
La tabla 4 muestra el análisis de los 13 resultados falsos negativos para la trisomía 21.
Análisis de los resultados falsos negativos para la trisomía 21
| Días de gestación | Peso (kg) | Fetos | MoMTN | MoM BHCG | MoM PAPP-A | Riesgo bioquímico | Riesgo combinado | |
| 1 | 110 | 55,5 | 1 | 1,18 | 1/1.048 | |||
| 2 | 108 | 73 | 1 | 1,20 | 1/1.353 | |||
| 3 | 61 | 55,7 | 2 | 1,6 | 0,97 | 1,08 | 1/2.439 | 1/4.985 |
| 4 | 77 | 62 | 1 | 0,7 | 1,30 | 0,31 | 1/55 | 1/389 |
| 5 | 69 | 109,2 | 1 | 1,5 | 2,04 | 0,42 | 1/91 | 1/585 |
| 6 | 69 | 74,5 | 1 | 1,4 | 2,65 | 0,82 | 1/87 | 1/447 |
| 7 | 73 | 67,5 | 1 | 1,4 | 1,38 | 0,36 | 1/144 | 1/875 |
| 8 | 88 | 60,5 | 1 | 1,3 | 7,89 | 1,11 | 1/174 | 1/753 |
| 9 | 74 | 1 | 1,3 | 0,97 | 0,10 | 1/46 | 1/347 | |
| 10 | 65 | 71 | 1 | 2,4 | 0,45 | 0,38 | 1/638 | 1/323 |
| 11 | 81 | 76 | 1 | 0,8 | 1,69 | 1,41 | 1/489 | 1/2.405 |
| 12 | 77 | 61,2 | 1 | 0,8 | 1,29 | 0,55 | 1/332 | 1/2.001 |
| 13 | 79 | 65 | 1 | 3,5 | 1,18 | 3,74 | 1/10.000 | 1/1.642 |
Los casos 1 y 2 se corresponden con cribados bioquímicos de 2.° trimestre.
Los MoM indicados son corregidos.
El abordaje del control de calidad del cribado prenatal de aneuploidías debe realizarse englobando todas las variables que intervienen en el proceso con objeto de garantizar unos resultados adecuados6.
Un objetivo esencial de todo programa de cribado prenatal es asegurar la equidad en el acceso de todas las gestantes5. Conocer el grado de implantación es una herramienta imprescindible para valorar la calidad del programa y lograr la universalización del mismo7. Con frecuencia observamos resultados de programas universales de cribado en los que no se informa de este dato.
La gestión de incidencias es un aspecto importante para la mejora de la calidad. En primer lugar, la falta de datos esenciales (edad materna, edad gestacional…) imposibilita el cálculo del riesgo y la carencia de otros que modifican la concentración sérica de los marcadores bioquímicos (peso materno, diabetes, etnia, hábito tabáquico…) repercute directamente sobre su cálculo4. En nuestra área sanitaria, aproximadamente el 20% de la población gestante supera los 80kg de peso. En estos casos, el riesgo combinado calculado puede modificarse hasta en un 50%, dependiendo de que conozcamos o no este dato. Es evidente la importancia de este hecho en la correcta clasificación de las gestantes si estamos en riesgos cercanos al punto de corte. En segundo lugar, una adecuada gestión de incidencias es esencial para minimizar el número de gestantes que quedan sin cribar como consecuencia de la determinación de marcadores bioquímicos o ecográficos fuera de los plazos adecuados u otras causas de no conformidad en la solicitud. El software desarrollado para el cálculo del riesgo debe estar dotado de sistemas que alerten de estas incidencias (campos obligatorios, comprobación automática de plazos al datar ecográficamente la gestación…). Además, en nuestra experiencia, es necesario definir claramente quién debe realizar la gestión de incidencias y hacer una monitorización continua de las mismas. En la bibliografía consultada, no se recogen datos respecto a la gestión de incidencias. En nuestro caso hemos implementado la centralización de la gestión en el Laboratorio y en la Unidad de Diagnóstico Prenatal, se ha establecido una revisión continua del flujo de trabajo y se han impartido cursos de formación al personal implicado en el proceso tanto en Atención Primaria como en especializada.
En cuanto al control de la precisión en la medición de las magnitudes bioquímicas, podemos afirmar que la mayoría de los reactivos disponibles permiten alcanzar el objetivo de calidad (imprecisión interdía con un CV inferior al 5%)6. Además, pequeñas diferencias en el grado de precisión de las mediciones no repercuten de manera significativa en el cálculo del riesgo.
Sobre nuestra experiencia de participación en el programa de control de calidad externo, queremos destacar la enorme dispersión de los datos remitidos por los participantes. Dicha dispersión depende de los distintos métodos empleados y de la falta de un material de referencia único. Un cambio de metodología en nuestro laboratorio obligaría a establecer nuevas medianas, así como a recalcular los factores de corrección y parámetros poblaciones, si estos son propios.
Clásicamente, el control de las medianas es la herramienta fundamental para garantizar la calidad4,6,8. Debemos insistir en la importancia de utilizar medianas que sean propias y consistentes (calculadas al menos con 100 muestras) especialmente en las semanas centrales del programa (novena y décima semanas de gestación) donde se concentran la mayoría de las solicitudes9. Es importante llevar a cabo un control mensual de las medianas de los MoM de los marcadores bioquímicos para detectar desviaciones relevantes (sostenidas en el tiempo y con repercusión en los resultados finales). Como ya indicamos, debemos reevaluar las medianas cuando se produzcan cambios metodológicos. En nuestro laboratorio, un cambio en el patrón respecto al que estaban referenciados nuestros calibradores de PAPP-A obligó a utilizar las medianas proporcionadas por el proveedor durante un trimestre, generando un descenso significativo en la mediana de los MoM y un aumento de la tasa de falsos positivos, que se incrementó de un trimestre a otro de 5,74 a 9,94%. En dicho trimestre se sobreofertaron 40 técnicas invasivas. Esta desviación observada nos llevó a recalcular medianas propias para dicho marcador cuando se dispuso de un número suficiente de datos.
Asegurar la fiabilidad en la medición de la TN es especialmente importante por ser el marcador con más peso en el cálculo del riesgo4,6,10. Nuestras medianas de los MoM de TN muestran una tendencia constante a situarse un 10-20% por debajo de la unidad. Para corregir esta desviación, se puede optar por la sustitución de las medianas por otras que se asemejen más a las obtenidas en nuestro programa y que estén refrendadas por la bibliografía. Hay otros autores que defienden el cálculo de medianas propias para el centro, como se hace con los marcadores bioquímicos, o incluso para cada ecografista11. En nuestro caso, optamos por utilizar las medianas de TN para cada edad gestacional propuestas por Nicolaides12 en lugar de las propuestas por Spencer13 que eran las implementadas en nuestro software. A pesar de ello, seguimos observando una clara tendencia a la infravaloración de la TN. Nuestra opinión es que hay que garantizar la adecuada medición de la TN, para lo cual es necesario, además de la certificación de los ecografistas, disponer del tiempo y de los medios adecuados (ecógrafos de alta resolución), así como implementar nuevas medidas de control de calidad para las mediciones ecográficas. En este contexto surge la aplicación en el control ecográfico de herramientas ya utilizadas en el ámbito del laboratorio. Las gráficas cumulative sum control chart (CUSUM) permiten una monitorización continua e individual de cada ecografista con objeto de detectar la tendencia a desviaciones sistemáticas, positivas o negativas, en sus mediciones14.
El resultado final de la gestación es el gold standard para evaluar la calidad del cribado prenatal efectuado4,6. Una tasa de detección superior al 80% para una tasa de falsos positivos inferior al 5% es lo descrito por la bibliografía para el cribado combinado de primer trimestre1,15–17. Pero conocer este dato no siempre es fácil. Se requiere la existencia de una correcta comunicación entre las unidades que participan en el proceso (Laboratorio, Genética, Obstetricia, Pediatría) y, a ser posible, un buen sistema de registro de la información a nivel hospitalario. La omisión del porcentaje de gestaciones cerradas sesga la información que se da sobre la tasa de detección de un determinado programa.
El análisis de nuestros falsos negativos nos lleva a 3 reflexiones. La primera es la baja tasa de detección del cribado bioquímico en el segundo trimestre. Este hecho puede estar sesgado por el bajo número de afectos, 3 en concreto, a los que se ha realizado este tipo de cribado. En nuestro caso efectuamos un doble cribado. Las alternativas para mejorar los resultados pasarían por implementar un triple o cuádruple test o complementar el cribado bioquímico con la inclusión del sonograma genético18,19. En segundo lugar, la complejidad en el tratamiento por el programa de las gestaciones múltiples. Uno de los 13 falsos negativos corresponde a un embarazo gemelar. En tercer lugar, en los falsos negativos con gestación única y cribado combinado de primer trimestre, observamos que en un porcentaje significativo (60%), el riesgo bioquímico resultó mayor a 1/270 y en otros casos (30%) se situó cercano a dicho punto de corte. Aunque es cierto que no se debe realizar una interpretación separada de la información que aportan los marcadores bioquímicos y ecográficos, el análisis de los resultados invita a reflexionar sobre la importancia de mejorar la calidad de la biometría fetal (CRL y TN)10 ya que el primero condiciona la datación de la gestación y, por tanto, todo el proceso de cálculo posterior, y el segundo es el marcador de mayor peso en la estimación del riesgo. Igualmente, debemos tener en cuenta que en ciertos casos los resultados individuales de algunos marcadores (bioquímicos o ecográficos) pueden ser de utilidad a la hora de ofertar una técnica diagnóstica, aunque el riesgo combinado fuese negativo. En este sentido hay que señalar la importancia de la ecografía morfológica de las 20 semanas, que permite el aumento significativo de la tasa de detección del conjunto del programa.
Aunque no han sido objeto de este trabajo, nos parece interesante señalar que distintas publicaciones inciden en la importancia del diseño del motor de cálculo20. La utilización de parámetros poblacionales adecuados y, a ser posible, propios y unos puntos de truncado correctos pueden mejorar la calidad de nuestros resultados.
Como consideraciones finales, cabe indicar que la calidad de estos programas no debe valorarse solamente por la precisión y exactitud de las mediciones de las magnitudes utilizadas ni por el cumplimiento de unos estándares de calidad en el resultado final (tasa de detección, tasa de falsos positivos…). Es necesario dar valor a otros aspectos como el nivel de acceso de las mujeres al programa, la correcta gestión de incidencias, el grado de satisfacción de gestantes y profesionales… En este contexto, el papel del Laboratorio debe ser central, como coordinador de estos programas en estrecha colaboración con las Unidades de Obstetricia y con los profesionales de Atención Primaria.
Conflicto de interesesEl primer autor del manuscrito, en su nombre y en el de todos los autores firmantes, declara que no existe ningún conflicto de intereses relacionado con el artículo.