La presencia de anticuerpos anti-ENA precede con frecuencia al inicio de la enfermedad y al establecimiento de un diagnóstico, lo que conlleva la solicitud reiterada del perfil autoinmune. Los patrones de ENA a menudo no se modifican, por lo que su repetición no proporciona información clínica relevante y genera un consumo inefectivo. Nuestro objetivo fue establecer un intervalo mínimo de repetición por debajo del cual la repetición del estudio no sería procedente.
Material y métodosEstudio retrospectivo de todas las muestras con resultado para ENA comprendidas entre diciembre de 2005 y diciembre de 2008. Se incluyeron en el estudio todos los pacientes con más de un resultado. Todos ellos fueron remitidos desde atención especializada. Se analizó para cada paciente el cambio en el perfil de ENA y se calculó la probabilidad de cambio del patrón en un intervalo de tiempo mediante un análisis de supervivencia de Kaplan y Meier.
ResultadosNo habrá cambio en el patrón de ENA con una probabilidad del 75% en un intervalo de 10 meses, con un 80% en 8 meses, con un 85% en 6 meses, con un 91% en 4 meses y con un 96% en 2 meses.
ConclusionesEl tiempo mínimo para la reevaluación del perfil de ENA no debe ser inferior a 82 d (probabilidad de cambio del patrón de ENA del 5%) en ausencia de otros datos clínicos que lo sugieran. Cada centro debería fijar un intervalo de tiempo mínimo de repetición entre 2 y 10 meses (probabilidades de cambio del patrón de ENA entre el 4 y el 25%).
The presence of anti-ENA antibodies often precedes the onset of disease and the establishment of a diagnosis. This leads to a repeat request of the autoimmune profile of the patient. ENA patterns often do not change and their repetition does not provide relevant clinical information and leads to ineffective testing. Our objective was to establish a minimum time below which the repetition of anti-ENA patterns would not be appropriate.
Material and methodsA retrospective study was conducted on all the samples with an ENA result between December 2005 and December 2008. The study included all patients with more than one result. All of them were referred from specialist care. The change in the profile of ENA was studied in each patient, and the probability of change in the ENA pattern over a time interval was calculated using the Kaplan and Meier analysis of survival.
ResultsThe results showed a probability of 75% that there would be no change with 10 months as a minimum time to repetition, 80% with 8 months, 85% with 6 months, 91% with 4 months, and 96% with 2 months.
ConclusionsThe minimum time to repeat the ENA study should not be less than 82 days (5% probability of a changing ENA pattern) in the absence of new clinical symptoms. Each center should set an interval of repetition between 2 and 10 months (4% and 25% probability of changing ENA pattern, respectively).
La respuesta autoinmune humoral es una manifestación común de las enfermedades reumáticas del tejido conectivo (ETC). Debido a la diversidad en los síntomas clínicos con que se manifiestan la solicitud del estudio de anticuerpos antinucleares (ANA) suele incluirse en el diagnóstico diferencial inicial1–4.
Dado que existe un perfil característico de ANA asociado con la mayoría de ETC la identificación de los autoanticuerpos contra antígenos extraíbles del núcleo (ENA) y otras especificidades antigénicas nucleares puede proporcionar datos muy valiosos para el establecimiento del diagnóstico. Así, anti-dsDNA y anti-Sm se asocian con el lupus eritematoso sistémico (LES), el anti-Scl70 y el anticentrómero con esclerosis sistémica (difusa y enfermedad cutánea limitada, respectivamente) y el anti-Jo-1 con polimiositis. Los anticuerpos anti-SSA y anti-SSB tienen un espectro más amplio de asociación, incluyendo el síndrome de Sjögren (SS), el LES y el lupus cutáneo, la esclerodermia y la artritis reumatoide (AR). Los anti-RNP se han asociado con la enfermedad mixta del tejido conectivo (EMTC) pero pueden encontrarse en otras ETC1. Las personas sanas y los pacientes con afecciones no reumáticas como la enfermedad hepática crónica, tumores o infecciones activas pueden presentar autoanticuerpos pero generalmente a títulos menores que los detectados en las ETC1,5,6.
La presencia de autoanticuerpos precede con frecuencia al inicio de los síntomas clínicos1, pudiendo detectarse antes de la aparición de manifestaciones clínicas y del establecimiento de un diagnóstico definitivo7, lo que induce a la solicitud reiterada del perfil autoinmune. Estas repeticiones pueden ser solicitadas por los clínicos o generarse desde el laboratorio por el seguimiento de un protocolo de trabajo.
La mayoría de pruebas autoinmunes cambian poco en el tiempo8, por lo que la repetición del perfil de ENA podría no proporcionar información clínica relevante y generar, por tanto, un consumo inefectivo de recursos.
El objetivo de este estudio fue evaluar si se producen cambios en el patrón de ENA en una serie temporal de pacientes para establecer un tiempo mínimo por debajo del cual la repetición del análisis no sería procedente en ausencia de otros datos clínicos o de laboratorio que lo justifiquen como la aparición de sintomatología nueva en el paciente o un cambio significativo en el título o el patrón de inmunofluorescencia indirecta (IFI).
Material y métodosEstudio retrospectivo de todas las muestras con resultado para ENA comprendidas entre diciembre de 2005 y diciembre de 2008 en el Hospital Universitario de Fuenlabrada (Madrid). Solo se incluyeron en el estudio los pacientes con más de un resultado (445 pacientes y 1.344 determinaciones). Todos ellos fueron remitidos desde atención especializada.
Los datos demográficos y los resultados del laboratorio se obtuvieron del sistema informático del servicio (Servolab).
Se analizó para cada paciente el cambio en el perfil de ENA y se calculó la probabilidad de cambio del patrón en un intervalo de tiempo.
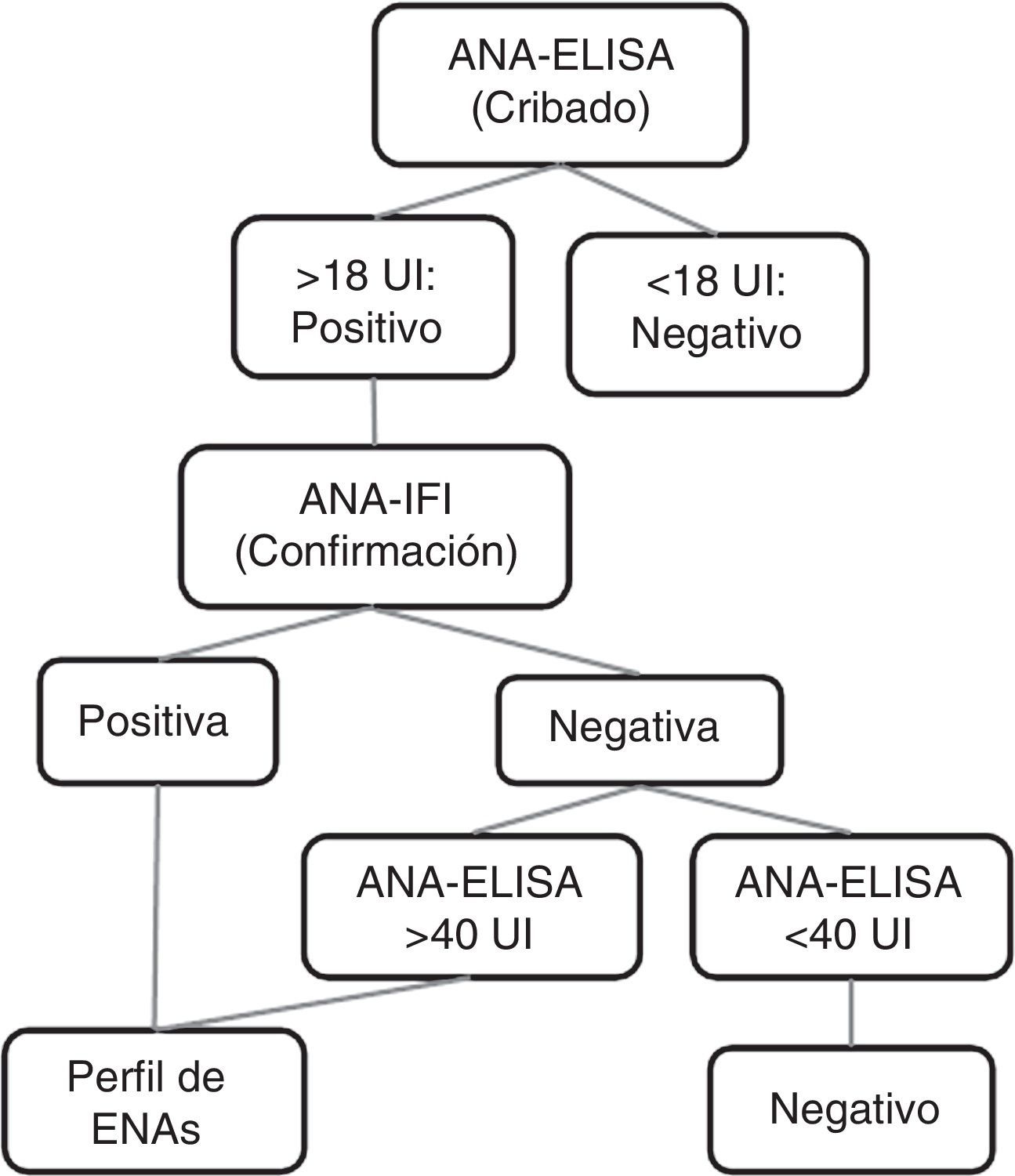
Protocolo de trabajoPara la detección de ANA se suele emplear una cascada de pruebas diagnósticas. En nuestro hospital se emplea el siguiente protocolo de trabajo: el cribado de ANA se realiza con ELISA y los valores > 18 UI se confirman con IFI sobre células HEp-2. Se informan el título y el patrón y se realiza un estudio de ENA en aquellas muestras que son positivas a un título ≥ 1/80. Los ensayos ELISA para el cribado de ANA emplean extractos nucleares de células HEp-2. Se han detectado casos de IFI negativa con ELISA muy positivo, por lo que también se realiza un perfil de ENA a pacientes con cribado positivo > 40 UI e IFI negativa. Esta estrategia permite detectar falsos negativos por IFI para las especificidades SSA, SSB y Jo19–12 (fig. 1).
Nuestro centro dispone de la historia clínica electrónica, por lo que la solicitud de ANA y los resultados del laboratorio se consultan en la historia clínica común a todas las especialidades.
Reactivos y técnicasANA ELISA (Innova)La detección es semicuantitativa mediante un análisis de ELISA. Emplea una mezcla de antígenos de un extracto celular de HEp-2 fijados a micropocillos (cromatina, dsDNA e histonas, Sm/RNP, SSA, SSB, ScL-70, centrómero, PCA, Jo-1, M2 y proteína P-ribosomal). La realización del ensayo se llevó a cabo según las instrucciones del fabricante. La casa comercial establece el punto de corte en 20 UI con una sensibilidad y una especificidad del 89%. Nuestro laboratorio utiliza para esta técnica un punto de corte de 18 UI (usando un criterio del 10% respecto al punto de corte recomendado para aumentar la sensibilidad de la técnica).
ANA-IFI en HEp-2 (Kallestad-Bio Rad)Emplea un portaobjetos con células HEp-2 fijadas sobre su superficie. La técnica se realiza según las instrucciones del fabricante. La presencia de anticuerpos se pone de manifiesto mediante el desarrollo de fluorescencia que se mide semicuantitativamente con el título (dilución final que presenta fluorescencia) y el patrón.
ENA (EUROIMMUN. Medizinische Labordiagnostika AG)Es un inmunoensayo lineal Perfil 3 de EUROLINE que incluye antígenos RNP, Sm, SSA (Ro-60 y Ro-52), SSB, ScL-70, PM-ScL, Jo-1, CENP B, PCNA, dsDNA, nucleosomas, histonas, proteína-P ribosomal y AMA-M2. Los antígenos nucleares purificados recombinantes están unidos a líneas discretas de nylon dispuestas en una tira plástica. La realización del ensayo se llevó a cabo según las instrucciones del fabricante.
Base de datosPara cada paciente se recogió un identificador único: el sexo, la edad, la fecha de petición y los resultados del patrón de ENA referido a los siguientes anticuerpos y en el siguiente orden: SSA, SSB, Sm, RNP, Scl70, Jo1, ribosoma, histonas y centrómero. El patrón de ENA se recodificó en un solo campo, asignando un número compuesto por 0 y 1 según fuese negativo o positivo, respectivamente, el anticuerpo al que hace referencia. Por ejemplo, el código 0 implica un resultado negativo para todos los ENA y 100100000 implica positivo para SSA y RNP. En otro campo se calculó el tiempo entre analíticas consecutivas del mismo paciente. Finalmente, se codificó el cambio en el patrón de ENA, considerando «cambio» cualquier modificación del número codificado respecto al previo.
Métodos estadísticosCon el fin de determinar el tiempo mínimo que tiene que pasar entre 2 análisis de ENA se realizó un análisis de supervivencia de Kaplan Meier evaluando el tiempo entre analíticas frente a cambio/no cambio en el patrón de ENA.
ResultadosEl período estudiado incluye 3.189 pacientes (4.088 muestras). De ellos, 445 pacientes tenían más de una determinación de ENA (1.344 muestras; media: 2,7 muestras por paciente) que son el objeto de este estudio (fig. 2). Los servicios peticionarios fueron Medicina Interna (30%), Reumatología (24%), Dermatología (12%), Nefrología (11%), Digestivo (10%) y otros (12%).
La distribución por sexo fue: 341 mujeres (76,6%) y 104 hombres (23,4%). La mediana de edad fue de 47 años (rango intercuartílico: 37-58).
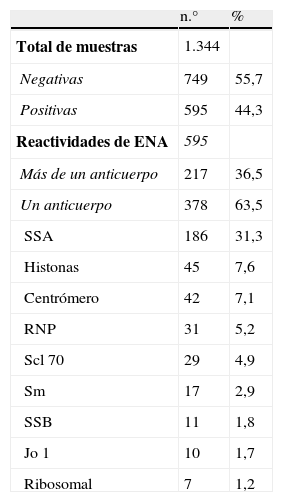
Se obtuvieron 595 muestras positivas (44,3%) para ENA. Las reactividades específicas se muestran en la tabla 1. En 217 muestras (36,5%) se identificaron múltiples reactividades (2 en un 28,9%, 3 en un 6,1% y más de 3 en un 1,5% [tabla 1]).
En 313 pacientes (70%) no se produjo variación en el patrón de ENA y 208 de estos tenían en todas las muestras ensayadas los ENA negativos.
Las peticiones se repitieron con una mediana de 147 d (rango intercuartílico: 74-232). El 31% de las repeticiones se realizaron antes de los 3 meses, el 51% antes de los 5 meses, el 60% antes de los 6 meses, el 75% antes de los 8 meses y el 85% antes de los 11 meses.
En el análisis de supervivencia de Kaplan y Meier se observó que, con un 95% de probabilidad, no habrá un cambio en el patrón de ENA cuando el tiempo entre analíticas sea menor de 82 d. Asimismo, no habrá cambio con una probabilidad del 75% cuando el intervalo sea de 10 meses, con un 80% cuando sea de 8 meses, un 85% para 6 meses, un 91% para 4 meses y un 96% para 2 meses.
DiscusiónLa presencia de autoanticuerpos precede con frecuencia al inicio de la ETC en individuos asintomáticos y así podemos detectar ENA antes de las manifestaciones clínicas y del establecimiento de un diagnóstico definitivo1.
La mayoría de las pruebas autoinmunes cambian poco en el tiempo, por lo que repetirlas en un periodo corto no tiene utilidad clínica8 y su repetición no está indicada en un periodo menor a un mes4,13,14. La sobredemanda puede deberse por parte de los clínicos a la inexperiencia, la falta de conocimientos sobre las pruebas, las rutinas de petición o el miedo a errores y por parte del laboratorio a la protocolización y la generación automática de pruebas. Como consecuencia aumenta el gasto en tiempo de trabajo y reactivos15,16.
La reevaluación clínica del paciente con sintomatología de ETC está establecida en las guías clínicas3,4 pero no así el tiempo para la repetición del estudio de ENA que, con frecuencia, se hace coincidir con la reevaluación clínica aunque no esté justificado. El objetivo del estudio ha sido establecer un tiempo mínimo por debajo del cual esta repetición no sería procedente. En este estudio consideramos «cambio» cualquier modificación en los resultados del laboratorio que en ocasiones no es relevante desde el punto de vista clínico, por lo que en la práctica el número de cambios con importancia clínica sería aún menor.
Como resultados encontramos que el tiempo mínimo para la reevaluación de un estudio de ENA es de 82 d con un 5% de error, pero este tiempo podría ampliarse asumiendo un porcentaje de error superior. Puede haber casos en los que el «cambio» se deba a mínimas variaciones en la concentración del anticuerpo y que este pase de positivo a negativo y viceversa en analíticas consecutivas. Si estos cambios no se contabilizaran podríamos asumir un error mayor y ampliar el tiempo mínimo para la reevaluación. Solo los cambios clínicos como la aparición de sintomatología nueva en el paciente o determinados datos observados en el laboratorio (como un cambio significativo en el título o el patrón de IFI) podrían justificar la repetición antes del periodo establecido.
Usando un criterio de tiempo de repetición no inferior a 3 meses en nuestro laboratorio se eliminarían un 31% de repeticiones y un 85% con un criterio de 11 meses.
En conclusión, se evidencia que la repetición sistemática de estudios de ENA no es efectiva y, por lo tanto, es improcedente. Proponemos que el tiempo mínimo para la reevaluación no debe ser inferior a 82 d (probabilidad de cambio de patrón del 5%) y que cada centro debería fijar un intervalo de tiempo mínimo de repetición en un rango comprendido entre 2 y 10 meses (probabilidades de cambio de patrón de ENA del 4 y del 25%) en ausencia de datos clínicos o del laboratorio que justifiquen una repetición en un tiempo menor y según los recursos propios y el protocolo de trabajo consensuado entre el clínico y el laboratorio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.