Diversos estudios demuestran que las velocidades de cizallamiento elevadas provocan activación plaquetaria. Sin embargo, no está descrito cómo se comportan las plaquetas activadas por cizallamiento ante estímulos posteriores. No está bien establecido si las plaquetas después de activarse por cizallamiento en el flujo sanguíneo in vivo responden más o menos a la subsiguiente acción de agonistas fisiológicos, como el ADP (adenosine diphosphate ‘difosfato de adenosina’). Ésta es la cuestión abordada en el presente estudio, en el que se remedan in vitro las condiciones del flujo sanguíneo en las arterias no estenóticas.
Material y métodosSe valora la activación plaquetaria mediante citometría de flujo. El cizallamiento se induce en un viscosímetro de cono y plato a una velocidad de 230s−1, que remeda el cizallamiento fisiológico del flujo sanguíneo en las arterias sanas. Como marcadores de activación se determinan el antígeno CD62, el complejo glucoproteínas IIb/IIIa en su forma activa y la formación de los microagregados plaquetarios (MAP).
Se valora el porcentaje de plaquetas activadas espontáneamente y el número de los MAP. Seguidamente, se valora el porcentaje de las plaquetas activadas y los MAP tras estimular con ADP. En paralelo, se sigue el mismo procedimiento, pero se somete previamente la sangre a cizallamiento durante 5min. En estas muestras cizalladas se valora el porcentaje de las plaquetas activadas y los MAP antes y después de estimular con ADP.
ResultadosEl cizallamiento, así como el ADP, aumentan el porcentaje de las plaquetas activadas en la sangre. Cuando las plaquetas cizalladas se someten ulteriormente al ADP, el porcentaje de las plaquetas que se activan resulta significativamente menor que cuando el ADP estimula directamente las plaquetas en la sangre sin cizallar.
ConclusionesLas plaquetas sometidas a cizallamiento resultan refractarias a activarse subsiguientemente por acción de los agonistas, mientras que las plaquetas no cizalladas responden adecuadamente a éste. Esta respuesta refractaria in vitro puede representar un mecanismo de defensa celular que podría evitar in vivo un mayor grado de activación y agregación cuando las plaquetas se enfrentan a un agonista fisiológico en zonas donde aumente el cizallamiento de la sangre circulante.
Several studies show that high shear rate cause platelet activation. But the behaviour of these activated platelets by shear and subsequent stimulus by, for example, ADP is not well established. This paper investigates an in vitro model of blood flow conditions in non-stenotic arteries.
Material and methodsPlatelet activation is studied by flow cytometry. The shear is induced in a cone-plate viscometer at 230s−1 that mimics the blood flow conditions in healthy arteries. CD62 and GpIIb/IIIa in their active form are selected as platelet activation markers, as well as for the formation of platelet microaggregates (MAP).
The percentage of spontaneously activated platelets and the number of MAP are determined. The percentage of activated platelets and MAP after stimulating with ADP is then evaluated. In parallel, the same procedure is followed, but after previously subjecting blood samples to a shear for 5min. In these sheared samples the percentage of activated platelets and MAP also are measured before and after stimulating with ADP.
ResultsShearing, as well as ADP, increases the percentage of activated platelets in whole blood. When the platelets are subsequently subjected to ADP, the percentage of activated platelets is significantly lower than when the ADP directly stimulates platelets without shearing.
ConclusionsPlatelets subjected to shearing become refractory when they are subsequently activated by action of a physiological agonist such as ADP. However the platelets that are not sheared respond appropriately to this agonist. This refractory response in vitro may represent a cellular defence mechanism to prevent a greater degree of in vivo activation-aggregation when platelets are faced with an agonist in areas where the shear rate increases in the blood flow.
Actualmente está bien establecido el papel de las plaquetas en la patogénesis de la aterotrombosis, proceso en el que desempeñan un papel fundamental. La activación del complejo glucoproteínas (GP) IIb/IIIa interviene en la primera fase de la agregación plaquetaria por interacción con diversos ligandos solubles, principalmente fibrinógeno y factor de von Willebrand1–3. La agregación de las plaquetas sometidas a baja velocidad de cizallamiento (0 a 1.000s−1) depende, fundamentalmente, del fibrinógeno2; en tanto que cuando se exponen a un elevado cizallamiento (1.000 a 10.000s−1) depende en mayor medida del factor von Willebrand4,5, lo que demuestra que el proceso de formación de los microagregados plaquetarios (MAP) es función de las condiciones del flujo. El proceso inicial de agregación puede conducir a la formación de los MAP y microtrombos ricos en plaquetas. La exposición de CD62 en la superficie plaquetaria estabiliza este microtrombo inicial y permite su posterior crecimiento y la formación de agregados de plaqueta y leucocito6,7. La acumulación de plaquetas activadas en el sitio de rotura de una placa aterosclerótica es el hecho patogénico clave que facilita la formación del trombo arterial. En la activación de las plaquetas, necesaria para que se produzcan estos fenómenos, intervienen numerosos factores, entre los que pueden citarse la acción de agonistas fisiológicos y la velocidad de cizallamiento (shear rate) causada por el propio flujo sanguíneo al pasar por una arteria estenótica8.
Entre los agonistas fisiológicos que actúan sobre las plaquetas, el ADP (adenosine diphosphate ‘difosfato de adenosina’) desempeña un importante papel in vivo en la hemostasia normal y en la trombosis. Aunque el ADP se considera un agonista débil, en comparación con la trombina o el colágeno, resulta un cofactor necesario para la activación de las plaquetas por parte de otros agonistas, por lo que es de gran interés valorar su acción sobre la activación de las plaquetas. Está bien establecido que esta acción, consistente fundamentalmente en inducir la formación de agregados, se ejerce fundamentalmente a través de los 2 principales receptores plaquetarios de ADP9,10.
Actualmente hay un creciente interés en la valoración de la función plaquetaria bajo diferentes condiciones de flujo. Según los diversos autores, el cizallamiento per se puede activar las plaquetas7,11,12. La mayoría de los investigadores que trabajan en este campo someten las plaquetas a elevadas velocidades de cizallamiento durante intervalos de tiempo generalmente cortos. Si los períodos de tiempo son excesivamente cortos (inferiores a 1min), las plaquetas sólo pueden formar agregados inestables, ya que en estas condiciones no llega a expresarse el CD62 en la superficie plaquetaria13. Por otro lado, cuando se cizallan durante más de 20s a velocidades de cizallamiento elevadas, las plaquetas se agregan irreversiblemente y forman microtrombos, que hacen difícil su estudio en el laboratorio. La activación y la agregación plaquetaria se intensifican cuando se mide en sangre debido a la mayor densidad celular, que facilita el contacto y el intercambio de célula a célula y a ciertos agonistas que pueden liberar los hematíes durante el proceso de cizallamiento13. En concreto, el ADP liberado por las células sanguíneas cuando se someten a fuerte cizallamiento desempeña un importante papel en la activación y en la formación de agregados plaquetarios14. Las condiciones experimentales del presente trabajo tratan de soslayar los inconvenientes indicados, por lo que se ha elegido una velocidad de cizallamiento fisiológica en las arterias sanas (230s−1), un tiempo de cizallamiento suficiente (5min) y la sangre (respuesta plaquetaria más fisiológica); en estas condiciones experimentales no se dispone de información acerca de la interacción de cizallamiento, agonista, activación y formación de los agregados plaquetarios. No está bien establecido si el cizallamiento del flujo sanguíneo actúa sinérgicamente con los agonistas fisiológicos, lo que establecería un peligroso círculo vicioso en el que en las zonas estenóticas, donde aumenta el cizallamiento del flujo, se potenciaría la activación de las plaquetas por posterior acción de un agonista. Por el contrario, si se observa que las plaquetas cizalladas en las zonas estenóticas resultaran menos activables por parte de los agonistas fisiológicos, este hecho supondría un interesante mecanismo antitrombótico fisiológico no descrito en la bibliografía científica. El objetivo del presente estudio es, pues, valorar la acción de un agonista fisiológico sobre plaquetas previamente cizalladas para comprobar si éstas se activan en mayor o en menor medida que las plaquetas sin cizallar. Esta valoración in vitro trata de remedar lo que sucede in vivo en las zonas correspondientes al flujo sanguíneo en las arterias no estenóticas.
Material y métodosLas muestras procesadas provenían de 12 voluntarios que no recibieron ningún tipo de tratamiento farmacológico con acción antiplaquetaria o antiagregante. Todos ellos provenían de la plantilla del laboratorio y se los había expuesto previamente a los protocolos clínicos y analíticos del Servicio de Medicina Preventiva del Hospital Universitario La Fe, y se clasificaron como sanos. Antes de participar en el estudio, los voluntarios dieron su consentimiento por escrito, de acuerdo con la declaración de Helsinki. Las muestras de sangre anticoagulada con citrato (129mmol/l; 9:1, por vía venosa) se obtuvieron después de un ayuno de 12h en tubos de vidrio siliconados mediante punción venosa de la vena antecubital, se evitó al máximo la estasis y se desechó el primer tubo. Dado que las plaquetas se activan fácilmente in vitro, los análisis plaquetarios se iniciaron antes de los 30min siguientes a su extracción, sin agitar, a temperatura ambiente y en tubos de polipropileno.
Métodos citométricosTanto la activación plaquetaria espontánea como la capacidad de activación debida al cizallamiento o a la acción del ADP se valoraron en un citómetro de flujo Epics XL-MCL Flow Cytometer (Beckman-Coulter, Florida, EE. UU.); éste mide la fracción de plaquetas positivas (lo que indica la activación de una subpoblación plaquetaria) de acuerdo con las recomendaciones metodológicas para los análisis citométricos15. El citómetro se preparó para registrar forward y side scatter, y para medir las intensidades de la fluorescencia de los antígenos conjugados con fluorocromo CD61-PE, CD62-FITC (Immunotech, Marseille, France) y PAC1-FITC (Becton-Dickinson, California, EE. UU.), que se recogieron como histogramas en escala logarítmica. Los anticuerpos utilizados pertenecían al mismo lote. Las muestras se analizaron por duplicado después de comprobar el alineamiento del citómetro de flujo con Immunocheck beads (Beckman-Coulter, Florida, EE. UU.).
Las micropartículas y los microagregados se distinguieron de las plaquetas en función de sus valores de forward y side scatter, que se relacionan respectivamente con el tamaño y la complejidad de la membrana celular. De acuerdo con Matzdorff16, con la utilización de muestras de voluntarios sanos, se definió arbitrariamente en función del valor forward una región que incluía el 90% de los episodios CD61 positivos. Esta región se definió como “región de las plaquetas”. Inmediatamente por debajo de ésta se estableció otra región, que incluía el 5% de los episodios CD61 positivos, que se definió como “región de micropartículas” y por encima se definió otra región que incluía el 5% de los episodios de mayor tamaño, que incluía los MAP. Los resultados de los microagregados se expresan como su número por 5.000 plaquetas analizadas.
La exposición del CD62 para estimar tanto la exposición in vivo del CD62 como la capacidad de las plaquetas de responder in vitro al ADP o al cizallamiento se valoró por medio de un método citométrico de doble color descrito previamente por este grupo17. Brevemente, consiste en lo siguiente: 10μl de sangre citratada se diluyeron en 100μl de tampón Hepes (Hepes [10mM], cloruro sódico [150mM], cloruro de potasio [5mM], sulfato de magnesio [1mM], glucosa [10mM] y pH [7,4 y 290 mOsm]). Se añadieron 5μl de CD62.FITC y 5 μl de CD61.PE. Después de mezclar cuidadosamente e incubar durante 20min en oscuridad, se añadieron 1.000μl de Hepes a cada tubo. Las muestras se evaluaron inmediatamente en el citómetro y se adquirieron 5.000 episodios CD61 positivos (plaquetas).
Para evaluar el complejo GPIIb/IIIa en su forma activa (+) mediante la utilización de un ensayo a un solo color, 10μl de sangre citratada se diluyeron en 100μl de tampón Hepes. Se añadieron 4μl del anticuerpo que reconoce el complejo GPIIb/IIIa+ (PAC1.FITC). Se añadieron 3μl de tampón (para medir las plaquetas activadas espontáneamente in vivo) o 3μl de ADP (concentración final de 2,5μM para medir las plaquetas activadas in vitro por el agonista) y se incubó durante 30min en oscuridad. A continuación se añadieron 1.000μl de tampón Hepes, las muestras se analizaron inmediatamente en el citómetro y se adquirieron 5.000 plaquetas.
Para estudiar la activación plaquetaria después de someter la sangre a cizallamiento y posterior acción del ADP, se realizaron 2 ensayos con cada muestra. En el primer ensayo se determinó el porcentaje de las plaquetas circulantes activadas espontáneamente y tras estimulación con ADP (2,5μM). En el segundo ensayo se sometió la sangre a un cizallamiento de 230s−1 durante 5min y se valoró la activación plaquetaria de esta sangre cizallada. Seguidamente se sometió esta sangre cizallada a la acción del ADP (2,5μM) y se valoró la activación plaquetaria en ésta. Con esta metodología se obtuvieron datos acerca de la expresión del CD62, del complejo GPIIb/IIIa+, y la formación de los MAP en la sangre circulante, estimulada con ADP, cizallada, y cizallada y estimulada.
La velocidad de cizallamiento de la sangre (5min a 230s−1 a temperatura ambiente) se indujo con un viscosímetro de cono y plato Brookfield DVII (Stoughton, England).
El análisis de datos se realizó mediante el programa System II software (Beckman-Coulter, Florida, EE. UU.). Los resultados se presentan como valor medio ± desviación estándar. La significación estadística de las diferencias se valoró mediante el test no paramétrico de Wilcoxon y las correlaciones se establecieron mediante los coeficientes de correlación de Pearson (SPSS for Windows Statistical Software, versión 15.0, Chicago, Illinois, EE. UU.). La significación estadística se estableció para un valor de p<0,05.
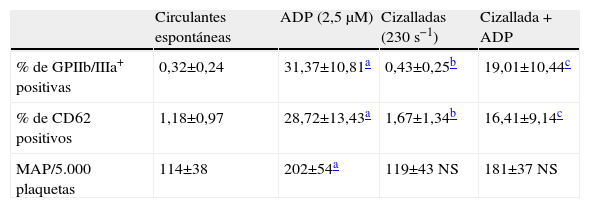
ResultadosLos resultados obtenidos se indican en las tablas 1 y 2. En la tabla 1 puede observarse que el porcentaje de las plaquetas activadas espontáneamente en la sangre circulante es del 0,32±0,24% para la expresión del complejo GPIIb/IIIa+, y del 1,18±0,97% para la exposición del CD62. El número de los microagregados formados espontáneamente en la sangre circulante es de 114±38/5.000 plaquetas. Cuando la sangre se estimula con ADP, aumentan significativamente (p<0,001) todos los marcadores de activación estudiados, que pasan a ser del 31,37±10,81% para el complejo GPIIb/IIIa+, del 28,72±13,43% para el CD62 y de 202±54/5.000 plaquetas para los MAP.
Porcentaje de plaquetas activadas (antígenos glucoproteína IIb/IIIa o CD62 positivos) y número de agregados plaquetarios formados espontáneamente, por acción del difosfato de adenosina, por cizallamiento y por cizallamiento más difosfato de adenosina
| Circulantes espontáneas | ADP (2,5μM) | Cizalladas (230s−1) | Cizallada + ADP | |
| % de GPIIb/IIIa+ positivas | 0,32±0,24 | 31,37±10,81a | 0,43±0,25b | 19,01±10,44c |
| % de CD62 positivos | 1,18±0,97 | 28,72±13,43a | 1,67±1,34b | 16,41±9,14c |
| MAP/5.000 plaquetas | 114±38 | 202±54a | 119±43 NS | 181±37 NS |
NS frente a circulantes.
ADP: difosfato de adenosina; GPIIb/IIIa+: glucoproteínas IIb/IIIa en su forma activa; MAP: microagregados plaquetarios; NS: no significativo.
NS frente a ADP.
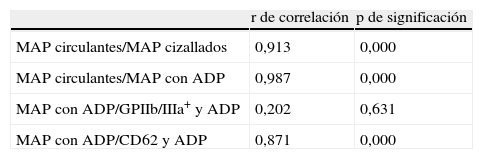
Estudio de correlaciones (test de Pearson) entre los parámetros indicados
| r de correlación | p de significación | |
| MAP circulantes/MAP cizallados | 0,913 | 0,000 |
| MAP circulantes/MAP con ADP | 0,987 | 0,000 |
| MAP con ADP/GPIIb/IIIa+ y ADP | 0,202 | 0,631 |
| MAP con ADP/CD62 y ADP | 0,871 | 0,000 |
ADP: difosfato de adenosina; GPIIb/IIIa+: glucoproteínas IIb/IIIa en su forma activa; MAP: microagregados plaquetarios.
La acción del cizallamiento aumenta significativamente (p<0,01) la expresión del complejo GPIIb/IIIa+ y del CD62, que alcanzan valores del 0,43±0,25% y del 1,67±1,34%, respectivamente. El aumento en el número de los MAP por acción del cizallamiento no alcanza significación estadística respecto a la sangre nativa. La acción del ADP sobre las plaquetas previamente cizalladas induce una menor activación que cuando este agonista actúa directamente sobre la sangre nativa (el 19,01±10,44% frente al 31,37±10,81% para la expresión del complejo GPIIb/IIIa+, y el 16,41±9,14% frente al 28,72±13,43% en el caso del CD62). No se observan cambios significativos en relación con la formación de los MAP.
En la tabla 2 se aprecia una correlación altamente significativa entre el número de los MAP formados espontáneamente y los formados in vitro por cizallamiento o por acción del agonista. La formación de los MAP por estimulación con el ADP no parece tener correlación con la expresión del complejo GPIIb/IIIa+, pero sí con la exposición del CD62 en la plaqueta activada (r=0,871; p=0,000).
DiscusiónActualmente está bien establecido que la valoración de las plaquetas activas y de su reactividad puede ser de gran interés clínico, ya que desempeñan un papel clave en la patofisiología del trombo arterial oclusivo18–20 y pueden disminuir el riesgo de hemorragia en diversas enfermedades mediante la estimulación de la hemostasia primaria y secundaria21. Entre los marcadores de activación plaquetaria más estudiados figuran la expresión del complejo GPIIb/IIIa+ y la exposición del CD62 en la superficie plaquetaria. Debido a la presencia de plaquetas activadas, se forman los MAP circulantes que pueden considerarse marcadores de activación y que son un importante factor de riesgo de trombosis22,23, por lo que su estudio puede ser de gran interés clínico. La técnica más adecuada para su valoración es la citometría de flujo de sangre, que es la utilizada para la realización del presente estudio.
Los resultados del presente trabajo indican que el cizallamiento utilizado, a pesar de su escasa entidad (230s−1), es capaz de activar las plaquetas in vitro. Otros grupos de trabajo han observado este hecho, pero cuando la velocidad de cizallamiento aplicada es elevada (1.000 a 10.000s−1), remeda la situación reológica en las arterias estenóticas7,24,25. Sin embargo, otros autores han comunicado que las plaquetas reaccionan tanto a las elevadas condiciones de cizallamiento características del flujo arterial como a las bajas condiciones propias del flujo venoso26, lo que sería congruente con lo descrito en el presente estudio.
Parece bien establecido que cuando la sangre se somete a cizallamiento, los hematíes ejercen efectos físicos y químicos sobre las plaquetas e inducen su activación y la formación de agregados27. Este efecto podría atribuirse a la hemólisis, que liberaría sustancias activadoras. Sin embargo, en estas condiciones experimentales se descartó la presencia de hemólisis, al comprobar que la concentración de lactatodeshidrogenasa en el plasma sobrenadante de la sangre cizallada no era mayor que en la sangre nativa. La activación plaquetaria observada tras el cizallamiento tampoco podría atribuirse al contacto de ésta con la superficie metálica del viscosímetro de cono y plato, potencialmente trombogénica. En efecto, al mantener las muestras de sangre durante 5min dentro del viscosímetro en reposo, no se apreció ningún cambio en la función plaquetaria ni en la formación de los MAP.
Dado que cuando la sangre se somete a cizallamiento se liberan pequeñas concentraciones de ADP28, es posible que los resultados observados se deban más bien a estas pequeñas cantidades de ADP que al propio proceso de cizallamiento. Sin embargo, esta especulación resulta discutible, ya que la concentración de ADP liberada en estas condiciones resulta demasiado pequeña como para activar las plaquetas y formar los MAP observados en este estudio.
En relación con la activación plaquetaria y con la formación de los MAP por acción del ADP, los resultados obtenidos son coherentes con los comunicados por este grupo en trabajos anteriores29 y confirman el hecho de que una misma concentración de ADP estimula en mayor medida la expresión del complejo GPIIb/IIIa+ que la del CD6217.
En el presente estudio se describe por primera vez en la literatura médica consultada que las plaquetas activadas por cizallamiento son refractarias a una posterior activación por un agonista fisiológico como el ADP. Esta observación es congruente con lo comunicado por otros autores25; según éstos, las plaquetas estimuladas previamente por un alto cizallamiento se vuelven refractarias al activarse nuevamente mediante un cizallamiento posterior.
Como conclusión, los resultados del presente estudio indican que el cizallamiento ejerce un efecto dual sobre las plaquetas. Por un lado las activa, lo que facilitaría la formación de agregados y, por otro lado, parece actuar como agente antiactivante y antiagregante al prevenir la subsiguiente activación plaquetaria por agonistas. Este mecanismo, por el que la plaqueta activada mediante cizallamiento del flujo sanguíneo resulta refractaria a su posterior estimulación por agonistas fisiológicos, puede significar un importante mecanismo de defensa contra la formación de agregados y trombos en zonas arteriales estenóticas, donde aumenta significativamente el cizallamiento.