Evaluar y comparar la estabilidad de las concentraciones de IGF-1 (insulin-like growth factor ‘factor de crecimiento similar a la insulina, tipo 1’), gastrina y androstendiona en 2 tipos de suero: uno alicuotado en un tubo secundario tras una centrifugación y otro directamente en un tubo primario con gel separador.
Material y métodosLas muestras de sangre se obtuvieron de 11 voluntarios sanos (8 mujeres, 3 varones). Los tubos se centrifugaron durante 20min y se almacenaron a 4–8°C. Las muestras se procesaron en el analizador Immulite 2000 Siemens en 8 tiempos, comprendidos entre los 90min y los 10 días. Los límites de estabilidad se establecieron por medio de la utilización de las directrices de la Sociedad Española de Química Clínica (SEQC) sobre muestras biológicas.
ResultadosLas concentraciones de IGF-1 y androstendiona permanecieron estables en los 2 tipos de suero durante los 10 días estudiados. La gastrina mostró un descenso progresivo en los valores obtenidos. Permaneció estable solamente 8h en el suero alicuotado y 48h en el tubo primario. En ningún parámetro se observaron diferencias en las concentraciones basales obtenidas entre los 2 tipos de muestra.
ConclusionesLa conservación de muestras tanto en suero alicuotado como en tubo primario con gel separador a 4°C es adecuada para el IGF-1 y la androstendiona hasta los 10 días. La gastrina es estable hasta 8h en suero alicuotado y hasta 48h en tubo primario con gel separador. Los tubos primarios con gel separador parecen adecuados para la conservación habitual de las 3 determinaciones.
To assess the stability of insuline-like growth factor-1 (IGF-1), gastrin and androstenedione in two types of serum sample: One of them aliquoted into a secondary tube after centrifugation and another one directly in a primary tube with gel separator.
Material and methodsBlood samples were obtained from 11 healthy individuals (8 female, 3 male). Tubes were centrifuged 20min and then stored at 4–8°C. Samples were processed with the Siemens Immulite 2000 analyzer at 8 different times, between 90min and 10 days. The stability limits were calculated using the SEQC guidelines regarding biological samples.
ResultsIGF-1 and androstenedione concentrations remained stable in both types of serum during the 10 days of the study. Gastrin showed a progressive decrease in the measured concentrations. It was stable only for 8h in the aliquoted serum group and for 48h in the gel separator group. No differences were found in baseline concentrations between both serum samples.
ConclusionsStorage of samples in aliquoted serum or in primary tubes with gel separator at 4°C is suitable for IGF-1 and androstenedione for up to 10 days. Gastrin was stable up to 8h in aliquoted serum and up to 48h in a primary tube with gel separator. Gel separator tubes seem to be suitable for routine storage for the three determinations.
En los últimos años se está produciendo la progresiva incorporación de las determinaciones de magnitudes hormonales a plataformas automatizadas. Esto ha propiciado grandes cambios en el procesamiento preanalítico de estas muestras, éstas incluyen su integración en los procesos preanalíticos generales del laboratorio de bioquímica. Cuando la determinación de estas magnitudes hormonales sólo era posible mediante métodos manuales (RIA [radioinmunoanálisis], IRMA [radioinmunometría] o ELISA [técnica de radioinmunoanálisis]), las muestras para determinar hormonas se extraían en tubos, con o sin anticoagulante, y el suero o plasma se separaba inmediatamente de los elementos formes y se congelaba hasta el momento del procesamiento de la muestra. Éste podía demorarse varias semanas, ya que habitualmente se procesaba cuando había un número de muestras suficiente para completar un kit. Algunas de las magnitudes que se han automatizado recientemente son el IGF-1 (insulin-like growth factor ‘factor de crecimiento similar a la insulina, tipo 1’), la gastrina y la androstendiona. Gracias a estos avances, su determinación puede realizarse mediante un inmunoanalizador automatizado y procesarse en muchas ocasiones el mismo día en que se obtiene la muestra. Es importante conocer la estabilidad de estos parámetros hormonales en el contexto de su determinación automatizada y estudiar la posibilidad de utilizar tubos primarios con gel separador, que son más practicables en plataformas automatizadas.
La estabilidad de una magnitud bioquímica se puede definir como el período de tiempo en que la magnitud mantiene su valor dentro de unos límites establecidos, conservando la muestra en la que se realiza la medición en unas condiciones especificadas1.
La realización de estudios de estabilidad en el propio laboratorio es un procedimiento que puede resultar muy laborioso y con un coste económico elevado. Por otro lado, no es fácil disponer de datos sobre la estabilidad de las diferentes magnitudes bioquímicas ya que, aunque hay numerosos trabajos publicados, hay tantas posibles variaciones de las distintas variables preanalíticas que es difícil que coincidan con las condiciones de trabajo. Además, no hay acuerdo en la literatura médica respecto a los criterios que se deben utilizar para establecer el límite de estabilidad (EST) de las muestras. Por este motivo, la Sociedad Española de Química Clínica (SEQC) elaboró una guía2 para evaluar la estabilidad de las magnitudes en las muestras biológicas humanas que permite estimar de manera protocolizada algunos factores preanalíticos. Además, formuló un protocolo sobre la base de criterios biológicos3 y metrológicos para definir el límite de variación que implique la pérdida de la estabilidad de las magnitudes biológicas en las muestras del laboratorio clínico4. De acuerdo con esta metodología, en este mismo centro se realizó un estudio previo en relación con la estabilidad de distintas magnitudes hormonales5.
El objetivo del presente estudio fue evaluar la estabilidad de las concentraciones de IGF-1, gastrina y androstendiona en 2 tipos de suero: uno alicuotado en un tubo secundario (que se denominará muestra S) y otro mantenido en el tubo primario con gel separador (que se denominará muestra G).
Material y métodosObtención de las muestras: las muestras de sangre se obtuvieron de 11 voluntarios sanos (8 mujeres y 3 varones). La extracción de las muestras se realizó entre las 8:30 y las 9:30 a.m. Para este estudio no fue necesario estar en ayunas. Se informó a todos los sujetos sobre la finalidad del estudio y dieron su consentimiento por escrito.
Protocolo de trabajo: se realizó el estudio sobre la base del modelo propuesto por la SEQC2, donde la variable es el tiempo transcurrido desde la obtención y la centrifugación de la muestra hasta su procesamiento.
A cada sujeto se le extrajeron las siguientes muestras:
- •
Un tubo de plástico de silica/gel de 8,5ml Vacutainer® SST II Advance Ref: 367953 (muestra G).
- •
Un tubo teja de 10ml Vacutainer® SST II Advance Ref: 367957 (muestra S).
Las 2 muestras se centrifugaron a los 20±5min de la extracción a temperatura ambiente. El suero del tubo teja se traspasó a un tubo secundario y el suero del tubo con gel se mantuvo en el tubo primario. Durante el estudio se determinaron las concentraciones de las magnitudes estudiadas en función de la variable tiempo, que se define como intervalo de tiempo que transcurre desde la extracción de la muestra hasta la obtención del resultado.
Los tiempos (T) en los que se realizaron las determinaciones fueron:
- •
T1: 90 a 120min (se lo trató como tiempo de referencia).
- •
T2: 210 a 240min.
- •
T3: 330 a 360min.
- •
T4: 450 a 480min.
- •
T5: 24h.
- •
T6: 48h.
- •
T7: 7 días.
- •
T8: 10 días.
Las muestras S1 y G1 se centrifugaron y analizaron en el T1, y se las consideró como muestras de referencia para el estudio. Posteriormente, las muestras S1 y G1 se analizaron de manera sucesiva en los T2, T3, T4, T5, T6, T7 y T8.
Después de cada determinación, las muestras se conservaron tapadas con Parafilm® a una temperatura controlada y registrada entre +4°C y +8°C.
Metodología: las concentraciones de IGF-1, gastrina y androstendiona se determinaron por inmunoanálisis quimioluminiscente mediante el analizador Immulite 2000, Siemens Medical Solutions Diagnostics Limited, Glyn Rhonwy, Llanberis, Reino Unido. Todas las determinaciones se realizaron por duplicado.
Análisis de los datosEl análisis de los resultados se realizó sobre la base de la media obtenida de los duplicados y se compararon con los resultados medios obtenidos en las muestras de referencia S1 y G1.
El criterio de estabilidad propuesto por la Comisión de Calidad Analítica de la SEQC establece cuál es la menor variación en la concentración de una magnitud que, sin deberse a razones analíticas o biológicas, refleja una pérdida de estabilidad (decremento o incremento) de ésta en la muestra biológica4. Se sobrepasa el EST en una muestra cuando la variación entre resultados supera 1,65 veces el coeficiente de variación analítico (CVA) para una magnitud concreta, según la expresión:
Donde 1,65 es el valor que asegura una confianza estadística del 95% y un riesgo α=0,05 en una prueba unilateral. En este estudio, el CVA corresponde a los coeficientes de variación interanálisis obtenidos durante el último año en este laboratorio para cada magnitud estudiada4,6.
Para cada magnitud (Cx) y cada tiempo se calculó el porcentaje de cambio observado (CVo) respecto a la muestra de referencia (Cq) de la siguiente manera:
Se consideró que se sobrepasaba el EST cuando el CVo era superior al EST. En esos casos, la estabilidad de la magnitud se estableció en el tiempo inmediatamente anterior. En los casos en que no se sobrepasó el EST en ninguno de los tiempos estudiados, la estabilidad de la magnitud se estableció en el último tiempo estudiado.
Análisis estadísticoPara determinar a partir de qué tiempo se encontraban diferencias significativas en las concentraciones de las 3 magnitudes, se realizó un modelo lineal generalizado para medidas repetidas en el tiempo, con ajuste de Tukey para la multiplicidad de contrastes, tomando al individuo como factor aleatorizado, y mediante el paquete estadístico SAS v 9.1.3 (SAS Institute Inc., Cary, NC, EE. UU.).
Para la comparación entre los 2 tipos de muestra, suero y gel separador en los diferentes tiempos estudiados, se utilizó la prueba de Wilcoxon. Se consideró significativa una p<0,05.
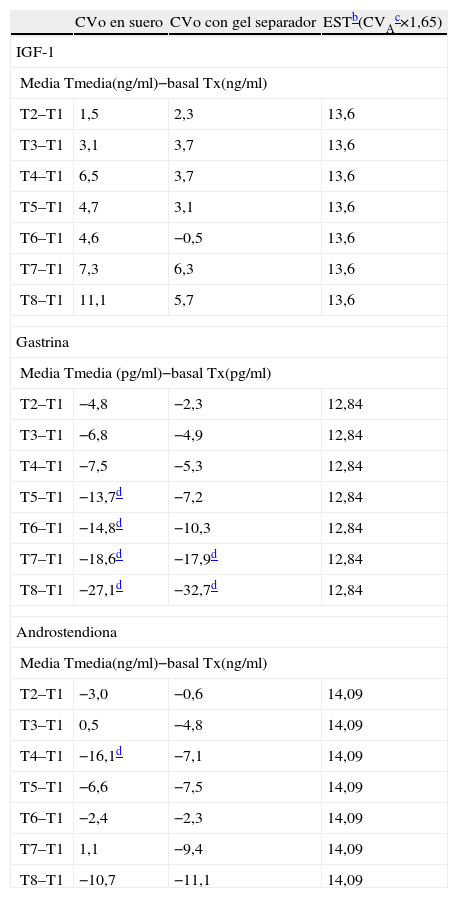
ResultadosEfecto del tiempoEn la tabla 1 se muestra el porcentaje de cambio observado para cada magnitud en los diferentes tiempos estudiados respecto al tiempo de referencia 1. El CVA interanálisis obtenido en este laboratorio en el último año para las 3 magnitudes fue para IGF-1 de 8,24% en una concentración de 218ng/ml; para la gastrina de 7,78% en una concentración de 109pg/ml y para la androstendiona de 8,54% en una concentración de 1,91ng/ml.
Porcentaje de cambio observado (CVo) para cada magnitud en los diferentes tiempos (T) estudiados respecto al tiempo de referencia (T1) y comparación con el límite de estabilidad (EST) obtenidoa
| CVo en suero | CVo con gel separador | ESTb(CVAc×1,65) | |
| IGF-1 | |||
| Media Tmedia(ng/ml)−basal Tx(ng/ml) | |||
| T2–T1 | 1,5 | 2,3 | 13,6 |
| T3–T1 | 3,1 | 3,7 | 13,6 |
| T4–T1 | 6,5 | 3,7 | 13,6 |
| T5–T1 | 4,7 | 3,1 | 13,6 |
| T6–T1 | 4,6 | −0,5 | 13,6 |
| T7–T1 | 7,3 | 6,3 | 13,6 |
| T8–T1 | 11,1 | 5,7 | 13,6 |
| Gastrina | |||
| Media Tmedia (pg/ml)−basal Tx(pg/ml) | |||
| T2–T1 | −4,8 | −2,3 | 12,84 |
| T3–T1 | −6,8 | −4,9 | 12,84 |
| T4–T1 | −7,5 | −5,3 | 12,84 |
| T5–T1 | −13,7d | −7,2 | 12,84 |
| T6–T1 | −14,8d | −10,3 | 12,84 |
| T7–T1 | −18,6d | −17,9d | 12,84 |
| T8–T1 | −27,1d | −32,7d | 12,84 |
| Androstendiona | |||
| Media Tmedia(ng/ml)−basal Tx(ng/ml) | |||
| T2–T1 | −3,0 | −0,6 | 14,09 |
| T3–T1 | 0,5 | −4,8 | 14,09 |
| T4–T1 | −16,1d | −7,1 | 14,09 |
| T5–T1 | −6,6 | −7,5 | 14,09 |
| T6–T1 | −2,4 | −2,3 | 14,09 |
| T7–T1 | 1,1 | −9,4 | 14,09 |
| T8–T1 | −10,7 | −11,1 | 14,09 |
CVA: coeficiente de variación analítico; IGF-1: insulin-like growth factor ‘factor de crecimiento similar a la insulina, tipo1’.
Los resultados con asteriscos muestran un CVo superior al EST.
Las concentraciones de IGF-1 mostraron una tendencia a aumentar con el transcurso del tiempo, aunque no sobrepasó el EST. Las variaciones en las concentraciones de gastrina mostraron un descenso progresivo y llegaron a superar el EST a partir del tiempo 7 (1 semana) en la muestra G y a partir del tiempo 5 (24h) en la muestra S. Es decir, las concentraciones de gastrina fueron estables durante 48h mantenidas a 4°C en el tubo primario con gel separador y durante 8h en el suero alicuotado. Las variaciones en las concentraciones de androstendiona en suero solamente superaron el EST en el tiempo 4 (8h) en la muestra S. Sin embargo, no se superó el EST en el resto de tiempos estudiados en la muestra S ni en todo el período estudiado en la muestra G.
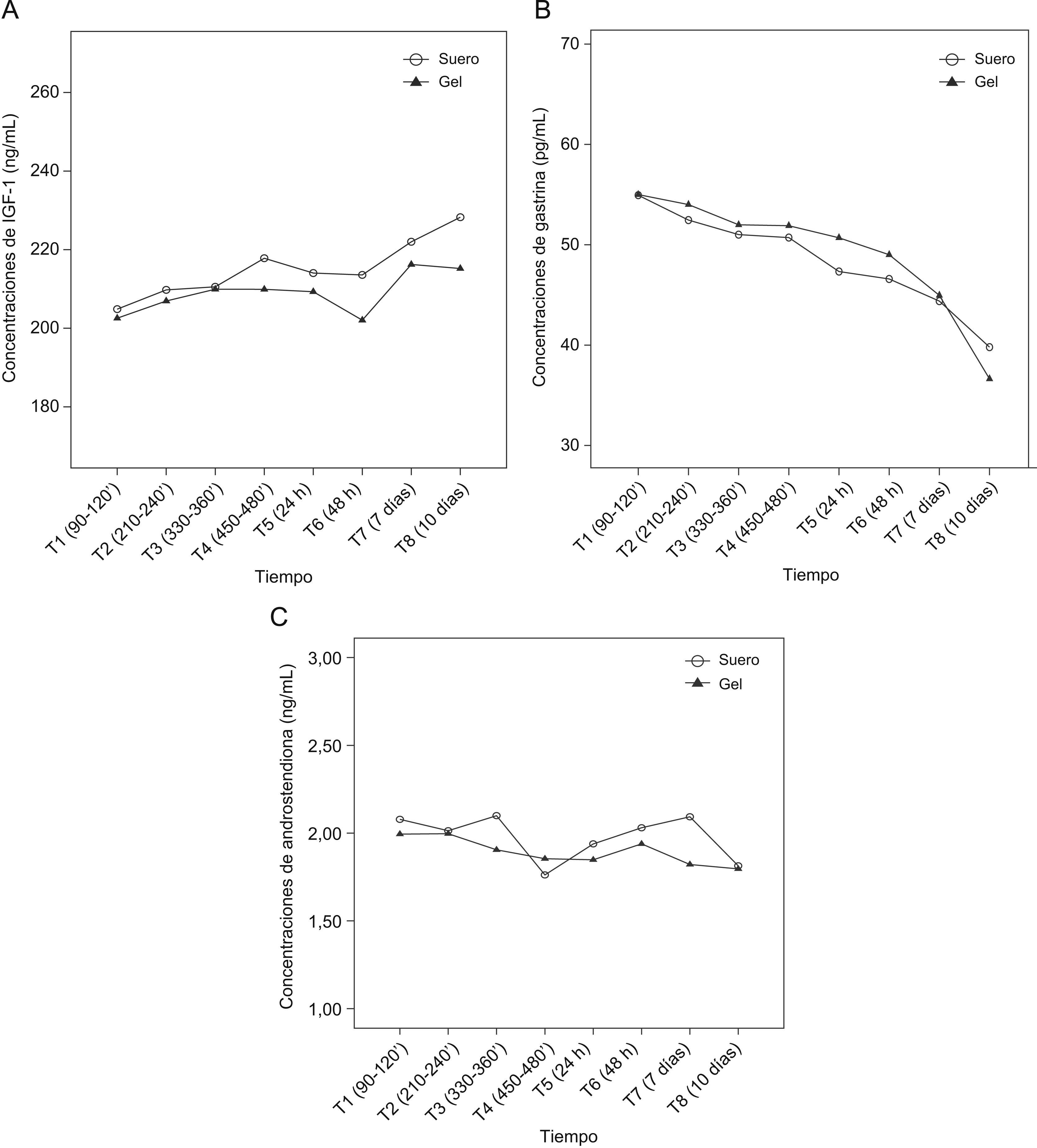
Al analizar las diferencias mediante un modelo lineal generalizado para medidas repetidas en el tiempo y al tomar al individuo como factor aleatorizado, se halló que las concentraciones de IGF-1 aumentaban progresivamente y que llegaban a ser significativas para los 2 tipos de muestra (G y S) respecto al tiempo de referencia a partir del tiempo 7 (1 semana). Por tanto, al aplicar este modelo estadístico, la estabilidad de las concentraciones de IGF-1 tanto en la muestra S como en la muestra G fue de 48h (fig. 1A).
A) Evolución de las concentraciones medias de factor de crecimiento similar a la insulina tipo 1 (IGF-1) obtenidas durante 10 días en los 2 tipos de muestra. B) Evolución de las concentraciones medias de gastrina obtenidas durante 10 días en los 2 tipos de muestra. C) Evolución de las concentraciones medias de androstendiona obtenidas durante 10 días en los 2 tipos de muestra.
Se hallaron diferencias significativas en las concentraciones de gastrina a partir del tiempo 5 (24h) en la muestra S y a partir del tiempo 6 (48h) en la muestra G, por lo que la estabilidad fue de 8h y 24h, respectivamente (fig. 1B).
No se hallaron diferencias significativas en las concentraciones de androstendiona durante todo el tiempo estudiado en la muestra G. En la muestra S, se hallaron diferencias significativas en el tiempo 4 y en el tiempo 8, pero no en los tiempos 5, 6 y 7. (fig. 1C).
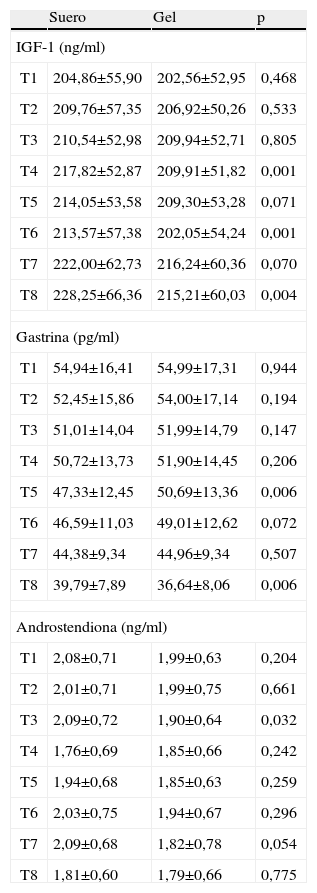
Efecto del espécimen analizadoLa tabla 2 muestra las concentraciones de IGF-1, gastrina y androstendiona obtenidas en las muestras S y G para todos los tiempos estudiados, y se expresan como la media aritmética y la desviación estándar. No se hallaron diferencias significativas entre la muestra S y en la muestra G en los tiempos de referencia en ninguno de los 3 parámetros. Para el IGF-1 se encontraron diferencias significativas en los T4, T6 y T8, para la gastrina en los T5 y T8, y para la androstendiona en el T3, pero éstas probablemente se debieron a la diferencia de estabilidad que existe entre la muestra S y la muestra G.
Comparación de las concentraciones de factor de crecimiento similar a la insulina tipo 1 (IGF-1), gastrina y androstendiona en los 2 tipos de muestra analizada: suero alicuotado y tubo primario con gel separador
| Suero | Gel | p | |
| IGF-1 (ng/ml) | |||
| T1 | 204,86±55,90 | 202,56±52,95 | 0,468 |
| T2 | 209,76±57,35 | 206,92±50,26 | 0,533 |
| T3 | 210,54±52,98 | 209,94±52,71 | 0,805 |
| T4 | 217,82±52,87 | 209,91±51,82 | 0,001 |
| T5 | 214,05±53,58 | 209,30±53,28 | 0,071 |
| T6 | 213,57±57,38 | 202,05±54,24 | 0,001 |
| T7 | 222,00±62,73 | 216,24±60,36 | 0,070 |
| T8 | 228,25±66,36 | 215,21±60,03 | 0,004 |
| Gastrina (pg/ml) | |||
| T1 | 54,94±16,41 | 54,99±17,31 | 0,944 |
| T2 | 52,45±15,86 | 54,00±17,14 | 0,194 |
| T3 | 51,01±14,04 | 51,99±14,79 | 0,147 |
| T4 | 50,72±13,73 | 51,90±14,45 | 0,206 |
| T5 | 47,33±12,45 | 50,69±13,36 | 0,006 |
| T6 | 46,59±11,03 | 49,01±12,62 | 0,072 |
| T7 | 44,38±9,34 | 44,96±9,34 | 0,507 |
| T8 | 39,79±7,89 | 36,64±8,06 | 0,006 |
| Androstendiona (ng/ml) | |||
| T1 | 2,08±0,71 | 1,99±0,63 | 0,204 |
| T2 | 2,01±0,71 | 1,99±0,75 | 0,661 |
| T3 | 2,09±0,72 | 1,90±0,64 | 0,032 |
| T4 | 1,76±0,69 | 1,85±0,66 | 0,242 |
| T5 | 1,94±0,68 | 1,85±0,63 | 0,259 |
| T6 | 2,03±0,75 | 1,94±0,67 | 0,296 |
| T7 | 2,09±0,68 | 1,82±0,78 | 0,054 |
| T8 | 1,81±0,60 | 1,79±0,66 | 0,775 |
T: tiempo.
En este estudio no se han hallado diferencias significativas entre las muestras de suero alicuotadas en un tubo secundario (muestra S) y las muestras de suero conservadas en el tubo primario con gel separador (muestra G) en los tiempos basales en ningún parámetro estudiado. Las concentraciones de gastrina, en las muestras almacenadas a 4°C, disminuyeron progresivamente con el tiempo transcurrido y superaron el EST a partir del tiempo 5 en la muestra S, y a partir del tiempo 7 en la muestra G. No se superó el EST establecido sobre la base de los criterios de la SEQC en las concentraciones de IGF-1 y androstendiona, por lo que se consideró que fueron estables durante los 10 días del estudio.
Recientemente, las determinaciones de IGF-1, gastrina y androstendiona se han automatizado, lo que favorece a las mejoras en la obtención de resultados y disminuye la imprecisión analítica y el tiempo de respuesta. Esta mejora se ha asociado a cambios en el procesamiento preanalítico de estas muestras, que han pasado de seguir un proceso en el que la extracción (generalmente en tubos sin aditivos), centrifugación, separación del suero o plasma y congelación se realizaban en el menor tiempo posible, a seguir el mismo proceso que otras muestras automatizadas, que incluye obtención, conservación y análisis de la muestra en el mismo tubo primario almacenado a 4°C durante un período de tiempo variable.
En la literatura médica, hay pocos estudios que evalúen la estabilidad de la androstendiona, la gastrina y el IGF-1. En la mayoría de ellos, la estabilidad se ha evaluado en muestras de suero o plasma alicuotadas, después de centrifugarlas y congelarlas durante períodos de tiempo variables. En este estudio, 2 muestras de suero, una alicuotada en un tubo secundario y otra en un tubo primario con gel separador, se conservaron en nevera a 4°C para intentar reproducir las condiciones de trabajo que se dan en el laboratorio clínico para las determinaciones automatizadas7,8.
En los estudios sobre estabilidad, a menudo se observan discordancias en los resultados obtenidos para una misma magnitud que pueden llegar a ser notables. Entre las causas de esta discordancia está la disparidad de protocolos existentes para estudiar la estabilidad, ya que no hay un consenso en los tiempos de estudio, ni en el tratamiento que hay que dar a las muestras durante su almacenamiento, ni en los criterios para definir los EST. Algunos de los criterios en los que se han basado diferentes autores para determinar el EST de las magnitudes biológicas son criterios exclusivamente estadísticos en los que se utilizan diferentes pruebas, como la prueba de Friedman utilizada por el grupo de Heil et al9 y publicada en el año 1998; o criterios exclusivamente metrológicos, como los de Martínez-Cervera et al10 o el de Skoop11, o incluso hay combinaciones de criterios estadísticos y metrológicos12 o de criterios biológicos y metrológicos13. Esto hace difícil la comparación de los resultados obtenidos por distintos autores.
En este estudio se ha seguido el criterio propuesto por la Comisión de Calidad Analítica de la SEQC, al igual que se ha seguido en otros estudios5,14, que es una combinación del criterio estadístico, metrológico y biológico. Este comité considera que se sobrepasa el EST estabilidad en una muestra cuando su valor excede, por encima o por debajo, el número que representa el valor inicial más (si aumentan los valores) o menos (si disminuyen los valores) 1,65 veces el CVA de esa magnitud6.
Estos resultados sobre la estabilidad en las concentraciones de IGF-1 coinciden con los resultados obtenidos por Elmlinger et al15. En este estudio, las concentraciones de IGF-1 en suero conservadas a 4aC se mantuvieron estables durante todo el período estudiado (10 días). Elmlinger et al estudiaron la estabilidad de IGF-1 en muestras de suero y plasma, y hallaron que las concentraciones de IGF-1 en suero se mantuvieron estables a 4°C todo el tiempo estudiado, pero, en su estudio, este período fue de 72h (3 días). Asimismo, en el estudio de Evans et al7, las concentraciones de IGF-1 permanecieron estables durante todo el período de tiempo estudiado, 120h, conservadas tanto a 4°C como a 30°C de temperatura.
Hartog et al5,16 han reportado un aumento del 15% en las concentraciones de IGF-1, mantenidas a temperatura ambiente, a partir de las 24h. En estos resultados se observa una tendencia a aumentar en las concentraciones de IGF-1 en suero a medida que pasa el tiempo, sin embargo, no se encuentran diferencias significativas en las muestras almacenadas a 4°C según los criterios de la SEQC.
En el estudio realizado por Eastvold et al17 no se encontraron diferencias significativas entre las concentraciones de gastrina obtenidas en suero y en suero con gel separador. En este estudio, las concentraciones de gastrina en las muestras de suero alicuotadas se almacenaron a temperatura ambiente y disminuyeron un 2,8% cada hora. En las muestras almacenadas en la nevera, las concentraciones de gastrina fueron estables hasta 3 días. En este estudio, la estabilidad para las concentraciones de gastrina fue menor de 8h para la muestra de suero y de 48h para la muestra de suero con gel separador. Esta diferencia respecto a los resultados obtenidos por Eastvold et al puede ser debida a las diferencias en el criterio del EST: mientras que su criterio de estabilidad era definido como el hallazgo de una diferencia superior al 20% respecto a la muestra de referencia, en este estudio el límite se situaba en el 12,8%, que corresponde a 1,65 veces el CVA y, por tanto, es más restrictivo. En el estudio realizado por la Organización Mundial de la Salud (OMS)18, las recomendaciones preanalíticas para la gastrina incluyeron separar el suero en las 2h siguientes a la extracción y congelarlo lo antes posible. La estabilidad reportada es de una semana en muestras recogidas en tubos que contengan aprotinina (2.000KIU/ml) y conservadas tanto a 4–8°C como a temperatura ambiente.
En el mismo estudio realizado por la OMS, las concentraciones de androstendiona se mantuvieron estables un día en suero almacenado a temperatura ambiente, 4 días a 4–8°C y un año en muestras de suero congeladas. En nuestro estudio, las concentraciones de androstendiona en los diferentes tiempos mostraron tanto aumento como disminuciones respecto a la muestra de referencia, por lo que las variaciones observadas no se atribuyeron al efecto del tiempo, sino a la imprecisión analítica del método. Al analizar estos resultados y al aplicar un criterio exclusivamente estadístico, como el modelo lineal generalizado, se obtuvieron resultados similares para la gastrina y la androstendiona, pero en el caso del IGF-1, la estabilidad disminuyó a las 48h. Aunque los resultados obtenidos por análisis estadístico fueron similares a los obtenidos con el protocolo de la SEQC, los autores de este artículo creen que este último criterio es el que se debe utilizar por 2 razones. Por un lado, tiene en cuenta para cada magnitud tanto criterios estadísticos como metrológicos y biológicos. Además, no requiere disponer de programas estadísticos avanzados y cualquier laboratorio lo puede calcular.
Las concentraciones plasmáticas de diferentes magnitudes pueden presentar variaciones importantes en función del tubo utilizado en la extracción y de los aditivos que éste contenga, por lo que el fabricante de inmunoanálisis suele recomendar que la recogida de sangre se realice en tubos sin aditivos, en los que se incluyen barreras de gel, barreras físicas, activadores de la coagulación o anticoagulantes. En este estudio, en que se han comparado los resultados en muestras obtenidas en tubos de la casa comercial Vacutainer® SST II Advance sin aditivos y con gel separador, en las muestras mantenidas en el tubo primario con gel separador la estabilidad no se vio afectada e, incluso, en el caso de la gastrina, mejoró respecto a las mantenidas en alícuota secundaria. Sin embargo, estos resultados no se pueden extrapolar a otros tubos con gel separador ya que, en general, no se conoce la composición exacta del gel separador y ésta puede variar en los tubos de distintas casas comerciales.
Es necesario concluir que los resultados obtenidos en este estudio únicamente serían aplicables a este laboratorio, ya que dependen del método analítico utilizado y las condiciones de trabajo aplicadas. Aunque sí servirían de guía para aquellos laboratorios que utilicen el mismo analizador y el mismo método analítico. Sería necesario para cada laboratorio calcular el CVA de las magnitudes biológicas que se determinan para poder definir su EST y, de esta manera, garantizar una adecuada interpretación.
Una limitación de este estudio es que sólo se realizó en muestras procedentes de 11 voluntarios sanos, en lugar de los 30 que propone el protocolo de la SEQC2, es por esto necesario realizar futuros estudios con un mayor número de sujetos sanos y también en poblaciones con diversas enfermedades19 para poder definir la estabilidad de las distintas magnitudes en las distintas situaciones clínicas en las que se trabaja en el laboratorio clínico.
Los autores de este artículo quieren agradecer a la SEQC el apoyo recibido y la financiación que ha hecho posible la realización del trabajo.
Agradecemos a los miembros de la Comisión de Hormonas de la Sociedad Española de Bioquímica Clínica y Patología Molecular (E. Álvarez García, A. Aniel Quiroga, L. Audí Parera, E. Berlanga Escalera, C. García Lacalle, N. López Lazareno, M. J. Martínez de Osaba Madariaga, M. Mauri Dot y M. E. Torregrosa Quesada) su inestimable ayuda en la selección de los analitos y de los protocolos que se han seguido en este estudio.
Asimismo, quieren agradecer a la empresa Siemens S. A. la donación de una parte de los reactivos.