El CA 19-9 es uno de los marcadores tumorales (MT) más inespecíficos. El incremento de este marcador puede estar influido por diversas circunstancias, por lo que un resultado elevado debe ser interpretado siempre considerando el contexto clínico. Se presenta el caso clínico de un varón de 79 años con síntomas digestivos inespecíficos y con una elevación de CA 19-9 sin ninguna otra prueba complementaria con valores alterados, por lo que desde el laboratorio se realizó un estudio de interferencias para determinar la verosimilitud de este resultado. El objetivo de este trabajo es resaltar el papel que desempeña el laboratorio clínico en la interpretación de los MT en el diagnóstico del cáncer.
CA 19-9 is one of the most non-specific tumour markers (TM). It may be increased in different conditions, and thus a high result must be interpreted in a clinical context. In this article the case is presented of a 79 year-old man who had non-specific gastrointestinal symptoms and an elevation of CA 19-9, with no other alterations in the complementary tests. Because of this, the laboratory carried out a complete interference study. The objective of the present work is to emphasise the role of the clinical laboratory in the interpretation of the TM in cancer diagnosis.
Un marcador tumoral (MT) es toda sustancia producida o inducida por la célula tumoral, cuya detección sea de interés en el diagnóstico, pronóstico precoz de recidiva, evaluación terapéutica o control evolutivo del paciente con cáncer1. Sin embargo, estos marcadores no son específicos de las neoplasias, pudiendo encontrarse concentraciones apreciables en un gran número de situaciones fisiológicas o en enfermedades no malignas. Por este motivo, es importante destacar que los cambios que se deben considerar en un determinado MT son fundamentalmente cuantitativos, es decir, la señal de alarma debe aparecer cuando existen incrementos anormales en las concentraciones del mismo2,3. En caso de duda, se recomienda repetir la determinación cuando haya pasado un periodo superior a la vida media del MT (generalmente 15 días). Se considera que hay cambio en el valor del marcador cuando se producen 2 incrementos consecutivos del 20%.
El CA 19-9 en el suero se encuentra en forma de mucina con masa molecular elevada (200-1.000kDa). Los métodos disponibles utilizan un anticuerpo (1116-NS-19-9) que reconoce un determinante antigénico mucínico formado por un gangliósido que es un derivado siálico del antígeno del grupo Lewis a (5-10% de la población son Lewis a negativo y, por lo tanto, no producirá CA 19-9).
El CA 19-9 se eleva en los pacientes con cáncer de páncreas por encima de un valor normal de 37 U/ml con una sensibilidad del 70-85%. La principal fuente de falsos positivos son las hepatopatías, sobre todo si cursan con ictericia, y las pancreatitis donde pueden detectarse valores elevados, incluso superiores a 1.000 U/ml. La insuficiencia renal puede provocar discretos incrementos habitualmente inferiores a 150 U/ml. También se eleva moderadamente en algunos pacientes con derrame, quistes mucinosos o bronquiectasias.
Excluyendo los falsos positivos, el CA 19-9 se encuentra elevado en otras neoplasias como en el cáncer de ovario (adenocarcinomas mucinosos) y en las neoplasias broncopulmonares (principalmente en adenocarcinomas y carcinomas indiferenciados de células grandes). En todos estos casos las concentraciones medianas del CA 19-9 son inferiores a las que se registran en el cáncer de páncreas4.
El problema principal en el cáncer de páncreas es que suele presentar una sintomatología muy inespecífica, siendo esta la causa de su diagnóstico tardío y mal pronóstico (solo el 20% de los casos se diagnostican en estadios localizados de la enfermedad)5. Asimismo, no suelen encontrarse valores elevados de CA 19-9 hasta estadios avanzados de la enfermedad.
El síntoma más habitual en el cáncer de páncreas es el dolor abdominal epigástrico. La pérdida de peso también es frecuente, relacionándose con la insuficiencia pancreática exocrina y con el síndrome metabólico secundario.
En el laboratorio, todos los ensayos utilizan el mismo anticuerpo para medir el CA 19-9. La variación de los resultados entre las diferentes plataformas puede ser debida a las diferencias en el diseño o en la utilización de diferentes calibradores de la técnica6,16. Además, debemos considerar que los fluidos biológicos utilizados para análisis tienen una matriz compleja con compuestos endógenos y exógenos que pueden interferir con la medición exacta del analito7.
El objetivo de este trabajo es resaltar el papel que desempeña el laboratorio clínico en la interpretación de los MT en el diagnóstico del cáncer. Como ejemplo de ello, se presenta el caso clínico de un paciente que presentaba una elevación de CA 19-9 en el que se sospechaba una interferencia analítica.
Caso clínicoPaciente varón de 79 años sin antecedentes personales de interés salvo tratamiento crónico con propranolol por temblor esencial y con tamsulosina por hipertrofia benigna de próstata, remitido a la consulta de digestivo por presentar una clínica de dispepsia y meteorismo de larga evolución, que se acompaña últimamente de distensión abdominal y una leve pérdida de peso.
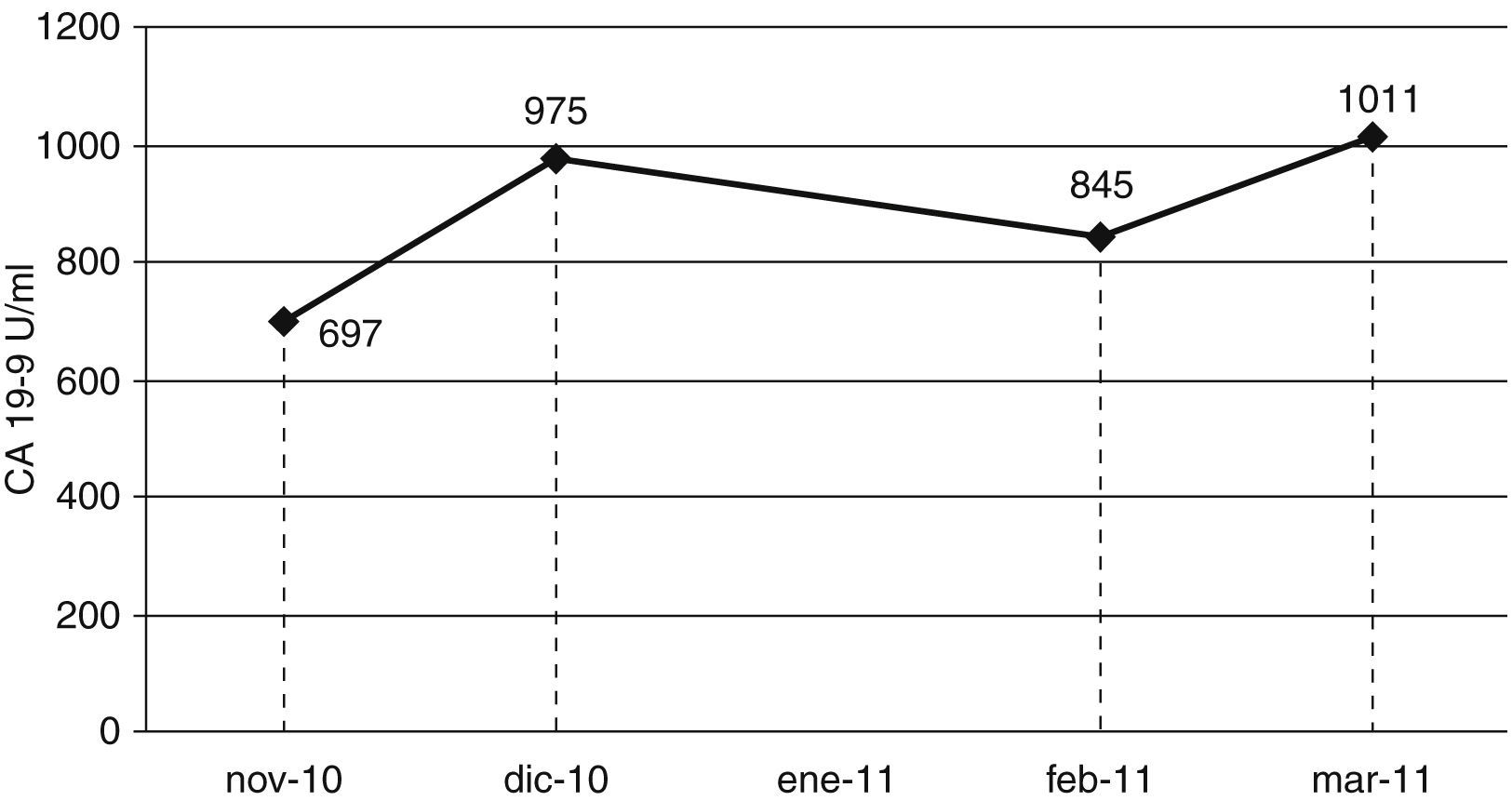
Se realiza un estudio general de laboratorio en el contexto de un síndrome constitucional en el que se solicita una analítica de bioquímica general, hemograma completo y marcadores tumorales: CEA y CA 19-9 (ADVIA Centaur® XP, Siemens) con los siguientes resultados: CEA: 1,40ng/ml (<5ng/ml); CA 19-9: 697 U/ml (<37 U/ml), el resto de los resultados analíticos se encontraban dentro de los intervalos de referencia, incluyendo las pruebas de función hepática y renal. Desde el laboratorio se recomienda descartar neoplasia pancreática y, en todo caso, repetir determinación de marcadores tumorales, por lo que al paciente se le realiza una TAC de tórax, abdomen y pelvis con resultados dentro de la normalidad.
Un mes después se obtiene un resultado de CA 19-9 de 975 U/ml, el valor del MT había aumentado un 29% (elevación mayor que el 10% de coeficiente de variación (CV) interensayo de nuestro laboratorio) con respecto al valor anterior. Considerando que ese aumento no se asociaba a ningún otro dato alterado (de laboratorio ni de imagen), se recomienda el envío de una tercera muestra para descartar un incremento progresivo de dicho marcador.
Tres semanas después, en una nueva muestra se obtiene un valor de CA 19-9 de 845 U/ml que no se consideró significativamente diferente respecto al obtenido con anterioridad.
Ante estos resultados, el laboratorio informa finalmente de que probablemente se trate de un aumento de CA 19-9 no patológico. Aun así, y para descartar totalmente la existencia de enfermedad neoplásica e intentar deducir las causas de ese incremento tan importante del MT, se procede a realizar un estudio de interferencias analíticas8–15 (tabla 1).
Estudio de interferencias analíticas
| Prueba de linealidad | Se valora en paralelo el comportamiento del analito en la muestra sospechosa con el mismo analito en una muestra no sospechosa |
| Diluciones seriadas | Eliminar el posible efecto Hook o gancho |
| Medición por otro método analítico | Nos permite conocer si la interferencia es propia del método o de un analizador en concreto |
| Precipitación con PEG 6000 | Precipita las proteínas en función de su solubilidad. Útil para descartar la presencia de una forma macro de la proteína o paraproteínas interferentes |
| Estudio de anticuerpo heterófilos | Repetición de la prueba después de la adición de un agente bloqueante comercial (Heterophilic Blocking Tubes®) |
| Cuantificación de anticuerpos antianimal | Los más conocidos y frecuentes son los anticuerpos antimurinos |
| Proteinograma sérico | Para descartar la presencia de paraproteínas potencialmente interferentes. La interferencia es de tipo analítico debido a la precipitación, incremento de la viscosidad o interferencia química |
| Inhibición con lectinas | La especificidad que muestra la lectina de trigo sobre los residuos de ácido siálico hace que se una al CA 19-9 impidiendo que el anticuerpo monoclonal de captura reconozca su epítopo. Si no existe interferencia los resultados deberían disminuir en todos los casos |
Para dicho estudio se realiza una nueva determinación del CA 19-9 en el paciente 3 semanas después, con una nueva muestra y con un valor del CA 19-9 de 1.011 U/ml.
La prueba de linealidad, la prueba de diluciones seriadas, la precipitación con polietilenglicol 6.000 (PEG 6.000), el estudio de anticuerpos heterófilos y la cuantificación de anticuerpos antianimal fueron negativos. En el proteinograma no se observaron paraproteínas, que son sustancias potencialmente interferentes9 (tabla 1).
Se realizó la medición del CA 19-9 en otras plataformas analíticas, con los siguientes resultados; Architect® Abbott: 763 U/ml, Liaison® Diasorin: 247 U/ml y Modular E-170® Roche: 337 U/ml. En dichas plataformas el CA 19-9 fue elevado (valor de normalidad en suero hasta 37 U/ml) pero con diferencias en el valor numérico debido posiblemente a la falta de estandarización de los diferentes métodos de medida del MT, lo que significa una exactitud diferente en todos ellos aunque utilicen el mismo anticuerpo de captura16.
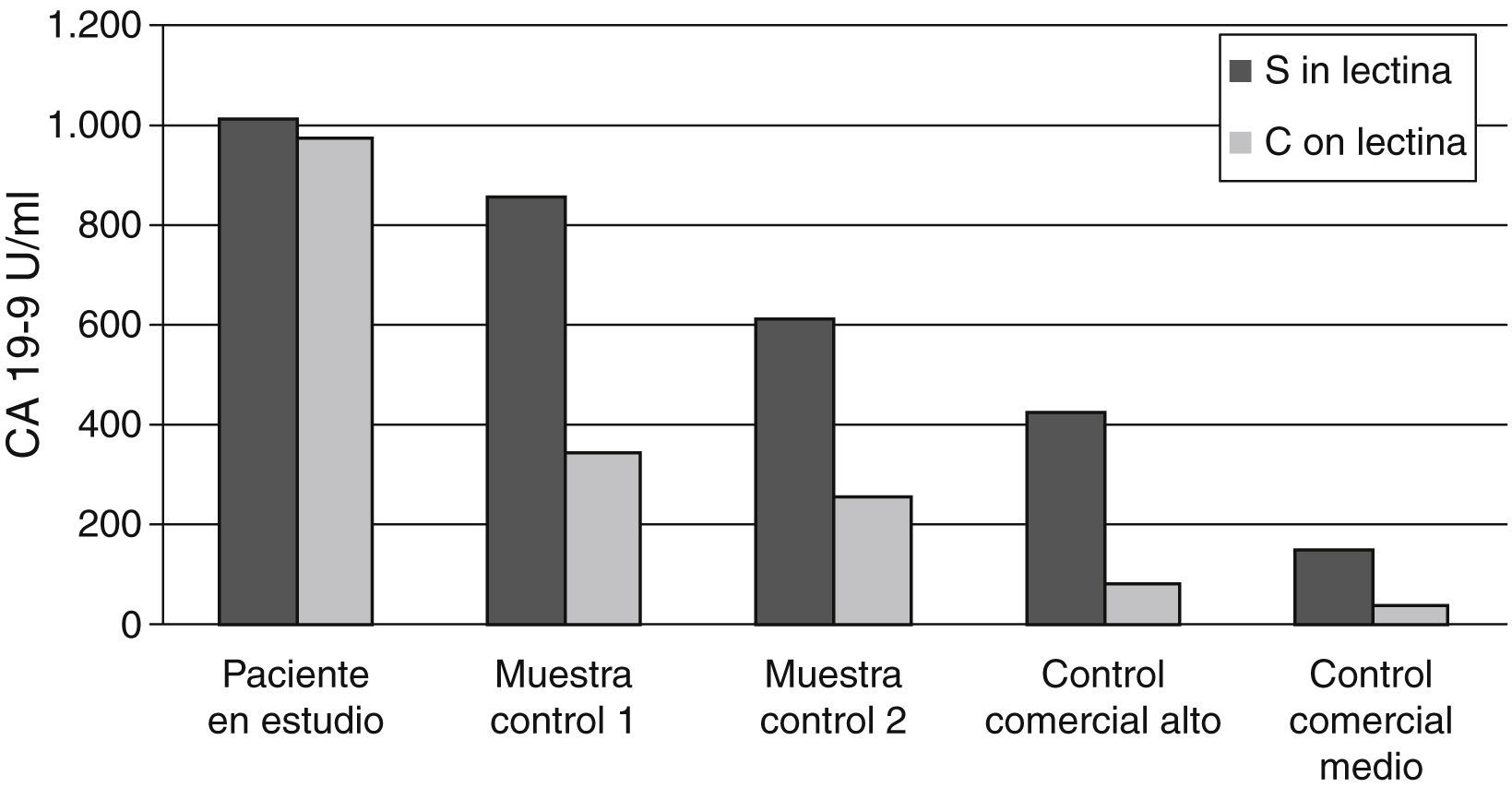
Finalmente, se realizó el estudio de la inhibición con lectina (fig. 1). Si no existe interferencia, los valores de CA 19-9 deberán disminuir después del tratamiento con lectina de trigo. Para el estudio se utilizaron 2 muestras control provenientes de pacientes con enfermedad tumoral conocida y con valores de CA 19-9 similares a la del paciente en estudio (855 U/ml y 610 U/ml respectivamente) y 2 controles comerciales con valores de 422 U/ml y 153 U/ml. En nuestro caso, se observó que tras el tratamiento con lectina de trigo se obtenía un porcentaje de recuperación inferior al 25% en el caso de los controles comerciales, de un 40% aproximadamente en los muestras control y una recuperación prácticamente del 90% en el caso de la muestra en estudio, por lo que se observa una diferencia clara entre el comportamiento del CA 19-9 en nuestro paciente y las muestras comparadas10,15.
Estudio de inhibición con lectina de trigo.
La muestra control 1 (855 U/ml) y la muestra control 2 (610 U/ml) se corresponden con muestras de pacientes con cáncer de páncreas conocido y niveles de CA 19-9 similares al paciente en estudio. Los controles comerciales alto y medio corresponden al nivel 3 (422 U/ml) y 2 (153 U/ml) respectivamente de Lyphochek® Tumor Marker Plus de Bio-Rad.
En la gráfica se observa que, en el caso de la muestra del paciente en estudio, no existe una disminución clara en la concentración de CA 19-9 después del tratamiento con lectina.
Es relativamente frecuente el hallazgo ocasional de valores elevados de algún marcador tumoral en pacientes sin evidencia de enfermedad neoplásica. No obstante, en estos casos los valores encontrados no suelen ser elevados. Un valor de CA 19-9 cercano a 1.000 U/ml, excluyendo colestasis hepática y pancreatitis, suele indicar con una probabilidad del 95% la existencia de una neoplasia. En estos casos, cuando las pruebas complementarias (radiológicas y de laboratorio) no apoyan la sospecha diagnóstica, se suele recomendar realizar mediciones seriadas para descartar o confirmar el incremento progresivo de los valores del marcador. La ausencia de un incremento progresivo de los valores en el tiempo, teniendo en cuenta que se realizaron en total 4 determinaciones con un tiempo total entre la primera y la última de 4 meses, en un paciente sin tratamiento, indica con una alta probabilidad la ausencia de una enfermedad neoplásica asociada (fig. 2)1–4.
Los profesionales del laboratorio no pueden detectar fácilmente los errores causados por las sustancias interferentes, por eso, muchas de ellas pasan desapercibidas. En nuestro caso, la única prueba que nos ha ayudado a identificar la interferencia analítica es el estudio de la inhibición con lectina, que se interpretó como un aumento en la determinación del CA 19-9 sin la presencia de esta molécula en el suero del paciente, pudiendo ser varias las causas según la literatura consultada: existencia en la muestra de una proteína de pequeño tamaño con epítopo similar al del CA 19-9, presencia de un anticuerpo desconocido en el suero del paciente con capacidad de unión al 1116-NS-19-9, presencia de algún derivado del CA 19-9 como el disialil-Lewis a o que exista alguna interferencia exógena (fármacos, infusiones…)8,12,17-19.
ConclusionesLa función del laboratorio clínico no es necesariamente llegar a identificar las causas de las posibles interferencias analíticas, pero lo que sí es verdaderamente importante es que se informe al médico de la posible existencia de un resultado falsamente elevado.
En nuestro estudio no llegamos a demostrar la causa exacta del aumento del CA 19-9 en el paciente, pero sí informamos al clínico con toda seguridad de que dicho aumento del MT no era patológico. Se realizó un informe dirigido al Servicio de Digestivo, detallando el estudio de interferencias realizado e incluyendo todas las posibles causas de aumento del CA 19-9, que fue bien recibido por el clínico responsable.
Finalmente, el paciente fue dado de alta del Servicio de Digestivo y sigue realizando revisiones periódicas en otros servicios de nuestro hospital.