Presentamos un caso de hemólisis masiva fulminante a causa de una sepsis por Clostridium perfringens en un paciente diabético que acude a un hospital comarcal manifestando dolor abdominal. Mostramos las imágenes de la sangre periférica obtenida antes de la muerte del paciente, que tuvo lugar 22 h después de su ingreso hospitalario.
We report a case of fulminant massive hemolysis due to Clostridium perfringens sepsis in a diabetic patient who was seen in a local hospital complaining of abdominal pain. The patient died 22h after hospital admission. We present images of peripheral blood taken before death.
La hemólisis intravascular masiva es una complicación rara de la sepsis por Clostridium perfringens (C. perfringens), ocurriendo en un 7-15% de las bacteriemias por este microorganismo1. La tasa de mortalidad de la sepsis por C. perfringens oscila entre el 70 y el 100%, siendo la tasa más elevada cuando la infección induce hemólisis masiva2.
Caso clínicoVarón de 59 años que acudió al servicio de urgencias de un hospital comarcal por presentar dolor abdominal difuso de carácter cólico acompañado de vómitos. Como antecedentes de interés destacaba la presencia de DM tipo 2, hipertensión arterial, dislipidemia y obesidad. En la exploración física el paciente manifestaba un buen estado general, el abdomen globuloso, blando y con dolor difuso a la palpación, y una temperatura de 36,30°C. Las pruebas de laboratorio mostraron un hemograma normal y una bioquímica en la que destacó una glucosa de 231mg/dl, GOT 159 U/l, PCR 1.59mg/dl, amilasa 525 U/l y LDH 269 U/l, siendo normales los resultados de las determinaciones de creatinina, urea, bilirrubina total, sodio y potasio. Se realizó una radiografía de tórax y un electrocardiograma que fueron normales. El paciente ingresó con el diagnóstico de pancreatitis aguda.
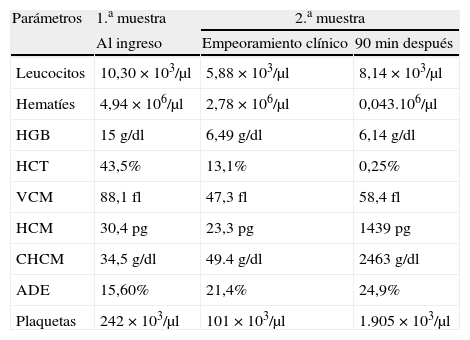
Evolución y diagnósticoVeinte horas después del ingreso el paciente sufrió un cuadro de depresión respiratoria y obnubilación. En la exploración física se observó una importante distensión abdominal, ligera ictericia conjuntival y una temperatura de 38°C. El hemograma mostró una hemoglobina de 6,49g/dl (15g/dl al ingreso), hematocrito de 13% y un recuento de plaquetas de 101×109/l (tabla 1). Las pruebas de bioquímica y coagulación no se pudieron realizar por intensa hemólisis.
Evolución de los parámetros analíticos
| Parámetros | 1.a muestra | 2.a muestra | |
| Al ingreso | Empeoramiento clínico | 90 min después | |
| Leucocitos | 10,30×103/μl | 5,88×103/μl | 8,14×103/μl |
| Hematíes | 4,94×106/μl | 2,78×106/μl | 0,043.106/μl |
| HGB | 15g/dl | 6,49g/dl | 6,14g/dl |
| HCT | 43,5% | 13,1% | 0,25% |
| VCM | 88,1fl | 47,3fl | 58,4fl |
| HCM | 30,4pg | 23,3pg | 1439pg |
| CHCM | 34,5g/dl | 49.4g/dl | 2463g/dl |
| ADE | 15,60% | 21,4% | 24,9% |
| Plaquetas | 242×103/μl | 101×103/μl | 1.905×103/μl |
ADE: amplitud de distribución eritrocitaria; CHCM: concentración de hemoglobina corpuscular media; HCM: hemoglobina corpuscular media; HCT: hematocrito; HGB: hemoglobina; VCM: volumen corpuscular medio.
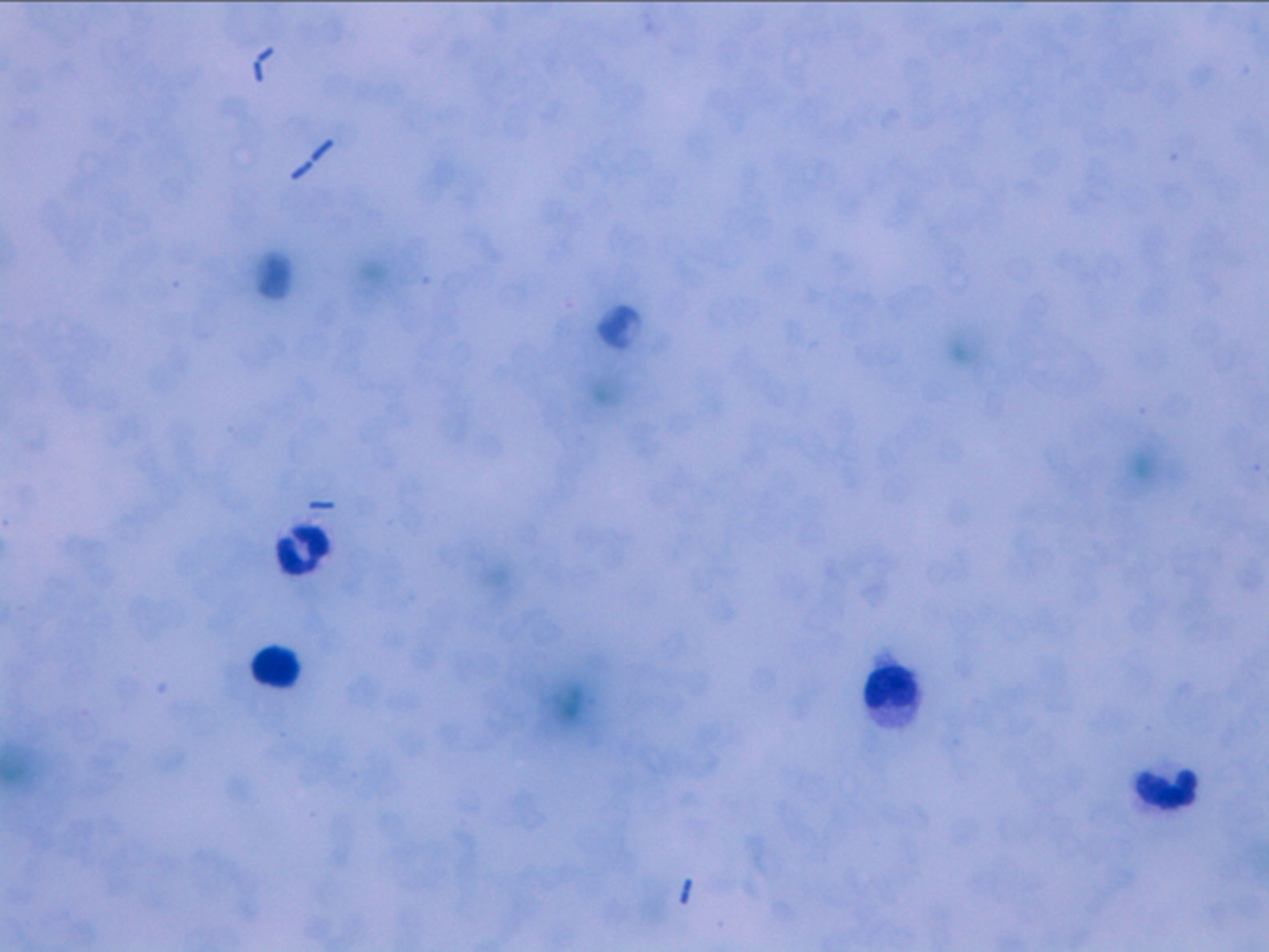
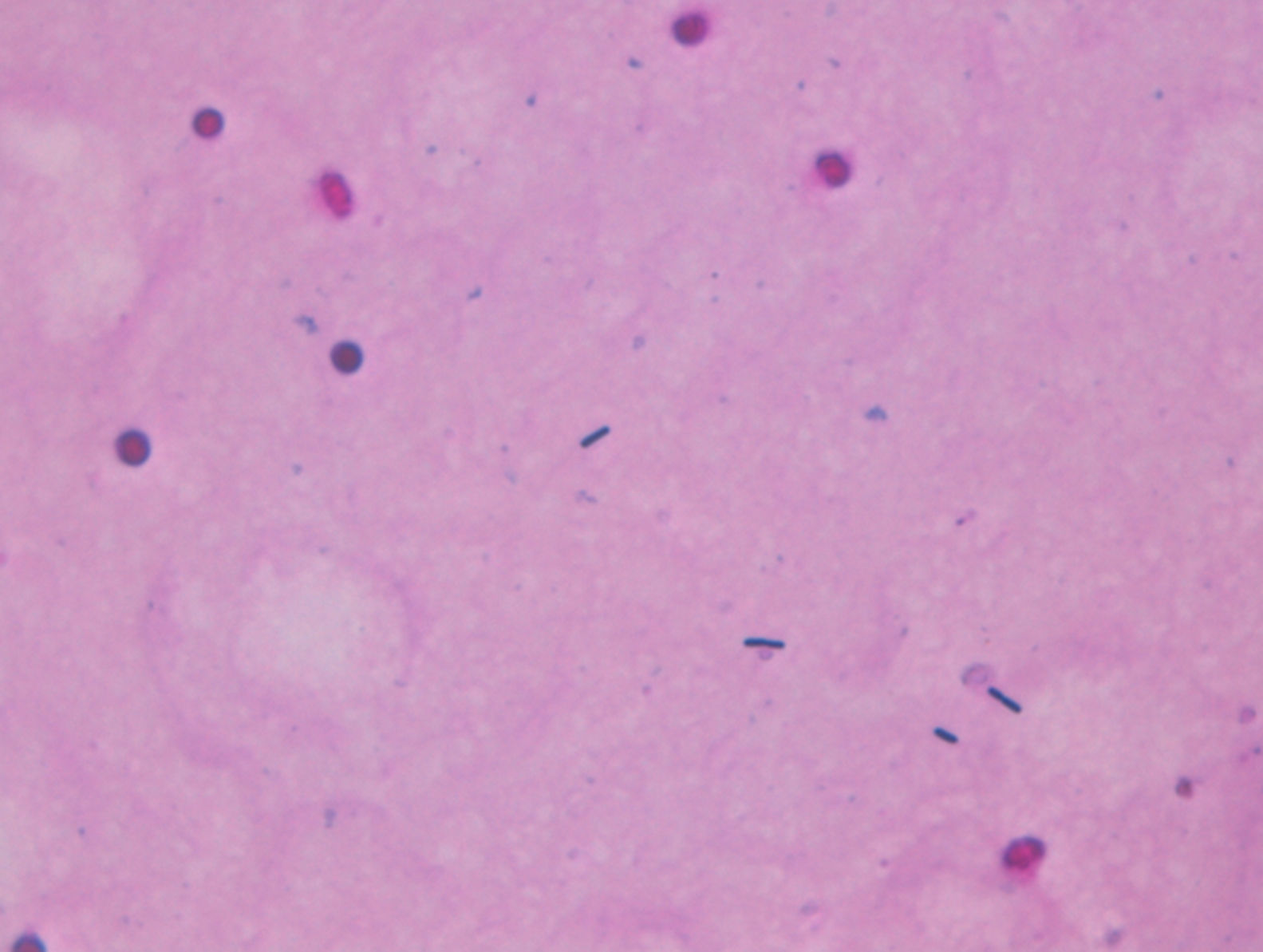
Ante estos resultados se decidió el envío de las muestras al laboratorio del hospital de referencia, donde al analizar la misma muestra una hora y media más tarde se obtuvo un hemograma con 43.000 hematíes/μl, hemoglobina de 6,14g/dl y hematocrito de 0,25% (tabla 1). Se realizó una extensión de sangre periférica que reveló la presencia de escasos hematíes con intensa hipocromía, abundantes bacterias de forma bacilar y trombocitopenia (fig. 1). La tinción de Gram de la sangre periférica evidenció la presencia de bacilos grampositivos (fig. 2). Ante la gravedad de los hallazgos de laboratorio se decidió informar de los resultados al clínico responsable telefónicamente, el cual informó que durante el traslado del paciente para la realización de una radiografía abdominal este presentó una parada cardiorrespiratoria por lo que volvieron a urgencias para su estabilización. El paciente no respondió a las técnicas de reanimación y falleció 22 h después de su ingreso sin haber podido instaurar terapia antibiótica. Posteriormente, mediante el cultivo de la sangre periférica en anaerobiosis, se obtuvo el crecimiento de C. perfringens, identificado mediante espectrometría de masas MALDI-TOF.
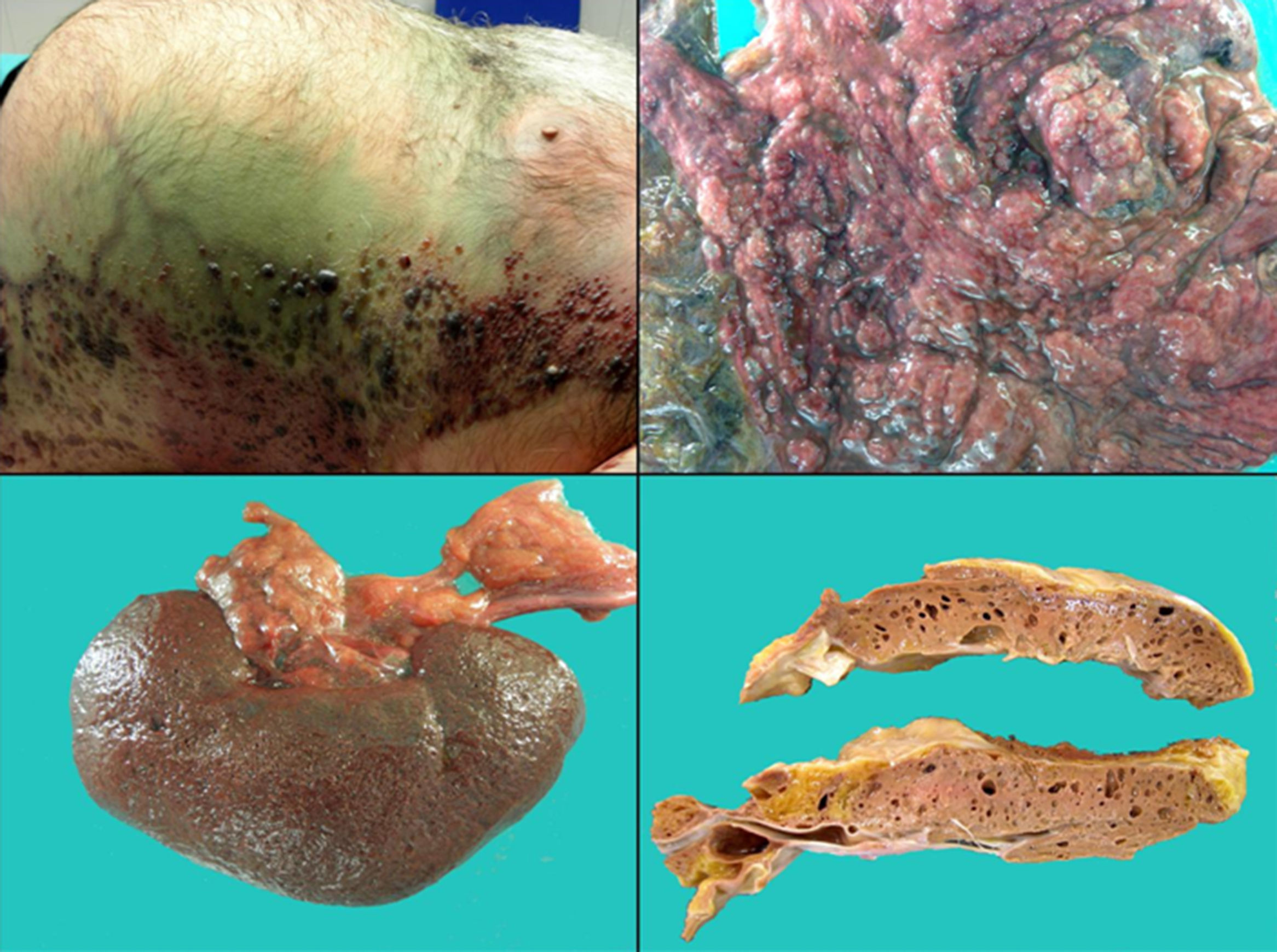
Se realizó el estudio autópsico 36 h después de la muerte (fig. 3). En el examen externo se observó un estado enfisematoso de descomposición cadavérica y, microscópicamente, neumatosis visceral generalizada con presencia de abundantes colonias bacterianas de tipo bacilar, sepsis hepática y trombos sépticos localizados en estómago, pulmones y piel. Entre otros hallazgos destacó colelitiasis. El diagnóstico definitivo fue de sepsis fulminante por C. perfringens.
DiscusiónHay determinados factores de riesgo que predisponen a la adquisición de una infección grave por Clostridium, como la edad avanzada, la diabetes, enfermedades hepatobiliares, intestinales o neoplasias hematológicas2. En una revisión de 40 casos, la diabetes fue la única enfermedad subyacente en el 15% de los pacientes, y era concomitante con otras enfermedades en un 30% de los casos1. Es importante buscar la fuente de infección primaria que da lugar a una invasión vascular secundaria, pero el diagnóstico pre-mortem raramente se consigue. En nuestro caso, la sintomatología junto con la presencia de colelitiasis en un paciente diabético, la inexistencia de un proceso neoplásico, y la ausencia de perforación o fístula en algún órgano, podría sugerir que el foco primario de la sepsis fuese biliar o gastrointestinal.
C. perfringens produce principalmente cuatro toxinas: la toxina alfa, las toxinas beta y epsilon y la toxina iota3. La toxina alfa puede dañar la integridad estructural y funcional de la membrana de los hematíes mediante su actividad fosfolipasa, ocasionando esferocitosis y la consecuente hemólisis4. Además, la mayoría de los casos de gangrena gaseosa se asocian con cepas de C. perfringens productoras de la toxina alfa5. La bacteria no libera toxinas cuando está limitada al torrente sanguíneo, para ello necesita un ambiente anaerobio como el tejido necrótico6. Bajo unas condiciones ideales de crecimiento, C. perfringens tiene un tiempo de duplicación de 7 minutos7 y por lo tanto, produce grandes cantidades de toxinas en un corto periodo de tiempo, lo que puede explicar el rápido empeoramiento clínico y las anormalidades en los parámetros analíticos obtenidos cuando la misma muestra es analizada 90 minutos más tarde en nuestro hospital. El recuento automático de la sangre puede mostrar unos niveles desproporcionadamente altos de hemoglobina en comparación con el hematocrito y en consecuencia, un aumento artificial de la hemoglobina corpuscular media (HCM) y la concentración de hemoglobina corpuscular media (CHCM). En nuestro caso además el recuento óptico de plaquetas fue anormalmente elevado debido a que el analizador clasificó erróneamente los bacilos como plaquetas (tabla 1).
Es difícil realizar un diagnóstico rápido de la sepsis por C. perfringens. Aunque normalmente en agar sangre produce una beta-hemólisis característica, con una segunda zona hemolítica menos intensa, es indispensable la identificación bacteriana después del cultivo de la sangre para realizar el diagnóstico. Este proceso de confirmación requiere tiempo; sin embargo, una extensión de la sangre periférica y una tinción de Gram pueden ayudar en la obtención de un diagnóstico presuntivo rápido.