El hierro es un elemento químico esencial para todos los organismos vivos, necesario para un amplio espectro de funciones metabólicas vitales. La exploración del metabolismo del hierro puede ser difícil en algunas situaciones, tales como en el paciente con una enfermedad crónica, por la respuesta de los biomarcadores frente a la inflamación. En los últimos años el laboratorio clínico ha incorporado nuevos biomarcadores a los tradicionalmente empleados, con el fin de mejorar su contribución al diagnóstico y seguimiento de la ferropenia. Se ha realizado una búsqueda sistemática de la evidencia científica publicada en los diez últimos años para los siguientes biomarcadores: el diagnóstico morfológico de la sangre periférica, los índices hematimétricos, y las concentraciones plasmáticas de transferrina (y sus índices), ferritina, receptor soluble de transferrina y hemoglobina, en la ferropenia. Se emiten recomendaciones para estos biomarcadores en relación al diagnóstico y manejo del paciente ferropénico.
Iron is an essential chemical element for all living organisms, and is required for a broad spectrum of vital metabolic functions. The study of iron metabolism can be challenging in some situations, such as in patients with chronic diseases, due to the effect of inflammation response. In recent years, clinical laboratory research has introduced new biomarkers to those commonly used, with the aim of improving the diagnosis and management of iron deficiency. In this work, a systematic search of the scientific evidence reported during the last decade has been made for the following biomarkers: morphological diagnosis of peripheral blood, hematimetric indices, and plasma concentrations of transferrin (and its indices), ferritin, transferrin receptor, and haemoglobin, in iron deficiency. Recommendations are made for these biomarkers related to the diagnosis and management of the iron-deficient patient.
El hierro es un elemento químico esencial para todos los organismos vivos. Este metal de transición es necesario para llevar a cabo un amplio espectro de funciones metabólicas tan importantes como el control del transporte de electrones a través de la cadena respiratoria, la síntesis de ADN y el aporte de oxígeno a los tejidos. Habitualmente, el hierro realiza su función unido a proteínas. Así, podemos hallar el hierro como: cofactor de varias enzimas (oxidasas, peroxidasas, catalasas e hidroxilasas), componente esencial de proteínas de transporte (transferrina, hemoglobina, mioglobina) o elemento activo en la cadena de transporte de electrones (citocromos y proteínas de hierro-azufre).
Principalmente, se atribuye su importancia biológica a su facilidad oxido-reductora. El hierro posee la capacidad de aceptar o donar un electrón, por lo que puede encontrarse en dos estados de oxidación: el ion férrico (hierro (III), la forma oxidada), y el ion ferroso (hierro (II), la forma reducida). Sin embargo, esta misma propiedad es la base de su toxicidad ya que, cuando no está unido a proteína o se encuentra en elevadas concentraciones, cataliza la producción de radicales hidroxilo (reacción de Fenton) que originan peroxidación de lípidos de membrana, proteínas y ácidos nucleicos y resulta finalmente en un estrés oxidativo que conduce hacia la muerte celular2.
Por tanto, el balance entre absorción, almacenamiento, utilización, transporte y eliminación de hierro se halla estrictamente regulado por complejos circuitos homeostáticos en el que intervienen numerosas proteínas especializadas. Tal es su complejidad, que la prevalencia de las entidades clínicas relacionadas con la homeostasis del hierro es elevada, incluyendo diferentes manifestaciones clínicas y abarcando todo el espectro desde la deficiencia de hierro, con o sin anemia, hasta la sobrecarga férrica hereditaria o adquirida.
El contenido total de hierro de un individuo sano se mantiene entre 3,5 a 4g en la mujer y de 4 a 5g en el hombre. Puede considerarse que el hierro en el organismo se distribuye en tres grandes compartimentos: funcional, depósito y transporte. Aproximadamente, el 60-70% está constituido por hierro funcional que se localiza esencialmente en la hemoglobina de los hematíes maduros (circulación; 1800mg) y precursores eritroides (médula ósea; 300mg), y en la mioglobina (músculo esquelético; 300mg). Entre el 30-40% del hierro restante es almacenado (hierro de depósito) en las células del parénquima hepático (1000mg) y en los macrófagos del sistema reticuloendotelial (600mg) en forma de ferritina y hemosiderina. Únicamente 3-4mg de hierro (0,1-0,2% del hierro del organismo) circulan en el plasma como hierro intercambiable unido a la transferrina3.
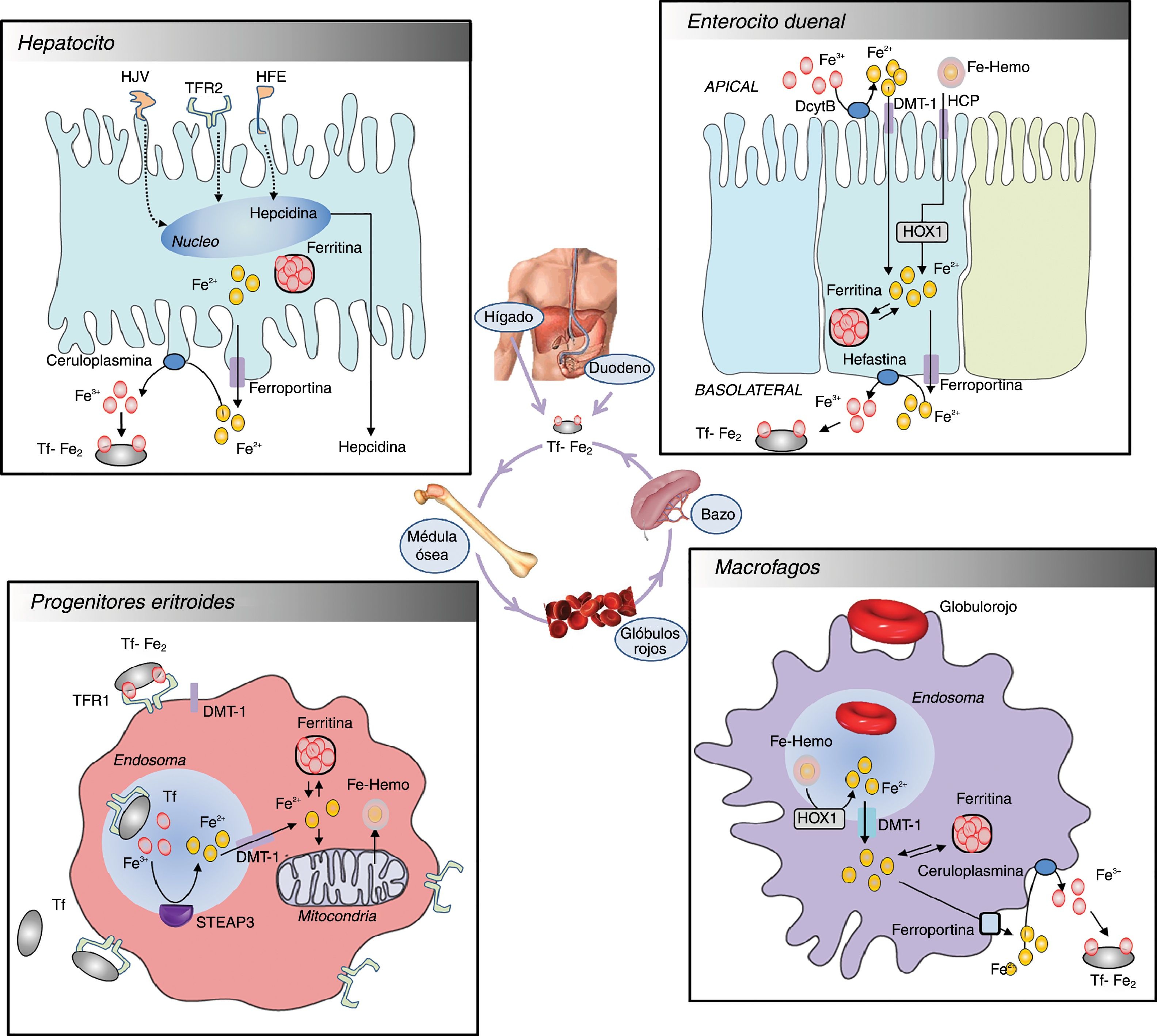
MetabolismoAbsorción de hierroDiariamente se absorben 1-2mg de hierro a través de la dieta por los enterocitos duodenales. En la dieta el hierro puede encontrarse en forma inorgánica o no hemínico (hierro (III), o hierro (II)), o mayoritariamente, como hierro hemínico (Fe-hemo). Inicialmente, el hierro (III) se reduce a hierro (II) por la acción de la reductasa citocromo B duodenal (DcytB)4. El hierro (II) generado es transportado dentro de la célula por el transportador de metales divalentes 1 (DMT-1). El hierro unido al grupo hemo, por el contrario, entra al enterocito a través de un proceso que no se conoce totalmente. Si bien la entrada del hierro está cuestionada, ésta puede estar mediada por la proteína transportadora de hemo (HCP). De esta forma, el grupo hemo internalizado es posteriormente degradado por la hemoxigenasa 1 (HOX1) y se libera el hierro (II)5. Una vez internalizado, el hierro puede ser almacenado dentro de los enterocitos intestinales en forma de ferritina, o bien puede ser transportado a la sangre. El hierro (II) es liberado a la circulación portal a través de la membrana basolateral mediante la proteína transportadora ferroportina6. El último paso requiere la hefestina, una oxidasa homóloga a la ceruloplasmina, que oxida el hierro (II), para que pueda ser transportado por transferrina. La transferrina facilita la distribución y el intercambio celular del hierro en los tejidos mediante la interacción con los receptores de transferrina celulares. Este transporte de hierro es inhibido por la unión de la hormona peptídica hepcidina a la ferroportina. La hepcidina se une a la ferroportina y se forma un complejo que induce un cambio conformacional, resultando internalizado en una vesícula por endocitosis. Posteriormente, dicho complejo hepcidina-ferroportina sufre degradación lisosomal, el hierro queda así atrapado intracelularmente en el enterocito, con la consecuente disminución de la absorción del hierro7. En una homeostasis férrica normal, la hepcidina inhibe el transporte de hierro al plasma desde el intestino al impedir la absorción en los enterocitos duodenales8. Véase la figura 1.
Transporte y uso de hierroEl hierro (III) plasmático vehiculado por la transferrina se une a los receptores de la transferrina (TfRs) situados en la membrana celular de los progenitores eritroides de la médula ósea, principal consumidor de hierro del organismo (véase apartado Receptor soluble de transferrina). El complejo es internalizado en las células mediante vesículas endosómicas, donde al acidificarse, los iones hierro (III) son liberados del complejo TfR1-Transferrina, reducidos a hierro (II) por la ferroreductasa STEAP3 y enviados al citosol mediante los transportadores de hierro DMT-19. El hierro citoplasmático o bien permanece almacenado en forma de ferritina o es empleado en la mitocondria fundamentalmente para la síntesis del grupo Fe-hemo de la hemoglobina y las agrupaciones proteicas de hierro-azufre10.
Almacenaje y reciclaje de hierroJunto con el bazo y la medula ósea, el hígado es uno de los principales reservorios de hierro. El hierro (II) puede ser liberado al torrente sanguíneo por la acción conjunta de ferroportina y ceruloplasmina. El hígado es también productor de hepcidina, hormona que está íntimamente implicada en la homeostasis de hierro11. La hepcidina secretada por los hepatocitos circula por el plasma unida a α2-macroglobulina12. La producción de esta hormona, además de estar regulada por el grado de saturación de transferrina y el nivel de TFRs, también responde a estímulos inflamatorios e infecciosos, así como a estados de hipoxia13.
El macrófago, célula retículoendotelial, es responsable de reciclar el hierro de los glóbulos rojos senescentes. El hierro liberado del grupo hemo por acción de la HOX1 puede ser almacenado intracelularmente por la ferritina o la hemosiderina, o ser entregado a los progenitores eritroides para la formación de nuevos eritrocitos. La ferroportina es responsable del transporte del hierro (II) del macrófago a la circulación, para ello requiere la acción de la ceruloplasmina, que lo oxida a hierro (III), para que sea unido a la apotransferrina, de la misma manera que ocurre en los hepatocitos. En una homeostasis férrica normal, la hepcidina inhibe el transporte de hierro al plasma, gracias a la acción sobre la ferroportina, desde los macrófagos hepáticos y esplénicos, que reciclan el hierro de los hematíes senescentes y desde los hepatocitos que almacenan hierro8.
Deficiencia de hierroLa causa más frecuente de anemia en todo el mundo es la eritropoyesis con restricción del hierro, que se produce como consecuencia de uno o más tipos de déficit de hierro o ferropenia. La deficiencia de hierro puede distinguirse entre déficit absoluto de hierro, déficit funcional de hierro y secuestro de hierro por inflamación (también llamado anemia de enfermedades crónicas o anemia inflamatoria)14.
Déficit absoluto de hierro. Es la alteración nutricional más frecuente y ampliamente distribuida, la principal causa de anemia y un problema importante de salud pública15. Es especialmente común en niños en edad preescolar y adolescente, mujeres en edad fértil y ancianos. La deficiencia de hierro se relaciona con una absorción insuficiente (ingesta dietética insuficiente o inadecuada, enfermedades gastrointestinales e infecciones), requerimiento de hierro fisiológicamente aumentado (períodos de crecimiento rápido, lactantes, embarazo, lactancia), pérdidas de sangre agudas o crónicas (hemorragias perinatales o digestivas, pérdidas menstruales excesivas, pérdidas de sangre por otros órganos). Aunque el déficit absoluto de hierro es un proceso continuo puede desglosarse en tres etapas secuenciales16:
- •
Depleción de los depósitos de hierro: El hierro de depósito esta disminuido, descendiendo progresivamente la concentración de ferritina sérica.
- •
Eritropoyesis ferropénica: La eritropoyesis disminuye debido a la deficiencia de hierro de depósito. Característicamente se observa ferropenia, índice de saturación de transferrina bajo, aumento de la concentración de transferrina y del receptor soluble de transferrina. Sin embargo, la concentración en sangre de hemoglobina es casi normal.
- •
Anemia ferropénica (déficit absoluto de hierro): El hierro de depósito ya se ha consumido y la concentración sanguínea de hemoglobina se halla significativamente disminuida. La anemia ferropénica se caracteriza por presentar hematíes con un menor volumen corpuscular medio (microcíticos) y menor concentración de hemoglobina corpuscular media (hipocrómicos), que también se refleja en un aumento de los eritrocitos hipocrómicos. Además, la concentración plasmática de ferritina es baja, si no coexiste inflamación.
Se caracteriza por una incorporación insuficiente de hierro a los progenitores eritroides pese a que los depósitos de hierro totales del organismo son suficientes17. Aparece cuando la movilización del hierro no es suficientemente rápida para satisfacer el aumento de la demanda durante la estimulación intensa por la eritropoyetina endógena o con el tratamiento con agentes estimulantes de la eritropoyesis. El déficit de hierro funcional también puede desarrollarse durante el aumento de la eritropoyesis mediado por la eritropoyetina endógena en respuesta a la anemia o a una flebotomía. En un sentido más amplio, este tipo de déficit es un componente principal de la anemia de enfermedades crónicas.
Anemia de enfermedades crónicasSe instala en el contexto de enfermedades autoinmunes, crónicas, infecciosas o neoplásicas18. El común denominador es el componente inflamatorio, por lo que también se denomina como anemia inflamatoria. Se observa en la mayoría de los casos en pacientes con enfermedades inflamatorias crónicas, cuando se bloquea la liberación de hierro de los macrófagos del sistema reticuloendotelial, enterocitos y hepatocitos, de forma que el suministro de hierro disponible en el plasma disminuye. Representa la segunda forma de anemia más prevalente19. El secuestro del hierro está impulsado por la activación crónica de células inflamatorias y la producción excesiva de citocinas, principalmente proinflamatorias (IL-1β, IL-6, TNF-α e IFN-γ). Las citocinas proinflamatorias tienen las siguientes funciones: 1) estimulan la captación y almacenamiento de hierro en los macrófagos del sistema reticuloendotelial (acumulación de ferritina y hemosiderina), 2) inhiben tanto la proliferación y diferenciación de células progenitoras eritroides (efectos inhibidores de IFN-γ, TNF-α e IL-1, inducción de apoptosis por TNF-α), como la respuesta de la médula ósea a la eritropoyetina, y 3) reducen la vida media de los hematíes. La expresión aumentada en hepatocitos de hepcidina, proteína de fase aguda cuya síntesis es estimulada por IL-6 y endotoxina, produce en modelos experimentales anemia, inhibiendo la absorción duodenal de hierro. Las citocinas antiinflamatorias (IL-4, IL-10 e IL-13) favorecen la retención de hierro en los macrófagos activados y participan en la inducción de ferropenia e hiperferritinemia de las enfermedades crónicas inflamatorias20.
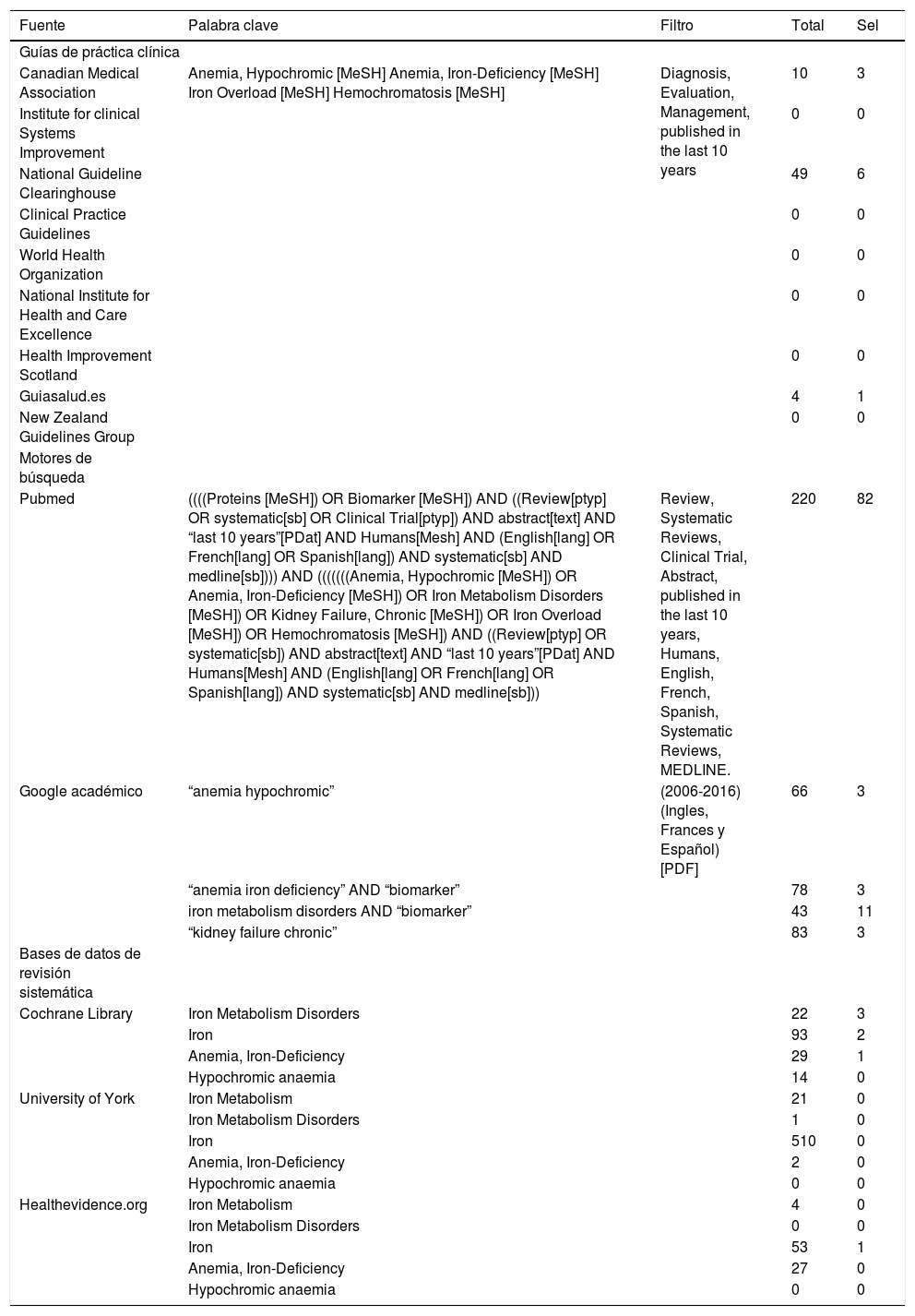
ObjetoEl objeto de este documento es una revisión sobre el significado clínico del diagnóstico morfológico de la sangre periférica, de los índices hematimétricos, y de las magnitudes proteicas utilizadas habitualmente en la exploración de la ferropenia, que son las siguientes: 1) concentraciones plasmáticas de transferrina y sus índices (capacidad de fijación de hierro, coeficiente de fijación de hierro por la transferrina e índice de saturación de transferrina), 2) ferritina, 3) receptor soluble de transferrina, 4) hemoglobina. Asimismo, el documento pretende establecer recomendaciones para la adecuada utilización de los parámetros mencionados en el laboratorio clínico. La tabla 1 resume la evidencia científica que la revisión bibliográfica puso de manifiesto y que motivó la realización del documento.
Detalles de la búsqueda sistemática realizada en el primer semestre de 2016
| Fuente | Palabra clave | Filtro | Total | Sel |
|---|---|---|---|---|
| Guías de práctica clínica | ||||
| Canadian Medical Association | Anemia, Hypochromic [MeSH] Anemia, Iron-Deficiency [MeSH] Iron Overload [MeSH] Hemochromatosis [MeSH] | Diagnosis, Evaluation, Management, published in the last 10 years | 10 | 3 |
| Institute for clinical Systems Improvement | 0 | 0 | ||
| National Guideline Clearinghouse | 49 | 6 | ||
| Clinical Practice Guidelines | 0 | 0 | ||
| World Health Organization | 0 | 0 | ||
| National Institute for Health and Care Excellence | 0 | 0 | ||
| Health Improvement Scotland | 0 | 0 | ||
| Guiasalud.es | 4 | 1 | ||
| New Zealand Guidelines Group | 0 | 0 | ||
| Motores de búsqueda | ||||
| Pubmed | ((((Proteins [MeSH]) OR Biomarker [MeSH]) AND ((Review[ptyp] OR systematic[sb] OR Clinical Trial[ptyp]) AND abstract[text] AND “last 10 years”[PDat] AND Humans[Mesh] AND (English[lang] OR French[lang] OR Spanish[lang]) AND systematic[sb] AND medline[sb]))) AND (((((((Anemia, Hypochromic [MeSH]) OR Anemia, Iron-Deficiency [MeSH]) OR Iron Metabolism Disorders [MeSH]) OR Kidney Failure, Chronic [MeSH]) OR Iron Overload [MeSH]) OR Hemochromatosis [MeSH]) AND ((Review[ptyp] OR systematic[sb]) AND abstract[text] AND “last 10 years”[PDat] AND Humans[Mesh] AND (English[lang] OR French[lang] OR Spanish[lang]) AND systematic[sb] AND medline[sb])) | Review, Systematic Reviews, Clinical Trial, Abstract, published in the last 10 years, Humans, English, French, Spanish, Systematic Reviews, MEDLINE. | 220 | 82 |
| Google académico | “anemia hypochromic” | (2006-2016) (Ingles, Frances y Español) [PDF] | 66 | 3 |
| “anemia iron deficiency” AND “biomarker” | 78 | 3 | ||
| iron metabolism disorders AND “biomarker” | 43 | 11 | ||
| “kidney failure chronic” | 83 | 3 | ||
| Bases de datos de revisión sistemática | ||||
| Cochrane Library | Iron Metabolism Disorders | 22 | 3 | |
| Iron | 93 | 2 | ||
| Anemia, Iron-Deficiency | 29 | 1 | ||
| Hypochromic anaemia | 14 | 0 | ||
| University of York | Iron Metabolism | 21 | 0 | |
| Iron Metabolism Disorders | 1 | 0 | ||
| Iron | 510 | 0 | ||
| Anemia, Iron-Deficiency | 2 | 0 | ||
| Hypochromic anaemia | 0 | 0 | ||
| Healthevidence.org | Iron Metabolism | 4 | 0 | |
| Iron Metabolism Disorders | 0 | 0 | ||
| Iron | 53 | 1 | ||
| Anemia, Iron-Deficiency | 27 | 0 | ||
| Hypochromic anaemia | 0 | 0 | ||
Sel: trabajos seleccionados
Dado que la anemia ferropénica se debe a una disminución de la síntesis de hemoglobina, el diagnóstico morfológico de esta entidad se realiza mediante la simple observación de la morfología eritrocitaria en la extensión de sangre periférica teñida con May Grünwald-Giemsa. En la anemia ferropénica los hematíes son microcíticos (con volumen corpuscular medio o VCM< 80 fL) e hipocromos debido a su menor contenido hemoglobínico. Junto al menor valor del VCM, es interesante comprobar el valor aumentado de la dispersión de la curva de distribución eritrocitaria (ADE), lo que pone de manifiesto la anisocitosis eritrocitaria. Además de la microcitosis ferropénica, los valores de la hemoglobina corpuscular media o HCM se encontrarán también disminuidos, siendo el reflejo de la hipocromía manifiesta observada en el frotis sanguíneo.
Junto a las alteraciones eritrocitarias, es muy frecuente en la observación del frotis sanguíneo el hallazgo de un elevado número de plaquetas (trombocitosis reactiva). No obstante, la trombocitosis no suele superar los valores de 700 x 109/L. Además, el núcleo de los leucocitos puede presentar un cierto grado de hipersegmentación, aunque esta alteración morfológica no es tan marcada como en la anemia megaloblástica. Tanto la trombocitosis como la leucocitosis, si acompañan a la ferropenia, desaparecen con el tratamiento21.
La disminución de la síntesis de hemoglobina, en más del 90% de los casos, obedece a un déficit de hierro. En el 10% restante, otros mecanismos que determinan el equilibrio del hierro en el organismo pueden estar implicados, como por ejemplo la llegada insuficiente de hierro a los eritroblastos por anemia inflamatoria, o trastornos congénitos de la síntesis de cadenas de globina (talasemias) y defectos congénitos en la síntesis del grupo hemo (anemias sideroblásticas). Los trastornos mencionados también darían lugar a una microcitosis junto a hipocromía en la observación del frotis de sangre periférica, por lo que antes de iniciar el tratamiento con hierro debe realizarse el correcto diagnóstico diferencial de la anemia hipocroma y microcítica22.
La tinción con May Grünwald-Giemsa es la más recomendable y ampliamente utilizada para poner de manifiesto las alteraciones morfológicas de las células sanguíneas. Aunque los tiempos de tinción, diluciones y pH del tampón pueden ser variables en cada laboratorio, y en los diferentes equipos de tinción automatizada, por lo general se utiliza un minuto para la fijación con May Grünwald y 10 minutos para la tinción con Giemsa.
TransferrinaLa transferrina es una glucoproteína con una masa molecular de 79,6 KDa y forma elipsoidal, que presenta una cadena peptídica de 679 aminoácidos. La parte glucídica la constituyen dos cadenas complejas de oligosacáridos N-enlazadas, que varían en su grado de ramificación, presentando cada una de ellas un residuo de ácido siálico en posición terminal23.
La proteína dispone de dos puntos de unión reversible para dos iones hierro Fe (III), uno en el extremo carboxi-terminal y otro en el amino-terminal. Su migración electroforética corresponde a la zona β1-globulina, y es su concentración la mayoritaria de esta fracción. Su síntesis es fundamentalmente hepática, y se produce cuando la ferritina intracelular de los hepatocitos disminuye. El gen que la codifica se sitúa en el brazo largo del cromosoma 3 (3q21), cerca del correspondiente al receptor de la transferrina. La molécula sintetizada inicialmente tiene de 19 a 20 aminoácidos más, y antes de pasar a la circulación sufre una proteólisis, y posteriormente una glicosilación. Tiene una semivida de 8 días. Se han descrito más de 20 variantes genéticas de transferrina. La transferrina existe en la circulación como apotransferrina y formas mono-diférricas23.
La función principal de la transferrina es el transporte del hierro procedente bien de la absorción intestinal, del catabolismo de la hemoglobina o de los depósitos tisulares, hacia su posterior cesión mayoritariamente a los reticulocitos y los eritroblastos para la síntesis de la hemoglobina, o para almacenaje en depósitos hepáticos, a través de la interacción con receptores específicos. La transferrina tiene también un papel protector, ya que su unión con el hierro evita los efectos adversos que éste podría causar si circulara libremente. La transferrina también está relacionada con el transporte del Zn(II), Mn(II), Cr(III), Cu(III), y quizás posea un papel detoxificante de estos metales. Asimismo, tiene una acción bacteriostática al limitar el hierro necesario para el crecimiento bacteriano23.
La concentración plasmática de transferrina se encuentra elevada en la ferropenia, en el embarazo y durante el tratamiento con anticonceptivos orales, ya que los estrógenos aumentan su síntesis. Se halla disminuida en las siguientes situaciones: 1) el déficit congénito de transferrina, 2) en cualquier inflamación crónica o neoplasia, 3) en infecciones, 4) en estados de catabolismo o pérdida proteica, tales como la malnutrición y el síndrome nefrótico, 5) en los estados en que el organismo tiene una presión oncótica elevada, tales como el mieloma múltiple o las enfermedades hepatocelulares, y 6) en los estados de sobrecarga férrica.
La sensibilidad en el diagnóstico de la ferropenia se ve limitada, ya que en los estados de ferropenia asociados a una malnutrición hay una disminución de la síntesis de transferrina, y su concentración plasmática permanece dentro del intervalo de referencia.
Los principios de medida más utilizados para la determinación de la transferrina son la inmunonefelometría y la inmunoturbidimetría. Existe un material de referencia internacional certificado (ERM-DA-470k) con valores asignados para diferentes proteínas incluyendo la transferrina24.
Capacidad de fijación de hierroLa capacidad total de fijación de hierro (CTFH) es la concentración de hierro máxima que puede transportar un volumen determinado de suero. Dado que la transferrina es la principal proteína de transporte de hierro en la sangre, es una medida indirecta de su concentración. El método clásico de Ramsay se basa en la determinación de la concentración de hierro que es capaz de fijar el suero tras la saturación con hierro Fe (III) y la eliminación del exceso mediante adsorción con carbonato de calcio o magnesio25. La capacidad latente de fijación de hierro (CLFH) es la capacidad de reserva de transporte de hierro que tiene el suero. Puede medirse directamente o calcularse mediante la siguiente fórmula:
CLFH (μmol hierro/L) = CTFH (μmol hierro/L) – sideremia (μmol hierro/L)
La capacidad de fijación de hierro por la transferrina (CFTf) es la concentración de hierro teórica que transporta la transferrina presente en un volumen determinado de suero. En el cálculo de la capacidad de fijación del hierro por la transferrina, se considera que cada molécula de transferrina es capaz de transportar dos iones Fe (III).
CFTf (μmol hierro/L) = Transferrina (μmol/L) x 2
Dado que la masa molecular de la transferrina es de 79,6 kDa, la fórmula queda como:
CFTf (μmol hierro/L) = Transferrina (g/L) x 25,1
La capacidad de la saturación de la transferrina representa la concentración plasmática de la transferrina, y se eleva y disminuye por las mismas causas que ésta. Su utilidad clínica es la misma que la de la transferrina, además del cribado de la hemocromatosis hereditaria, aunque es menos efectivo para ello que el índice de la saturación de la transferrina.
Coeficientes de saturación.El coeficiente de saturación es el cociente expresado como porcentaje entre la sideremia y la capacidad total de fijación de hierro por el suero. Determina qué porcentaje de las proteínas de transporte del hierro en el suero (mayoritariamente la transferrina) se encuentran saturadas con hierro.
El índice de saturación de transferrina (IST) es el cociente expresado como porcentaje entre la sideremia y la capacidad de fijación del hierro por la transferrina.
IST = Hierro (μmol/L) x 100 / CFTf (μmol hierro/L)
El IST expresa el porcentaje del hierro presente en el suero en relación con la totalidad del hierro que teóricamente puede asumir la transferrina presente en este sistema.
El IST se halla elevado en la hemocromatosis hereditaria, la ingestión excesiva del hierro, las talasemias, la deficiencia de la vitamina B6, las anemias aplásicas, y las anemias sideroblásticas. Se encuentra disminuido en la eritropoyesis ferropénica, las enfermedades malignas del estómago e intestino delgado, y en el embarazo.
El IST es un marcador de la eritropoyesis en relación al hierro: define el hierro presente en el compartimento funcional, en contraposición al que se encuentra en el compartimento de reserva. Por otro lado, la saturación de transferrina parece ser un test válido para el cribado de pacientes seleccionados con sospecha de sobrecarga férrica y enfermedad hepática para realizar el estudio genético de hemocromatosis hereditaria.
Un IST elevado se ha sugerido como marcador de riesgo de enfermedad coronaria, diabetes mellitus (DM), cáncer o mortalidad. Asimismo, se ha propuesto el estrés oxidativo que induce el hierro como mecanismo subyacente entre la asociación de índice de la saturación de la transferrina elevado y DM, cáncer, y mortalidad total. Se requieren estudios adicionales para valorar la posible utilización de este índice como marcador de riesgo26.
FerritinaLas ferritinas constituyen una amplia superfamilia de proteínas de almacenamiento del hierro. La apoferritina forma un recipiente aproximadamente esférico, con una cavidad central de 80Å de diámetro capaz de contener hasta 4500 átomos de hierro (III) en forma de hidróxido de fosfato férrico insoluble ([(FeOOH8). FeO. PO3H2])32. Cada molécula tiene una masa molecular de aproximadamente 450 KDa y un diámetro de 120Å. La estructura de la apoferritina está compuesta por 24 subunidades unidas por enlaces no covalentes.
Las subunidades pueden estar formadas por dos tipos de polipéptidos: el monómero H (heavy, heart), que tiene 182 aminoácidos, un peso de 21 KDa y un punto isoeléctrico ácido (4,8 – 5,2), y el monómero L (light, liver), que contiene 174 aminoácidos, con una masa molecular de 18,5 KDa y un punto isoeléctrico más básico (5,3 – 5,8). Las cadenas H confieren actividad de ferroxidasa al heteropolímero, y las cadenas L proporcionan sitios de nucleación para la fijación de hierro. Ambas subunidades presentan aproximadamente 55% de homología en la secuencia de aminoácidos. La proporción de estas subunidades varia ampliamente dependiendo del tipo de tejido, así, el corazón y el riñón son ricos en el monómero H, y en el hígado y el bazo predomina el monómero L.
Las propiedades electroforéticas, inmunológicas y metabólicas de las isoferritinas aisladas de diferentes tejidos dependen esencialmente del cociente H/L de la molécula. Las ferritinas ricas en subunidades H poseen elevada actividad de ferroxidasa y almacenan hierro de forma limitada (menos de 1000 átomos de hierro [III] por molécula de ferritina). Las ferritinas ricas en subunidades L, características de tejidos que almacenan hierro como el hígado y el bazo, contienen más de 1500 átomos de hierro por molécula de ferritina.
La forma molecular que contiene el hierro se denomina holoferritina o simplemente ferritina. La mayor parte de las células del organismo contienen ferritina en el citosol, y es especialmente abundante su expresión en las células relacionadas con la síntesis de hemoglobina (eritroblastos y reticulocitos), con su degradación (macrófagos), o con su reserva (hepatocitos)27. La ferritina citosólica es producida por el retículo endoplásmico liso y no está glicosilada. La síntesis de ferritina es regulada principalmente a nivel post-transcripcional en el citosol y depende de la concentración de hierro libre intracelular. Este es el sistema de regulación mejor caracterizado. Véase el siguiente apartado.
La ferritina circulante solo contiene cantidades traza de hierro, por lo que no contribuye al transporte interno de hierro. Es sintetizada por el retículo endoplásmico rugoso y es glicosilada en el aparato de Golgi antes de su liberación. La ferritina plasmática es un homopolímero L (60-80% glicosiladas). La mayoría de las células del organismo producen ferritina y secretan una proporción de ferritina glicosilada al plasma, por lo que la concentración de ferritina plasmática refleja la cantidad de ferritina del organismo y por tanto los depósitos de hierro en ausencia de inflamación o de enfermedades genéticas como el síndrome de hiperferritinemia con cataratas28,29.
La ferritina convierte el Fe (II) en Fe (III). Asimismo, facilita hierro en situaciones celulares críticas a la vez que captura el hierro intracelular, y así protege a los lípidos, ADN y proteínas del potencial efecto toxico del hierro.
Existe un tercer tipo de ferritina, ferritina mitocondrial, formada por subunidades de 22 KDa de tipo H codificadas por un gen en el cromosoma 5q23.129. La ferritina mitocondrial posee actividad ferroxidasa (citoprotector en anemias sideroblásticas), y además tiene una función moduladora en el tráfico de hierro desde el citoplasma a las mitocondrias, y en la síntesis del grupo hemo30,31.
La neuroferrinopatía o enfermedad de los ganglios del adulto, es una enfermedad autosómica dominante extrapiramidal resultante de varias mutaciones en el gen FTL, implicado en la síntesis de una región receptiva al hierro de la subunidad L (véase el siguiente apartado). La mutación afecta a la zona que regula la síntesis en función de la disponibilidad de hierro. Estas llevan a una acumulación de hierro dentro de las células cerebrales, con una lesión posterior de los ganglios basales. El síndrome de hiperferritinemia y cataratas congénitas es debido a varias mutaciones en la misma secuencia que la antes mencionada. Cursa con concentraciones séricas de ferritina altas sin sobrecarga de hierro, y cataratas congénitas por la acumulación de hierro en el cristalino. Se transmite mediante herencia autosómica dominante.
En ausencia de inflamación, la concentración plasmática de ferritina se correlaciona estrechamente con los depósitos de hierro del organismo: 1μg/L de ferritina sérica corresponde a 8-10mg de hierro almacenado en un adulto sano32. Véase la tabla 2. Hay diferencias fisiológicas en función de la edad y el sexo: los recién nacidos tienen concentraciones séricas altas de ferritina, que disminuyen en los primeros 5 meses de vida. Durante la infancia van aumentando hasta el fin de la adolescencia. Existe una alta variación intraindividual, con un coeficiente de variación biológica intraindividual (CVi) del 20%.
Causas de concentraciones bajas y altas en suero de ferritina
| Disminución | Deficiencia de hierroEmbarazoPérdidas crónicas de sangreHipotiroidismoDéficit de ácido ascórbicoSíndrome de piernas inquietas |
| Aumento | Enfermedad hepáticaRespuesta de fase aguda (inflamación, infección)Neoplasias (linfoma, leucemia, carcinomas...)Anemia de enfermedad crónicaInsuficiencia renal crónicaTalasemiaAnemia sideroblásticaHemocromatosis hereditariaHiperferritinemia hereditaria con cataratas congénitasHipertiroidismoPrimer trimestre del embarazoEnfermedad de StillSíndrome hemofagocíticoAtaxia de Friedreich |
Las indicaciones para la medida de la concentración plasmática de la ferritina son la detección de deficiencia de hierro y la monitorización del tratamiento. La ferritina es una proteína de fase aguda que aumenta significativamente en procesos inflamatorios, infección, hepatopatías (incluyendo hemocromatosis hereditaria), y ciertas neoplasias. El aumento de la concentración de ferritina en enfermedades crónicas, independiente de los depósitos de hierro constituye la principal limitación del uso de la ferritina para la detección de deficiencia de hierro. Aunque la ferritina no es un buen marcador para la detección de sobrecarga férrica, resulta útil para monitorizar el tratamiento con sangrías de la hemocromatosis hereditaria.
Actualmente hay una gran variedad de procedimientos de medida de la ferritina basados en el inmunoanálisis. Existe un material de referencia de la Oficina Comunitaria de Referencia (BCR) preparado originalmente a partir de ferritina humana del hígado o el bazo, certificado por la Organización Mundial de la Salud, y distribuido por el Instituto Nacional de Patrones Biológicos y Control (NIBSC). El material de referencia empleado actualmente, NIBSC 94/572, consiste en una dilución en plasma humano de la subunidad L de una ferritina recombinante.
Receptor soluble de transferrinaEl receptor de transferrina TfR1 es una glucoproteína transmembrana de estructura homodimérica, de masa molecular 190 kDa. El extremo aminoterminal está en el dominio citoplasmático y se encuentra fosforilado. El dominio extracelular contiene dos puentes disulfuro (en la posición 89 y 98) que unen los dos monómeros, e incluye una pequeña región glicosilada y 3 subdominios: proteasa, apical y helicoidal. Existe también un tercer segmento transmembrana de carácter hidrofóbico. Cada molécula de receptor puede fijar dos moléculas de transferrina. A un pH de 7,4 la afinidad del TfR1 es mayor para la transferrina diférrica en comparación con la monoférrica o apotransferrina. Los residuos glucídicos del receptor pueden influir en la unión a la transferrina: el TfR1 no glicosilado tiene una menor afinidad por la transferrina. El gen que codifica el receptor de transferrina TfR1 está localizado en el cromosoma 3q29.
El receptor de transferrina TfR1 es esencial para la captación celular de hierro. Se localiza en la mayoría de las células, con la excepción de los hematíes maduros. Su mayor expresión ocurre en los tejidos que sintetizan hemoglobina (precursores eritroides de la médula ósea), y también en células normales en fase de división rápida, en la placenta, y en tejidos neoplásicos. Se distribuye en la superficie celular y a nivel intracelular. El número de TfR1 superficiales está determinado por la proliferación celular, diferenciación celular y la demanda de hierro celular. La regulación positiva de la expresión TfR1 puede resultar de un aumento de la síntesis de TfR de novo o desde la movilización de TfR1 desde el pool de almacenamiento.
Mediante un mecanismo de endocitosis, los receptores de transferrina unidos al ligando (transferrina diférrica) son incluidos en un endosoma especializado, donde mediante la acción de una bomba de protones (ATP-asa dependiente) se produce un descenso en el pH. Este produce cambios conformacionales en las proteínas que resultan en la liberación del hierro unido a transferrina en el citosol. En las células eritroides medulares la mayor parte del hierro liberado se utiliza para la síntesis de hemoglobina, mientras que el exceso se deposita en la ferritina. A pH neutro, la apotransferrina se disocia del TfR1 y son utilizados en nuevos ciclos de fijación y captación de hierro.
El control de la homeostasis del hierro celular está regulado a través de un mecanismo post-transcripcional que implica a la síntesis de TfR1 y ferritina. En el proceso intervienen proteínas capaces de unirse al ARNm citoplasmático, conocidas como proteínas reguladoras del hierro (IRP1 e IRP2). La unión se produce de forma muy específica con “elementos receptivos al hierro” (IRE) situados en las regiones 3’ y 5’ no traducidas de ARNm, que codifican para TfR1 y ferritina respectivamente. La unión de las IRP al ARN está mediada por la concentración de hierro intracelular. Cuando hay deficiencia de hierro, las IRP se unen con alta afinidad a los IRE. Como resultado, el ARNm de TfR1 se estabiliza, y se facilita la síntesis de TfR1 y la captación de hierro, mientras que la traducción de ferritina está reprimida. Por el contrario, cuando el hierro celular está en exceso, las IRP no se unen al ARN, lo que permite la traducción de ARNm de la ferritina, y se favorece concomitantemente el almacenamiento de hierro en ferritina. A la vez, la degradación de ARNm de TfR1 es acelerada, y disminuye la síntesis de TfR1 y aumenta la concentración de hierro. Este mecanismo regulador permite a la célula coordinar la captación y almacenamiento del hierro según el hierro disponible y requisitos del mismo.
Aparte de las demandas de hierro celular, la proliferación de eritrocitos es un estímulo importante para la síntesis y expresión de TfR eritroide. La eritropoyetina (EPO), una glico-proteína predominantemente sintetizada por el riñón, es el principal factor de crecimiento que regula la producción de eritrocitos. Actúa a través de receptores de superficie específicos en células progenitoras de eritrocitos y estimula la proliferación, expresión de TfR, esta última posiblemente vía activación del IRP.
El receptor de transferrina TfR2 presenta moderada homología con TfR1. La homología de aminoácidos con TfR1 es del 66%. Comparado con TfR1, el papel de TfR2 es menos significativo. TfR2 tiene 25 veces menos afinidad por el complejo hierro-transferrina que TfR1. En cambio, la expresión de TfR2, es específica y mayor que la de TfR1 en el tejido hepático y duodenal, y no hay mecanismo de regulación postranscripcional. El gen que codifica TfR2 está localizado en el cromosoma 3q22. Algunas mutaciones en este gen del TfR2 causan la hemocromatosis hereditaria tipo 3, enfermedad caracterizada por un exceso de absorción del hierro de la dieta y unos depósitos de hierro en varios tejidos, sobre todo en el hígado.
Algunos estudios indican que el hígado es el principal regulador de la absorción de hierro de la dieta y de la liberación del hierro almacenado31. Las moléculas de TfR2 actúan como sensores de la concentración plasmática de transferrina diférrica. La expresión de TfR2 depende directamente de la concentración de transferrina diférrica (holotransferrina), independientemente de la presencia de anemia o de sobrecarga férrica hepática. Existe evidencia de que en el hígado TfR2, hemojuvelina y HFE, son reguladores de la síntesis y secreción de hepcidina33–37.
En el suero humano, menos del 1% del receptor de transferrina se halla intacto, la mayoría está en la forma truncada, el receptor soluble de transferrina. La forma truncada resulta de la pérdida de los dominios citoplasmático y transmembrana, mediante proteólisis entre los aminoácidos 100 y 101. Se trata de una forma monomérica de masa molecular 85 KDa que forma un complejo con una molécula de transferrina. Se originan en el ciclo endocítico: una pequeña cantidad de TfR endocitados son procesados de un modo diferente y, posteriormente, son liberados por exocitosis y se complejan para transferrina en la circulación38,39.
En los adultos sanos la concentración del receptor soluble de transferrina presenta una distribución normal y no está influida por la edad, sexo y estado pre o postmenopáusico. Sí se han hallado diferencias raciales: en negros, las concentraciones del receptor soluble de transferrina son aproximadamente un 9% mayores que en asiáticos, caucásicos e hispanos. La variación intraindividual del receptor soluble de transferrina en sujetos sanos es moderada con un CVi del 12%40.
Los precursores medulares eritroides (eritroblastos) constituyen la principal fuente de receptor soluble de transferrina (70-80% del total). Existe una buena correlación entre la concentración sérica de receptor de transferrina y la actividad proliferativa eritropoyética medular39,41. La concentración de receptor soluble de transferrina aumenta rápidamente en la eritropoyesis ferropénica, y no está afectada por inflamación, infección, hepatopatías, terapia con estrógenos o embarazo. Véase la tabla 3.
Causas de concentraciones bajas y altas en suero de receptor soluble de transferrina
| Disminución | Eritropoyesis hipoproliferativa: insuficiencia renal crónica, anemia aplásica y enfermedad post-transplante de medula ósea.Aplasia medular (post-quimioterapia)Hemocromatosis hereditaria |
| Aumento | Trastornos hematológicos con eritropoyesis hiperplásica: anemias, esferocitosis hereditaria, beta talasemia y policitemia vera, síndrome mielodisplásico, mielofibrosis, leucemia linfocítica crónica.Anemia ferropénicaDeficiencia de hierro funcional y anemia ferropénicaAnemia hemolítica (autoinmune)Eritropoyesis hiperproliferativa (talasemia, anemia megaloblástica) |
No se han elaborado recomendaciones en relación con el uso de anticoagulante, extracción de sangre y el intervalo de tiempo entre esta última y la centrifugación. La concentración del receptor soluble de transferrina en suero aumenta progresivamente con el tiempo de centrifugación previa, como resultado del contacto con EDTA que se utilizó como anticoagulante. Existen varios procedimientos de medida disponibles basados en el inmunoanálisis para la determinación del receptor soluble de transferrina: inmunoensayos enzimáticos basados en el método de doble sandwich de anticuerpos utilizando anticuerpos mono o policlonales, bien en ensayos inmuno-nefelométricos/turbidimétricos. Los procedimientos pueden realizarse usando un volumen de muestra muy pequeño, lo que hace que el receptor soluble de transferrina una magnitud útil para su uso en pacientes pediátricos.
Actualmente no existen materiales de referencia certificados para el receptor soluble de transferrina, ni tampoco consenso entre los fabricantes sobre la obtención de calibradores. La disparidad de valores de referencia y valores discriminantes para la concentración de receptor soluble de transferrina, dependiendo del calibrador y el método empleado, dificulta su aplicación clínica en la práctica, y obliga a que el seguimiento para un mismo paciente se realice en un único laboratorio.
Índices que relacionan Receptor soluble de transferrina y ferritinaEl índice más utilizado es el índice de ferritina (receptor soluble de transferrina/log ferritina). Este índice es especialmente útil para diferenciar la anemia ferropénica de la anemia de enfermedades crónicas y para detectar deficiencia de hierro en pacientes con anemia de enfermedades crónicas, ya que es más sensible para detectar un déficit de hierro comparado con las medidas aisladas del receptor soluble de transferrina y ferritina16,27,42,43.
Índices hematimétricos en el diagnóstico de la anemiaLa anemia se clasifica en base al volumen corpuscular medio como microcítica, normocítica o macrocítica, y según la concentración corpuscular media de hemoglobina en hipocroma, normocroma o hipercroma.
Calculada a partir de los histogramas de volumen celular, los modernos analizadores reportan la amplitud de distribución de los volúmenes (RDW o ADE) de la distribución eritrocitaria. Así, en la actualidad la anemia se clasifica además en homogénea o heterogénea, de acuerdo con la anisocitosis medida por este índice eritrocitario (RDW/ADE).
La hemoglobina corpuscular media o HCM es una magnitud que informa sobre el valor medio del contenido hemoglobínico de los hematíes circulantes y se correlaciona con el volumen corpuscular medio.
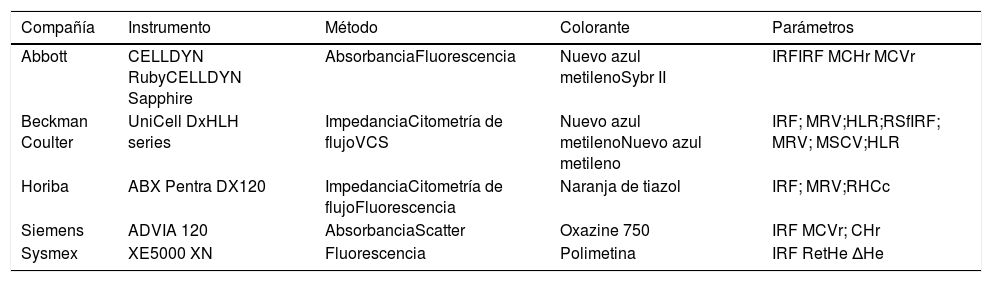
Los modernos contadores hematológicos, aplicando principios de impedancia y citometría de flujo, reportan parámetros avanzados junto al hemograma tradicional. La información adicional es potencialmente útil en el diagnóstico diferencial de diversas situaciones clínicas44. Cada fabricante emplea la tecnología de manera distinta, de forma que los nuevos parámetros son exclusivos de cada proveedor, tal como se muestra en la tabla 4.
Resumen de los nuevos parámetros eritrocitarios y reticulocitarios relacionados con el contenido de hemoglobina celular
| Parámetros | Abreviatura (unidades) | Compañía |
|---|---|---|
| RBC Hipocromos | Hypo (%) | Siemens |
| Hb reticulocitaria | CHr (pg) | Siemens |
| RBC Hipocromos | %HPO (%) | Abbott |
| Hb reticulocitaria media | MCHr (pg) | Abbott |
| RBC Hipocromos | Hypo He (%) | Sysmex |
| Hb Reticulocitaria equivalente | Ret He (pg) | Sysmex |
| Contenido de Hb reticulocitariaExpresión Hb reticulocitaria | RHCc (pg)RHE (pg) | Horiba ABXMindray |
RBC: hematíes, Hb: hemoglobina, %Hypo: porcentaje de RBC hipocromos (Siemens), CHr: contenido de hemoglobina de reticulocitos (Siemens), %HPO: porcentaje de RBC hipocromos (Abbott), MCHr: Hb reticulocitaria media (MCHr) (Abbott), %Hypo He: porcentaje de RBC hipocromos (Sysmex), Ret He: Hb reticulocitaria equivalente (Sysmex), RHCc: contenido de Hb reticulocitaria (Horiba ABX), RHE: expresion Hb reticulocitaria (Mindray).
La vida media del eritrocito en sangre periférica es aproximadamente de 120 días y diversas cohortes, o tipos de células con diferentes grados de maduración y contenido hemoglobínico, pueden coexistir al mismo tiempo. El término anisocitosis se refiere a la variedad de volúmenes eritrocitarios, mientras que la anisocromía se refiere a la coexistencia de hematíes con distinto contenido hemoglobínico.
Mientras que el VCM representa el valor medio de los volúmenes de los hematíes, el valor de la ADE representa la desviación estándar, permitiendo estimar la contribución de las subpoblaciones eritrocitarias con volúmenes marginales. Así, estos nuevos parámetros aportan información acerca de los valores de hemoglobina en cada célula individual, además del valor medio de hemoglobina o hemoglobina corpuscular media, ya que permiten medir los porcentajes de subpoblaciones eritrocitarias con contenido de hemoglobina por encima o por debajo de ciertos valores, y clasificarlos en eritrocitos hipocromos e hipercromos respectivamente45. También son medidos por distintos analizadores los porcentajes de hematíes microcíticos y macrocíticos, o con volúmenes por debajo o por encima de ciertos valores, respectivamente. Véase la tabla 4.
ReticulocitosEl recuento de reticulocitos es clínicamente importante para la clasificación fisiopatológica de la anemia. Ésta puede deberse a una insuficiente producción de eritrocitos por la médula ósea, en cuyo caso se acompaña de una reducción del recuento de reticulocitos (anemia arregenerativa), o a un aumento en su destrucción, en cuyo caso se encuentra un aumento en el recuento de reticulocitos como mecanismo compensatorio (anemia regenerativa).
Al ser su vida media de 1-2 días, el recuento de reticulocitos permite además la identificación temprana de la normalización de la eritropoyesis después de la intervención terapéutica (hierro, cobalamina, ácido fólico, etc.), así como la monitorización de la recuperación de la aplasia medular y del trasplante de médula ósea. La tabla 5 recoge las características técnicas del canal de reticulocitos, y los índices derivados, propios de cada uno de los analizadores.
Métodos automatizados de análisis de reticulocitos y parámetros derivados
| Compañía | Instrumento | Método | Colorante | Parámetros |
|---|---|---|---|---|
| Abbott | CELLDYN RubyCELLDYN Sapphire | AbsorbanciaFluorescencia | Nuevo azul metilenoSybr II | IRFIRF MCHr MCVr |
| Beckman Coulter | UniCell DxHLH series | ImpedanciaCitometría de flujoVCS | Nuevo azul metilenoNuevo azul metileno | IRF; MRV;HLR;RSfIRF; MRV; MSCV;HLR |
| Horiba | ABX Pentra DX120 | ImpedanciaCitometría de flujoFluorescencia | Naranja de tiazol | IRF; MRV;RHCc |
| Siemens | ADVIA 120 | AbsorbanciaScatter | Oxazine 750 | IRF MCVr; CHr |
| Sysmex | XE5000 XN | Fluorescencia | Polimetina | IRF RetHe ΔHe |
Abbott: IRF: fracción de reticulocitos inmaduros, MCVr: volumen corpuscular medio de reticulocitos, MCHr: hemoglobina reticulocitaria media. Beckman Coulter: MVR: volumen reticulocitario medio, HLR: reticulocitos de dispersión de luz elevada, RFs: red cell size factor, MSCV: volumen esferocitado reticulocitario medio. Horiba ABX: RHCc: contenido de hemoglobina reticulocitaria. Siemens: MCVr: volumen corpuscular reticulocitario, CHr: hemoglobina reticulocitaria. Sysmex: RetHe: hemoglobina reticulocitaria equivalente, ΔHe: delta hemoglobina reticulocios y eritrocitos.
La fracción de reticulocitos inmaduros (FRI) es un parámetro basado en el contenido de ácido ribonucleico de los hematíes. Los reticulocitos se pueden subdividir en subpoblaciones, los más inmaduros son ricos en RNA.
La FRI es un índice precoz y sensible de eritropoyesis, ya que los reticulocitos inmaduros aparecen en una proporción mayor cuando la producción de eritrocitos a nivel de la médula ósea aumenta. Dicho índice se puede considerar una medida de aceleración en la producción eritrocitaria y el contaje de reticulocitos, en valor absoluto, una medida cuantitativa de la eficacia de la eritropoyesis46–48.
Este parámetro es por lo tanto útil en el diagnóstico diferencial49,50 de los siguientes tipos de anemias:
- •
Anemias caracterizadas por un aumento en la eritropoyesis, como por ejemplo las anemias hemolíticas y la esferocitosis hereditaria.
- •
Anemias que cursan con hipoplasia de la médula, en la que los valores están disminuidos.
- •
Anemias agudas en infecciones o síndromes mielodisplásicos, en las que existe una disociación entre el recuento total de reticulocitos (reducido o normal) y la FRI, que puede estar aumentada.
Junto al recuento automatizado de reticulocitos, fundamental para la evaluación de la actividad eritropoyética, disponemos de otros índices asociados. Los más prometedores desde el punto de vista clínico son: la hemoglobina reticulocitaria y el volumen reticulocitario. La hemoglobina reticulocitaria refleja la síntesis de hemoglobina en la masa eritrocitaria de la médula ósea, y es una estimación de la cantidad de hierro que llega de manera efectiva a la médula y su adecuación a las necesidades de la eritropoyesis51. Véase la tabla 5.
Recomendaciones para la práctica clínicaMagnitudes biológicas empleadasLa tabla 6 muestra las magnitudes biológicas recomendadas por las guías de práctica clínica para el diagnóstico de la anemia ferropénica.
Magnitudes biológicas recomendadas por las guías de práctica clínica para el diagnóstico de la anemia ferropénica
| GPC | Magnitudes |
|---|---|
| BSH 201352 | Ferritina mejor marcador para ferropenia |
| Hemograma | |
| VCM, HCM | |
| Hierro, CTFH, IST cuando ferritina es normal o alta | |
| NHS 200953 | Ferritina cuando VCM está bajo y no se trata de mujer gestante (valores poco fiables) |
| sTrR no recomendado | |
| OAML 201254 | Ferritina mejor marcador para ferropenia |
| Se desaconseja sideremia, CTFH y IST | |
| BCMA 201085 | Ferritina mejor marcador para ferropenia |
| Hemograma | |
| VCM, HCM | |
| IST en caso de resultado de ferritina dudoso, enfermedad renal crónica, infección crónica, inflamación o cáncer | |
| Aumento de hemoglobina 10-20 g/L en 2-4 semanas tras tratamiento indica ferropenia | |
| BSG 201156 | Ferritina |
| VCM, HCM | |
| HAS 201157 | Ferritina mejor marcador para ferropenia excepto en niños y mujeres gestantes |
| Hemograma | |
| IST en caso de inflamación, enfermedad renal crónica, resultado de ferritina dudoso | |
| Se desaconseja medida de sideremia aislada, o combinado con ferritina | |
| Se desaconseja medida de sTrR | |
| OMS 200458 | Ferritina y sSTrR mejores marcadores para ferropenia |
| Hemoglobina | |
| Marcadores de inflamación pueden ser útiles (proteína C reactiva, a-glicoproteína ácida) | |
| OMS 200159 | Ferritina mejor marcador para ferropenia |
| Zinc-Protoporfirina eritocitaria y IST peores marcadores | |
| Se recomienda el uso de varios marcadores: hemoglobina, sTrR+ ferritina o examen médula ósea |
GPC: guía de práctica clínica, VCM: volumen corpuscular medio, HCM: hemoglobina corpuscular medio, CTFH: capacidad total de fijación de hierro, IST: índice de saturación de transferrina, sTrR: medida del receptor soluble de transferrina en suero.
La anemia ferropénica es normocítica y normocrómica en un principio, y después se convierte en hipocroma y microcítica (volumen corpuscular medio <80 fL) con moderada anisocitosis, poiquilocitosis, presencia de algunos eliptocitos y, en ocasiones, de un punteado basófilo fino en el interior de algunos hematíes. El recuento de reticulocitos puede ser normal o ligeramente aumentado, especialmente después de una hemorragia, o cuando se instaura el tratamiento con hierro. Es frecuente la observación de un aumento en el recuento de plaquetas.
El diagnóstico diferencial de la anemia ferropénica se realiza con respecto a:
- -
Procesos inflamatorios crónicos o neoplasias, en los que puede producirse una alteración en la incorporación hemoglobínica del hierro por bloqueo del mismo a nivel de las células del Sistema Mononuclear Fagocítico (SMF). En estos casos existe una disminución de la sideremia, junto a un aumento del hierro a nivel de los macrófagos y una disminución de los eritroblastos con contenido de hierro ferritínico o sideroblastos en la médula ósea (tinción de Perls).
- -
β-talasemia menor, que se caracteriza por la presencia de una anemia, junto a una disminución del volumen corpuscular medio e hipocromía y un aumento compensador del recuento de hematíes o pseudopoliglobulia. En la β-talasemia menor, a diferencia de la anemia ferropénica, la hemoglobina A2 se encuentra aumentada (electroforesis de hemoglobina en sangre).
- -
Anemia sideroblástica congénita, debida a enzimopatías de la vía de síntesis del grupo hemo (déficit congénito de ácido aminolevulínico sintasa, EC 2.3.1.37) y que se caracteriza por:
- a)
presencia de hematíes hipocromos y microcíticos.
- b)
aumento de la sideremia.
- c)
elevación del hierro medular en las células del SMF y también en los eritroblastos en la médula ósea. Un signo de sobrecarga férrica lo constituye la presencia de hierro en el interior de las mitocondrias de los eritroblastos, fenómeno denominado sideroacrestia, lo que se traduce en la presencia de cuerpos de Pappenheimer en el interior de los hematíes.
La concentración en suero de la ferritina es esencial en el diagnóstico y manejo de pacientes en todas las formas de ferropenia, incluida la ferropenia funcional52–59.
Existe cierta disparidad en cuanto a los valores discriminantes recomendados por las guías de práctica clínica halladas para indicar la ausencia de reservas de hierro. El valor más frecuentemente empleado en adulto es el de 15μg/L54,60. Un estudio que utilizó sueros de 203 mujeres, a las que se les había realizado un diagnóstico de ferropenia a través del examen de médula ósea, halló un valor muy parecido, 16μg/L61. Por otra parte, otras guías de práctica clínica emplean el valor de 12μg/L, que proviene de un estudio realizado a partir de tan solo 14 sujetos41.
Este valor discriminante deja de ser útil en pacientes con inflamación crónica, cáncer, enfermedad hepática o renal. Por ello, distintas guías de práctica clínica no excluyen la presencia de reservas férricas disminuidas en pacientes que presentan valores entre 15 y 100μg/L52,54,55. En esta situación puede ser útil medir la concentración sérica de la proteína C reactiva para comprobar la inflamación existente. A nivel clínico se puede observar cómo responde el paciente a un tratamiento con hierro: un aumento de hemoglobina de 10-20g/L en 2 a 4 semanas es compatible con la existencia de ferropenia62 (véase la tabla 7). Sólo se han descrito dos entidades clínicas diferentes a la ferropenia que pueden asociarse a una disminución de la concentración sérica de ferritina, aunque muy raramente y que son el hipotiroidismo y la deficiencia de ascorbato40.
Valores discriminantes empleados por las guías de práctica clínica para ferritina
| GPC | Valores discriminantes (μg/L) |
|---|---|
| BSH 201352 | < 12 diagnóstico de ferropenia |
| < 100 en paciente no hemodializado diagnóstico de ferropenia altamente probable | |
| < 200 en paciente en hemodiálisis diagnóstico de ferropenia altamente probable | |
| >1200 considerar pruebas para sobrecarga férrica | |
| OAML 201254 | Se recomienda emplear valores de referencia por edad y sexo |
| < 15 adulto < 12 diagnóstico de ferropenia | |
| 15-50 reservas férricas bajas, ferropenia probable | |
| 51-100 reservas férricas bajas, ferropenia posible | |
| ferropenia improbable en ausencia de inflamación | |
| >300 puede reflejar inflamación o sobrecarga férrica | |
| >800 probable sobrecarga férrica, en ausencia de inflamación | |
| BCMA 201055 | Adulto |
| <15 diagnóstico de ferropenia | |
| 15-50 ferropenia probable | |
| 50-100 ferropenia posible | |
| > 100 ferropenia improbable | |
| persistentemente >1000: considerar pruebas para sobrecarga férrica | |
| Niño | |
| < 12 diagnóstico de ferropenia | |
| < 30 paciente > 5 años con infección diagnóstico de ferropenia | |
| BSG 201156 | < 15 adulto diagnóstico de ferropenia |
| < 12 niño diagnóstico de ferropenia | |
| HAS 201157 | < 50-60 diagnóstico de ferropenia excepto niños o gestantes |
| < 100 diagnóstico de ferropenia en caso de enfermedad inflamatoria intestinal crónica o de insuficiencia renal crónica con diálisis excepto niños o gestantes | |
| OMS / CDC 201158 | < 12-15 reservas de hierro agotadas cuando no hay infección |
| > 15 hay reservas de hierro cuando no hay infección | |
| OMS/UNICEF/UNU 200159 | < 5 años< 12 diagnóstico de ferropenia sin infección |
| < 30 diagnóstico de ferropenia en presencia de infección | |
| > 5 años | |
| < 15 diagnóstico de ferropenia | |
| Riesgo alto de sobrecarga férrica | |
| > 200 hombre | |
| > 150 mujer | |
| OMS/UNICEF/UNU 200159 | Adulto |
| < 12 diagnóstico de ferropenia | |
| < 30 diagnóstico de ferropenia en presencia de una infección | |
| Niño | |
| < 15 diagnóstico de ferropenia |
GPC: guía de práctica clínica
A pesar de los resultados inicialmente prometedores para la medición de la concentración en suero del receptor soluble de transferrina, tan sólo las guías de práctica clínica de la OMS de 2001 y 2004 recomiendan su empleo. Es un marcador caro, implantado en pocos centros y carece de control externo de calidad en muchos países52. Su utilización no tiene ninguna ventaja respecto a la ferritina, ya que carece de una indicación particular y se desaconseja su uso53,57.
Transferrina y sus índicesUna concentración en suero elevada de transferrina y un valor bajo del índice de saturación de la transferrina son característicos de la deficiencia de hierro funcional. No se recomienda el uso de la medida de la concentración en suero de hierro, transferrina, capacidad total de saturación de transferrina e índice de saturación de transferrina como únicos marcadores, por su baja especificidad diagnóstica. La sideremia (y el índice de saturación de transferrina) presenta un coeficiente de variación intraindividual de 26,5% que obedece a un ritmo circadiano63. Existe un gran solapamiento entre sideremias de pacientes ferropénicos y no ferropénicos59. En el embarazo, y en la terapia con estrógenos, la concentración en suero de transferrina está elevada, por lo que la capacidad total de saturación de transferrina y el índice de saturación de transferrina no son útiles.
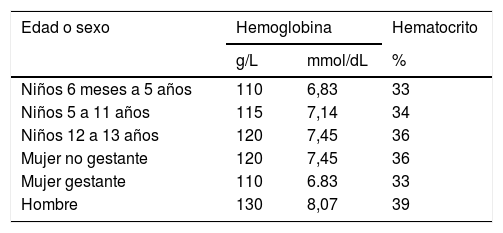
HemoglobinaLa definición de anemia de la OMS de 199864 es la más ampliamente aceptada57,65–67. Esta definición se basa en las concentraciones de hemoglobina en sangre, que fueron estimadas a partir de una población normal del mismo sexo y grupo de edad (ver tabla 8). Una concentración de hemoglobina dentro de los valores de referencia no excluye una ferropenia. Una concentración que disminuye en el tiempo puede conducir a su sospecha, sobre todo cuando se observa con un aumento de la amplitud de distribución eritrocitaria (RDW/ADE) y una disminución de volumen corpuscular medio y hemoglobina corpuscular media45.
Valores discriminantes empleados1 para el diagnóstico de anemia en pacientes que viven al nivel del mar (OMS, UNICEF, UNU 1998 64)
| Edad o sexo | Hemoglobina | Hematocrito | |
|---|---|---|---|
| g/L | mmol/dL | % | |
| Niños 6 meses a 5 años | 110 | 6,83 | 33 |
| Niños 5 a 11 años | 115 | 7,14 | 34 |
| Niños 12 a 13 años | 120 | 7,45 | 36 |
| Mujer no gestante | 120 | 7,45 | 36 |
| Mujer gestante | 110 | 6.83 | 33 |
| Hombre | 130 | 8,07 | 39 |
Deben considerarse factores modulantes como altitud en la que vive el paciente, edad y raza.
No se recomienda realizar un cribado para anemia en la población general, sino sólo en pacientes con riesgo, o que presentan signos y síntomas de anemia microcítica54. No hay evidencia científica que sustente el cribado en niños de 6 a 12 meses68, ni de ferropenia en niños de menos de cinco años69.
Siempre debe determinarse la causa de la anemia, aunque pueda resultar obvia deben descartarse otras posibles causas. Además de anemia ferropénica, la anemia microcítica puede ser debida a una hemoglobinopatía, o una anemia de enfermedad crónica.
Se recomienda el empleo conjunto de índices hematológicos eritrocitarios (volumen corpuscular medio, hemoglobina corpuscular media) y una combinación de proteínas: concentración sérica de ferritina, hierro, transferrina y el cálculo del índice de saturación de transferrina (la concentración de hierro siempre debe interpretarse al mismo tiempo que la de la transferrina), y la concentración sanguínea de hemoglobina.
Índices hematimétricosAlgunos marcadores del hemograma pueden sugerir ferropenia: el volumen corpuscular medio cuando muestra microcitosis, y la hemoglobina corpuscular media cuando muestra hipocromía55–57. Estos índices son útiles en el diagnóstico y seguimiento en períodos de semanas y meses52.
La principal utilidad de los nuevos índices hematimétricos estriba en las siguientes situaciones:
- •
Diagnóstico diferencial de la anemia microcítica. Así, en la eritropoyesis con deficiencia de hierro, una fracción mayor de hematíes es hipo en lugar de microcítica, y la relación población microcítica/hipocrómica es la que muestra el mejor rendimiento diagnóstico en el diagnóstico diferencial con respecto al rasgo de la ß-talasemia70,71.
- •
Déficit funcional de Fe y control de tratamiento con agentes estimulantes de eritropoyesis: algunos estudios recientes han demostrado que el porcentaje de eritrocitos hipocrómicos es útil en la identificación de restricción de hierro en la eritropoyesis en pacientes anémicos tratados con estimulantes de la eritropoyesis, particularmente en la anemia de la enfermedad renal crónica, o en los pacientes hemodializados. La respuesta al tratamiento con agentes estimuladores de la eritropoyesis (AEE) es estrictamente dependiente de la disponibilidad de hierro. Es decir que se limita por la deficiencia de hierro, que puede ser absoluta o funcional. Ello se traduce en una limitación de la actividad eritropoyética de la médula ósea por la incapacidad para movilizar el hierro suficiente de sus sitios de almacenamiento. El porcentaje de eritrocitos hipocrómicos (% HPO) es la mejor magnitud para comprobar la ferropenia funcional52.
- •
Diagnóstico diferencial de anemia hemolítica
La medida de los hematíes hipercrómicos es útil en el diagnóstico de la esferocitosis, ya sea hereditaria o hemólisis inmune72–75.
Índices reticulocitariosSon útiles en el diagnóstico diferencial de:
- •
Déficit latente de hierro. Se define como déficit latente de hierro (Fe) el estado en el que la disponibilidad de Fe es insuficiente para colmar las necesidades sistémicas, y puede estar presente con o sin anemia76–79.
- •
Control de tratamiento con agentes estimulantes de la eritropoyesis. La hemoglobina reticulocitaria es importante porque su reducción indica una eritropoyesis con deficiencia de hierro, incluso en las condiciones en las que los marcadores bioquímicos tradicionales, tales como la ferritina y la saturación de la transferrina no reflejan correctamente el estado del metabolismo férrico (por ejemplo, en las inflamaciones o anemia de la enfermedad crónica). Además, es útil para la monitorización de la respuesta temprana a la terapia con hierro intravenoso porque aumenta perceptiblemente a las 48 – 72 horas posteriores a dicho tratamiento. Valores bajos de este índice son indicativos en la deficiencia de hierro funcional que aparece en pacientes tratados con eritropoyetina80–84. Un valor de CHr < 29 pg o un valor de Ret-He < 25 pg predicen ferropenia funcional en pacientes que reciben agentes estimulantes de la eritropoyesis. Un valor de Ret-He < 30 pg indica mayor probabilidad de respuesta ante hierro intravenoso (i.v.) en la enfermedad renal crónica. Después del porcentaje de eritrocitos hipocrómicos, la siguiente mejor opción es el contenido de hemoglobina del reticulocito (CHr y RetHe). Si no se dispone de estos marcadores, la concentración de zinc-protoporfirina eritrocitaria es el mejor marcador para el diagnóstico de ferropenia funcional, aunque es menos sensible a cambios agudos y ninguna de las guías de práctica clínica consultadas recomienda su uso52.
- •
Respuesta a tratamiento con vitamina B12.
Pocos estudios están disponibles en referencia a la utilidad clínica del volumen reticulocitario. En sujetos con reservas de hierro agotadas, este índice aumenta rápidamente después de la terapia con hierro, y disminuye de la misma manera con el desarrollo de una eritropoyesis con deficiencia de hierro. El volumen de reticulocitos disminuye dramáticamente y los reticulocitos son más pequeños que los glóbulos rojos circulantes en la macrocitosis nutricional, después de la terapia con vitamina B12 o ácido fólico85.
OtrosLa concentración de eritropoyetina en suero es poco útil para diagnosticar una ferropenia funcional52. Valores bajos pueden estar asociados a cáncer y artritis.
La concentración de hepcidina en suero o plasma parece no presentar ventajas sobre el resto de marcadores52.
La realización de un examen de médula ósea para comprobar las reservas de hierro es raramente justificable. Puede ser útil cuando una concentración de ferritina mayor que 1200μg/L no parece reflejar reservas de hierro52.
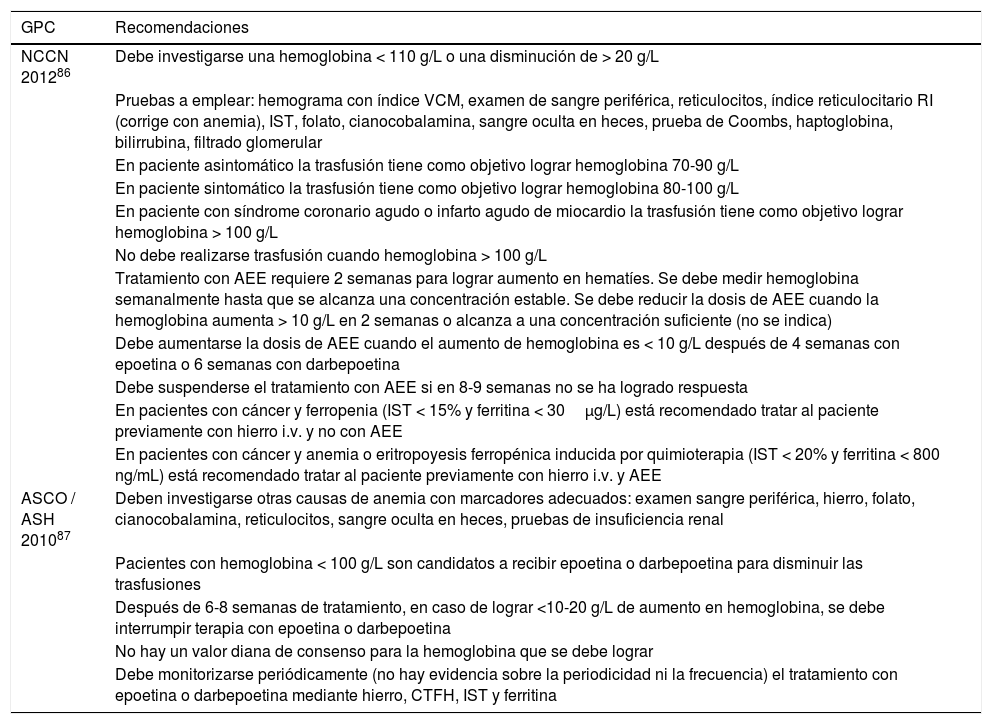
Estudio en grupos específicos de enfermedadFerropenia en cáncerPara el estudio de este tipo de anemia deben contemplarse diferentes marcadores como son: hemograma (con volumen corpuscular medio), examen morfológico de sangre periférica, recuento de reticulocitos, índices reticulocitarios (corrige con anemia), concentración en suero de hierro, índice de saturación de transferrina, concentración de ferritina, folato, cianocobalamina, presencia de sangre oculta en heces, prueba de Coombs, concentración de haptoglobina, bilirrubina, y pruebas de insuficiencia renal86,87.
La concentración de ferritina y el índice de saturación de transferrina se pueden utilizar para decidir el tratamiento de la anemia. Cuando la ferritinemia es < 30μg/L y el índice de saturación de transferrina < 15% el paciente debe tratarse con hierro y no con agentes estimulantes de la eritropoyetina. Cuando estos valores se hallan entre 30 y 800μg/L, y 15 y 20% respectivamente, debe administrarse hierro i.v. y agentes estimulantes de la eritropoyesis86. Alguna otra guía, por el contrario, establece que la ferritina no es útil para predecir respuesta a los agentes estimulantes de la eritropoyesis en anemia asociada a cáncer52. La concentración de hemoglobina debe medirse dos semanas tras el inicio del tratamiento86.
El uso de receptor soluble de transferrina mejora el diagnóstico de ferropenia, especialmente cuando hay enfermedad crónica o cáncer intestinal88. El índice de transferrina (incluye ferritina) es mejor que la ferritina en la predicción de respuesta de los agentes estimulantes de la eritropoyesis89.
La concentración de hemoglobina se utiliza para decidir sobre la realización de una trasfusión, si el paciente está sintomático, o ha sufrido un síndrome coronario agudo. Así mismo, también para monitorizar el tratamiento con agentes estimulantes de la eritropoyesis86. Véase la tabla 9.
Ferropenia en cáncer
| GPC | Recomendaciones |
|---|---|
| NCCN 201286 | Debe investigarse una hemoglobina < 110 g/L o una disminución de > 20 g/L |
| Pruebas a emplear: hemograma con índice VCM, examen de sangre periférica, reticulocitos, índice reticulocitario RI (corrige con anemia), IST, folato, cianocobalamina, sangre oculta en heces, prueba de Coombs, haptoglobina, bilirrubina, filtrado glomerular | |
| En paciente asintomático la trasfusión tiene como objetivo lograr hemoglobina 70-90 g/L | |
| En paciente sintomático la trasfusión tiene como objetivo lograr hemoglobina 80-100 g/L | |
| En paciente con síndrome coronario agudo o infarto agudo de miocardio la trasfusión tiene como objetivo lograr hemoglobina > 100 g/L | |
| No debe realizarse trasfusión cuando hemoglobina > 100 g/L | |
| Tratamiento con AEE requiere 2 semanas para lograr aumento en hematíes. Se debe medir hemoglobina semanalmente hasta que se alcanza una concentración estable. Se debe reducir la dosis de AEE cuando la hemoglobina aumenta > 10 g/L en 2 semanas o alcanza a una concentración suficiente (no se indica) | |
| Debe aumentarse la dosis de AEE cuando el aumento de hemoglobina es < 10 g/L después de 4 semanas con epoetina o 6 semanas con darbepoetina | |
| Debe suspenderse el tratamiento con AEE si en 8-9 semanas no se ha logrado respuesta | |
| En pacientes con cáncer y ferropenia (IST < 15% y ferritina < 30μg/L) está recomendado tratar al paciente previamente con hierro i.v. y no con AEE | |
| En pacientes con cáncer y anemia o eritropoyesis ferropénica inducida por quimioterapia (IST < 20% y ferritina < 800 ng/mL) está recomendado tratar al paciente previamente con hierro i.v. y AEE | |
| ASCO / ASH 201087 | Deben investigarse otras causas de anemia con marcadores adecuados: examen sangre periférica, hierro, folato, cianocobalamina, reticulocitos, sangre oculta en heces, pruebas de insuficiencia renal |
| Pacientes con hemoglobina < 100 g/L son candidatos a recibir epoetina o darbepoetina para disminuir las trasfusiones | |
| Después de 6-8 semanas de tratamiento, en caso de lograr <10-20 g/L de aumento en hemoglobina, se debe interrumpir terapia con epoetina o darbepoetina | |
| No hay un valor diana de consenso para la hemoglobina que se debe lograr | |
| Debe monitorizarse periódicamente (no hay evidencia sobre la periodicidad ni la frecuencia) el tratamiento con epoetina o darbepoetina mediante hierro, CTFH, IST y ferritina |
GPC: guía de práctica clínica, VCM: volumen corpuscular medio, IST: índice de saturación de transferrina, AEE: agentes estimulantes de la eritropoyesis, CTFH: capacidad total de fijación de hierro.
En la mayoría de casos la anemia se debe a la combinación de una anemia ferropénica y una anemia de enfermedades crónicas. Más raramente puede existir una deficiencia de cianocobalamina o folato65.
Los marcadores que se recomiendan para el cribado de anemia en este tipo de pacientes son los siguientes: hemograma, ferritina y proteína C reactiva. Cuando hay sospecha de deficiencia de cianocobalamina o folato, deben medirse estos marcadores al menos anualmente65.
Para el diagnóstico de anemia se recomienda además la medida de los índices del hemograma (amplitud de los volúmenes de la distribución eritrocitaria, volumen corpuscular medio y hemoglobina corpuscular media), el recuento de reticulocitos y el índice de saturación de transferrina. Puede ser útil para estudios complejos: la medida de la concentración de cianocobalamina, folato, haptoglobina, receptor soluble de transferrina, creatinina, urea, lactato deshidrogenasa, y el porcentaje de eritrocitos hipocromos y hemoglobina reticulocitaria. Si hay evidencia de inflamación se utilizan como valores discriminantes: 100μg/L para ferritina y 20% para índice de saturación de transferrina. Si la concentración de ferritina es < 30μg/L es probable que solo se produzca ferropenia, si el valor es >30 y <100 puede ser por la existencia de una combinación de anemia ferropénica y anemia de enfermedad crónica65.
En pacientes en remisión o con enfermedad moderada deben evaluarse el hemograma, ferritina, proteína C reactiva cada 6 a 12 meses; mientras que en pacientes con enfermedad activa se recomienda realizar las mismas pruebas cada tres meses65.
Ferropenia en enfermedad renal crónicaLa anemia es una complicación frecuente en la enfermedad renal crónica, especialmente cuando está avanzada. Su existencia en este tipo de pacientes contribuye significativamente a los síntomas que sufren y a su calidad de vida. Está asociada a un mayor riesgo de enfermedad cardiovascular, morbilidad y mortalidad. Esta anemia es susceptible a ser tratada con éxito desde hace años67. La causa principal es la síntesis inadecuada de eritropoyetina en el riñón, que no permite la producción de hemoglobina. Pueden existir otras causas, como una ferropenia, hemólisis, malnutrición, hiperparatiroidismo secundario, así como la existencia de una inflamación90. Esta inflamación tiene dos implicaciones: el bloqueo del hierro en los lugares de depósito que se asocia a una eritropoyesis ferropénica y la dificultad del diagnóstico de ferropenia, por la interpretación de la concentración de ferritina, la capacidad total de saturación de transferrina y el índice de saturación de transferrina67.
La ferritina es la prueba esencial en el inicio del manejo de pacientes con enfermedad renal crónica. Las guías de práctica clínica emplean un valor discriminante de 12μg/L, aunque una concentración entre 12 y 1200μg/L en estos pacientes no permite excluir una eritropoyesis ferropénica52. Los pacientes que no están en hemodiálisis con < 100μg/L y los pacientes en hemodiálisis crónica con < 200μg/L tienen mayor probabilidad de responder bien a la terapia con hierro i.v. y, por tanto, de que estén ferropénicos.
El tratamiento con agentes estimulantes de la eritropoyesis se asocia a una eritropoyesis ferropénica que puede tener lugar a pesar de que el paciente recibe tratamiento con hierro. Por tanto, en estos pacientes es esencial disponer de marcadores para la evaluación de los depósitos de hierro y para la detección temprana de la deficiencia funcional de hierro.
El empleo de índices hematológicos, especialmente el porcentaje de eritrocitos hipocromos es el mejor predictor de respuesta a tratamiento con hierro en pacientes de hemodiálisis. Si no se dispone de él, la hemoglobina reticulocitaria (CHr) o bien la reticulocitaria equivalente (RetHe)91.
El índice de saturación de transferrina no se recomienda como único marcador para predecir respuesta a un tratamiento con hierro por vía parenteral en pacientes con enfermedad renal crónica. Puede emplearse para monitorizar la respuesta a agentes estimulantes de la eritropoyesis, solo o conjuntamente con la concentración de ferritina66,67,91 y el contaje de reticulocitos y eritrocitos52. El receptor soluble de transferrina se puede utilizar para monitorizar los agentes estimulantes de la eritropoyesis cuando no se dispone de eritrocitos hipocromos o hemoglobina reticulocitaria (CHr, RetHe)52.
Los índices VCM y HCM son útiles en el diagnóstico y seguimiento en períodos de semanas y meses. Sin embargo, estos índices no son útiles en cambios agudos que se dan en tratamiento con los agentes estimulantes de la eritropoyesis52.
Hay controversia para establecer el valor discriminante a partir del cual no se recomienda a los pacientes con enfermedad renal crónica que reciben agentes estimulantes de la eritropoyesis una terapia con hierro por vía i.v.: > 800μg/L91, > 1200μg/L52 al existir el riesgo de producirse una sobrecarga.
La medida de eritropoyetina tiene un valor clínico limitado en el diagnóstico de una eritropoyesis ferropénica. En el caso de la hepcidina existe poca evidencia científica que sustente su empleo52. Véase la tabla 10.
Ferropenia en enfermedad renal crónica
| GPC | Recomendaciones |
|---|---|
| BSH 201352 | Ferritina esencial al inicio del manejo del paciente con ERC |
| < 12μg/L indica ferropenia en paciente con ERC, > 12 y > 1200 no excluye eritropoyesis ferropénica | |
| < 1200μg/L el paciente se pueda beneficiar de tratamiento con hierro iv | |
| VCM y HCM sólo útiles para seguimiento de semanas y meses | |
| IST no se recomienda como único marcador para predecir respuesta a hierro iv | |
| sTrR útil en monitorización tratamiento con AEE cuando no se dispone de HRC, CHr o RetHe | |
| < 110 g/L hemoglobina debe hacerse estudio | |
| KDIGO 201266 | Pruebas exploración inicial anemia en ERC: hemoglobina, índices eritrocitarios, leucocitos, fórmula leucocitaria, plaquetas, reticulocitos, ferritina, IST, cianocobalamina y folato |
| Cuando se hace terapia con AEE debe monitorizarse con IST y ferritina cada 3 meses. Al inicio del tratamiento hay que medirlos a menudo cuando se cambia dosis | |
| Hemoglobina > 100 g/L en adulto con ERC no dependiente de diálisis no debe iniciarse terapia con AEE. Cuando hemoglobina < 100 g/L debe iniciarse según la velocidad de descenso, respuesta a terapia con hierro, riesgo de trasfusión, riesgos de terapia con AEE y síntomas de anemia | |
| Hemoglobina 90-100 g/L en adulto con ERC estadio 5 dependiente de diálisis debe iniciarse terapia con AEE | |
| Hemoglobina > 115 g/L en adulto con ERC tratado con AEE, debe interrumpirse AEE. > 110-120 g/L en niño | |
| IST < 30% y ferritina < 500μg/L en paciente con ERC y anemia hay que administrar hierro i.v. Deben emplearse los mismos valores cuando el paciente recibía AEE y no hierro. | |
| IST < 20% y < 100μg/L en niños con ERC y anemia que no están recibiendo hierro hay que dar hierro oral o iv. Deben emplearse los mismos valores cuando el paciente recibía AEE y no hierro. | |
| Emplean valores discriminantes de la OMS 1998 para hemoglobina en anemia | |
| Debe medirse hemoglobina en pacientes sin anemia 1/año (ERC estadio 3), 2/año (ERC estadio 4-5 no dependiente de diálisis), 4/año (ERC estadio 5 dependiente de hemodiálisis y ERC estadio 5 dependiente de diálisis peritoneal). Debe medirse hemoglobina en pacientes con anemia no tratados con AEE 4/año (ERC estadios 3-5 no dependientes de diálisis y ERC estadio 5 dependiente de diálisis peritoneal), 1/mes (ERC dependiente de diálisis) | |
| NCGC 201567 | Emplean valores discriminantes de la OMS 1998 para hemoglobina en anemia |
| Mejor prueba para diagnosticar ferropenia y respuesta a terapia con hierro: HRC > 6%. Si no se dispone, CHr < 29 pg o bien RetHe. Si no se dispone, IST < 20% y ferritina < 100μg/L (estas pruebas siempre juntas). IST o ferritina solas no sirven para evaluar ferropenias en pacientes con ERC | |
| Cuando se trata con AEE no se debe intentar llevar hemoglobina a normalidad, sino entre 100 y 120 g/L en adultos y niños > 2 años, y 95-115 g/L en niños < 2 años | |
| Hay que dar tratamiento con hierro en pacientes que reciben AEE, con el objetivo de mantener HRC < 6%, o bien CHr > 29 pg, o bien IST > 20%, a menos que ferritina > 800μg/L | |
| No se recomienda medir eritropoyetina en enfermos con ERC para diagnóstico o monitorización de anemia | |
| Cada tres meses hay que monitorizar utilizando HRC > 6%, si no se dispone de HRC o se va a tardar más de 6 horas, debe usarse CHr > 29 pg o RetHe. Si no, IST (< 20%) y ferritina (< 100μg/L) conjuntamente | |
| NICE 201591 | Mejor prueba para diagnosticar ferropenia y respuesta a terapia con hierro: HRC > 6%. Si no se dispone, CHr < 29 pg o bien RetHe. Si no se dispone, IST < 20% y ferritina < 100μg/L (estas pruebas siempre juntas). IST o ferritina solas no sirven para evaluar ferropenias en pacientes con ERC |
| Cuando se trata con AEE no se debe intentar llevar hemoglobina a normalidad, sino entre 100 y 120 g/L en adultos y niños > 2 años, y 95-115 g/L en niños < 2 años | |
| Hay que dar tratamiento con hierro en pacientes que reciben AEE, con el objetivo de mantener HRC < 6%, o bien CHr > 29 pg, o bien IST > 20%, a menos que ferritina > 800μg/L |
GPC: guía de práctica clínica, ERC: enfermedad renal crónica, VCM: volumen corpuscular medio, HCM: hemoglobina corpuscular medio, IST: índice de saturación de transferrina, medida del receptor soluble de transferrina en suero, HRC % eritrocitos hipocromos, CHr y RetHe: contenido de hemoglobina del reticulocito, AEE: agentes estimulantes de la eritropoyesis.
- 1.
Se recomienda el empleo de la concentración plasmática de ferritina para el diagnóstico y manejo de pacientes con ferropenia. El valor discriminante que debe emplearse en adultos es 15μg/L. No existe suficiente evidencia científica para recomendar un valor para niños o gestantes.
- 2.
En caso de una concentración de ferritina de interpretación dudosa, o bien en pacientes con inflamación crónica, cáncer, enfermedad hepática o renal, está indicado utilizar la concentración plasmática de transferrina o alguno de sus índices conjuntamente con la ferritina. Se desaconseja el empleo de la sideremia aislada. En el embarazo y en la terapia con estrógenos estos marcadores no son útiles.
- 3.
En caso de hallarse una concentración plasmática de proteína C reactiva elevada, o en el contexto de una infección crónica, inflamación o cáncer debe utilizarse un valor discriminante de 100μg/L para la ferritina. En presencia de una enfermedad renal crónica una concentración hasta 1200μg/L no excluye una ferropenia.
- 4.
No está suficientemente demostrada la utilidad clínica del receptor soluble de transferrina, aunque este marcador o los índices que lo relacionan con la ferritina puede tener algún papel en la enfermedad renal crónica cuando no se dispone de otros marcadores más específicos.
- 5.
La medida de eritropoyetina y hepcidina tiene un valor clínico limitado o poco documentado para el estudio de la ferropenia.
- 6.
El diagnóstico morfológico de la anemia ferropénica se realiza mediante la simple observación de la morfología eritrocitaria en la extensión de sangre periférica teñida con May Grünwald-Giemsa.
- 7.
La anemia ferropénica es normocítica y normocrómica en un principio, y después se convierte en hipocroma y microcítica.
- 8.
El diagnóstico diferencial de la anemia ferropénica se debe realizar con procesos inflamatorios crónicos, β-talasemia menor y anemia sideroblástica congénita.
- 9.
Los nuevos índices hematimétricos son útiles en el diagnóstico diferencial de: la anemia microcítica, déficit funcional de Fe y control de tratamiento con agentes estimulantes de eritropoyesis y la anemia hemolítica.
No existe.
Conflicto de interesesNo existe.
Este documento constituye una nueva versión de uno elaborado en el año 2006 por parte de la Comisión de Proteínas1. Entre otros cambios, incluye el estudio de la morfología de sangre periférica, junto a los índices hematimétricos y reticulocitarios.
Este documento tiene la conformidad de las tres Sociedades (AEBM-ML, AEFA y SEQC-ML) como Recomendación profesional en el ámbito del Laboratorio Clínico.