Las infecciones genitourinarias exudativas o purulentas son un motivo de consulta frecuente en Atención Primaria y especializada. El objetivo de nuestro estudio fue determinar la incidencia de los microorganismos más frecuentemente implicados en el desarrollo de vulvovaginitis, vaginosis, cervicitis, uretritis y balanitis en una población general, atendida en el área sanitaria dependiente de 2hospitales de tercer nivel de la provincia de Granada.
Pacientes y métodosSe analizaron todas las muestras recibidas para diagnóstico microbiológico de infección genital baja entre el 1 de febrero y el 31 de mayo del 2015, siguiendo un protocolo de trabajo normalizado. La detección de los microorganismos en la muestra se realizó mediante técnicas de cultivo en medios artificiales o de hibridación de ácidos nucleicos (Affirm VPIII).
ResultadosSe analizaron 2.017 muestras, obtenidas de 1.722 pacientes distintos (1.626 mujeres y 96 varones). En 772 pacientes (44,8%; 745 mujeres y 27 varones) se detectó la presencia de, al menos, un microorganismo con significación clínica. Entre las mujeres, el microorganismo más frecuente fue Gardnerella vaginalis (G. vaginalis), presente en el 26,7% de las mujeres atendidas, seguido de Candida albicans (20,0%), Trichomonas vaginalis (1,0%) y Ureaplasma urealyticum (0,4%). En el 10,4% de los varones se detectó Neisseria gonorrhoeae y en un 6,3% Haemophilus spp.
ConclusionesEn nuestra población, la vaginosis bacteriana por G. vaginalis, la vulvovaginitis por Candida spp., la tricomoniasis, la gonococia y las uretritis por Ureaplasma spp. y Haemophilus spp. fueron, en este orden, las infecciones genitales exudativas más frecuentes.
Purulent or exudative genitourinary infections are a frequent reason for consultation in primary and specialized health care. The objective of this study was to determine the incidence of the microorganisms most commonly involved in the development of bacterial vaginosis, cervicitis, urethritis, vulvovaginitis, and balanitis in a general population attending 2tertiary level hospitals in the province of Granada (Spain).
Patients and methodsAll the samples received for the microbiological diagnosis of acute lower genital tract infection between February and May 2015 were analysed following a standard protocol. Detection of the microorganisms in the samples was performed by cultivation in artificial media or nucleic acid hybridisation techniques (Affirm VPIII).
ResultsThe analysis included a total of 2,017 samples, obtained from 1,722 different patients (1626 women and 96 men).. The presence of at least one microorganism with clinical significance was detected in 772 patients (44.8%; 745 women and 27 men). Among the women, the most frequent microorganism more found was Gardnerella vaginalis, present in the 26.7%, followed by Candida albicans (20.0%), Trichomonas. vaginalis (1.0%), and Ureaplasma urealyticum (0.4%). Neisseria gonorrhoeae and Haemophilus spp. were detected in 10.4% and 6.3% of samples of male origin, respectively.
ConclusionsIn the studied population, bacterial vaginosis by G. vaginalis, vulvovaginitis by Candida spp., trichomoniasis, gonorrhea, and urethritis by Ureaplasma spp. and Haemophilus spp., were the most frequent exudative genital infections.
Las infecciones genitourinarias exudativas o purulentas son un motivo de asistencia frecuente en Atención Primaria y consultas especializadas de Urología, Ginecología y Obstetricia. En la mujer, según la localización primaria de los síntomas o de los signos clínicos observados, se clasifican en infecciones vulvovaginales y cervicales. Las variaciones de la cantidad, color y olor del flujo vaginal, así como la presencia de prurito y otros síntomas, son altamente indicativos de infección vaginal, que, frecuentemente, se asocia a afectación vulvar y, en ocasiones, a infección cervical o cérvico-uterina1.
Las infecciones vulvovaginales son el motivo de más del 30% de las consultas ginecológicas. En España y países europeos de nuestro entorno las causas más frecuentes son la vulvovaginitis candidiásica, la vaginosis bacteriana y la vulvovaginitis tricomoniásica, por este orden2. Las vulvovaginitis incluyen todo proceso inflamatorio que afecte a la vulva o a la vagina. Más del 90% tienen un origen infeccioso, mientras que en el resto puede ser de causa alérgica, iatrogénica o atrófica (senil). Están favorecidas por factores que alteran el equilibrio normal de la microbiota vaginal y favorecen el crecimiento de microorganismos patógenos, como la administración de antibióticos de amplio espectro, las deficiencias inmunológicas, la utilización de métodos anticonceptivos hormonales o mecánicos, los lavados vaginales o la gestación3,4. Aproximadamente, el 20-25% de las vulvovaginitis infecciosas son candidiasis, y Candida albicans (C. albicans) es la responsable del 90% de estos episodios. Otras especies menos frecuentes de este género, como Candida glabrata, Candida tropicalis, Candida krusei, Candida kephyr, Candida guillermondii, u otras, han registrado en los últimos años un aumento en su prevalencia y un incremento en la resistencia al tratamiento habitual1,5. La vulvovaginitis por Trichomonas vaginalis (T. vaginalis) representa un 15-20%, según el área geográfica, y se considera una enfermedad de transmisión sexual, ya que la principal vía de contagio de este protozoo es a través de las relaciones sexuales6.
La vaginosis bacteriana es una alteración de la microbiota vaginal normal, que, en ausencia de componente inflamatorio, se caracteriza por una disminución de Lactobacillus spp. junto con un incremento, en torno a 100-1.000 veces más que en las vaginas normales, de la concentración de bacterias anaerobias facultativas y anaerobias estrictas como Gardnerella vaginalis (G. vaginalis), Mycoplasma hominis (M. hominis), Ureaplasma urealyticum (U. urealyticum), Eubacterium spp., Bacteroides spp., Mobiluncus spp., Prevotella spp., Propionibacterium spp., Peptococcus spp., o Peptostreptococcus spp., entre otros2.
Por último, en la mujer, los 2agentes etiológicos más frecuentes de endocervicitis son Chlamydia trachomatis (Chlamydia trachomatis) y Neisseria gonorrhoeae (N. gonorrhoeae), consideradas ambas enfermedades de transmisión sexual de baja prevalencia en países desarrollados, aunque muy frecuentes en los países en vías de desarrollo7.
En el varón las infecciones genitales de tipo exudativo o purulento (uretritis o balanitis, principalmente) son frecuentemente asintomáticas y tienden a estar infradiagnosticadas, lo que incrementa la posibilidad de transmisión. Entre los principales agentes etiológicos destacan Candida spp., C. trachomatis, N. gonorrhoeae, T. vaginalis, Haemophilus influenzae (H. influenzae) o Haemophilus parainfluenzae (H. parainfluenzae)8.
Aunque en la mayor parte de las ocasiones se trata de enfermedades leves, en las mujeres constituyen un factor de riesgo de enfermedad inflamatoria pélvica, esterilidad (también en los varones), infecciones obstétricas, embarazos extrauterinos, rotura prematura de membrana, malformaciones congénitas y morbimortalidad perinatal9. Además, la presencia de cualquiera de estas infecciones se relaciona con la posible aparición concomitante de otras infecciones de transmisión sexual, bacterianas o víricas10,11. Todo ello justifica la necesidad de un diagnóstico y tratamiento precoces.
El objetivo de nuestro estudio fue describir y analizar la epidemiología de los microorganismos, patógenos estrictos u oportunistas con capacidad de crecer en medios de cultivo artificiales, causantes de cervicitis, vulvovaginitis, vaginosis, uretritis y balanitis, en un periodo concreto y en una población general atendida en el área en la que prestan atención sanitaria 2hospitales universitarios de tercer nivel de la provincia de Granada (España), el Hospital Virgen de las Nieves y el Hospital San Cecilio.
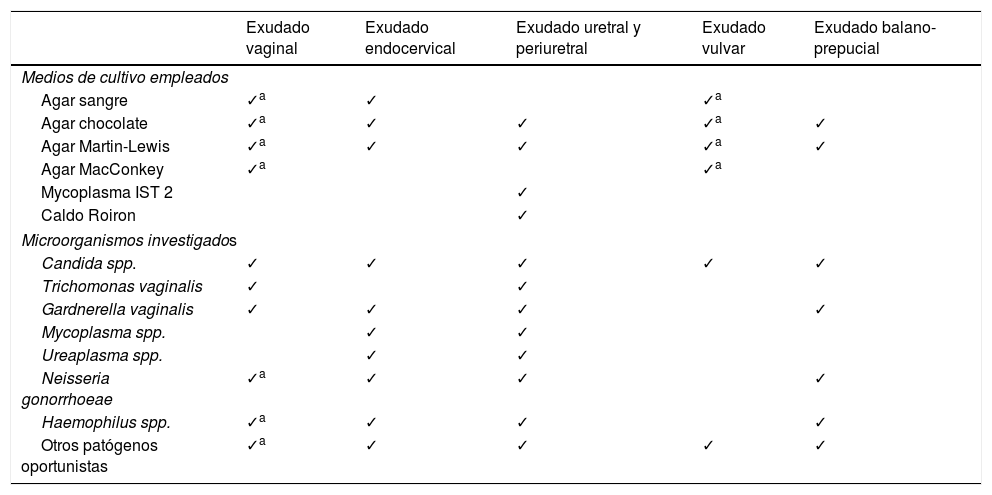
Material y métodoSe evaluaron todas las muestras recibidas para diagnóstico microbiológico de infección genital baja entre el 1 de febrero y el 31 de mayo del 2015. Todas ellas fueron procesadas siguiendo el protocolo de trabajo normalizado del laboratorio de Microbiología Clínica. Siempre que fue posible, con uno de los hisopos recibidos se realizó tinción de Gram. Si no se recibió un número adecuado de hisopos para garantizar la realización de todos los procedimientos (al menos 3), se priorizó el cultivo en placas de agar. En la tabla 1 se muestran los medios empleados para el cultivo, así como los microorganismos que se investigaron, con relación a cada uno de los diferentes tipos de muestra. Todos los medios se incubaron a 37°C durante 24-48 h. Los cultivos en agar sangre, agar chocolate y agar Martin-Lewis se incubaron en atmósfera enriquecida con CO2. Además, se utilizó el sistema de hibridación de ácidos nucleicos Affirm VPIII (Becton Dickinson, Sparks, EE. UU.) para detectar, directamente sobre las muestras, la presencia de G. vaginalis (a concentraciones superiores a 2×105 UFC por muestra), de las especies más comunes del género Candida (1×104 UFC) y T. vaginalis (5×103 parásitos), lo que se correlaciona, por su elevada concentración, con significación clínica12.
Medios de cultivos empleados y microorganismos investigados, según cada tipo de muestra
| Exudado vaginal | Exudado endocervical | Exudado uretral y periuretral | Exudado vulvar | Exudado balano-prepucial | |
|---|---|---|---|---|---|
| Medios de cultivo empleados | |||||
| Agar sangre | ✓a | ✓ | ✓a | ||
| Agar chocolate | ✓a | ✓ | ✓ | ✓a | ✓ |
| Agar Martin-Lewis | ✓a | ✓ | ✓ | ✓a | ✓ |
| Agar MacConkey | ✓a | ✓a | |||
| Mycoplasma IST 2 | ✓ | ||||
| Caldo Roiron | ✓ | ||||
| Microorganismos investigados | |||||
| Candida spp. | ✓ | ✓ | ✓ | ✓ | ✓ |
| Trichomonas vaginalis | ✓ | ✓ | |||
| Gardnerella vaginalis | ✓ | ✓ | ✓ | ✓ | |
| Mycoplasma spp. | ✓ | ✓ | |||
| Ureaplasma spp. | ✓ | ✓ | |||
| Neisseria gonorrhoeae | ✓a | ✓ | ✓ | ✓ | |
| Haemophilus spp. | ✓a | ✓ | ✓ | ✓ | |
| Otros patógenos oportunistas | ✓a | ✓ | ✓ | ✓ | ✓ |
Para la identificación de los microorganismos crecidos en cultivo se utilizaron los sistemas MALDI Biotyper (Bruker Daltonics, Billerica, EE. UU.) o MicroScan (Siemens Healthcare Diagnostics, Madrid, España)13. La identificación de Mycoplasma spp. y Ureaplasma spp. se realizó a partir del sistema Mycoplasma IST 2 (bioMérieux, Marcy l’Etoile, Francia) en caso de recuentos superiores a 104 UFC por muestra14. Para la identificación de las levaduras crecidas en cultivo, además de la utilización del medio CHROMagar Candida (Becton Dickinson), se realizó la prueba de filamentación en suero fetal bovino, para diferenciar C. albicans de otras especies. En caso de que la prueba fuese negativa la identificación de la especie de Candida se realizó mediante el sistema Vitek2 (bioMérieux).
Consideraciones éticasEl protocolo del estudio se llevó a cabo con arreglo a la Declaración de Helsinki y la Comisión de Ética e Investigación Sanitaria de los Centros Hospitalarios y Distritos de Atención Sanitaria. Este fue un estudio no intervencionista, con ninguna investigación adicional a los procedimientos rutinarios. El material biológico se utilizó solo para el diagnóstico estándar de infecciones del tracto genital, siguiendo las prescripciones de los médicos. No se realizó muestreo adicional ni modificación del protocolo diagnóstico de rutina. Se realizaron los análisis de datos utilizando una base de datos anónima. Por lo tanto, la aprobación fue considerada innecesaria según las pautas de nuestro país. La entidad que concedió el permiso para acceder y utilizar los datos fue la Unidad de Gestión Clínica de Enfermedades Infecciosas y Microbiología Clínica del Hospital Virgen de las Nieves de Granada, España.
ResultadosDurante los 4meses que comprendió el período de estudio, el Servicio de Microbiología recibió 2017 muestras para diagnóstico microbiológico de infección genital baja, obtenidas en 1.722 pacientes distintos (1.626 mujeres y 96 varones). Todas ellas procedieron de consultas de Atención Primaria o Consultas de Ginecología, Obstetricia o Urología. La muestra más frecuente fue el exudado vaginal (1.604 muestras), seguida de 179 muestras de exudado endocervical, 73 exudados uretrales (en varones), 44 exudados periuretrales (en mujeres), 85 exudados vulvares y 32 muestras de exudado balano-prepucial. El rango de edad de los pacientes osciló entre 1 y 93 años, con una media de 33, siendo el intervalo de edad comprendido entre los 20 y los 40 años aquel del que más número de muestras se recibieron (77,75%).
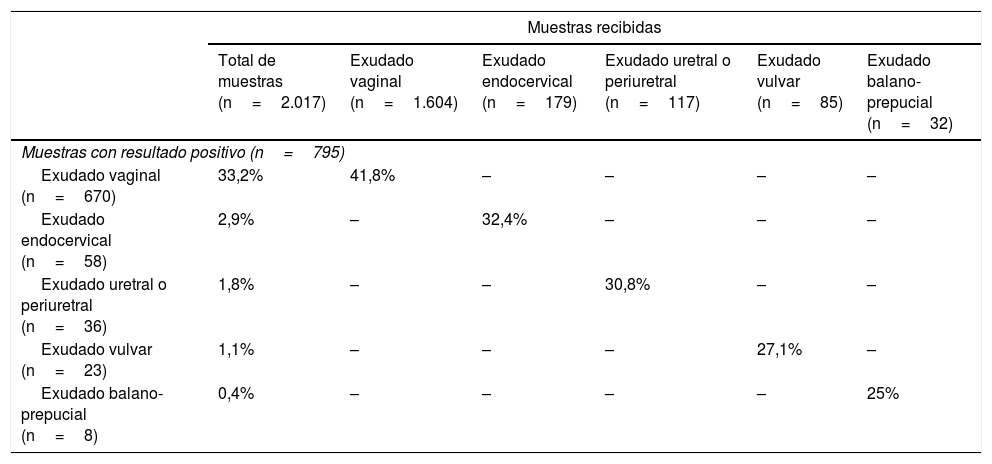
En 795 muestras (39,4% del total de las procesadas), pertenecientes a 772 pacientes distintos (745 mujeres y 27 varones), se detectó la presencia de, al menos, un microorganismo con significación clínica, lo que representó el 44,8% de los pacientes a los que se solicitó estudio microbiológico. En las tablas 2 y 3 se indica la frecuencia de resultados positivos con relación a las muestras recibidas y a los pacientes atendidos, respectivamente.
Porcentaje de muestras con resultado positivo con relación a las muestras recibidas para estudio microbiológico
| Muestras recibidas | ||||||
|---|---|---|---|---|---|---|
| Total de muestras (n=2.017) | Exudado vaginal (n=1.604) | Exudado endocervical (n=179) | Exudado uretral o periuretral (n=117) | Exudado vulvar (n=85) | Exudado balano-prepucial (n=32) | |
| Muestras con resultado positivo (n=795) | ||||||
| Exudado vaginal (n=670) | 33,2% | 41,8% | – | – | – | – |
| Exudado endocervical (n=58) | 2,9% | – | 32,4% | – | – | – |
| Exudado uretral o periuretral (n=36) | 1,8% | – | – | 30,8% | – | – |
| Exudado vulvar (n=23) | 1,1% | – | – | – | 27,1% | – |
| Exudado balano-prepucial (n=8) | 0,4% | – | – | – | – | 25% |
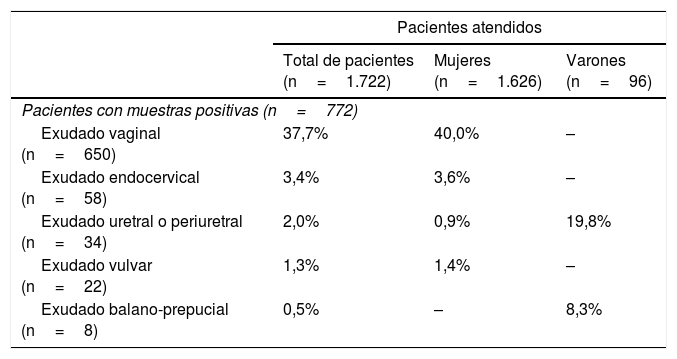
Porcentaje de pacientes con muestras positivas con relación a los atendidos
| Pacientes atendidos | |||
|---|---|---|---|
| Total de pacientes (n=1.722) | Mujeres (n=1.626) | Varones (n=96) | |
| Pacientes con muestras positivas (n=772) | |||
| Exudado vaginal (n=650) | 37,7% | 40,0% | – |
| Exudado endocervical (n=58) | 3,4% | 3,6% | – |
| Exudado uretral o periuretral (n=34) | 2,0% | 0,9% | 19,8% |
| Exudado vulvar (n=22) | 1,3% | 1,4% | – |
| Exudado balano-prepucial (n=8) | 0,5% | – | 8,3% |
Hubo 670 muestras vaginales positivas (33,2% de las muestras recibidas y 41,8% respecto a las muestras de este mismo tipo), obtenidas a partir de 650 mujeres (37,7% respecto al total de pacientes y 40,0% de las mujeres atendidas); 58 muestras endocervicales positivas (2,9%/32,4%), en otras tantas mujeres (3,4%/3,6%); 36 muestras uretrales o periuretrales (1,8%/30,8%) en 34 pacientes (2,0%), 15 mujeres (0,9%) y 19 varones (19,8%); 23 muestras vulvares (1,1% / 27,1%) obtenidas en 22 mujeres (1,3%/1,4%), y, finalmente, 8 muestras balano-prepuciales (0,4%/25%) en 8 varones (0,5%/8,3%). En conjunto, el 45,8% de las mujeres y el 28,1% de los varones tuvieron un diagnóstico microbiológico de infección genital baja.
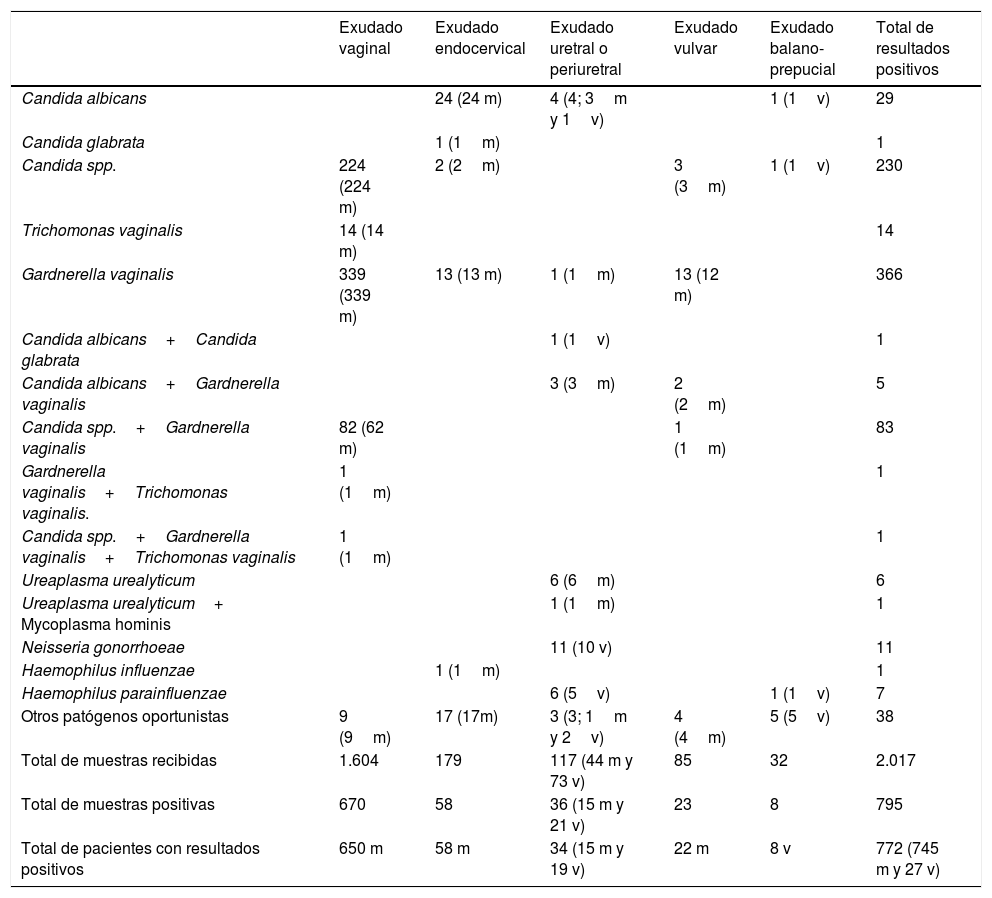
En la tabla 4 se indica la distribución de los microorganismos identificados con relación al tipo de muestra y al total de pacientes estudiados. En 434 pacientes se diagnosticó infección por G. vaginalis, lo que representó un 26,7% de todas las mujeres estudiadas y 58,3% entre las mujeres que tuvieron alguna muestra positiva. En 68 (15,7% de estas pacientes y 4,2% del total de mujeres) existió infección mixta con Candida spp., en otro paciente con T. vaginalis y en otro más, una infección mixta de G. vaginalis, Candida spp. y T. vaginalis. La presencia de esta bacteria fue especialmente frecuente en mujeres entre 20 y 33 años (49,78% de los diagnósticos se realizaron en pacientes en este rango de edad).
Distribución de los microorganismos identificados en el total de muestras y pacientes estudiados
| Exudado vaginal | Exudado endocervical | Exudado uretral o periuretral | Exudado vulvar | Exudado balano-prepucial | Total de resultados positivos | |
|---|---|---|---|---|---|---|
| Candida albicans | 24 (24 m) | 4 (4; 3m y 1v) | 1 (1v) | 29 | ||
| Candida glabrata | 1 (1m) | 1 | ||||
| Candida spp. | 224 (224 m) | 2 (2m) | 3 (3m) | 1 (1v) | 230 | |
| Trichomonas vaginalis | 14 (14 m) | 14 | ||||
| Gardnerella vaginalis | 339 (339 m) | 13 (13 m) | 1 (1m) | 13 (12 m) | 366 | |
| Candida albicans+Candida glabrata | 1 (1v) | 1 | ||||
| Candida albicans+Gardnerella vaginalis | 3 (3m) | 2 (2m) | 5 | |||
| Candida spp.+Gardnerella vaginalis | 82 (62 m) | 1 (1m) | 83 | |||
| Gardnerella vaginalis+Trichomonas vaginalis. | 1 (1m) | 1 | ||||
| Candida spp.+Gardnerella vaginalis+Trichomonas vaginalis | 1 (1m) | 1 | ||||
| Ureaplasma urealyticum | 6 (6m) | 6 | ||||
| Ureaplasma urealyticum+ Mycoplasma hominis | 1 (1m) | 1 | ||||
| Neisseria gonorrhoeae | 11 (10 v) | 11 | ||||
| Haemophilus influenzae | 1 (1m) | 1 | ||||
| Haemophilus parainfluenzae | 6 (5v) | 1 (1v) | 7 | |||
| Otros patógenos oportunistas | 9 (9m) | 17 (17m) | 3 (3; 1m y 2v) | 4 (4m) | 5 (5v) | 38 |
| Total de muestras recibidas | 1.604 | 179 | 117 (44 m y 73 v) | 85 | 32 | 2.017 |
| Total de muestras positivas | 670 | 58 | 36 (15 m y 21 v) | 23 | 8 | 795 |
| Total de pacientes con resultados positivos | 650 m | 58 m | 34 (15 m y 19 v) | 22 m | 8 v | 772 (745 m y 27 v) |
Entre paréntesis se indica el número de pacientes con resultado positivo para cada tipo de muestra y microorganismo identificado, según el sexo.
m: mujer; v: varón.
Hubo 330 pacientes (326 mujeres y 4 varones) con infección por Candida spp., incluidas, como se ha comentado anteriormente, las infecciones mixtas con G. vaginalis y T. vaginalis, además de un varón con una balanitis por C. albicans y C. glabrata. Esta levadura estuvo presente, por tanto, en el 19,2% de los pacientes atendidos (20,0% de las mujeres y 4,2% de los varones) y en el 44,7% de aquellos que tuvieron algún resultado positivo. Se realizó identificación de especie en 36 aislados, 34C. albicans y 2C. glabrata. Al igual que en G. vaginalis, la presencia de levaduras fue especialmente frecuente en el intervalo de edad comprendido entre los 20 y los 33 años (53,12% de los diagnósticos).
T. vaginalis fue detectada en 16 mujeres (1,0% de los pacientes de este sexo), incluidas las infecciones mixtas con G. vaginalis y Candida spp. Respecto al total, representó el 0,9% de pacientes atendidos y el 2,0% de los que tuvieron algún diagnóstico positivo. Cinco fueron pacientes entre 20 y 33 años, otras 5 tuvieron edades entre 34 y 47 y 5 más fueron mayores de 47 años. Entre las 10 gonococias diagnosticadas, todas ellas en pacientes varones (10,4% de los pacientes de este sexo), 7 se produjeron en el intervalo entre 20 y 40 años y el resto en edades superiores. Hubo 7 infecciones por U. urealyticum, una de ellas conjuntamente con M. hominis (0,4% de las mujeres), de las cuales, la mayor parte (71,4%) se diagnosticaron en el intervalo entre los 35 y 45 años. De las 7 infecciones por Haemophilus spp. (0,4% del total de pacientes y 0,9% de los que se identificó algún microorganismo), 6 fueron en pacientes varones (6,3% de los pacientes de este sexo). Estas bacterias fueron también especialmente frecuentes en el intervalo entre 35 y 45 años (57,1%).
Por último, también se aislaron, en 38 pacientes (2,2%), microorganismos patógenos oportunistas (11 Escherichia coli, 8 Staphylococcus aureus (S. aureus), 7 Streptococcus agalactiae, 3 Klebsiella pneumoniae, Pseudomonas aeruginosa y Enterococcus faecalis (E. faecalis), 2 Streptococcus pyogenes y un paciente con infección mixta por E. faecalis y S. aureus). El 38,5% de estas bacterias se detectó en pacientes menores de 20 años, mientras que el 53,8% se aisló en pacientes entre 20 y 47 años.
DiscusiónEn el presente estudio, el microorganismo más frecuentemente identificado en muestras genitales bajas fue G. vaginalis. En el 26,7% de las mujeres atendidas se diagnosticó, desde el punto de vista microbiológico, la existencia de una vaginosis bacteriana tras la detección de esta bacteria por la técnica de hibridación de ADN en alguna de las muestras. Aunque se considera que la simple detección de esta bacteria en secreciones vaginales, no puede usarse como prueba diagnóstica de vaginosis bacteriana, puesto que no es el único agente etiológico implicado y se trata de un síndrome infeccioso polimicrobiano; el aumento de la prevalencia y su presencia en altas concentraciones en toda mujer con esta enfermedad indican que desempeña un papel importante y que puede ser un prerrequisito para el desarrollo de la misma15.
Como se comentó anteriormente, la mayor parte de los estudios de ámbito europeo establecen que esta enfermedad es, tras la vulvovaginitis infecciosa, la principal causa de flujo vaginal anormal en la mujer en edad fértil, aunque en otros países, como EE. UU., ocupa el primer lugar16. En España hay pocos estudios epidemiológicos realizados en población general atendida en los centros de asistencia primaria. González-Pedraza Avilés et al.17 y Romero Herrero y Andreu Domingo18 han comunicado una frecuencia de vaginosis bacteriana del 33 y el 30%, respectivamente, entre mujeres asistidas en Atención Primaria, resultados ligeramente superiores a los encontrados por nosotros. Además, en un 6,5% de las pacientes la presencia de G. vaginalis se combinó con la de Candida spp. y en un 0,3% con T. vaginalis18, de forma parecida a lo que ocurrió en nuestra población de estudio, en la que estas combinaciones representaron el 4,2 y el 0,1%, respectivamente. En nuestro trabajo, la mayor frecuencia de vaginosis bacteriana se produjo en el intervalo de edad entre 20 y 33 años, muy coincidente con otros datos publicados en población similar a la nuestra17, pero contrario a los comunicados por autores como Morris et al.19 o Mendoza-González et al.20, que hallaron las frecuencias más altas en mujeres mayores de 30 años. En cualquier caso, diversas publicaciones indican que la mayor parte de las vaginosis bacterianas se producen en mujeres entre los 15 y 44 años, coincidiendo con la etapa de mayor actividad sexual2.
Como vemos, aunque las cifras varían ligeramente según las fuentes, se considera que este proceso infeccioso está presente en el 25-35% de las pacientes que acuden a consultas de Atención Primaria, ginecológicas o de enfermedades de transmisión sexual (rango en el que se encuentran nuestros resultados, así como los de otros autores en nuestro país) con una prevalencia en la población general en países desarrollados que oscila entre el 4 y el 14%, según los estudios21,22.
En nuestro trabajo no se han identificado otras causas de vaginosis bacteriana. Otros estudios microbiológicos que han analizado el flujo vaginal de mujeres con esta misma entidad han demostrado que G. vaginalis es el microorganismo más frecuente, detectándose en más del 98% de los casos como único agente responsable23.
El segundo microorganismo más frecuentemente aislado en las muestras genitales bajas de nuestro estudio fue Candida spp. (20,0% de las mujeres y 4,2% de los varones atendidos presentaron infección candidiásica), especialmente en el intervalo de edad entre 20 y 33 años, de forma similar a la vaginosis bacteriana. A pesar de que se considera que más de un 25% de las mujeres pueden ser portadoras asintomáticas, la presencia de esta levadura en la vagina debe considerarse siempre patológica5. Nuestros resultados sobre población general son similares a los de otras publicaciones que estiman que, en ese entorno, las micosis vulvovaginales representan el 20-30% de las vulvovaginitis infecciosas18, y que el 75% de las mujeres presentará al menos un episodio de candidiasis vulvovaginal a lo largo de su vida, y un 40-45% experimentará 2o más episodios5.
La tercera causa de infección genital baja, de forma similar a lo que indican otros estudios, fue la tricomoniasis. En el 1,0% de las mujeres estudiadas, y en ningún varón, se detectó este protozoo, con 2tercios de los casos en edades comprendidas entre los 20 y 47 años, y el tercero, por encima de estas edades. También Romero Herrero y Andreu Domingo18 han comunicado resultados similares (1%) en población general. Sin embargo, como cabría esperar, estudios realizados en prostitutas han obtenido frecuencias del 17%24.
Datos previos en España indican que las infecciones por T. vaginalis han sido frecuentes en varones de más de 30 años, con una prevalencia del 1,4% en 1986 al 0,9% en el año 2000, y en prostitutas, en las que la prevalencia pasó del 7,0% en 1986 al 3,4% en el año 20018,25. Aunque la tricomoniasis vaginal es una de las infecciones de transmisión sexual más frecuentes, su incidencia y prevalencia están progresivamente disminuyendo, al menos en países desarrollados, si bien se mantiene cierta estabilidad en países en desarrollo8,26. Aun considerando que se trata de una enfermedad de transmisión sexual, que puede afectar a cualquier persona, se identifican una serie de grupos poblacionales (adolescencia, prostitución, toxicomanías, etc.) que, por su comportamiento sexual, son más susceptibles de adquirir esta infección y que, al tratarse, en muchas ocasiones de portadores sanos de difícil detección y tratamiento, pueden difundirla al resto de la población, manteniendo tasas elevadas, aunque infradiagnosticadas.
La infección por gonococo fue, en nuestro trabajo, la cuarta entidad clínica en frecuencia absoluta, diagnosticándose en 10 pacientes, todos ellos varones (10,4% de los pacientes de este sexo) y, fundamentalmente, entre los 20 y 40 años. La mayor parte de los estudios epidemiológicos que incluyen datos sobre frecuencia de infección gonocócica se han realizado en población atendida en Unidades de Infecciones de Transmisión Sexual (UITS), en las que la incidencia de esta enfermedad ofrece tasas más elevadas que en población general. Es el caso, en España, del trabajo de Vall Mayans et al.27, en el que el 8% de los pacientes atendidos en las UITS de Barcelona entre los años 2001 y 2002 presentaron una gonococia. El 77% de estos diagnósticos se realizó entre varones homosexuales. Esta condición sexual es frecuente entre la población masculina diagnosticada de gonococia8.
Datos previos en España indican que la prevalencia de infecciones por N. gonorrhoeae en prostitutas disminuyó del 6,3% en 1986 al 0,13% en el 2000, aunque se observó un aumento al 1,7% en el 2001, mientras que las uretritis masculinas pasaron del 7,1% en el período 1989-1994 al 2,4% en el período 1995-2000. Se considera que, a partir del año 2000, se asistió en nuestro país a un aumento muy importante del número de gonococos aislados en pacientes varones8,25, un reflejo de lo cual pueden ser los datos obtenidos en nuestro estudio.
La uretritis por U. urealyticum se considera la primera causa de uretritis en todo el mundo, incluida España. Si consideramos estudios previos en población española, las tasas de prevalencia han oscilado entre el 15,3% en el período 1989-1994 y el 33,5% en el 1995-2000, siendo más frecuente, a diferencia de algunos de los procesos clínicos descritos anteriormente, como la vaginosis bacteriana o la vulvovaginitis candidiásica, en edades superiores a los 30 años25. En comparación a estos datos, la frecuencia de infecciones por U. urealyticum y M. hominis en nuestro estudio fue especialmente baja (0,4% de las mujeres atendidas), aunque a semejanza de los mismos, el 71,4% de los casos se diagnosticaron en mujeres entre 35 y 45 años.
Por último, aunque H. influenzae y H. parainfluenzae son bacterias comúnmente implicadas en infecciones respiratorias, también se han asociado con el desarrollo de uretritis, vulvovaginitis y cervicitis, entre otros procesos28. Nuestros datos revelan que en el 0,4% de los pacientes se aislaron estos microorganismos (6 H. parainfluenzae en 6 varones y 1 H. influenzae en una mujer), situándose la mayor parte de los casos entre los 35 y 45 años, datos por debajo de los que han encontrado otros autores, con cifras del 2,8% entre población de riesgo29.
Finalmente, nuestro trabajo aporta una descripción de los microorganismos presentes en infecciones genitales bajas en población general, un aspecto que no está suficientemente analizado, al menos en nuestro país, donde la mayor parte de los estudios publicados se han centrado en población de riesgo, lo que distorsiona los datos de incidencia poblacional de estas infecciones. Nuestros resultados indican que, al menos en nuestra población, la vaginosis bacteriana es el proceso más frecuente, seguido de las micosis por Candida spp., la tricomoniasis, la gonococia y las uretritis por Ureaplasma spp. y Haemophilus spp., con frecuencias similares a las aportadas por otros trabajos.
Conflicto de interesesLos autores declaran no tener conflictos de interés.