El laboratorio debe garantizar la estabilidad de las muestras conservadas con la finalidad de una eventual confirmación de resultados o corregir posibles errores u omisiones al ingresar las solicitudes médicas. Con este objetivo se comparó la estabilidad de los analitos de muestras conservadas en el tubo primario selladas con film contra cierre con tapa plástica.
Material y métodosVeinticuatro muestras de sangre fueron alicuotadas en dos tubos primarios, uno cerrado con tapa plástica y otro con film. A ambas alícuotas se les midieron 26 analitos de química clínica durante siete días consecutivos, en un autoanalizador Cobas c 501 de Roche y se conservaron en refrigerador a 2-8°C. Se calcularon los coeficientes de variación y el error total. Los resultados obtenidos se compararon con el requisito de calidad respectivo establecido por el laboratorio.
ConclusionesSe observó una mayor variabilidad en los tubos cerrados con film respecto de los cerrados con tapa plástica. Todas las enzimas evaluadas cumplieron el requisito de calidad durante 4 días. A excepción del hierro todos los iones fueron estables solo un día. Los metabolitos fueron estables durante una semana a excepción de glucosa, proteínas totales, ácido úrico y albúmina. Se recomienda que cada laboratorio evalúe la estabilidad de los analitos en base a su forma de trabajo.
The laboratory must be able to guarantee the stability of stored patient samples for confirmation of results or errors in the interpretation of the medical request. The aim of this study was to evaluate the stability of the blood analytes preserved in tubes sealed with film versus a plastic cap.
Material and methodsA total of 24 blood samples were aliquoted into two tubes; one sealed with film, and the other with a plastic cap. Twenty-six clinical chemistry analytes were measured for 7 consecutive days using a Roche Cobas c 501 autoanalyser. The samples were stored in a refrigerator between 2-8C. The total error and coefficient of variation were calculated, and the results were compared against the quality requirements of the laboratory.
ConclusionsThe variation was higher in the tubes sealed with film than in those with a plastic cap. Enzymes remained within the quality requirements for four days, and ions, apart from iron, were stable for only one day. The metabolites were stable for seven days excluding glucose, uric acid, total proteins, and albumin. It is suggested that each laboratory must evaluate the stability of analytes based on its workflow.
La fase preanalítica es una etapa muy importante en el proceso global del laboratorio. Existen muchas variables que pueden afectar los resultados de las muestras de sangre u otros fluidos corporales de los pacientes. Entre las variables de naturaleza fisiológica pueden citarse ritmo circadiano, stress, dieta, ayuno, ejercicio previo, hábito tabáquico y edad; por otra parte, entre las variables relacionadas con la toma de la muestra se destacan la postura, el reposo previo a la venopunción, la técnica empleada y el uso apropiado del torniquete.
En la fase preanalítica se pueden distinguir dos etapas, una externa al laboratorio y otra dentro del mismo. Lamentablemente, la etapa externa queda en la mayoría de los casos fuera del control directo de los profesionales del laboratorio. Los errores que pueden generarse en esta etapa tienen distinta importancia y su medición es difícil ya que algunos de ellos se ponen de manifiesto en la fase analítica y otros podrían no ser detectados (por ello, para algunos analitos especiales se entrega un instructivo para asegurar que el paciente concurra al laboratorio debidamente preparado). En este sentido, la fase preanalítica incluye diferentes acciones, iniciándose con la solicitud del análisis por el médico, seguido de la recolección de la muestra, su transporte al laboratorio, la recepción por el personal de admisión, la preparación para el examen, el envío hacia el sector correcto del laboratorio y el acondicionamiento de la misma para su análisis. Como se demostró en algunos estudios, la frecuencia de errores en la etapa preanalítica no es despreciable; Plebani et al.1–3 concluyen que los errores en la etapa preanalítica representan entre 46 a 68,2% del total de errores en el proceso del laboratorio. Pueden existir errores en la solicitud del análisis, en la identificación del paciente y/o de la muestra o en el ingreso de las pruebas al sistema informático del laboratorio. La conservación de las muestras es fundamental para la posible ampliación de pruebas por el clínico y/o la aplicación de algoritmos diagnósticos y adicionalmente permitiría el agregado de pruebas solicitadas y no introducidas por error en el sistema informático del laboratorio. En consecuencia, resulta determinante comprender cómo la estabilidad de los analitos puede verse alterada con el transcurso del tiempo debiendo tomarse los recaudos para asegurar la integridad de las muestras4,5.
Es una tendencia generalizada en los laboratorios modernos, para la seguridad del paciente y para garantizar la trazabilidad de las muestras biológicas trabajar con el tubo primario. Actualmente, existen sistemas de procesamiento automatizado de la fase preanalítica que se encargan de centrifugar la muestra, fraccionar en alícuotas si corresponde, tapar los tubos individualmente y direccionarlos al sector adecuado del laboratorio. Los laboratorios que no cuentan con estos sistemas realizan este trabajo manualmente, tarea que insume un tiempo considerable. Para disminuir el tiempo invertido en esta operación se propone efectuar el cierre de los tubos con un film adherente. El objetivo de este trabajo fue analizar la estabilidad de analitos medidos en química clínica a partir de muestras conservadas en el tubo primario con gel acelerador de la coagulación cerrados con tapa versus tubos cerrados con film de forma de obtener el lapso de tiempo en el cual los analitos cumplen el requisito de calidad (RC) establecido por el laboratorio.
Material y métodosFueron obtenidas muestras de sangre de 28 integrantes del laboratorio que se incorporaron voluntariamente para realizar el estudio, previa firma de consentimiento informado. Los criterios de inclusión fueron: no padecer ninguna enfermedad crónica, no estar cursando ningún episodio agudo, no haber realizado ejercicio físico y haber respetado el ayuno de 12 h. Fueron excluidos 4 participantes que no cumplían con los requisitos de ayuno mencionado. Un único flebotomista extrajo a cada sujeto 8mL de sangre por punción venosa, que se recogieron en dos tubos primarios estériles con gel activador de la coagulación, con capacidad para 4mL (Vacuette®, Greiner Bio One International). Los tubos se agitaron por inversión 8 veces y permanecieron 30 min en reposo antes de ser centrifugados6 a 3.600 revoluciones por minuto durante 15 min. En los sueros obtenidos se midieron por duplicado 26 analitos de química clínica en un autoanalizador Cobas® c501 de Roche (Alemania) empleando reactivos y calibradores de la línea Cobas® de Roche (Alemania) y se procesaron como control de calidad interno los dos niveles del material Assayed Chemistry Bio-Rad® (Estados Unidos), trabajando a una temperatura ambiente controlada de 24°C. Finalizados los ensayos, los tubos primarios de cada participante se dividieron en dos grupos: 1) tubos primarios conservados con su propia tapa plástica (t) y 2) tubos primarios conservados en una gradilla envuelta con film adherente (f) Hermeticam (Argentina). Ambos grupos de tubos se conservaron en refrigerador a una temperatura de entre 2 y 8° C. Las mediciones se repitieron en forma consecutiva durante los seis días posteriores, en el mismo horario y bajo las mismas condiciones de trabajo y se calcularon los promedios y el coeficiente de variación (CV%) diarios y el error total (ET%) de cada uno de los analitos para ambas formas de conservación. El ET % se calculó según la expresión:
ET % = sesgo % + 1,65 CV%7
Para el cálculo del sesgo% (error sistemático) se tomó como referencia el promedio del primer día (día cero) para cada analito en ambos grupos de tubos y se calculó a través de los seis días siguientes. La fórmula utilizada fue la siguiente:
Sesgo% (i) = Xi – X0 × 100
X0
Sesgo% (i) corresponde al sesgo% del día i-ésimo; Xi es el promedio del día i-ésimo y X0 representa el promedio del día cero. El CV% correspondió al acumulado que se obtuvo de los datos de suero de control de calidad interno en dos niveles: Assayed Chemistry Bio-Rad® (Estados Unidos) procesados durante 688 días consecutivos. Para el cálculo se utilizó el programa Bio-Rad Unity Real Time ® (Estados Unidos). El ET% obtenido diariamente para ambos grupos de tubos se contrastó con los RC establecidos por el laboratorio para cada uno de los analitos: variabilidad biológica mínima, para: lipasa, magnesio, calcio, albúmina, colesterol asociado a lipoproteína de alta densidad y proteínas totales; variabilidad biológica deseable, para: fosfatasa alcalina, amilasa, aspartato aminotransferasa, lactato deshidrogenasa, potasio, fósforo, bilirrubina total, colesterol total, creatinina, glucosa, ácido úrico y urea; variabilidad biológica óptima, para: bilirrubina directa y proteína C reactiva ultrasensible; Clinical Laboratory Improvement Amendments, para: alanina aminotransferasa, creatina fosfoquinasa, cloruro, hierro y triglicéridos y requisito propio para el sodio.
Los cálculos estadísticos se realizaron con el programa SPSS 10.0 (SPSS Inc., 1999).
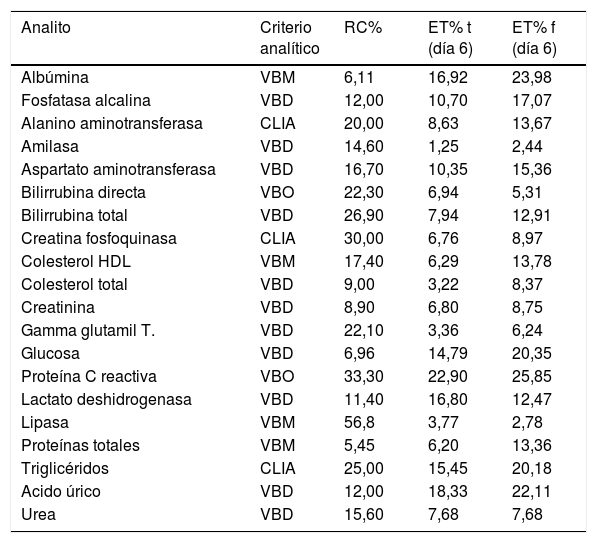
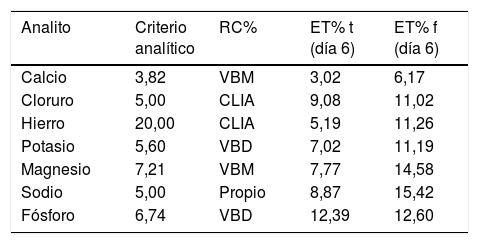
ResultadosLos resultados obtenidos para los ET% al cabo del sexto día se presentan en dos tablas; en la tabla 1 se incluyen las enzimas y los metabolitos y en la tabla 2 se listan los iones evaluados.
Error total de analitos conservados con tapa versus conservados con film: enzimas y metabolitos
| Analito | Criterio analítico | RC% | ET% t (día 6) | ET% f (día 6) |
|---|---|---|---|---|
| Albúmina | VBM | 6,11 | 16,92 | 23,98 |
| Fosfatasa alcalina | VBD | 12,00 | 10,70 | 17,07 |
| Alanino aminotransferasa | CLIA | 20,00 | 8,63 | 13,67 |
| Amilasa | VBD | 14,60 | 1,25 | 2,44 |
| Aspartato aminotransferasa | VBD | 16,70 | 10,35 | 15,36 |
| Bilirrubina directa | VBO | 22,30 | 6,94 | 5,31 |
| Bilirrubina total | VBD | 26,90 | 7,94 | 12,91 |
| Creatina fosfoquinasa | CLIA | 30,00 | 6,76 | 8,97 |
| Colesterol HDL | VBM | 17,40 | 6,29 | 13,78 |
| Colesterol total | VBD | 9,00 | 3,22 | 8,37 |
| Creatinina | VBD | 8,90 | 6,80 | 8,75 |
| Gamma glutamil T. | VBD | 22,10 | 3,36 | 6,24 |
| Glucosa | VBD | 6,96 | 14,79 | 20,35 |
| Proteína C reactiva | VBO | 33,30 | 22,90 | 25,85 |
| Lactato deshidrogenasa | VBD | 11,40 | 16,80 | 12,47 |
| Lipasa | VBM | 56,8 | 3,77 | 2,78 |
| Proteínas totales | VBM | 5,45 | 6,20 | 13,36 |
| Triglicéridos | CLIA | 25,00 | 15,45 | 20,18 |
| Acido úrico | VBD | 12,00 | 18,33 | 22,11 |
| Urea | VBD | 15,60 | 7,68 | 7,68 |
CLIA: Clinical Laboratory Improvement Amendments; ETf: error total para tubos cerrados con film; ETt: error total para tubos cerrados con tapa; RC: requisito de calidad; VBD: variabilidad biológica deseable; VBM: variabilidad biológica mínima; VBO: variabilidad biológica óptima.
Error total de analitos (iones) conservados con tapa plástica versus conservados con film
| Analito | Criterio analítico | RC% | ET% t (día 6) | ET% f (día 6) |
|---|---|---|---|---|
| Calcio | 3,82 | VBM | 3,02 | 6,17 |
| Cloruro | 5,00 | CLIA | 9,08 | 11,02 |
| Hierro | 20,00 | CLIA | 5,19 | 11,26 |
| Potasio | 5,60 | VBD | 7,02 | 11,19 |
| Magnesio | 7,21 | VBM | 7,77 | 14,58 |
| Sodio | 5,00 | Propio | 8,87 | 15,42 |
| Fósforo | 6,74 | VBD | 12,39 | 12,60 |
CLIA: Clinical Laboratory Improvement Amendments; ETf: error total para tubos cerrados con film; ETt: error total para tubos cerrados con tapa; Propio: requisito de calidad fijado por el laboratorio; RC: requisito de calidad; VBD: variabilidad biológica deseable; VBM: variabilidad biológica mínima.
Todas las enzimas evaluadas en este trabajo fueron estables a lo largo de una semana en ambas formas de conservación a excepción de la enzima fosfatasa alcalina que solo se mantuvo estable durante cuatro días en el tubo cerrado con film (ET%f día 5: 15,20%) y la enzima lactato deshidrogenasa que solo fue estable durante cuatro días en ambas formas de conservación (ET%t día 5: 12,47%; ET%f día 5: 12,66%). Con respecto a los iones, el hierro fue el único que se mantuvo estable durante los seis días en las dos formas de conservación evaluadas. En el caso particular de los electrólitos, ninguno de los incluidos en este trabajo se mantuvo dentro del RC al sexto día, solamente cumplieron con el RC el primer día, a excepción del fósforo conservado en tubo cerrado con film que permaneció dentro de las especificaciones de calidad durante dos días (ET%f día 3: 16,67%). Los metabolitos bilirrubina directa, bilirrubina total, colesterol asociado a lipoproteínas de alta densidad, colesterol total, proteína C reactiva de alta sensibilidad, creatinina, triglicéridos y urea cumplieron con el RC respectivo independientemente de la forma de conservación durante todo el período estudiado. Los analitos albúmina, glucosa, proteínas totales y ácido úrico se mantuvieron dentro del RC entre uno y tres días (datos no mostrados).
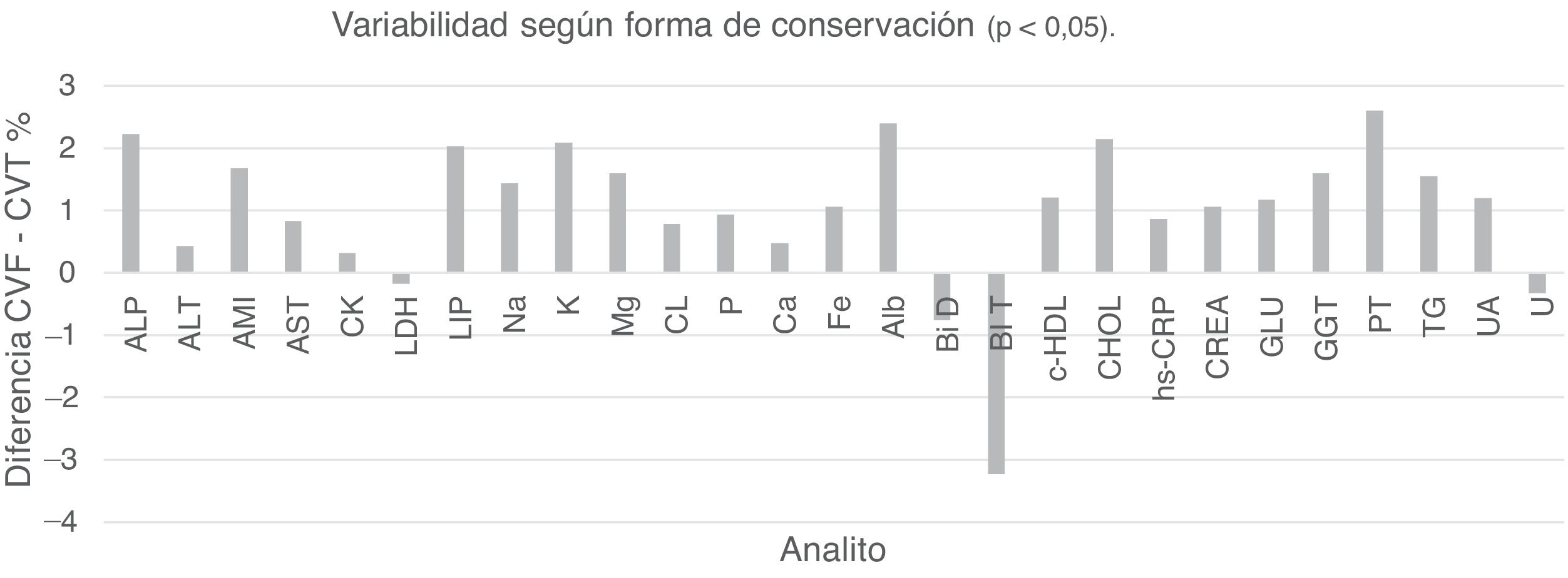
Durante el desarrollo de este trabajo, la forma de conservación que demostró la menor variabilidad fue la de los tubos cerrados con su propia tapa plástica. Este comportamiento se muestra en la figura 1, donde se grafica la diferencia entre los coeficientes de variación de los tubos cerrados con film (CV F) y los coeficientes de variación de los tubos cerrados con tapa plástica (CV T). A excepción de los metabolitos bilirrubina directa, bilirrubina total, urea y la enzima lactato deshidrogenasa los CV fueron siempre mayores en los tubos cerrados con film.
Variabilidad de los analitos según forma de conservación. ALP: fosfatasa alcalina; ALT: alanina aminotransferasa; AMI: α-amilasa; AST: aspartato aminotransferasa; Bil D: bilirrubina directa; Bil T: bilirrubina total; Ca: calcio; CK: creatina fosfoquinasa; c-HDL: colesterol asociado a lipoproteínas de alta densidad; Cl: cloruro; CREA: creatinina; CT: colesterol total; CVF: coeficiente de variación promedio film; CVT: coeficiente de variación promedio tapa plástica; Fe: hierro; GGT: γ-glutamil transferasa; GLU: glucosa; hs-CRP: proteína C reactiva ultrasensible; LDH: lactato deshidrogenasa; Lipasa: lipasa; K: potasio; Mg: magnesio; Na: sodio; P: fósforo; PT: proteínas totales; TG: triglicéridos; U: urea; UA: ácido úrico.
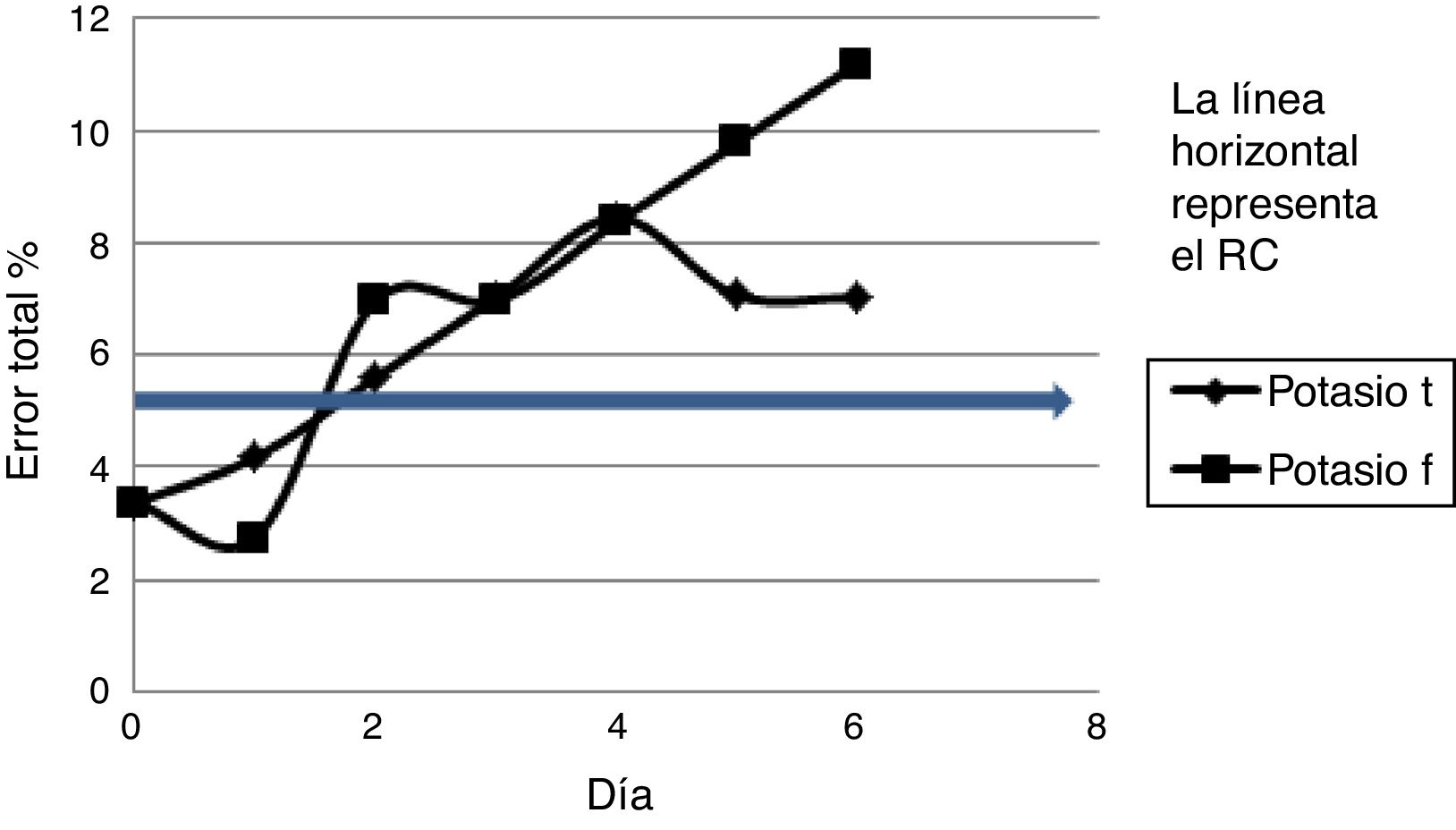
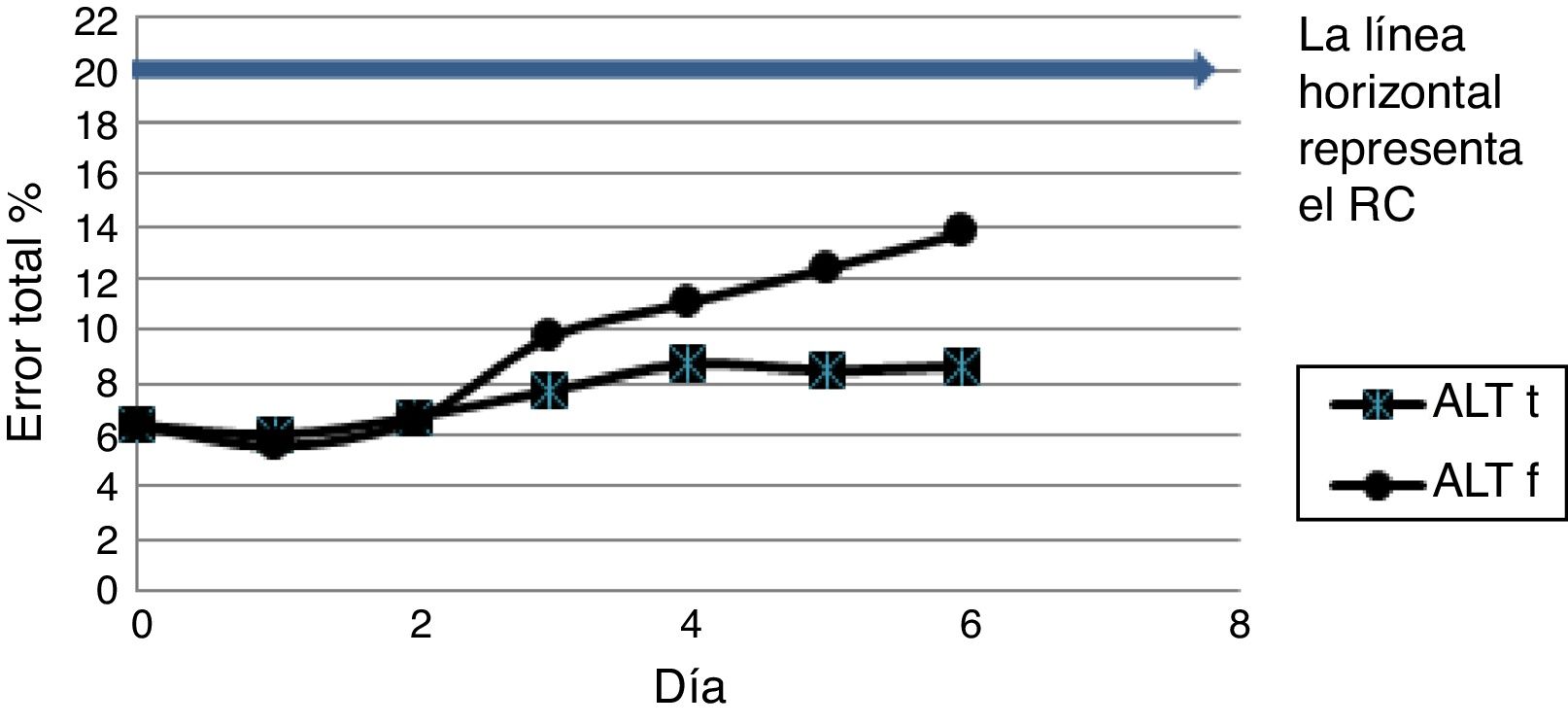
La tendencia general a lo largo del estudio fue de un aumento en el ET% para todos los analitos estudiados en ambas formas de conservación. Las figuras 2 y 3 esquematizan la progresión del ET % para el ion potasio que solo cumple el RC el primer día (el color de la figura solo puede apreciarse en la versión electrónica del artículo) y para la enzima alanino aminotransferasa que cumple durante los seis días su RC en ambas formas de conservación.
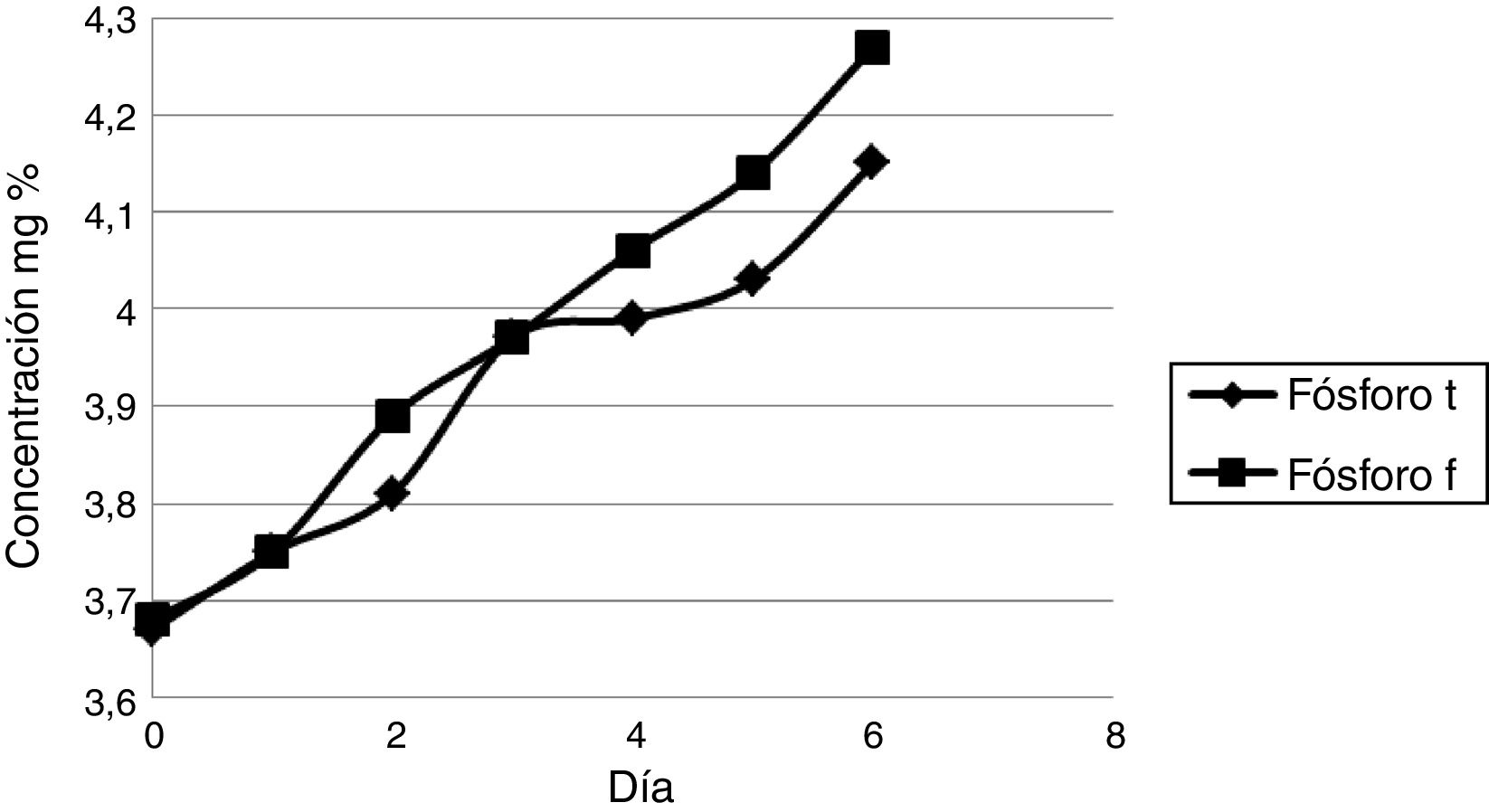
En el mismo sentido, los valores promedio diarios de la mayoría de los analitos tendieron a aumentar con el transcurso de los días, a excepción de los analitos glucosa, bilirrubina directa y bilirrubina total. La figura 4 representa el aumento de los valores promedio del fósforo a lo largo de los siete días del estudio.
El promedio de días en que los analitos se mantuvieron dentro de los RC fue de 1,9 días para las muestras cerradas con tapa y de 1,4 días para las muestras conservadas con film.
DiscusiónEn este trabajo hemos propuesto y evaluado una forma alternativa de conservación de los tubos primarios una vez que han sido efectuadas las determinaciones solicitadas por el médico. La modalidad propuesta consistió en la conservación de las muestras a una temperatura de entre 2 y 8° C en gradillas selladas con film durante una semana, como una forma rápida, económica y ágil de almacenar las muestras durante la fase postanalítica. La estabilidad de esta forma de conservación se comparó con la estabilidad de las muestras conservadas en tubos cerrados con su propia tapa de plástico. El objetivo de garantizar la estabilidad de las muestras responde a la necesidad de eventuales confirmaciones de resultados o para poder efectuar determinaciones solicitadas en forma posterior a la toma de muestra o con el fin de subsanar errores de omisión o de ingreso de una prueba en lugar de la prueba solicitada al sistema informático del laboratorio.
Para evaluar si las muestras conservadas de ambas maneras permanecieron en condiciones aceptables a lo largo de la duración del estudio, se eligió como criterio de evaluación el RC del laboratorio para cada uno de los analitos estudiados. En la elección de este criterio se asumió que el sistema analítico se mantuvo estable ya que el CVA se obtuvo de un acumulado de 688 días y el sesgo% de la comparación con el grupo par a lo largo de 8 meses. De esta manera, el cambio observado día a día fue sistemático y se atribuyó al deterioro que sufrieron las muestras debido a la forma de conservación.
Los resultados obtenidos en este estudio demostraron que no todos los analitos pueden almacenarse en tubos sellados con film a lo largo de una semana ya que algunos de ellos y en particular los electrólitos transgredieron rápidamente el RC asignado por el laboratorio. De la misma manera, algunos de los analitos conservados en tubos cerrados con tapa tampoco verificaron el requisito de calidad a lo largo de una semana de almacenamiento.
La forma de conservación que evidenció la menor variabilidad a lo largo de todo el estudio fue la de los tubos cerrados con tapa plástica, cuyos CV % fueron menores a los CV % de las muestras conservadas con film para todos los analitos a excepción de las bilirrubinas directa y total (fig. 1). Este comportamiento puede justificarse en que los valores promedio de ambos metabolitos fueron descendiendo con el paso de los días, pero la magnitud del descenso fue menor en los tubos cerrados con film permitiendo pensar en un efecto de concentración de estas muestras opuesto al deterioro de estos analitos. Las pequeñas diferencias halladas en los casos de la enzima lactato deshidrogenasa y urea no fueron significativas.
Todas las enzimas ensayadas fueron estables al menos 4 días en ambas formas de conservación (datos no presentados). Las enzimas que no pudieron cumplir con el RC al cabo del día 4 fueron la fosfatasa alcalina conservada en film y lactato deshidrogenasa independientemente de la forma de conservación. El resto de las enzimas evaluadas fueron estables a lo largo de todo el desarrollo del trabajo en concordancia con lo reportado en bibliografía8,9. En particular, se observó un aumento moderado en la actividad de la enzima lactato deshidrogenasa al cabo del segundo día que pudo deberse al deterioro de las membranas de los eritrocitos y plaquetas contenidos en el paquete globular10 facilitando la liberación de la enzima hacia el suero.
En el caso de los iones incluidos en este estudio, el único ion que se mantuvo dentro del RC durante todo el desarrollo de este trabajo fue el hierro (tabla 2). El resto de los iones solo verificaron el RC durante el primer día. Este resultado fue diferente a las observaciones de otros trabajos9,11,12 donde se reportó que los iones cloruro, calcio, fósforo y magnesio presentaron una mayor estabilidad pero con modalidades de conservación diferentes. En el caso del fósforo, la figura 4 mostró el aumento de los valores promedio día por día. Otros autores asociaron el aumento de este ion como una consecuencia de la hidrólisis de los fosfatos orgánicos, que resulta en ion fosfato inorgánico liberado de los eritrocitos10,13.
Respecto de los metabolitos, la bilirrubina directa, bilirrubina total, colesterol asociado a lipoproteínas de alta densidad, colesterol total, proteína C reactiva de alta sensibilidad, creatinina, triglicéridos y urea fueron estables durante los siete días en que se desarrolló el estudio en ambas formas de conservación. Glucosa, proteínas totales y ácido úrico fueron estables al menos dos días mientras que la albúmina solo se mantuvo dentro de los límites del RC un día (datos no mostrados). Christensen14 ha estudiado el comportamiento de este analito y lo atribuye al método de medida empleado.
En general, se observó una mayor estabilidad en las muestras cerradas con tapa plástica evidenciada por la mayor cantidad de días que todos los analitos permanecieron sin transgredir los límites del RC arriba mencionados así como menores ET% al cabo de los siete días. Debe considerarse que el cierre del tubo primario con tapa es un sellado hermético mientras que la envoltura con film representa un cierre poroso que podría facilitar la concentración de las muestras por efecto de la evaporación.
Si bien el gel de los tubos con gel acelerador de la coagulación representa una separación física entre el paquete globular y el suero, esta barrera permite conservar las muestras de suero por tiempo limitado. Cada laboratorio utiliza tubos de distintas marcas comerciales, conserva sus muestras de diferentes formas y adopta requisitos de calidad propios15,16. Como consecuencia, nuestros resultados no son aplicables a todas las modalidades de trabajo por lo que se sugiere que cada laboratorio evalúe la estabilidad de los analitos en sus propias condiciones de conservación de muestras de pacientes.
Finalmente, los hallazgos de este estudio nos han proporcionado la información necesaria a partir de la cual hemos elaborado una guía con aquellos analitos que pueden medirse en días posteriores al día cero y aquellos analitos en los que es necesario proceder a la toma de una nueva muestra.
FinanciaciónInformamos que el presente trabajo se ha realizado con financiamiento propio del Laboratorio D’Agostino-Bruno, institución del ámbito privado de nuestra profesión.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.