La hemólisis, la turbidez y la presencia de concentraciones elevadas de bilirrubina son las fuentes de interferencia más frecuentes en el laboratorio clínico. Muchos analizadores incorporan sistemas de detección de estos interferentes denominados «índices séricos» de hemólisis, ictericia y lipidemia. El grado de veracidad de los índices no suele ser verificado por la dificultad en conseguir materiales de referencia adecuados. En este trabajo se presentan los resultados de un estudio interlaboratorios de los índices hemólisis, ictericia y lipidemia empleando materiales de referencia con concentraciones conocidas de los interferentes.
Material y métodosEn el estudio han participado los laboratorios clínicos de 10 centros con 7 analizadores distintos. Los materiales de referencia de índices séricos contenían concentraciones conocidas de bilirrubina, hemoglobina (hemolisado) y triglicéridos (Intralipid).
ResultadosTodos los instrumentos proporcionaron resultados aceptables para el índice de ictericia y de hemólisis. Entre los analizadores que dan valores cuantitativos se encontraron resultados bajos en uno de los analizadores para los materiales que contenían Intralipid. Los analizadores que expresan el resultado en forma de un intervalo proporcionaron resultados correctos para los materiales con turbidez menor y bajos para el material con turbidez mayor.
ConclusionesLos materiales de referencia utilizados han demostrado su utilidad para verificar los índices séricos de ictericia, hemólisis y lipidemia en los analizadores. Generalmente los índices proporcionados por los instrumentos concuerdan entre sí y con los valores asignados. Las diferencias más importantes entre analizadores se encuentran en el índice de lipidemia.
Hemolysis, turbidity and the presence of high concentrations of bilirubin are the most frequent sources of interference in the clinical laboratory. Many analyzers incorporate detection systems for these interferents called “serum indexes” of hemolysis, icterus and lipidemia. The accuracy of such indexes is usually not verified by the difficulty in obtaining appropriate reference materials. In this work we show the results of an interlaboratory study of hemolysis, icterus and lipidemia indexes using reference materials containing known concentrations of these interfering substances.
Material and methodsTen clinical laboratories from different centres have participated in the study using 7 different analyzers. The reference materials for the serum indexes contained known concentrations of bilirubin, hemoglobin (hemolysate) and triglycerides (Intralipid).
ResultsAll instruments provided acceptable results for the icterus and hemolysis index. Among the analyzers providing quantitative values, low results were found in one of the analyzers for materials containing Intralipid. The analyzers expressing the result as an interval provided correct results for materials with low turbidity but a low result for the material with the highest turbidity.
ConclusionsThe reference materials used have proved to be useful to verify the serum indexes for hemolysis, icterus and lipidemia in analyzers. The results obtained in different instruments generally agree among them and with the assigned values. The most important differences between analyzers were found in the lipidemia index.
Las principales causas de error sistemático en los resultados del laboratorio clínico son los defectos en la calibración y la presencia de interferentes en la muestra. Los defectos en la calibración pueden ser detectados mediante los procedimientos de control interno y externo y corregidos mediante intervenciones adecuadas sobre los calibradores o el proceso de calibración. Más complicado resulta evitar los errores debidos a interferentes en la muestra ya que, generalmente, se desconoce su presencia.
El error en un resultado causado por una interferencia puede conducir a establecer un diagnóstico equivocado, realizar análisis o exploraciones adicionales inapropiadas y aplicar tratamientos innecesarios o potencialmente desfavorables para el paciente. Por estos motivos, reviste una gran importancia la detección de interferencias en las muestras analizadas.
La hemólisis, la turbidez y la presencia de concentraciones elevadas de bilirrubina en muestras biológicas son las fuentes de interferencia más frecuentes en el laboratorio clínico1–4.
La hemólisis es la rotura de los eritrocitos con la consiguiente liberación en el plasma del contenido intracelular. Ocasiona una coloración rojiza en las muestras de suero o plasma y es la causa de entre el 18 y el 30% de los rechazos de muestras de laboratorio según datos de programas externos de calidad preanalítica5,6. La hemólisis puede causar interferencias por diversos motivos7–10: su elevada absorbancia entre 400 y 600nm, interferir en diversas reacciones químicas, liberación de componentes intracelulares del eritrocito al plasma y dilución de los analitos del plasma por liberación de líquido intracelular.
Las concentraciones elevadas de bilirrubina en la muestra pueden producir interferencias por su elevada absorbancia entre 340 y 500nm y también por la reactividad de la bilirrubina con el peróxido de hidrógeno o con otros intermediarios de las reacciones bioquímicas11–13.
La turbidez puede ser debida a la presencia de restos de células sanguíneas, coágulos de fibrina, partículas contaminantes, aglutininas, inmunoglobulinas monoclonales, algunos componentes presentes en nutrientes parenterales y, sobre todo, a las lipoproteínas ricas en triglicéridos: VLDL y quilomicrones. La turbidez puede originar interferencia principalmente porque absorbe y dispersa la luz en un amplio rango de longitudes de onda14.
Hasta hace unos años, era una práctica habitual la inspección visual de las muestras para la detección de dichos interferentes por su color o turbidez. Sin embargo se ha demostrado que este procedimiento visual es subjetivo, arbitrario, laborioso y no es suficientemente sensible15. En la actualidad, muchos analizadores incorporan sistemas de detección de estos interferentes, denominados índices séricos de hemólisis, ictericia y lipidemia (HIL). La detección está basada en las características espectrales de la hemoglobina, la bilirrubina y la turbidez. Estos sistemas aportan objetividad y rapidez en la detección16.
Los índices HIL son una estimación del grado de hemólisis, ictericia y turbidez de las muestras, y se correlacionan, respectivamente, con la concentración de hemoglobina, de bilirrubina y con el grado de dispersión de la luz, en la muestra. La utilidad de los índices es alertar al laboratorio de la presencia de estos interferentes en las muestras. Adicionalmente el fabricante indica para cada analito la mínima concentración de interferente (índice de alerta) a partir de la cual la concentración de analito resulta falsamente elevada o disminuida.
La estimación de los índices se realiza de forma automática en el analizador para cada muestra de suero o plasma a partir de una serie de cálculos realizados con los valores de absorbancia obtenidos para la muestra a unas longitudes de onda determinadas. Las fórmulas de cálculo incluyen correcciones para compensar el solapamiento espectral cuando hay más de un factor HIL presente9,16.
Para establecer los índices, los fabricantes de analizadores utilizan un hemolizado (H), bilirrubina no esterificada y/o ditaurobilirrubina (I) e Intralipid® (L). Intralipid® es una suspensión acuosa de aceite vegetal (utilizada en nutrición parenteral) que resulta apropiada para estudiar las interferencias ocasionadas por la turbidez16.
Es importante destacar que aunque los índices son una estimación de las concentraciones de hemoglobina, bilirrubina o triglicéridos, el resultado obtenido en una muestra puede verse alterado por otras sustancias de similares características espectrales como son algunos nutrientes parenterales, carotenos, fármacos, medios de contraste, etc.16.
Según el fabricante, los índices pueden expresarse en unidades de concentración (por ejemplo mg/dL) o mediante una escala ordinal sin unidades (por ejemplo: 1, 2, 3, …). Cada valor de la escala ordinal se corresponde con un determinado intervalo de concentraciones.
El grado de veracidad de los índices HIL proporcionados por los analizadores no suele ser verificado como parte del control interno en los laboratorios clínicos, entre otras razones, por la dificultad en conseguir materiales de control adecuados. No obstante, teniendo en cuenta su importancia en la detección de interferencias en muestras de pacientes, es deseable su verificación periódica o en determinadas circunstancias.
En este trabajo se presentan los resultados de una evaluación multicéntrica de los índices HIL obtenidos en diferentes analizadores y empleando unos materiales de control liofilizados con valores conocidos de los interferentes.
Material y métodosLaboratorios y analizadores participantesEn el estudio han participado 10 laboratorios clínicos: 1) Hospital Germans Trias i Pujol, Badalona; 2) Hospital Universitari Joan XXIII, Tarragona; 3) Hospital Universitari Doctor Josep Trueta, Girona; 4) Laboratori Clínic Bon Pastor, Barcelona; 5) Hospital Universitari Arnau de Vilanova, Lleida; 6) Consorci de Laboratori Intercomarcal, Vilafranca del Penedés; 7) Hospital Vall d’Hebron, Barcelona; 8) Laboratori Clínic L’Hospitalet, L’Hospitalet de Llobregat; 9) Hospital de la Santa Creu i Sant Pau, Barcelona y 10) Hospital Verge de la Cinta, Tortosa. Algunos de estos centros han participado en el estudio con dos analizadores distintos.
El estudio se ha realizado en 7 analizadores de 4 fabricantes: ADVIA 2400, ADVIA 1800 y VISTA (Siemens), Architect ci16200 (Abbott), Cobas 711 y 6000 (Roche) y AU 5800 (Beckman).
Materiales de control de índices séricosLos materiales de control liofilizados de índices séricos fueron proporcionados por BioSystems, S.A con concentraciones conocidas de bilirrubina (no esterificada), hemoglobina (de hemolizado) y triglicéridos (de Intralipid).
Se prepararon 6 materiales distintos que contenían las siguientes concentraciones de: bilirrubina 5 (A) y 10mg/dL (B), hemoglobina 0,23 (C) y 4,50g/L (D), triglicéridos 325 (E) y 650mg/dL (F).
Otros 2 materiales contenían una mezcla de interferentes para poder evaluar la posible influencia de uno sobre el otro: bilirrubina 5mg/dL y hemoglobina 0,23g/L (G) y bilirrubina 10mg/dL y triglicéridos 325mg/dL (H).
A cada laboratorio se enviaron 2 viales de cada uno de los 8 materiales.
Procedimiento analíticoCada vial de material control se reconstituyó con 1,0mL de agua destilada y se procesó en el analizador como si fuera una muestra más. Cada vial se analizó una única vez.
Se anotaron los resultados de índices séricos HIL que proporcionó el analizador.
Resultados y discusiónLos resultados obtenidos en cada centro y para cada analizador para los índices se muestran en las tablas 1–3. El dato mostrado es la media de los resultados obtenidos para los 2 viales de cada material. En algún caso el analizador informó de una alarma de «absorbancia anómala» para uno de los dos viales y se muestran entonces ambos resultados.
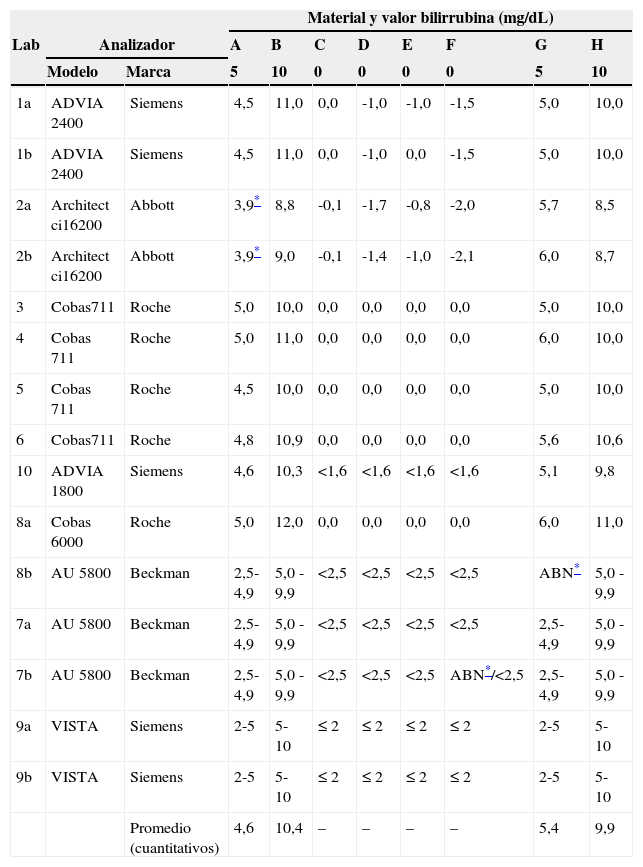
Índice de ictericia. Se muestran los resultados de índice de ictericia obtenidos en los distintos analizadores para los materiales de la A a la H
| Material y valor bilirrubina (mg/dL) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Lab | Analizador | A | B | C | D | E | F | G | H | |
| Modelo | Marca | 5 | 10 | 0 | 0 | 0 | 0 | 5 | 10 | |
| 1a | ADVIA 2400 | Siemens | 4,5 | 11,0 | 0,0 | -1,0 | -1,0 | -1,5 | 5,0 | 10,0 |
| 1b | ADVIA 2400 | Siemens | 4,5 | 11,0 | 0,0 | -1,0 | 0,0 | -1,5 | 5,0 | 10,0 |
| 2a | Architect ci16200 | Abbott | 3,9* | 8,8 | -0,1 | -1,7 | -0,8 | -2,0 | 5,7 | 8,5 |
| 2b | Architect ci16200 | Abbott | 3,9* | 9,0 | -0,1 | -1,4 | -1,0 | -2,1 | 6,0 | 8,7 |
| 3 | Cobas711 | Roche | 5,0 | 10,0 | 0,0 | 0,0 | 0,0 | 0,0 | 5,0 | 10,0 |
| 4 | Cobas 711 | Roche | 5,0 | 11,0 | 0,0 | 0,0 | 0,0 | 0,0 | 6,0 | 10,0 |
| 5 | Cobas 711 | Roche | 4,5 | 10,0 | 0,0 | 0,0 | 0,0 | 0,0 | 5,0 | 10,0 |
| 6 | Cobas711 | Roche | 4,8 | 10,9 | 0,0 | 0,0 | 0,0 | 0,0 | 5,6 | 10,6 |
| 10 | ADVIA 1800 | Siemens | 4,6 | 10,3 | <1,6 | <1,6 | <1,6 | <1,6 | 5,1 | 9,8 |
| 8a | Cobas 6000 | Roche | 5,0 | 12,0 | 0,0 | 0,0 | 0,0 | 0,0 | 6,0 | 11,0 |
| 8b | AU 5800 | Beckman | 2,5-4,9 | 5,0 - 9,9 | <2,5 | <2,5 | <2,5 | <2,5 | ABN* | 5,0 - 9,9 |
| 7a | AU 5800 | Beckman | 2,5-4,9 | 5,0 - 9,9 | <2,5 | <2,5 | <2,5 | <2,5 | 2,5-4,9 | 5,0 - 9,9 |
| 7b | AU 5800 | Beckman | 2,5-4,9 | 5,0 - 9,9 | <2,5 | <2,5 | <2,5 | ABN*/<2,5 | 2,5-4,9 | 5,0 - 9,9 |
| 9a | VISTA | Siemens | 2-5 | 5-10 | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 | 2-5 | 5-10 |
| 9b | VISTA | Siemens | 2-5 | 5-10 | ≤ 2 | ≤ 2 | ≤ 2 | ≤ 2 | 2-5 | 5-10 |
| Promedio (cuantitativos) | 4,6 | 10,4 | – | – | – | – | 5,4 | 9,9 | ||
En la última fila se muestra el promedio de los resultados cuantitativos. Los laboratorios participantes (Lab) se identifican en materiales y métodos. Algún laboratorio participó con 2 analizadores distintos (indicados como a y b).
ABN: absorbancia anómala.
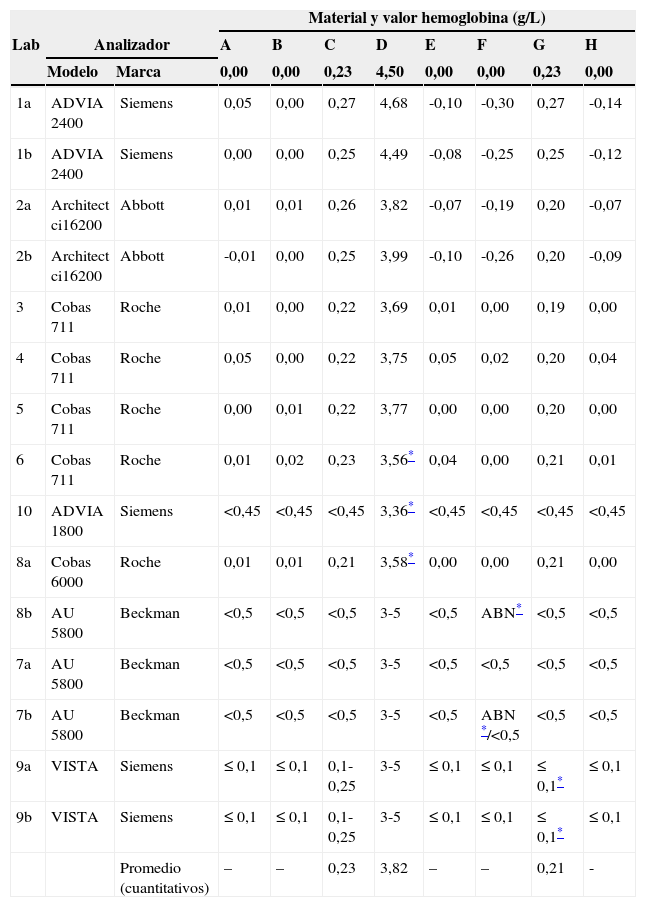
Índice de hemólisis. Se muestran los resultados de índice de hemólisis obtenidos en los distintos analizadores para los materiales de la A a la H
| Material y valor hemoglobina (g/L) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Lab | Analizador | A | B | C | D | E | F | G | H | |
| Modelo | Marca | 0,00 | 0,00 | 0,23 | 4,50 | 0,00 | 0,00 | 0,23 | 0,00 | |
| 1a | ADVIA 2400 | Siemens | 0,05 | 0,00 | 0,27 | 4,68 | -0,10 | -0,30 | 0,27 | -0,14 |
| 1b | ADVIA 2400 | Siemens | 0,00 | 0,00 | 0,25 | 4,49 | -0,08 | -0,25 | 0,25 | -0,12 |
| 2a | Architect ci16200 | Abbott | 0,01 | 0,01 | 0,26 | 3,82 | -0,07 | -0,19 | 0,20 | -0,07 |
| 2b | Architect ci16200 | Abbott | -0,01 | 0,00 | 0,25 | 3,99 | -0,10 | -0,26 | 0,20 | -0,09 |
| 3 | Cobas 711 | Roche | 0,01 | 0,00 | 0,22 | 3,69 | 0,01 | 0,00 | 0,19 | 0,00 |
| 4 | Cobas 711 | Roche | 0,05 | 0,00 | 0,22 | 3,75 | 0,05 | 0,02 | 0,20 | 0,04 |
| 5 | Cobas 711 | Roche | 0,00 | 0,01 | 0,22 | 3,77 | 0,00 | 0,00 | 0,20 | 0,00 |
| 6 | Cobas 711 | Roche | 0,01 | 0,02 | 0,23 | 3,56* | 0,04 | 0,00 | 0,21 | 0,01 |
| 10 | ADVIA 1800 | Siemens | <0,45 | <0,45 | <0,45 | 3,36* | <0,45 | <0,45 | <0,45 | <0,45 |
| 8a | Cobas 6000 | Roche | 0,01 | 0,01 | 0,21 | 3,58* | 0,00 | 0,00 | 0,21 | 0,00 |
| 8b | AU 5800 | Beckman | <0,5 | <0,5 | <0,5 | 3-5 | <0,5 | ABN* | <0,5 | <0,5 |
| 7a | AU 5800 | Beckman | <0,5 | <0,5 | <0,5 | 3-5 | <0,5 | <0,5 | <0,5 | <0,5 |
| 7b | AU 5800 | Beckman | <0,5 | <0,5 | <0,5 | 3-5 | <0,5 | ABN */<0,5 | <0,5 | <0,5 |
| 9a | VISTA | Siemens | ≤ 0,1 | ≤ 0,1 | 0,1-0,25 | 3-5 | ≤ 0,1 | ≤ 0,1 | ≤ 0,1* | ≤ 0,1 |
| 9b | VISTA | Siemens | ≤ 0,1 | ≤ 0,1 | 0,1-0,25 | 3-5 | ≤ 0,1 | ≤ 0,1 | ≤ 0,1* | ≤ 0,1 |
| Promedio (cuantitativos) | – | – | 0,23 | 3,82 | – | – | 0,21 | - | ||
En la última fila se muestra el promedio de los resultados cuantitativos. Los laboratorios participantes (Lab) se identifican en materiales y métodos. Algún laboratorio participó con 2 analizadores distintos (indicados como a y b).
ABN: absorbancia anómala.
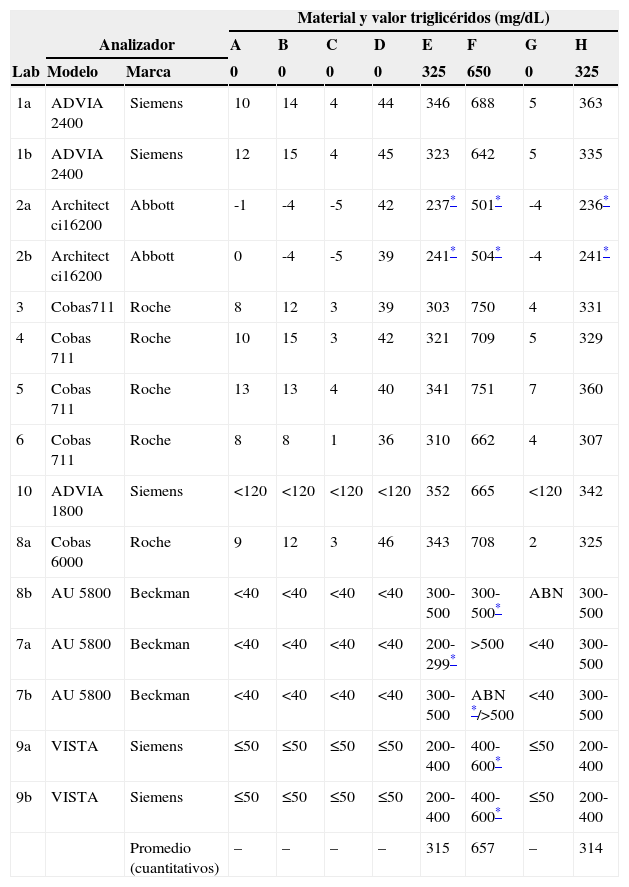
Índice de lipidemia. Se muestran los resultados de índice de lipidemia obtenidos en los distintos analizadores para los materiales de la A a la H
| Material y valor triglicéridos (mg/dL) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Analizador | A | B | C | D | E | F | G | H | ||
| Lab | Modelo | Marca | 0 | 0 | 0 | 0 | 325 | 650 | 0 | 325 |
| 1a | ADVIA 2400 | Siemens | 10 | 14 | 4 | 44 | 346 | 688 | 5 | 363 |
| 1b | ADVIA 2400 | Siemens | 12 | 15 | 4 | 45 | 323 | 642 | 5 | 335 |
| 2a | Architect ci16200 | Abbott | -1 | -4 | -5 | 42 | 237* | 501* | -4 | 236* |
| 2b | Architect ci16200 | Abbott | 0 | -4 | -5 | 39 | 241* | 504* | -4 | 241* |
| 3 | Cobas711 | Roche | 8 | 12 | 3 | 39 | 303 | 750 | 4 | 331 |
| 4 | Cobas 711 | Roche | 10 | 15 | 3 | 42 | 321 | 709 | 5 | 329 |
| 5 | Cobas 711 | Roche | 13 | 13 | 4 | 40 | 341 | 751 | 7 | 360 |
| 6 | Cobas 711 | Roche | 8 | 8 | 1 | 36 | 310 | 662 | 4 | 307 |
| 10 | ADVIA 1800 | Siemens | <120 | <120 | <120 | <120 | 352 | 665 | <120 | 342 |
| 8a | Cobas 6000 | Roche | 9 | 12 | 3 | 46 | 343 | 708 | 2 | 325 |
| 8b | AU 5800 | Beckman | <40 | <40 | <40 | <40 | 300-500 | 300-500* | ABN | 300-500 |
| 7a | AU 5800 | Beckman | <40 | <40 | <40 | <40 | 200-299* | >500 | <40 | 300-500 |
| 7b | AU 5800 | Beckman | <40 | <40 | <40 | <40 | 300-500 | ABN */>500 | <40 | 300-500 |
| 9a | VISTA | Siemens | ≤50 | ≤50 | ≤50 | ≤50 | 200-400 | 400-600* | ≤50 | 200-400 |
| 9b | VISTA | Siemens | ≤50 | ≤50 | ≤50 | ≤50 | 200-400 | 400-600* | ≤50 | 200-400 |
| Promedio (cuantitativos) | – | – | – | – | 315 | 657 | – | 314 | ||
En la última fila se muestra el promedio de los resultados cuantitativos. Los laboratorios participantes (Lab) se identifican en materiales y métodos. Algún laboratorio participó con 2 analizadores distintos (indicados como a y b).
ABN: absorbancia anómala.
Se consideraron aceptables (de forma arbitraria) los resultados cuantitativos de índice que diferían menos de un 20% del valor asignado al material. En el caso de los índices semicuantitativos se consideraron aceptables los resultados de intervalos que incluían el valor asignado.
Los materiales que contenían bilirrubina fueron los A y G (5mg/dL) y los B y H (10mg/dL). Todos los instrumentos estudiados proporcionaron resultados para el índice de ictericia aceptables o muy cercanos a los valores aceptables (tabla 1). Entre los analizadores con valores cuantitativos destacan resultados más bajos en el Architect, quedando fuera de tolerancia para el material A, pero aceptables para los materiales B, G y H. El promedio de los valores cuantitativos de los distintos instrumentos fue muy cercano al valor asignado al material. Los analizadores que expresan el resultado en forma de un intervalo de concentraciones proporcionaron resultados en general correctos con la única excepción de uno de los AU 5800 que informó de absorbancia anormal. La presencia de turbidez elevada en el material H ocasionó una ligera disminución del índice de ictericia dependiendo del instrumento (como máximo un 9% en ADVIA 2400). La presencia de hemólisis en el material G hacía aumentar ligeramente el índice de ictericia respecto al material A en los analizadores ADVIA y Cobas y de forma mas importante (un 53%) en el Architect ci16200.
Los materiales que contenían hemolizado (tabla 2) fueron los C y G (0,23g/L) y el D (4,5g/L). La mayor parte de los analizadores con valores cuantitativos proporcionaron resultados correctos o muy cercanos a los límites aceptables del 20%. El promedio de los valores cuantitativos de los distintos instrumentos fue muy cercano al valor asignado al material. Destaca el ADVIA 1800 cuyo límite inferior para este índice es demasiado alto (< 0,45g/L) lo que ocasionó que el resultado para los materiales C y G que contenían hemolizado 0,23g/L fuese el mismo que para los materiales que no contenían hemolizado. La misma situación se apreció para el AU 5800: su índice menor (< 0,5g/L) es demasiado elevado por lo que no detecta hemólisis bajas. Por otra parte, el instrumento VISTA detectó el ligero grado de hemólisis en el material C, pero no el G, que contenía también una elevada concentración de bilirrubina. La presencia de bilirrubina en la muestra G ocasionó un índice hemolítico algo más bajo en Architect ci16200. No se observó variación en el índice hemolítico de 0 en el material con bilirrubina y triglicéridos (vial H).
El efecto de la turbidez se estudió con materiales que contenían Intralipid a las concentraciones de 325mg/dL (E y H) y 650mg/dL (F) y los resultados se muestran en la tabla 3. Entre los analizadores con valores cuantitativos se encontraron resultados bajos en el Architect para los tres materiales y en algún caso para el AU 5800. El promedio de los valores cuantitativos de los distintos instrumentos fue muy cercano al valor asignado al material. Los analizadores que expresan el resultado en forma de un intervalo de concentraciones proporcionaron resultados en general correctos para los materiales con turbidez menor (E y H) y en cambio bajos para el material con turbidez mayor (F). La presencia de bilirrubina elevada en el material H no tuvo influencia sobre el índice de lipidemia en la mayor parte de los instrumentos.
ConclusionesLos materiales de control preparados con concentraciones conocidas de bilirrubina, hemoglobina y triglicéridos pueden ser útiles para verificar los índices séricos de ictericia, hemólisis y lipidemia en la mayoría de los analizadores automáticos estudiados. Para poder utilizarlos en el Architect ci 16200 se debería hacer un ensayo específico con estos analizadores en el que participen más laboratorios para intentar conocer la causa de los problemas encontrados en dos de estos índices (lipidemia e ictericia).
Es posible preparar materiales simples, con uno solo de los interferentes, o con una combinación de varios de ellos. Las materiales simples podrían ser más adecuados para un control interno de los índices, mientras que los materiales con combinaciones de interferentes podrían emplearse en programas de control externo.
Algunos analizadores no son capaces de detectar hemólisis inferiores a 0,5g/L de hemoglobina. Es este un defecto importante ya que dicho grado de hemólisis es capaz de generar interferencias significativas en la medición de diversas magnitudes biológicas17.
Las diferencias más importantes entre analizadores se encontraron en el índice de lipidemia, especialmente a concentraciones elevadas de triglicéridos.
Conflicto de interesesF. Javier Gella es Director del Área de Reactivos de Biosystems, S.A.
Maribel Sánchez es Investigadora del Área de Reactivos de Biosystems, S.A.
El resto de autores declaran no tener ningún conflicto de intereses.