El tratamiento con metotrexato (MTX) a dosis elevadas implica una monitorización estrecha de los niveles del fármaco para confirmar su correcta eliminación. Uno de los posibles efectos secundarios es el fracaso renal, lo que ocasiona una acumulación de fármaco y un mayor efecto tóxico. La glucarpidasa (carboxipeptidasa-G2 o CPDG2) es una enzima recombinante que se utiliza para disminuir los niveles de MTX en pacientes que desarrollan fallo renal durante el tratamiento con altas dosis de MTX. La enzima reduce la concentración de MTX en un 95-99% de 15 a 30min después de la dosis. La glucarpidasa escinde el MTX en glutamato y ácido 2,4-diamino-N10-metilpteroico un metabolito menor e inactivo. Es conocida la reactividad cruzada del ácido 2,4-diamino-N10-metilpteroico en la medición de MTX mediante ensayos inmunológicos, que da lugar a una enorme sobreestimación de MTX. Sin embargo, los ensayos inmunológicos son la técnica mayoritariamente empleada en los laboratorios clínicos para la medición de MTX.
Se presenta un caso de interferencia explicando la detección de MTX en las muestras de suero mediante cromatografía líquida acoplada a espectrometría de masas (LC-UHR-QTOF).
High-dose methotrexate (MTX) treatment involves close monitoring of drug level in order to confirm its proper elimination. One of the possible side effects of this therapy is renal failure, causing accumulation of the drug, and therefore is a mayor toxic effect. Glucarpidase (carboxypeptidase-G2 or CPDG2) is a recombinant enzyme used to reduce MTX serum levels in patients who develop acute renal failure during high-dose MTX treatment. The enzyme reduces MTX concentration by 95-99% within 15-30minutes after the dose. Glucarpidase cleaves MTX into glutamate and 2,4-diamino-N10-methylpteroic acid, a minor and non-active metabolite. Cross-reactivity of 2,4-diamino-N10-methylpteroic acid in immunological assays of MTX has been previously reported, and is said to cause an enormous overestimation in serum MTX analysis. However immunoassay is a widely used technique for MTX analysis, being the main method for its determination in most clinical laboratories.
An interference case report is presented and MTX analysis in serum samples by liquid chromatography coupled with Ultra-High Resolution Q-Time of Flight Mass Spectrometry (LC-UHR-QTOF) is described.
La paciente era una mujer de 47 años, diagnosticada de leucemia linfoblástica aguda que acude al hospital para la administración intravenosa de metotrexato (MTX) a dosis elevadas (3g m–2 durante 24h) de acuerdo al protocolo de tratamiento del grupo PETHEMA para leucemia linfoblástica aguda tipo B1. Las dosis previas del fármaco fueron bien toleradas, sin embargo durante esta intervención la paciente desarrolló un fracaso renal agudo (creatinina: 291,73μmol L–1 y filtrado glomerular MDRD-4-IDMS: 15mL/min/1,73m2) como una complicación descrita en la bibliografía del tratamiento con MTX a dosis elevadas a pesar de las medidas preventivas y, como consecuencia, el aclaramiento de MTX disminuyó alcanzado una concentración tóxica de 57,47μmol dL–1 a las 36h después de la infusión2,3.
El tratamiento con glucarpidasa (carboxipeptidasa-G2 o CPDG2) está indicado en el contexto del fracaso renal inducido por MTX a dosis elevadas siempre que la concentración de MTX sea superior a 10μmol L–1 entre las 42 y 48h después de finalizar la infusión de MTX y/o si la creatinina sérica es superior a 132,6μmol L–1. La paciente cumplía ambos criterios. El esquema de administración fue de 50 unidades kg–1 de CPDG2 en forma de inyección intravenosa durante 5min4 y se midió la concentración de MTX de forma seriada a los 15, 30 y 60min postratamiento mediante la técnica de enzimoinmunoanálisis. A los 15min se observó un descenso del 57,4%, muy lejos de lo esperado y este hecho fue atribuido a la interferencia por ácido 2,4-diamino-N10-metilpteroico (DAMPA) en la cuantificación de MTX mediante inmunoanálisis, de acuerdo con lo descrito en la bibliografía4,5
Los principales obstáculos que suponen el uso de glucarpidasa son: la interferencia por el DAMPA, que inhabilita los métodos inmunológicos para la monitorización de MTX en los laboratorios clínicos y la falta de actividad intracelular de la enzima, que ocasiona gran efecto rebote debido a la acumulación tisular de MTX6.
En el caso descrito, la decisión clínica fue someter a la paciente a sesiones de depuración extracorpórea para eliminar el MTX residual e intentar recuperar la función renal. La técnica elegida fue hemodiafiltración online porque mostraba los mejores resultados según la bibliografía7,8. Las condiciones seleccionadas fueron: modo de infusión posdilución/predilución (volumen: 130L), dializador Poliflux 210, acceso vascular Shaldom femoral, flujo de sangre 400mL min–1 anticoagulación con heparina y tiempo total de sesión de 6h. Se realizaron un total de 9 sesiones hasta que la concentración de MTX era indetectable. Se extrajeron muestras cada hora durante las sesiones de hemodiálisis, que fueron analizadas para MTX mediante el método inmunológico del laboratorio y congeladas durante una semana hasta que se dispuso de un método cromatográfico alternativo. En el laboratorio se dispone de un enzimoinmunoanálisis EMIT® adaptado en canal abierto en un analizador Dimension® EXL (Siemens Healthcare Diagnostics, S.A.), con un límite de detección de 0,10μmol L–1 y límite de cuantificación de 0,20μmol L–1. Los calibradores están incluidos en el kit y tienen concentraciones de 0 a 2μmol L–1. Como control interno de calidad se empleó el nivel 1 de Lyphochek® Therapeutic Drug Monitoring (Bio-Rad Laboratories S.A. Alcobendas, Madrid) que presenta un CV del 9,94%.
Las muestras conservadas se descongelaron a temperatura ambiente y fueron desproteinizadas por adición de metanol 1:10 (Metanol ACS, 99,8%. Merck KGaA, Darmstadt, Alemania), homogeneizadas y centrifugadas durante 2min a 13.400g. Los sobrenadantes fueron analizados por cromatografía líquida acoplada a espectrometría de masas con detector de tiempo de vuelo (LC-UHR-QTOF) suministrado por Bruker Daltonics (Bremen, Alemania)9. Para calcular la concentración límite del método, se inyectaron distintas concentraciones de calibrador: 0/0,2/ 0,5 y 1μmol L–1. La ratio señal/ruido para el nivel más bajo de concentración fue de 480 para el ión mono isotópico ([M+H]+) y 94 para el producto ión. La curva de calibración presentó un coeficiente de correlación, r, de 0,9993 y una desviación estándar de los factores de respuesta del 3,43%.
Los controles internos se prepararon de la misma forma descrita para las muestras y fueron interpolados en la curva de calibración preparada a partir de los calibradores. Las concentraciones de MTX encontradas fueron 0,388/1,53 y 9,37μmol L–1 y las recuperaciones calculadas de 108,7/88,9 y 78,2%, respectivamente, de forma que no se detectó efecto matriz.
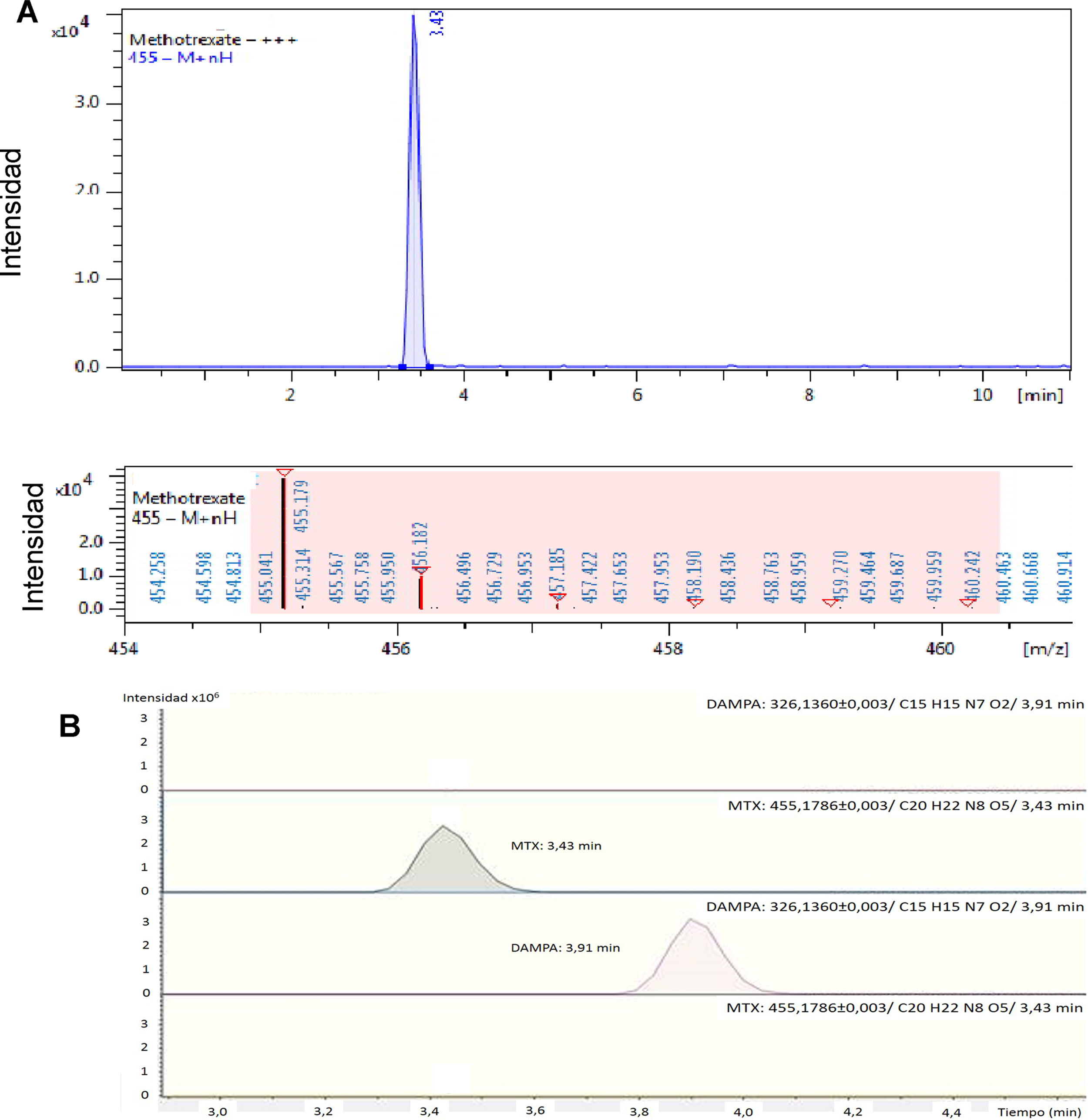
El tiempo de retención (TR) del MTX fue de 3,43min. Otros metabolitos identificados fueron 7-OH MTX (TR: 4,19min), DAMPA (TR: 3,91min) y su metabolito hidroxilado, OH-DAMPA (TR: 4,94min).
Los iones moleculares (m/z+) que permitieron la identificación inequívoca de los analitos fueron 455,2 y 308,1 para MTX, 326,1/176,1 (DAMPA), 471,2/134,1 (7-OH-MTX) y 324,1/148,1 (OH-DAMPA). Ver figura 1.
Cromatogramas obtenidos de las muestras de la paciente. (A) Preglucarpidasa: solo se encuentra MTX con tiempo de retención 3,43min y MTX m/z+ ion 455,179. (B) De arriba a abajo, ausencia de DAMPA previo a glucarpidasa, MTX preglucarpidasa, DAMPA posglucarpidasa y MTX posglucarpidasa.
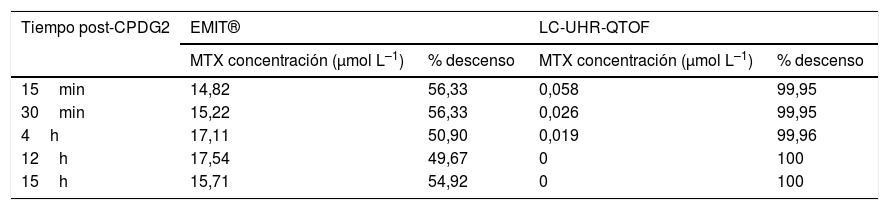
Se observa una gran discrepancia entre ambos métodos como consecuencia de la reactividad cruzada del DAMPA en el enzimoinmunoanálisis. Tras la administración de la enzima, la concentración de MTX descendió más del 99%, de acuerdo a lo descrito en la bibliografía, llegando a ser indetectable a las 12 horas (tabla 1)
Concentración y % descenso de MTX después de la administración de glucarpidasa obtenido mediante el método inmunológico EMIT® y el método de referencia, LC-UHR-QTOF
| Tiempo post-CPDG2 | EMIT® | LC-UHR-QTOF | ||
|---|---|---|---|---|
| MTX concentración (μmol L–1) | % descenso | MTX concentración (μmol L–1) | % descenso | |
| 15min | 14,82 | 56,33 | 0,058 | 99,95 |
| 30min | 15,22 | 56,33 | 0,026 | 99,95 |
| 4h | 17,11 | 50,90 | 0,019 | 99,96 |
| 12h | 17,54 | 49,67 | 0 | 100 |
| 15h | 15,71 | 54,92 | 0 | 100 |
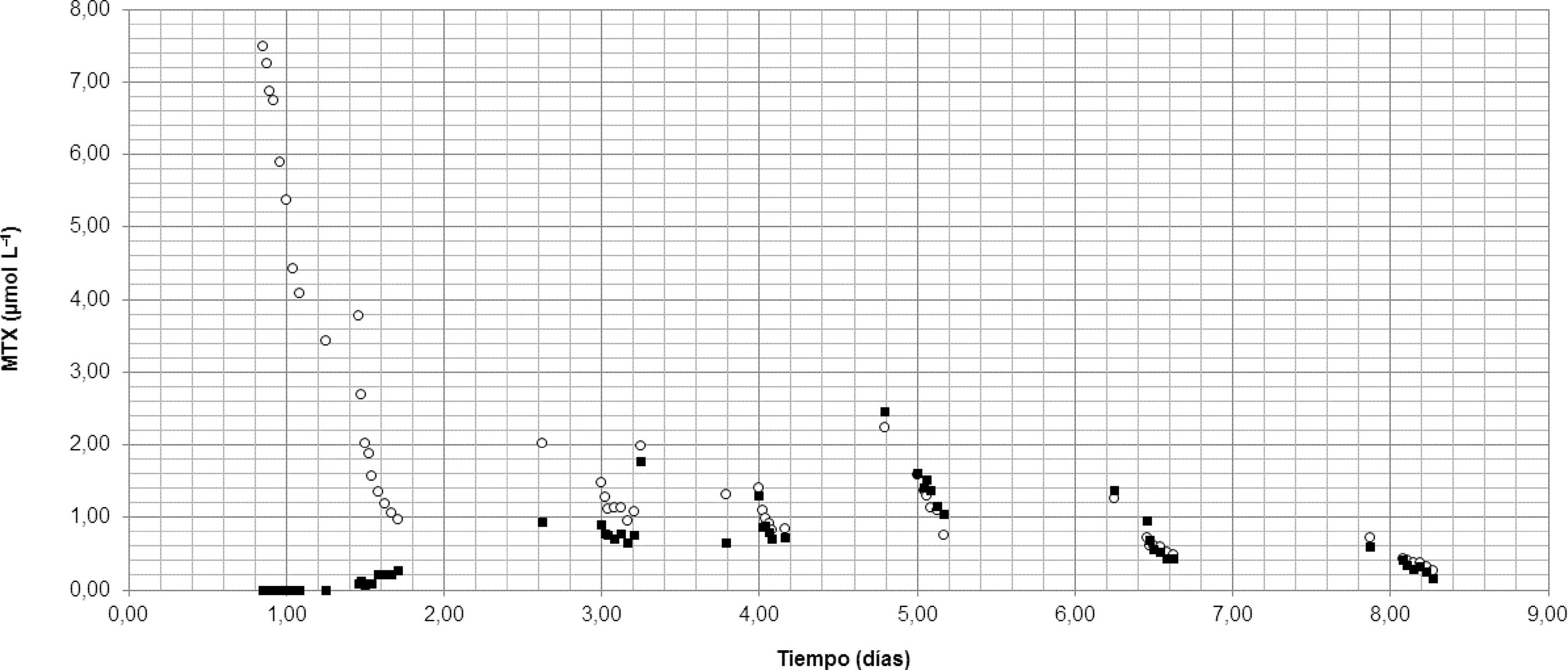
En la figura 2 se observa que a las 24h posglucarpidasa empieza a detectarse MTX que sigue aumentando hasta alcanzar un máximo de 2,44μmol L–1 el día 5 posglucarpidasa. Este incremento observado, a pesar de las medidas de soporte (hemodiafiltración, ácido folínico, resincolestiramina y alcalinización urinaria) fue atribuido al fin de la actividad enzimática, dada su vida media de 24-48h, además de la salida del MTX de las células, reflejo de la importante acumulación tisular. La obtención de muestras seriadas durante las sesiones de hemodialfiltración sirvió para ver cómo se comporta el MTX intracelular tras la administración de glucarpidasa.
Otro hecho a destacar es que la ficha técnica de la glucarpidasa indica que a las 48h tras su administración se podrían emplear inmunoanálisiss para determinar la concentración de MTX, sin embargo, en nuestro caso seguíamos observando una sobreestimación con nuestro método utilizado. La regresión lineal de los puntos obtenidos desde las 48 hasta las 54h después de la glucarpidasa muestran escasa concordancia, con una pendiente de −5,683 (IC 95%: −10,821 a −0,544) y ordenada en el origen de 2,473 (IC 95%: 1,593 a 3,353). Probablemente la diferencia radica en que la paciente estudiada presentaba una elevada acumulación intracelular.
Para finalizar, concluimos que la glucarpidasa ha sido una herramienta adecuada en el caso descrito10–12, aunque la experiencia al respecto en la práctica clínica es escasa y no existen procedimientos estandarizados de actuación. A este problema se añade la invalidez de los inmunoanálisiss, métodos empleados habitualmente en los laboratorios clínicos, por la interferencia del DAMPA6,13.
En este caso la efectividad inicial de la glucarpidasa fue la esperada, pero dudamos si el manejo del efecto rebote del MTX fue adecuado. Si se hubiese dispuesto de los niveles reales de MTX la paciente no habría sido sometida a tantas sesiones de hemodiafiltración, técnica invasiva no exenta de complicaciones.
Por todo lo expuesto anteriormente, recomendamos a los laboratorios clínicos tener disponible, o con fácil acceso, un método cromatográfico para la medición de MTX tras la administración de glucarpidasa.