Este documento describe recomendaciones para la estandarización de la medida de las magnitudes lipídicas, puesto que resultan críticas para la toma de decisiones clínicas. Deben emplearse métodos recomendados validados frente a un método de referencia o definitivo, y materiales de control que cumplan con la Directiva Europea sobre Diagnóstico in vitro; deben cumplir también los objetivos recomendados por el National Cholesterol Education Program (NCEP) y la Sociedad Española de Medicina del Laboratorio (SEQCML). La determinación de colesterol de HDL por métodos homogéneos en equipos automatizados se considera aceptable para la práctica rutinaria, y la fórmula de Friedewald utilizable para estimar la concentración de colesterol de LDL siempre que las concentraciones de triglicéridos sean iguales o inferiores a 200mg/dL (2,3mmol/L); en otro caso, se recomienda utilizar la concentración de colesterol-no-HDL. La cuantificación rutinaria de apolipoproteínas A1 y B, y lipoproteína (a), puede efectuarse por métodos de inmunonefelometría e inmunoturbidimetría, con calibradores trazables a materiales de referencia.
Some recommendations are presented for standardising the measurement of lipids and lipoproteins, as they are critical for clinical decisions making. Recommended methods validated against a reference or definitive method should be employed, as well as the use of control materials that comply with European Directives on in vitro diagnostics. Additionally, the chosen methods must comply with the objectives set forth by the National Cholesterol Education Program (NCEP) and by the Spanish Society of Laboratory Medicine (SEQCML). Determination of HDL cholesterol using automatic homogenous methods is considered acceptable for normal clinical practice, and the Friedewald Formula is considered to be usable to estimate LDL cholesterol concentration when triglyceride concentrations are below 200mg/dL (2.3mmol/L). If this should not be the case, the use of non-HDL cholesterol is recommended. Routine quantification of apolipoproteins A1 and B, and lipoprotein (a) can be measured using immunonephelometric or immunoturbidimetric methods, with calibrators that are traceable to reference materials.
El objetivo de la estandarización es conseguir la comparabilidad de los resultados de medida de las magnitudes biológicas obtenidos cuando un espécimen es analizado utilizando distintos procedimientos de medida1. El concepto de transferibilidad podría ampliarse a la obtención de resultados comparables entre sí, con objeto de ayudar al paciente que acude al mismo laboratorio varias veces a lo largo del tiempo y, también, cuando es atendido en laboratorios diferentes2. La obtención de resultados transferibles adquiere especial relevancia cuando se utilizan valores discriminantes universales, ya sea en el diagnóstico o en el control del tratamiento de los pacientes3.
Las dislipidemias son un tipo de patología usualmente asintomática que suelen detectarse y diagnosticarse con la ayuda de pruebas del laboratorio. Además, las dislipidemias, y en especial las elevaciones de la concentración del colesterol de lipoproteínas de baja densidad (LDL), así como los aumentos de apolipoproteína B100 y los descensos del colesterol de lipoproteínas de alta densidad (HDL) y apolipoproteína A1 (apo A1) confieren un mayor riesgo para el desarrollo de enfermedad cardiovascular aterosclerótica4,5. Por ello, para valorar el riesgo que tienen los individuos de padecer enfermedad cardiovascular, las guías recomiendan unánimemente no utilizar únicamente valores discriminantes. Las guías actuales de prevención cardiovascular clasifican a los sujetos en distintas categorías de riesgo según la probabilidad que tengan de desarrollar en un futuro la enfermedad aterosclerótica6-8, para lo cual se tienen en cuenta los principales factores de riesgo establecidos, y en especial la concentración de colesterol de LDL. Precisamente, son los valores de la concentración de colesterol de LDL los más determinantes en las guías para decidir el inicio de la intervención dietética o farmacológica, y además los utilizados para definir las concentraciones deseables (objetivos de prevención) que cada individuo debe alcanzar en función de su nivel de riesgo de padecer enfermedad cardiovascular6,7.
En cualquier caso, para conseguir la transferibilidad de los resultados, es especialmente importante la estandarización de las mediciones de los lípidos y lipoproteínas1,9, siendo para ello necesario disponer de métodos normalizados para la medición de las diferentes magnitudes lipídicas, y que los laboratorios clínicos adopten unas normas que equiparen su calidad analítica y condiciones preanalíticas con los de aquellos que han generado los valores que se adoptan como discriminantes10-16.
La fiabilidad de las determinaciones de lípidos y lipoproteínas está definida en función de la calidad del proceso analítico (variación analítica), de los factores previos (variación preanalítica) y de las posibles variaciones posteriores (fase postanalítica). La preanalítica ya ha sido analizada en un documento elaborado por esta comisión17, y la postanalítica no es objeto del presente documento.
Objetivo y campo de aplicaciónEl propósito de este documento es desarrollar unas recomendaciones para la estandarización de la fase analítica de las magnitudes lipídicas con el objeto de conseguir que los resultados de las mediciones sean exactos. El campo de aplicación es el del laboratorio clínico, y más concretamente las mediciones de las siguientes magnitudes lipoproteicas: colesterol total, colesterol de LDL, colesterol de HDL, triglicéridos, apo A1, apolipoproteína B (apo B) y lipoproteína (a) (Lp(a)).
Criterios de calidad analíticaLa fase analítica o metrológica incluye todos los pasos necesarios para realizar la medición, es decir, la metodología, los reactivos, la instrumentación y el material de calibración y control. Para garantizar la calidad de esta fase, los laboratorios clínicos deberían aplicar criterios similares con respecto a estos factores. Las fuentes de variación de esta fase se traducen en imprecisión o sesgo, y se contemplan en el error analítico total, o error de medida. En consecuencia, la comparabilidad de resultados entre laboratorios dependerá del grado de estandarización de sus mediciones.
Se ha descrito que los materiales de referencia, de calibración y de control utilizados para la medición de las magnitudes lipídicas, a menudo presentan problemas de no conmutabilidad que han sido atribuidos al efecto matriz18. En este sentido, el Clinical Laboratory Standards Institute ha publicado un documento caracterizando y cualificando la conmutabilidad de los materiales de referencia19.
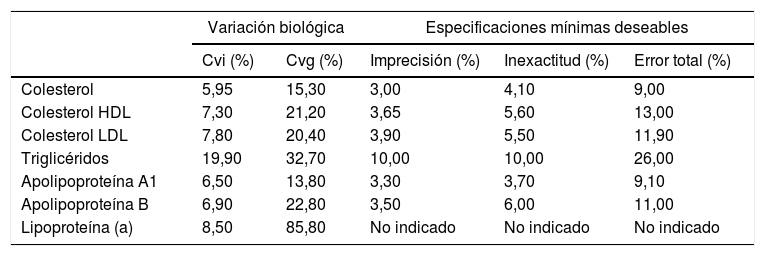
Requerimientos de calidad analíticaEl grupo de trabajo para la medida de lipoproteínas del Programa Nacional de Educación en Colesterol Norteamericano (National Cholesterol Education Program [NCEP]) publicó en el año 2001 unos objetivos de calidad analítica para la medición de lípidos y de las principales lipoproteínas (tabla 1)14, basados en el efecto que tienen las características analíticas en el establecimiento del riesgo cardiovascular. Para poder lograr estos objetivos, la imprecisión debe ser minimizada mediante la estandarización del proceso técnico y la aplicación de un sistema de control de calidad. El sesgo también debe ser minimizado, debido a que el intervalo en el que se asocia un determinado riesgo de desarrollar enfermedad cardiovascular es estrecho.
NCEP: Objetivos de calidad analítica para las mediciones de lípidos y lipoproteínas
| CV analítica | Error sistemático | Error total | |
|---|---|---|---|
| Colesterol total | 3% | ±3% VReal | 8,9% |
| Triglicéridos | 5% | ±5% VReal | 15% |
| Colesterol de HDL<42mg/dL (1,09mmol/L) | DE <1,7mg/dL (0,044mmol/L) | ±5% VReal | 13% |
| Colesterol de HDL ≥42mg/dL (1,09mmol/L) | 4% | ±5% VReal | 13% |
| Colesterol de LDL | 4% | ±4% VReal | 12% |
CV: coeficiente de variación; DE: desviación estándar; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; NCEP: National Cholesterol Education Program; VReal: valor real.
Por otro lado, Ricós et al.20, basándose en los datos publicados sobre la variabilidad biológica, establecieron en el año 1999 unas especificaciones o requerimientos de calidad analítica a alcanzar en el laboratorio clínico, que satisfacen los requisitos médicos para el diagnóstico, cribado y seguimiento de los pacientes. Estos datos fueron actualizados en el año 201421, estableciéndose requerimientos de calidad mínimos, óptimos y deseables atendiendo a criterios de variabilidad biológica.
En la tabla 2 se exponen las especificaciones recomendadas, que han sido asumidas por la Sociedad Española de Medicina de Laboratorio (SEQCML).
Objetivos de calidad analítica para las mediciones de lípidos y lipoproteínas (mínimas deseables SEQCML)
| Variación biológica | Especificaciones mínimas deseables | ||||
|---|---|---|---|---|---|
| Cvi (%) | Cvg (%) | Imprecisión (%) | Inexactitud (%) | Error total (%) | |
| Colesterol | 5,95 | 15,30 | 3,00 | 4,10 | 9,00 |
| Colesterol HDL | 7,30 | 21,20 | 3,65 | 5,60 | 13,00 |
| Colesterol LDL | 7,80 | 20,40 | 3,90 | 5,50 | 11,90 |
| Triglicéridos | 19,90 | 32,70 | 10,00 | 10,00 | 26,00 |
| Apolipoproteína A1 | 6,50 | 13,80 | 3,30 | 3,70 | 9,10 |
| Apolipoproteína B | 6,90 | 22,80 | 3,50 | 6,00 | 11,00 |
| Lipoproteína (a) | 8,50 | 85,80 | No indicado | No indicado | No indicado |
Cvg: variación biológica interindividual; Cvi: variación biológica intraindividual; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad; SEQCML: Sociedad Española de Medicina del Laboratorio.
Para la correcta estandarización de las mediciones de lípidos y lipoproteínas, es preciso disponer de procedimientos validados frente a un método de referencia o definitivo, empleando un patrón adecuado, conmutable y suficientemente estable.
Para su utilización en el laboratorio clínico se recurre a los métodos recomendados, que emplean procedimientos suficientemente practicables, y con los que es posible alcanzar los objetivos de calidad analítica propuestos. Con todo, la estandarización se complica a veces por falta de materiales de referencia sin la necesaria conmutabilidad, especialmente en las mediciones de apolipoproteínas, lo que ha requerido serios esfuerzos de los comités dedicados a la estandarización de la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) y de la Organización Mundial de la Salud (OMS).
Calibradores, controles y reactivosLas concentraciones de los lípidos y lipoproteínas de los materiales de calibración de los sistemas analíticos deben asignarse a partir de los métodos de referencia.
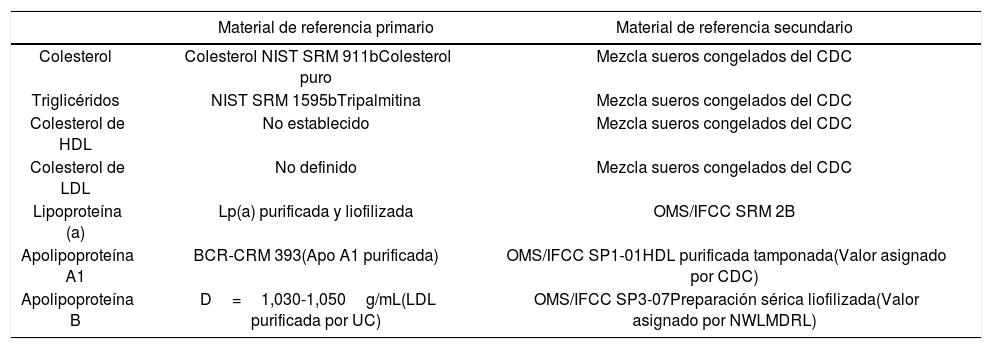
Con este objeto se han establecido programas internacionales dirigidos a los fabricantes como los del Cholesterol Reference Method Laboratory Network (CRMLN) y el Center for Diseases Control and Prevention (CDC)22 destinados a evaluar las características de los reactivos con respecto a los métodos de referencia, en términos de sesgo, así como de los materiales de calibración y control23-25. En la tabla 3 se esquematizan los materiales de referencia primarios y secundarios para la medición de lípidos y lipoproteínas.
Materiales de referencia primarios y secundarios para la medición de lípidos y lipoproteínas
| Material de referencia primario | Material de referencia secundario | |
|---|---|---|
| Colesterol | Colesterol NIST SRM 911bColesterol puro | Mezcla sueros congelados del CDC |
| Triglicéridos | NIST SRM 1595bTripalmitina | Mezcla sueros congelados del CDC |
| Colesterol de HDL | No establecido | Mezcla sueros congelados del CDC |
| Colesterol de LDL | No definido | Mezcla sueros congelados del CDC |
| Lipoproteína (a) | Lp(a) purificada y liofilizada | OMS/IFCC SRM 2B |
| Apolipoproteína A1 | BCR-CRM 393(Apo A1 purificada) | OMS/IFCC SP1-01HDL purificada tamponada(Valor asignado por CDC) |
| Apolipoproteína B | D=1,030-1,050g/mL(LDL purificada por UC) | OMS/IFCC SP3-07Preparación sérica liofilizada(Valor asignado por NWLMDRL) |
BCR: European Community Bureau of Reference; CDC: Centers for Disease Control and Prevention; CRM: Certified Reference Material; D: densidad; HDL: lipoproteínas de alta densidad; IFCC: Federación Internacional de Química Clínica; LDL: lipoproteínas de baja densidad; NIST: National Institute of Standards and Technology; NWLMDRL: Northwest Lipid Metabolism and Diabetes Research Laboratories; OMS: Organización Mundial de la Salud; SRM: Standard Reference Materials; UC: ultracentrifugación.
Por otra parte, los fabricantes están obligados por una Directiva Europea a evaluar sus productos, y asegurar su trazabilidad con los sistemas de referencia. Así las cosas, los laboratorios clínicos deben exigir a la industria del diagnóstico in vitro la información sobre la trazabilidad metrológica de los valores asignados a sus materiales de calibración. Además, los organizadores de los programas de evaluación externa de la calidad deberían proporcionar los valores obtenidos por los métodos de referencia en las mezclas utilizadas como material de control de calidad externo15.
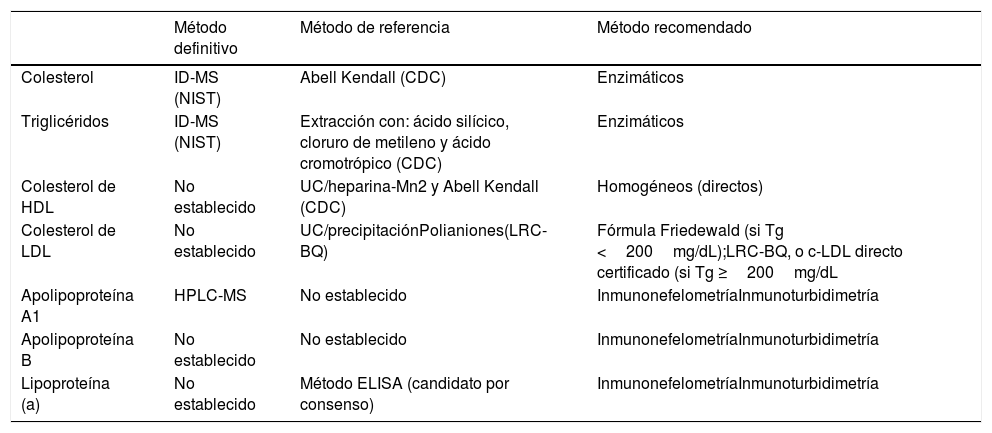
Métodos definitivos y de referenciaLa correcta estandarización de las determinaciones de lípidos y lipoproteínas requiere de la existencia de unos métodos recomendados validados frente a un procedimiento de medición definitivo o de referencia con el empleo de materiales de referencia primarios o secundarios adecuados y lo suficientemente estables16. En la tabla 4 se resumen los procedimientos de medición de referencia, definitivos y recomendados para la cuantificación de lípidos y lipoproteínas.
Métodos definitivos, de referencia y recomendados para la medición de lípidos y lipoproteínas
| Método definitivo | Método de referencia | Método recomendado | |
|---|---|---|---|
| Colesterol | ID-MS (NIST) | Abell Kendall (CDC) | Enzimáticos |
| Triglicéridos | ID-MS (NIST) | Extracción con: ácido silícico, cloruro de metileno y ácido cromotrópico (CDC) | Enzimáticos |
| Colesterol de HDL | No establecido | UC/heparina-Mn2 y Abell Kendall (CDC) | Homogéneos (directos) |
| Colesterol de LDL | No establecido | UC/precipitaciónPolianiones(LRC-BQ) | Fórmula Friedewald (si Tg <200mg/dL);LRC-BQ, o c-LDL directo certificado (si Tg ≥200mg/dL |
| Apolipoproteína A1 | HPLC-MS | No establecido | InmunonefelometríaInmunoturbidimetría |
| Apolipoproteína B | No establecido | No establecido | InmunonefelometríaInmunoturbidimetría |
| Lipoproteína (a) | No establecido | Método ELISA (candidato por consenso) | InmunonefelometríaInmunoturbidimetría |
CDC: Centers for Disease Control and Prevention; ELISA: análisis de inmunoabsorción ligado a las enzimas; HDL: lipoproteínas de alta densidad; HPLC-MS: cromatografía líquida de alta resolución con espectrometría de masas; ID-MS: espectrometría de masas con dilución isotópica; LDL: lipoproteínas de baja densidad; LRC-BQ: Lipid Research Clinic - beta cuantificación; NIST: National Institute of Standards and Technology; Tg: triglicérido; UC: ultracentrifugación.
El colesterol total es un analito claramente definido, y que existe en el plasma de forma libre y esterificada; sin embargo, para su análisis las formas esterificadas son previamente hidrolizadas, de tal manera que la medición del colesterol total, así como moléculas de colesterol libre, puede ser definida sin ambigüedades1. Para el colesterol el método de referencia es una modificación del método de Abell-Kendall, aunque ha sido propuesto un método de cromatografía de gases-espectrometría de masas (CG-MS) con dilución isotópica26. Dicho método modificado de Abell-Kendall (CDC) se basa en la liberación del colesterol en forma de éster contenido en la muestra de suero por saponificación con hidróxido de potasio alcohólico27; a continuación se extrae con hexano y se evapora una alícuota del extracto, desarrollándose un cromóforo a 620nm con el reactivo de Liebermann-Burchard (anhídrido acético, ácido acético glacial y ácido sulfúrico concentrado). Este método de referencia se calibra con el material de referencia NIST SRM 911c, siendo trazable al método definitivo de dilución isotópica-espectrometría de masas (ID-MS) (National Institute of Standards and Technology [NIST]).
TriglicéridosPara los triglicéridos, el NIST considera el método de espectrometría de masas-dilución isotópica (ID-MS) como método definitivo, y ha sido propuesto como de referencia28. Para llevarlo a cabo es preciso diluir previamente la muestra de suero con 13C3-glicerol marcado isotópicamente; a continuación se mezclan y se hidrolizan con alcohol/KOH a 60°C durante 1h, y seguidamente el disolvente se evapora bajo nitrógeno y el residuo que queda, que contiene glicerol libre e hidrolizado, se derivatiza con anhídrido acético en presencia de piridina. Seguidamente, este producto se extrae con acetato de etilo, y la capa orgánica se extrae y se seca bajo nitrógeno a 60°C. Por último, este derivado de acetato de glicerol se reconstituye en metanol y se analiza mediante cromatografía de gases-espectrometría de masas (GC-MS). Por su parte, el método de referencia del CDC precisa de la extracción con ácido silícico, cloruro de metileno y ácido cromotrópico.
Colesterol de LDL y colesterol de HDLLas principales lipoproteínas, al tratarse de partículas complejas, heterogéneas y dispersas, y con unos rangos de densidades que a veces se solapan, no han sido caracterizadas por completo, por lo que resulta muy difícil definir cuál es la fracción de interés para desarrollar un método de referencia para su medición. Por ello, para la medición de las concentraciones de colesterol en las lipoproteínas (colesterol de LDL, colesterol de HDL, colesterol de lipoproteínas de muy baja densidad [VLDL], colesterol de lipoproteínas de densidad intermedia [IDL] y colesterol de Lp(a)) no existe ningún método aprobado y validado como procedimiento de medición definitivo, aunque sí existe como método de referencia.
Para la cuantificación del colesterol de LDL existe un método de referencia, recomendado por el CDC, que se basa en separar primero por ultracentrifugación las VLDL y quilomicrones del resto, para después precipitar con polianiones las LDL, quedando aisladas las HDL. Las mediciones de colesterol en las distintas fracciones se realizan por el método de Abell-Kendall. Finalmente, el colesterol de LDL se obtiene por diferencia. De este modo, en la fracción de LDL así obtenida, tendremos en realidad una mezcla de lipoproteínas. Este método, también conocido como beta cuantificación, mide toda una población de lipopartículas: VLDL residuales, IDL, Lp(a), apo E-HDL, todas ellas consideradas como aterogénicas, y siendo las LDL claramente mayoritarias, si bien la contribución relativa de las lipoproteínas minoritarias puede variar ampliamente entre diferentes individuos, lo que introduce un factor de variabilidad importante.
Para el colesterol de HDL existe un consenso mundial sobre la conveniencia de utilizar el método desarrollado por el CDC (CDC-MR) que mide exclusivamente las HDL2 y HDL325, como método de referencia para la asignación de los valores de los materiales de referencia29, puesto que ha sido la base de los amplios estudios epidemiológicos y clínicos en los que se fundamentan los valores discriminantes utilizados para la estratificación del riesgo coronario. Como en el caso anterior, el método de referencia separa primero las VLDL y posibles quilomicrones por ultracentrifugación, y precipitando posteriormente con heparina-manganeso se obtienen la HDL aislada en la que se cuantifica el colesterol por el método de Abel-Kendall. La ultracentrifugación se realiza 105.000×g, y densidad de 1,006g/L, durante 18h a 18°C. Se estima que la desviación estándar global del método para el análisis de colesterol de HDL es igual o inferior a 1,5mg/dL (0,03879mmol/L).
Por otra parte, para concentraciones de triglicéridos inferiores a 200mg/dL, se elimina la necesidad de la ultracentrifugación1.
Apolipoproteínas A1 y B, y Lp(a)Hasta el momento no se han establecido métodos de referencia para apo A1 ni para apo B. Para la apo A1 se ha establecido un método definitivo basado en cromatografía líquida de alta resolución con espectrometría de masas (HPLC-MS), no así para la apo B, para la que no existe tampoco método definitivo.
Tampoco existe actualmente un método recomendado o que pueda ser considerado como de referencia para la medición de la concentración de Lp(a), debido a los problemas ocasionados por la variabilidad interindividual de la estructura de la apolipoproteína, aún no resueltos. Es necesario el desarrollo de futuras líneas de investigación que permitan solucionar la estandarización de su medición en plasma/suero30, habiéndose apuntado también hacia el número de partículas, y a la necesidad de desarrollar una prueba capaz de medirlas independientemente de la masa total de Lp(a)31, sobre la base del hallazgo de anticuerpos cuya inmunorreactividad frente a todas las isoformas de la apolipoproteína sea igual, de la disponibilidad de métodos precisos, y de la estandarización de todo el proceso30.
Aunque no existe un método definitivo para la medición de Lp(a), se ha propuesto como de referencia por el grupo de trabajo para la estandarización de la Lp(a) de la IFCC, un método ELISA que utiliza un anticuerpo monoclonal específico contra el epítopo único presente en el KIV tipo 9 (mAb40), que está consensuado como método propuesto de referencia para la preparación de material de referencia secundario31.
Métodos recomendadosEn la tabla 4 se recogen los métodos recomendados que se aplican en la práctica diaria en los laboratorios clínicos. Deben ser procedimientos lo suficientemente practicables como para alcanzar los objetivos analíticos propuestos (tablas 1 y 2) y comparables con los empleados, en su día, para establecer las bases epidemiológicas y definir el riesgo cardiovascular.
ColesterolEn los laboratorios clínicos se recomienda utilizar métodos enzimáticos que, en la práctica totalidad de las distintas versiones que proporcionan los fabricantes, están basados en la utilización de las enzimas: colesterol-esterasa, colesterol-oxidasa y peroxidasa (con la secuencia de reacciones que se describen en la figura 1A), con lectura final de absorbancias en longitudes de onda de 500nm, y aplicación de la ley de Lambert-Beer.
A) Reacciones del método recomendado para la cuantificación de colesterol. B) Reacciones del método recomendado para la cuantificación de triglicérido. C) Reacciones de los métodos recomendados para la cuantificación del cHDL (*).
CE: colesterol esterasa; CO: colesterol oxidasa; PEG: polietilenglicol; Qm: quilomicrones. (*) Tomado de Aguilar Doreste y Vella Ramírez32.
Para la concentración de triglicérido se recomienda utilizar métodos enzimáticos. Los triglicéridos se hidrolizan, y se calcula su concentración en función del contenido en glicerol en la muestra final (cuantifican la medición de glicéridos totales como triglicérido), para lo cual debe tenerse en cuenta el posible contenido en glicerol de la muestra antes de la hidrólisis; por esta razón algunos métodos incluyen una valoración del glicerol libre inicial, el cual restan del glicerol total antes de dar el resultado final. Como en el caso del colesterol, los distintos métodos disponibles en el mercado tienen los mismos fundamentos, pudiendo diferenciar únicamente entre los que efectúan corrección por el glicerol libre y los que no lo hacen. La práctica totalidad de los métodos están basados en la utilización de las enzimas: lipasa, glicerol quinasa, glicerol-3-fosfato oxidasa y peroxidasa, con la secuencia de reacciones que se describen en la figura 1B, y lectura final de absorbancias en longitudes de onda de 500nm, y aplicación de la ley de Lambert-Beer.
Colesterol de LDLEn los laboratorios clínicos la forma rutinaria de determinación de colesterol LDL es mediante la fórmula de Friedewald, que funciona razonablemente bien siempre y cuando la concentración de triglicérido sea inferior a 200mg/dL. Cuando se supera dicha concentración de triglicérido, no se debe hacer uso de dicha fórmula para el cálculo de LDL, sino utilizar en su lugar el colesterol-no-HDL o la apo B.
Colesterol de HDLLos métodos recomendados para la medición rutinaria de colesterol HDL en el laboratorio clínico son los métodos homogéneos suficientemente contrastados. En la tabla 5 se exponen los métodos patentados, todos ellos recomendables, que han sido adaptados a distintos autoanalizadores, y cuyas respectivas reacciones químicas aparecen en la figura 1C.
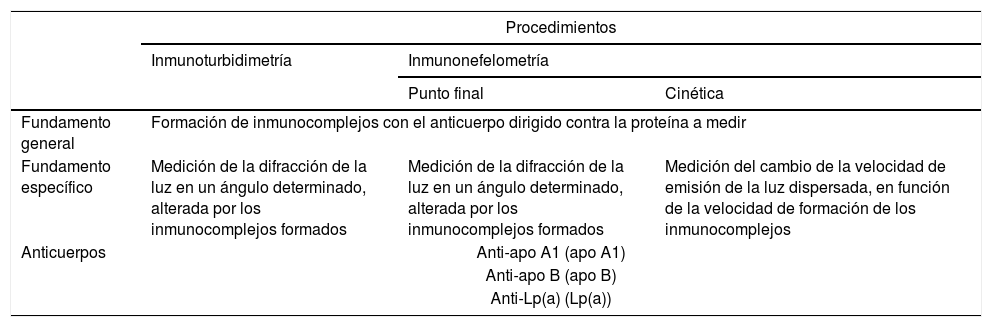
Procedimientos recomendados para la medición de apolipoproteínas A1 y B, y Lp(a)
| Procedimientos | |||
|---|---|---|---|
| Inmunoturbidimetría | Inmunonefelometría | ||
| Punto final | Cinética | ||
| Fundamento general | Formación de inmunocomplejos con el anticuerpo dirigido contra la proteína a medir | ||
| Fundamento específico | Medición de la difracción de la luz en un ángulo determinado, alterada por los inmunocomplejos formados | Medición de la difracción de la luz en un ángulo determinado, alterada por los inmunocomplejos formados | Medición del cambio de la velocidad de emisión de la luz dispersada, en función de la velocidad de formación de los inmunocomplejos |
| Anticuerpos | Anti-apo A1 (apo A1) | ||
| Anti-apo B (apo B) | |||
| Anti-Lp(a) (Lp(a)) | |||
apo A1: apolipoproteína A1; apo B: apolipoproteína B; Lp(a): lipoproteína (a).
Para la medición de ambas apolipoproteínas en la rutina de los laboratorios clínicos se recomienda emplear métodos inmunonefelométricos e inmunoturbidimétricos, que cumplan con los criterios que señalan la OMS y la IFCC1,19.
Los métodos inmunonefelométricos, lo mismo que los inmunoturbidimétricos, emplean anticuerpos anti-apo A1, anti-apo B y anti-Lp(a), y tienen análogos fundamentos para las tres determinaciones mencionadas, con pequeñas variaciones que tienen que ver con la forma de detección del complejo que sirve de base para el análisis, tal y como se expone en la tabla 5.
Limitaciones y debilidadesDebe tenerse siempre en cuenta que al realizar determinaciones de colesterol relacionado con una familia de lipoproteínas concreta (LDL, HDL), estamos cuantificando determinadas lipopartículas cuya contribución específica puede variar en función de la metodología utilizada. Por este motivo, es recomendable utilizar los procedimientos que han aportado los resultados constituyentes de las bases de datos epidemiológicas y clínicas mencionadas y no utilizar métodos que no se sabe qué es lo que miden, o que no hayan demostrado una clara transferibilidad de los resultados a los obtenidos con los métodos de referencia.
La definición de un material de referencia primario para las LDL, lo mismo que para las HDL, resulta extremadamente difícil debido a que, tanto a nivel individual como entre la totalidad de los pacientes, existe una gama heterogénea de partículas que varían en su contenido en colesterol, y que exhiben distintas propiedades físicas (densidad, tamaño, movilidad electroforética)1.
Hasta hace relativamente poco tiempo, la cuantificación del colesterol de HDL se realizaba casi exclusivamente por métodos de precipitación, mediante ensayos que requieren un paso de separación manual con reactivos precipitantes, seguido del análisis del contenido en colesterol en analizadores. La necesidad de mejorar la precisión de los métodos, así como la contención del coste en los laboratorios clínicos, tuvo como consecuencia el desarrollo de una generación de métodos completamente automatizados, los llamados «métodos homogéneos», que emplean reactivos específicos para, con criterio selectivo, medir directamente el colesterol de HDL. Cada laboratorio debe, por tanto, considerar una serie de factores técnicos y económicos para seleccionar el método que mejor se adapte a su situación32.
Respecto a los métodos directos para la medición del colesterol de HDL, todos los métodos actualmente disponibles, inicialmente desarrollados por fabricantes japoneses, fueron certificados por el CRMLN. La mayoría fueron posteriormente vendidos a otros fabricantes para su distribución. Por esta razón, aunque todos los sistemas reactivos primarios tienen certificación CRMLN, estarían en principio preparados para cada analizador y sistema de calibración en concreto, por lo que su aplicación universal a todas las versiones, todos los equipos, y todos los lotes de reactivos, no siempre estaría garantizada. Ante esta situación, se aconseja confirmar la exactitud de cada nuevo lote de calibradores llevando a cabo estudios de solapamiento con los lotes empleados previamente1, pues aunque la mayoría de los métodos directos concuerdan bien con los objetivos de error del NCEP para sujetos en ayunas y sin lipoproteínas alteradas33, todos ellos fallan al intentar los mismos objetivos con pacientes dislipidémicos, debido a la falta de selectividad hacia las lipoproteínas anormales34, lo que conduce a valores incorrectos del colesterol de LDL calculado por cualquiera de las cuatro ecuaciones disponibles para ello35.
De forma similar a lo acontecido con el colesterol de HDL, la aparición de varios métodos directos (homogéneos) para la cuantificación automática de colesterol de LDL, sin separación previa de lipoproteínas, ha hecho que un número creciente de laboratorios pase a utilizar métodos homogéneos para medir colesterol LDL, en muchos casos limitándolo a las muestras en las que no es recomendable emplear la ecuación de Friedewald, por su elevada concentración de triglicéridos.
Debido a las limitaciones de estos métodos directos, su utilización no es frecuente en los laboratorios, empleándose en su lugar el colesterol-no-HDL cuando la concentración de triglicérido es superior a 200mg/dL.
Los fabricantes que han desarrollado estos métodos homogéneos para colesterol de LDL han certificado sus productos a través de la CRMLN, y han demostrado que sus medidas pueden confluir con las recomendaciones de trabajo del NCEP para exactitud y precisión, aunque solamente cuando se utilizan muestras de pacientes en ayunas y sin presencia de lipoproteínas atípicas, ya que todos los métodos fallan a la hora de estudiar sujetos con patologías en las que aparecen lipoproteínas anormales34.
Se aconseja, como en el caso de las pruebas homogéneas para colesterol de HDL, confirmar la exactitud de cada nuevo lote de calibradores llevando a cabo estudios de solapamiento con los lotes empleados previamente1, pero con la mayoría de los métodos directos disponibles no se consigue mejorar la clasificación del riesgo cardiovascular, salvo para muestras hipertrigliceridémicas35, lo que ha llevado a sugerir el empleo del colesterol-no-HDL o de la apo B1,35,36. Por otra parte, los fallos de las ecuaciones para calcular el colesterol de LDL a partir de otras magnitudes han hecho surgir: planteamientos sobre una posible ecuación óptima37, propuestas de nuevas fórmulas38, e incluso de medida del número de partículas de LDL en lugar del colesterol contenido en ellas39, sobre la base de que el número de partículas de LDL se correlacionará más estrechamente con la concentración de apo B, dado que cada partícula de LDL contiene una sola molécula de dicha proteína. Este último planteamiento se ha apuntado también para la determinación de colesterol HDL, sugiriendo la medida del número de partículas de HDL, en lugar de la concentración de colesterol de HDL40.
Finalmente, deben extremarse las precauciones cuando se están llevando a cabo estudios a largo plazo, ya sean epidemiológicos o ensayos clínicos, con especial atención a la posible falta de especificidad para los especímenes atípicos, a la falta de información sobre los efectos de congelar las muestras, así como a los cambios por parte de los fabricantes en la elaboración de los reactivos que pueden afectar a los resultados de estos estudios de investigación a largo plazo16.
RecomendacionesLas mediciones de la concentración de los diversos componentes del metabolismo lipídico son críticas, ya que los valores obtenidos en las mismas pueden influir en la toma de decisiones clínicas, incluso en ausencia de síntomas de enfermedad, de instauración crónica de algún tipo de intervención con todas las implicaciones económicas y sanitarias que ello supone. Además, es considerable la proporción de población potencialmente implicada en esta toma de decisiones con fines preventivos.
Por todo lo expuesto, se recomienda lo siguiente:
Recomendación 1. En la práctica diaria el laboratorio clínico debe utilizar, para la medición de las concentraciones de lípidos y lipoproteínas, métodos recomendados validados frente a un método de referencia o definitivo, y debe emplear material de control adecuado que cumpla con lo previsto sobre trazabilidad con los sistemas de referencia por la Directiva Europea sobre Diagnóstico in vitro (EC IVDD 98/79/EC).
Recomendación 2. Los métodos recomendados deben ser lo suficientemente practicables como para poder alcanzar con ellos un error de medida inferior al 10%10, y cuando ello no fuera posible, conseguir los objetivos analíticos recomendados por el NCEP y los mínimos elaborados por la SEQCML2,20. En cualquier caso, los objetivos de calidad deben ajustarse a los expuestos en la tabla 2.
Recomendación 3. La determinación de colesterol de HDL por métodos homogéneos en equipos automatizados resulta aceptable para la práctica rutinaria, en el sentido de que cumplen los requisitos mínimos como para garantizar una adecuada valoración del riesgo cardiovascular. Se recomienda realizar la medición de colesterol HDL mediante métodos homogéneos en equipos automatizados (fig. 1C).
Recomendación 4. Para la cuantificación de la concentración de colesterol de LDL se recomienda el uso de la fórmula de Friedewald, siempre y cuando las muestras no tengan una concentración de triglicérido superior a 200mg/dL (2,3mmol/L). No se recomienda, por el momento, la utilización de métodos homogéneos directos para la medición de colesterol LDL.
Recomendación 5. La utilización del colesterol-no-HDL, y también de la apo B, pueden ser de gran utilidad en muestras hipertrigliceridémicas en la rutina de los laboratorios clínicos, ya que los métodos directos disponibles no consiguen distinguir bien cada fracción lipoproteica, y no mejoran la valoración del riesgo cardiovascular. Se recomienda informar de la concentración de colesterol-no-HDL en aquellos casos en los que la estimación de la concentración de colesterol de LDL no se pueda realizar debido a la elevada concentración de triglicéridos (>2,3mmol/L o 200mg/dL).
Recomendación 6. Los métodos recomendados para la cuantificación rutinaria de apo A1 y apo B en el laboratorio clínico son la inmunonefelometría y la inmunoturbidimetría, siempre que los calibradores sean trazables a materiales de referencia internacionales (OMS/IFCC SP1-01 y OMS/IFCC SP3-07). Para la cuantificación de Lp(a) se recomienda igualmente la inmunonefelometría e inmunoturbidimetría.
Recomendación 7. La cuantificación de colesterol y triglicérido en suero y plasma se recomienda realizarla mediante métodos enzimáticos automatizados, que son el método de la colesterol esterasa/colesterol oxidasa/peroxidasa, y el de la lipasa/glicerol quinasa/glicerol-3-fostato oxidasa/peroxidasa, respectivamente (fig. 1).