La cardiopatía isquémica supone el 1,3% de los casos de atención en un servicio de urgencias hospitalario en España. El manejo del paciente es complejo por el riesgo de producir una alta médica incorrecta, el beneficio de instaurar una revascularización rápida y el gasto excesivo por admisiones injustificadas.
La última década ha permitido un importante avance en el desarrollo de nuevos marcadores cardíacos. Tradicionalmente los marcadores del síndrome coronario agudo han sido indicadores de necrosis cardíaca. Esta función se ha ampliado actualmente. Aún hay muchas limitaciones en la medición de estos marcadores, como la falta de un procedimiento estandarizado o materiales de referencia certificados.
Además de las troponinas cardíacas y el electrocardiograma, medir la albúmina modificada por isquemia puede ayudar a excluir un síndrome coronario agudo en pacientes con baja probabilidad de isquemia miocárdica. La proteína fijadora de ácidos grasos-H es un marcador de necrosis útil en el diagnóstico precoz del infarto agudo de miocardio. En el pronóstico del síndrome coronario agudo, la proteína C reactiva, los péptidos natriuréticos y la mieloperoxidasa complementan el valor pronóstico de la troponina. El ligando soluble CD40 permite la clasificación e individualización del tratamiento del síndrome coronario agudo.
Actualmente no hay suficiente evidencia para que ningún nuevo marcador sustituya a los que recomiendan las sociedades científicas ni se dispone de procedimientos de medición rápidos para algunos de ellos. Deben establecerse paneles utilizando la evidencia científica disponible y tomando como objetivo su contribución a una mejor evolución del paciente.
Myocardical ischemia involves 1.3% of the patients attending emergency departments in Spain. The management of these patients is complex, due to the risk of an incorrect discharge diagnosis, the benefit of rapid revascularization and the excessive cost due to unnecessary admissions.
There has been a significant improvement in the development of new cardiac biomarkers over the last ten years. Biomarkers traditionally used for identifying acute coronary syndrome were indicators of myocardial necrosis. This role has currently been expanded. There are still some limitations in the measurement of these biomarkers, due to lack of standardised assays or certified calibrators.
Ischemia-modified albumin in conjunction with cardiac troponin and electrocardiogram, can help to rule out an acute coronary syndrome in patients with a low probability of having myocardical ischemia. Heart-type fatty acid-binding protein is a strong necrosis biomarker in the early diagnosis of acute myocardical infarction.
C-reactive protein, natriuretic peptides and myeloperoxidase have been shown to complement cardiac troponin in the prognosis of acute coronary syndrome. Soluble CD40 ligand enables the identification of a subgroup of patients who will benefit from a treatment in acute coronary syndrome.
There is currently not enough evidence to replace new biomarkers with any of these already been recommended by the scientific societies. Also, the assays of some of them are not sufficiently rapid. A multimarker strategy must be created to take into account the existing scientific-based evidence, with the aim of improving outcomes in patients.
Las enfermedades cardiovasculares son la primera causa de muerte en Europa, representando el 42% de los casos y 1,9 millones de fallecimientos por año1. En la Europa occidental la mortalidad por esta causa ha disminuido linealmente entre 1970 y 1990, y esta tendencia se ha extendido a la Europa del este desde 19902. Esta mortalidad es mayor entre pacientes con niveles ocupacionales o educacionales bajos3. En la mujer, el riesgo de enfermedad cardiovascular se desestima a menudo por la falsa percepción de que está protegida de esta enfermedad. Por razones que aún no han sido totalmente aclaradas, en la edad fértil el riesgo de eventos cardíacos es bajo. Por ello, en el caso de que tenga factores de riesgo frecuentemente no se tratan, y tras la aparición de la menopausia la mujer queda expuesta al riesgo de contraer la enfermedad cardiovascular4.
La cardiopatía isquémica supone el 1,3% de los casos de atención en un servicio de urgencias hospitalario en España5. Cabe destacar tres circunstancias que resultan decisivas en este contexto:
- –
Hay un riesgo potencial de que se produzca una alta médica incorrecta, hecho que sucede en un 1–4% de los casos de infarto agudo de miocardio y el 2,2% de los casos de angina inestable6.
- –
Hay una clara correlación entre la rapidez de la instauración de la revascularización y la reducción en la mortalidad asociada a la enfermedad7.
- –
Se produce un gasto excesivo por admisiones injustificadas en las unidades coronarias, que puede ser hasta el 50% del total de las admisiones8.
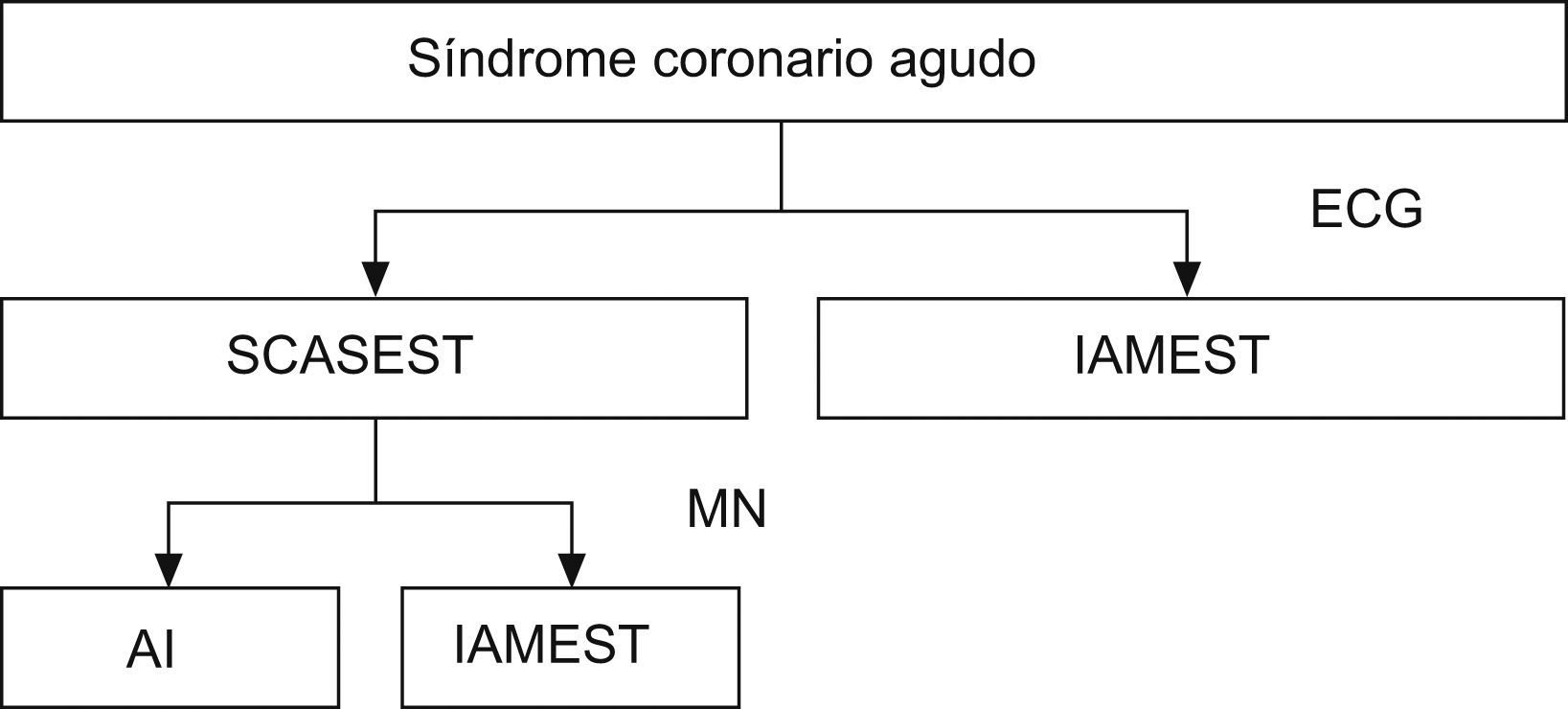
El síndrome coronario agudo se define por el conjunto de cuadros clínicos por los que se pone de manifiesto de forma aguda la isquemia miocárdica secundaria principalmente a arteriosclerosis coronaria (aunque puede deberse a otras causas)9. Este síndrome incluye la angina inestable, el infarto agudo de miocardio y la muerte súbita, que son tres formas de presentación de un mismo proceso por el que una placa aterosclerótica coronaria se erosiona o se rompe y vierte su contenido protrombótico a la luz de una arteria coronaria. Una vez vertido a la luz, entra en contacto con las proteínas del sistema de la coagulación y las plaquetas circulantes, y se forma un trombo intracoronario. En la mayoría de los pacientes con síndrome coronario agudo, la oclusión es parcial o transitoria y no se origina una elevación persistente del segmento ST, y se da lugar a una angina inestable o un infarto agudo sin elevación del segmento ST. En los demás pacientes, el trombo ocluye completamente la arteria y origina un infarto agudo de miocardio con elevación del segmento ST en el electrocardiograma10–12 (fig. 1).
Síndrome coronario agudo. El paciente con síndrome coronario agudo puede incluirse en dos categorías con base en la imagen de su electrocardiograma, según el segmento ST se eleve persistentemente o no. Los pacientes que no tienen esta elevación pueden tener una angina inestable o un infarto agudo de miocardio sin elevación del ST. La importancia de clasificar por la persistencia del segmento ST radica en la diferente aproximación terapéutica (se ha excluido la muerte súbita en el diagrama)11,12,17. AI: angina inestable; ECG: electrocardiograma; IAMEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; MN: marcadores de necrosis; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Entre 1950 y 1960 se describió y se extendió el empleo de la aspartato aminotransferasa (EC 2.6.1.1.) en la detección de la necrosis cardíaca y, más concretamente, su aplicación en el diagnóstico del infarto agudo de miocardio. Durante las siguientes cuatro décadas se fue mejorando la especificidad de los marcadores del síndrome coronario agudo restringiendo su origen al miocardio13. La última década ha supuesto un importante avance en el desarrollo de nuevos marcadores cardiacos. Existen varios factores que han influido en este proceso:
- –
La realización del proyecto Genoma Humano14 y el desarrollo de nuevas herramientas, como las micromatrices de ADN, microarrays de expresión, la proteómica y la nanotecnología, han permitido el descubrimiento de nuevas moléculas con una utilidad potencial como biomarcadores. A ello hay que añadir los avances en bioinformática que han mejorado el análisis de datos generados por la tecnología antes citada15.
- –
La dilucidación de la fisiopatología de la aterosclerosis y la descripción de los mediadores fisiológicos implicados han permitido su estudio como potenciales marcadores cardíacos16.
- –
La definición del infarto agudo de miocardio publicado en el año 200014 ha llevado a la necesidad de reevaluar los marcadores conocidos y al estudio de nuevos marcadores en el síndrome coronario agudo.
Algunos de estos marcadores, como es el caso de las troponinas cardíacas, han sido de gran ayuda en la práctica de la cardiología clínica. No obstante, el papel que tienen la mayor parte de los nuevos marcadores en la identificación y la atención de los pacientes con síntomas cardiovasculares aún debe ser establecido18.
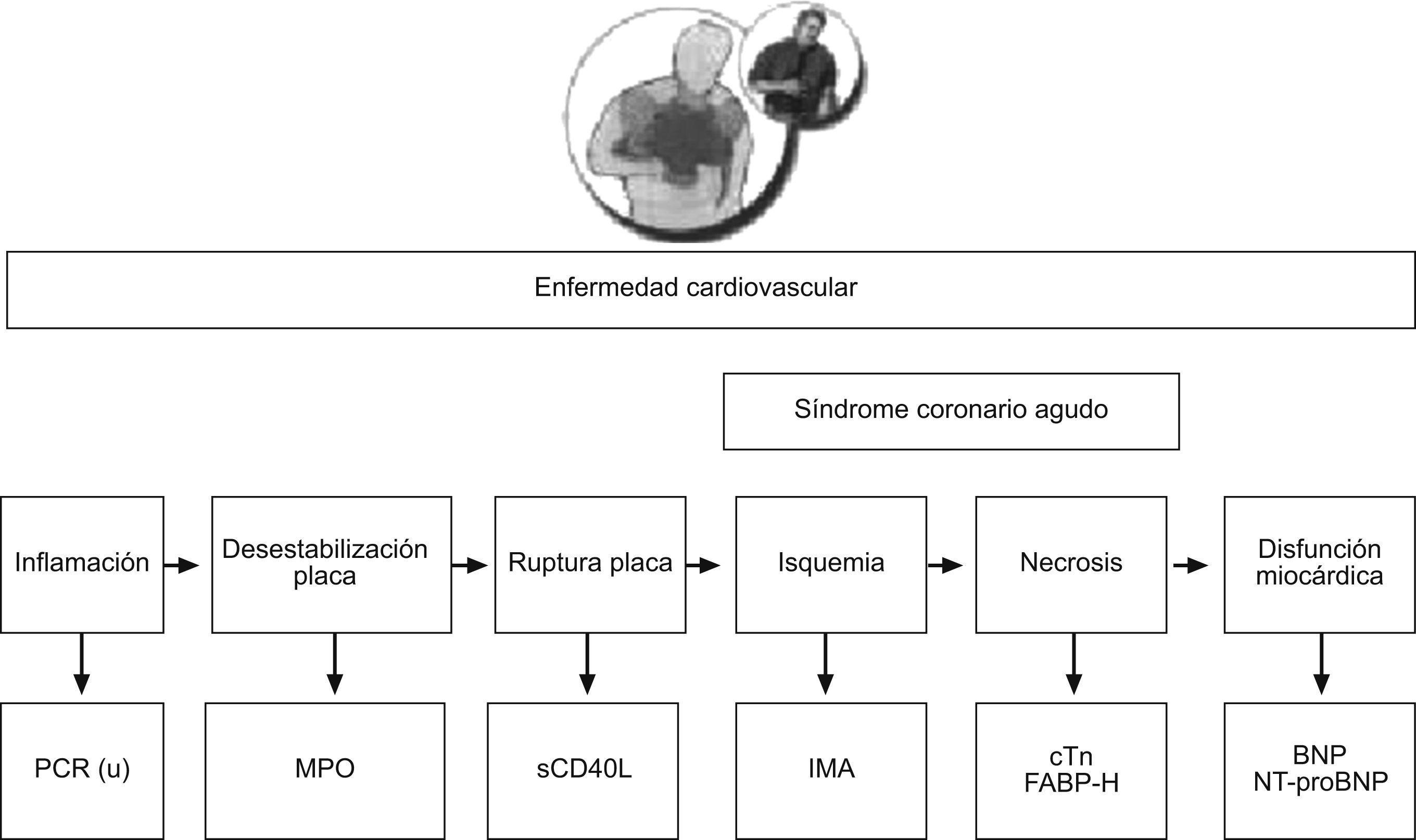
Nuevos marcadores y su importancia clínicaLa literatura científica recoge estudios cada vez más numerosos sobre marcadores nuevos o ya conocidos pero de uso emergente15,19, con conclusiones que resultan en ocasiones contradictorias, por lo que parece oportuno presentar una selección de esta información y revisar de forma crítica la evidencia científica de mayor trascendencia (fig. 2).
Nuevos marcadores en cada fase de la enfermedad cardiovascular. La enfermedad cardiovascular incluye una serie de respuestas celulares y moleculares asociadas a la inflamación que acaban con la formación de una placa. Después puede tener lugar su desestabilización y ruptura, con liberación del contenido protrombótico en la luz de una arteria coronaria. Este contenido entra en contacto con las proteínas del sistema de la coagulación y las plaquetas circulantes, y se forma un trombo intracoronario. El trombo puede interrumpir parcial, transitoria o completamente el aporte de sangre oxigenada al miocardio (isquemia); si ésta persiste, hay una pérdida celular irreversible que lleva a una disfunción cardíaca. Los marcadores cardíacos indicados contribuyen a poner de manifiesto estas fases. BNP: péptido natriurético cerebral; cTn: troponinas cardíacas; FABP-H: proteína fijadora de ácidos grasos-H; IMA: albúmina modificada por isquemia; MPO: mieloperoxidasa; NT-proBNP: fragmento aminoterminal del propéptido natriurético B; PCR(u): proteína C reactiva ultrasensible; sCD40L: ligando soluble CD40.
Para ello se hicieron las siguientes búsquedas entre septiembre de 2007 y marzo de 2008:
- –
MEDLINE: “Serum Albumin”[Majr] AND “Myocardial Ischemia”[Majr]. “Serum Albumin”[Majr] AND (“Coronary Disease”[Majr] OR (“Coronary Disease/blood”[Majr] OR “Coronary Disease/complications”[Majr] OR “Coronary Disease/diagnosis”[Majr] OR “Coronary Disease/drug therapy”[Majr])).
- –
La búsqueda se repitió para “fatty acid binding protein”, “CD40 ligand”, “peroxidase”, “c-reactive protein”, “natriuretic peptide”.
- –
National Guideline Clearinghouse: Diseases (MeSH Category) > Cardiovascular Diseases.
Idealmente, la concentración de los marcadores diagnósticos de síndrome coronario agudo debe elevarse rápidamente y permanecer alta durante un periodo suficientemente amplio (sensibilidad diagnóstica). Los marcadores deben ser específicos del tejido cardíaco (especificidad diagnóstica). Los marcadores empleados en el cribado deberían tener un bajo coste económico, además de una alta sensibilidad diagnóstica. Los marcadores empleados en la monitorización del tratamiento deberían poseer una baja variabilidad biológica intraindividual, y serían menos importantes su coste, su sensibilidad y su especificidad20. Su procedimiento de medición debe ser exacto y reproducible y estar estandarizado, y el resultado de la medida debe ser fácil de interpretar. En definitiva, el marcador debería ser capaz de incidir en la actitud terapéutica y la evolución del paciente y, en consecuencia, ser coste-efectivo15.
Tradicionalmente, los marcadores del síndrome coronario agudo han sido únicamente indicadores de necrosis. Este papel se ha ampliado actualmente debido a que:
- –
En muchos casos los nuevos marcadores detectan el síndrome coronario agudo antes de la necrosis.
- –
En la detección de necrosis, los marcadores actuales intentan mejorar las características de los marcadores ya conocidos.
- –
Tras la necrosis, proporcionan información sobre la remodelación ventricular.
- –
Tal como sucedía para las troponinas cardíacas y la concentración de masa de la isoenzima 2 de la creatina cinasa, los nuevos marcadores presentan un valor pronóstico evolutivo.
Muchos de los estudios publicados sobre estos nuevos marcadores presentan algunos inconvenientes:
- –
Las características de los procedimientos de medida utilizados no se describen con gran detalle. Las características preanalíticas (toma de muestras, estabilidad de los componentes biológicos) no se definen claramente19.
- –
Deberían realizarse estudios transversales del marcador en la población sana y la enferma y se debería estudiar ambas distribuciones. La selección de ambas poblaciones tiene que ser adecuada15 y representativa de las que se va a encontrar en la práctica clínica. La bibliografía encontrada a menudo emplea grupos reducidos de pacientes que padecen procesos muy bien establecidos que podrían sesgar los resultados publicados19.
- –
Para evaluar su eficacia diagnóstica, debería estudiarse el marcador en una amplia gama de valores, hecho que se cumple cuando se utilizan las curvas de rendimiento diagnóstico21. Numerosos trabajos emplean la sensibilidad y la especificidad diagnósticas o el cociente de probabilidades positivo (razón de verosimilitudes positiva)22, pero estos valores dependen del valor discriminatorio empleado. Además, se puede dar un cociente de probabilidades positivo elevado aunque las poblaciones enferma y sana tengan un gran solapamiento de valores para la concentración del marcador23.
- –
El nuevo marcador debería ser comparado con el mejor modelo de diagnóstico disponible para la enfermedad, y no sólo con un único marcador23.
La albúmina es la proteína de mayor concentración plasmática, y entre sus funciones está la del transporte de iones metálicos. Posee cuatro puntos de unión con diferentes especificidades para estos iones. Dos de ellas se hallan en su extremo aminoterminal, y proporcionan la capacidad de unirse a los metales de transición como el cobalto (II)24. No obstante, cuando hay isquemia, en los capilares hipoxémicos se produce un cambio en el octapéptido terminal que reduce esta capacidad de unión. Probablemente las especies de oxígeno reactivas son el agente causante y la albúmina actúa como un antioxidante con el fin de reducir el daño25.
El carácter de marcador de isquemia ha quedado en evidencia en varios estudios. En uno de ellos se sometió a una intervención cardíaca percutánea a 19 pacientes con angina crónica estable, así como a 11 pacientes control. La concentración de la albúmina modificada por isquemia se elevó en 18 de los 19 pacientes inmediatamente después de la intervención y 30min tras ella, y se normalizó a las 12h. En el grupo control esta concentración no varió antes y después de la intervención26. Paralelamente se sometió a un procedimiento idéntico a 34 pacientes con la misma enfermedad, y se hallaron aumentos en la concentración plasmática de la albúmina modificada tras la intervención. Cabe destacar que estas elevaciones fueron mayores en las intervenciones con mayor número de inflados, mayor presión y de mayor duración27.
Un trabajo multicéntrico estudió a 224 pacientes con síntomas de síndrome coronario agudo, y una evolución menor a tres horas. Se tomó una muestra en la primera hora (en todos los casos se halló una concentración de troponina I dentro del intervalo de referencia), y otra entre 6 y 24h después. La albúmina modificada presentó en la primera hora un área bajo la curva de rendimiento diagnóstico de 0,78 en la predicción de una troponina cardíaca elevada en la segunda muestra. El valor predictivo para un resultado negativo fue del 96%28 (tabla 1).
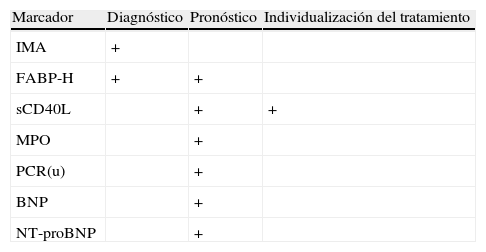
Principales aplicaciones clínicas de los marcadores de síndrome coronario agudo
| Marcador | Diagnóstico | Pronóstico | Individualización del tratamiento |
| IMA | + | ||
| FABP-H | + | + | |
| sCD40L | + | + | |
| MPO | + | ||
| PCR(u) | + | ||
| BNP | + | ||
| NT-proBNP | + |
BNP: péptido natriurético cerebral; FABP-H: proteína fijadora de ácidos grasos-H; IMA: albúmina modificada por isquemia; MPO: mieloperoxidasa; NT-proBNP: fragmento aminoterminal del propéptido natriurético B; PCR(u): proteína C reactiva ultrasensible; sCD40L: ligando soluble CD40.
La concentración plasmática de la albúmina modificada es más alta en los pacientes con síndrome coronario agudo que en los pacientes agudos que no presentan enfermedades isquémicas29,30. Además, la concentración plasmática de la albúmina modificada está más elevada en los pacientes con angina inestable que en los pacientes con infarto agudo, y en ambos casos es mayor que en los pacientes sin enfermedades isquémicas29. Su sensibilidad diagnóstica en el síndrome coronario agudo es de un 75–82% y el área bajo la curva de rendimiento diagnóstico, 0,63–0,8929–32. La estrategia diagnóstica comúnmente empleada para el diagnóstico del síndrome coronario agudo por los servicios médicos de urgencias es la medida de la troponina cardíaca plasmática y la realización de un electrocardiograma, con una sensibilidad diagnóstica del 53%. Si además se emplea la medida de la albúmina modificada plasmática, este valor se eleva hasta el 95%. El valor predictivo de un resultado negativo pasa del 53 al 84%, y el área bajo la curva de rendimiento diagnóstico, de 0,74 a 0,8329. Asimismo, la combinación de la concentración de la albúmina modificada, la isoenzima 2 de la creatina-cinasa y la troponina I logra una sensibilidad diagnóstica del 97%, con un valor predictivo para un resultado negativo del 92%31. Precisamente este elevado valor predictivo de un resultado negativo le confiere una valiosa utilidad dentro del cuidado al paciente con síndrome coronario agudo: además de las troponinas cardíacas y el electrocardiograma, medir los marcadores de isquemia puede ayudar a excluir un síndrome coronario agudo en pacientes con baja probabilidad de isquemia miocárdica11. En este mismo sentido, un metanálisis concluye que la coincidencia de un electrocardiograma no diagnóstico con troponina cardíaca y albúmina modificada negativas tiene un valor predictivo para un resultado negativo del 97,1%33.
La albúmina modificada puede estar elevada en cualquier enfermedad que curse con isquemia, como cáncer, infecciones, enfermedad renal crónica, enfermedad hepática e isquemia cerebral. Se han descrito elevaciones de este marcador a las 24–48h tras una carrera de maratón, probablemente por la isquemia intestinal que tiene lugar durante el ejercicio. En el estudio, paralelamente a este aumento no concurría una elevación en la concentración de la troponina I34. Por todo ello, es un marcador con una especificidad diagnóstica inaceptable, del 13,6%35.
Hay discrepancias en cuanto a su valor pronóstico en el síndrome coronario agudo, y se han publicado trabajos a favor36 y en contra35,37.
Se han descrito modificaciones estructurales en forma de deleción del dipéptido aminoterminal en la albúmina de varios pacientes. Estos cambios han sido la causa de falsos positivos para la medida de la albúmina modificada por isquemia. Se desconoce la prevalencia de estas deleciones en la población. Asimismo, también se han descrito circunstancias que pueden modificar este extremo in vivo (como la concentración de lactato, la acidosis y la presencia de radicales libres) e in vitro (almacenamiento del plasma a 30°C)38,39. Se debe interpretar con cautela los resultados de la concentración de este nuevo marcador en pacientes con concentraciones bajas de albúmina, ya que se ha observado una correlación negativa entre ambas mediciones38,40. Si se emplea un índice que relaciona la concentración de la albúmina modificada por isquemia con la de la albúmina plasmática, la sensibilidad diagnóstica aumenta del 93,0 al 98,4%41.
El principio de medida usado para la albúmina modificada por isquemia es la espectrometría de absorción molecular UV-visible. Cuando hay albúmina modificada en el suero, ésta no es capaz de unirse al cobalto añadido. El cobalto libre se une a ditiotreitol y se forma un complejo coloreado. El procedimiento se ha automatizado en diversos analizadores. Actualmente se está desarrollando un inmunoanálisis19,28.
Proteína fijadora de ácidos grasos-HEsta proteína se une a ácidos grasos de cadena larga, de forma reversible y no covalente. Tiene un peso molecular de 15kDa y entre 126 y 137 aminoácidos. Su estructura es parecida a un bivalvo, y el ácido graso se fija entre las dos valvas. Se han descrito nueve isoformas, cada una con un patrón característico de distribución en un tejido. Se sintetizan en tejidos con metabolismo activo para los ácidos grasos, entre otros, corazón, hígado e intestino42.
La isoforma H se sintetiza principalmente en el corazón, pero también en el músculo esquelético, las células tubulares distales del riñón, el cerebro, la mama y la placenta. Se encuentra en muy baja concentración en el plasma, y su origen es muscular. Se elimina por vía renal, por lo que su uso en caso de insuficiencia renal queda limitado. Hay variaciones por edad y sexo. Como la mioglobina, es una proteína de localización citosólica, de bajo peso molecular. Probablemente por ello se libera más rápidamente que las proteínas fijadas estructuralmente, como es el caso de las troponinas cardíacas. Su concentración celular es más alta que la de la mioglobina y las troponinas cardíacas. Por este motivo su concentración plasmática tras un infarto agudo de miocardio se eleva más que la de los otros marcadores antes referidos. Análogamente a la mioglobina, tiene una concentración máxima a las 8h de los síntomas y vuelve a los valores de referencia en menos de 36h43.
Es un marcador de necrosis de utilidad en el diagnóstico precoz del infarto agudo de miocardio (en las primeras 12h tras la aparición de los síntomas). Su sensibilidad diagnóstica oscila en un 69,0–97,6%. En el mismo período la sensibilidad de la mioglobina es de un 85,4–88,6%, y la de la isoenzima 2 de la creatina-cinasa, un 18,6–96,7%44–47. La proteína fijadora de ácidos grasos-H es más sensible en las primeras 6h que la troponina T46. La especificidad diagnóstica descrita en el período citado es de un 38,5-74% para la proteína fijadora de ácidos grasos-H, el 23,1% para la troponina T, un 34,6–57,1% para la mioglobina y el 98,0% para la isoenzima 2 de la creatina-cinasa44,45,47. Se ha descrito un área bajo la curva de rendimiento diagnóstico significativamente mejor para la proteína fijadora de ácidos grasos-H (0,921) que para la mioglobina y la isoenzima 2 de la creatina-cinasa (0,843 y 0,654 respectivamente)44. La proteína fijadora de ácidos grasos-H puede ayudar a detectar un daño cardíaco pero, dada su discreta especificidad diagnóstica, no se puede usarla como único marcador para descartar un infarto47.
Tal como sucede con la mioglobina, en la revascularización tras una trombólisis efectiva, la concentración plasmática de la proteína fijadora de ácidos grasos-H llega a un valor máximo a las 4h de la revascularización y vuelve a los valores de referencia en menos de 24h. Por ello tiene utilidad en la valoración precoz de la efectividad del tratamiento48,49. Este rápido descenso a concentraciones fisiológicas también la hace propicia para la detección de un reinfarto que tiene lugar en las 10h posteriores al infarto primario50 y para la detección de infartos en intervenciones quirúrgicas cardíacas51.
Recientemente se han descrito cocientes de probabilidades positivos entre 1,6 y 4,5 para evoluciones adversas en los 10 meses posteriores a un síndrome coronario agudo, como son la insuficiencia cardíaca, el infarto o la muerte52. Probablemente, la proteína fijadora de ácidos grasos-H se libera en el curso del remodelado del ventrículo izquierdo que tiene lugar tras un daño cardíaco. Este hecho la convierte en un marcador prometedor para el pronóstico de pacientes con insuficiencia cardíaca: en el pronóstico de un evento cardíaco recurrente en los siguientes 90 días, se ha descrito un valor predictivo para un resultado negativo del 81%. Este valor fue del 57% para la troponina I53. Incluso se ha descrito que es mejor marcador que la troponina T (área bajo la curva de rendimiento diagnóstico para la proteína fijadora de ácidos grasos-H, 0,779; troponina T, 0,581)54. También es de utilidad para predecir la evolución clínica de pacientes hipertensos con valvulopatías aórticas entre leves y moderadas55 (tabla 1).
Un estudio ha arrojado dudas sobre la habilidad como marcador exclusivo de necrosis, al describir que puede elevarse también en caso de isquemia cardíaca56.
Actualmente no existe un procedimiento de medición estandarizado ni materiales de referencia certificados para la proteína fijadora de ácidos grasos-H. En el mercado hay varios procedimientos para medir este marcador, aunque pocos se adaptan a un laboratorio de urgencias, ya que la mayoría son enzimoinmunoanálisis. Se han comercializado particuloinmunoanálisis automatizados con micropartículas de látex. El calibrador empleado suele ser una proteína fijadora de ácidos grasos-H recombinante equivalente a la aislada en muestras de tejidos43,57,58.
Ligando soluble CD40El sistema «receptor CD40-ligando soluble CD40» se expresa en muchas células, entre las que se encuentran las endoteliales, las células del músculo liso y también las plaquetas activadas. Éstas liberan la forma soluble, mientras que los linfocitos T CD4 positivos, los basófilos y los mastocitos la expresan en su superficie. La unión de la forma soluble con el receptor de los linfocitos B lleva a su proliferación, adhesión y diferenciación. La unión con el receptor en las células endoteliales tiene efectos proinflamatorios y promueve la coagulación al inducir la expresión del factor tisular en los monocitos y las células endoteliales. Esta misma unión origina la liberación de metaloproteinasas que desestabilizan la placa aterosclerótica y conducen a una trombosis coronaria. El descubrimiento de que las plaquetas expresan este sistema ha cambiado la idea de que éstas tenían un papel exclusivo en la coagulación y la trombosis y ha elucidado su participación activa en la inmunidad y la inflamación. Además se ha puesto en evidencia la importante contribución que tiene el ligando CD40 en la fisiopatología del síndrome coronario agudo59,60.
El ligando soluble CD40 está elevado en enfermedades inflamatorias y enfermedades autoinmunes, la esclerosis múltiple, la diabetes mellitus y la hipercolesterolemia y por ello es un marcador inespecífico19.
La mayor utilidad de esta proteína es que permite la individualización del tratamiento: los pacientes con una concentración plasmática elevada que son tratados con antagonistas de receptores de las glucoproteínas IIb/IIIa reducen de 2,71 a 0,37 su riesgo de sufrir un infarto o muerte en los siguientes 6 meses11,59.
En cuanto a su utilidad pronóstica, se han descrito cocientes de probabilidades positivos modestos (1,8–1,9) para una evolución a infarto o muerte en los 10 meses siguientes a un síndrome coronario agudo. Tan sólo una combinación con la troponina I logra aumentar el riesgo relativo a 4,3–12,161. En la mujer se ha hallado un cociente de probabilidades positivo de 3,3 asociado a una mala evolución en los siguientes 4 meses62. Un estudio reciente concluye que no hay relación entre una concentración plasmática elevada del ligando y las dos evoluciones adversas antes citadas63 (tabla 1).
Actualmente, a pesar de que se comercializan varios enzimoinmunoanálisis, no está descrito un principio de medida estandarizado ni materiales de referencia certificados para el ligando soluble CD4019,64.
MieloperoxidasaLa mieloperoxidasa (EC 1.11.1.7) es una enzima prooxidante que forma parte del sistema inmunitario innato. Se almacena en los neutrófilos, los monocitos y algunos macrófagos tisulares. En el curso de una inflamación, estas células se activan y liberan la enzima en el foco inflamatorio, con lo que se forman especies reactivas de oxígeno65. No obstante, la enzima puede tener efectos perjudiciales en la pared arterial66. Se han hallado evidencias a favor de la activación y la desgranulación de los leucocitos en pacientes con angina inestable67. Además, la concentración de mieloperoxidasa se encuentra más elevada en los leucocitos y la sangre de los pacientes con enfermedad cardiovascular68. Los neutrófilos y los macrófagos se encuentran más frecuentemente en placas de pacientes con angina inestable o infarto agudo de miocardio, y expresan en mayor cuantía esta enzima65. La mieloperoxidasa utiliza como sustrato el óxido nítrico, sustancia con propiedades ateroprotectoras66. Contribuye a la peroxidación de los lípidos y a la conversión de las lipoproteínas de baja densidad a una forma más aterogénica, de manera que son captadas por los macrófagos, que a su vez sufren cambios morfológicos y se convierten en células espumosas. Del mismo modo, oxida las lipoproteínas de alta densidad y reduce su capacidad de captación de colesterol y, por lo tanto, su posterior eliminación vía biliar66. Existen numerosas hipótesis que tratan de dilucidar el mecanismo por el que los leucocitos y los macrófagos tisulares inciden en la estabilidad de la placa, y la mieloperoxidasa parece jugar un papel importante. En definitiva, esta enzima activa reacciones en cascada de proteasas que afectan directamente a la estabilidad y la trombogenicidad de la placa67. Por otra parte, la mieloperoxidasa se ha relacionado con la inhibición de la función del endotelio microvascular que tiene lugar en la isquemia del miocardio humano69.
La principal utilidad clínica de la mieloperoxidasa estriba en la estratificación de riesgo del paciente con síndrome coronario agudo. Este paciente tiene mayor incidencia de infarto agudo de miocardio o mortalidad en los siguientes 30 días a 6 meses si presenta concentraciones altas de mieloperoxidasa (cocientes de probabilidades positivos, 2,25–4,7). En los pacientes con troponina T no detectable, estos cocientes son mayores, entre 4,4 y 7,4867,70. Para el pronóstico de mortalidad en los siguientes 5 años, se ha descrito un cociente de 1,871. En la predicción de un infarto o muerte en pacientes que sufren un infarto con elevación del segmento ST, se ha descrito un área bajo la curva de rendimiento diagnóstico de 0,62, cifra algo inferior a la hallada para el fragmento aminoterminal del propéptido natriurético cerebral (0,72). El cociente de probabilidades positivo hallado para la mieloperoxidasa es de 6,9172. Recientemente se ha publicado un estudio en el que no se ha hallado ninguna relación entre una concentración elevada de mieloperoxidasa y una mayor mortalidad, aunque sí con episodios cardíacos recurrentes a los 4 meses63 (tabla 1).
También se ha publicado sobre el uso de la mieloperoxidasa en la prevención primaria un cociente de probabilidades positivo de 1,36 para el desarrollo de enfermedad cardiovascular en individuos sanos73.
La activación de los neutrófilos y macrófagos puede tener lugar en enfermedades infecciosas e inflamatorias, por lo que el uso de esta proteína como marcador se asocia a una especificidad diagnóstica limitada. Por otra parte, la deficiencia en mieloperoxidasa, que se hereda como rasgo autosómico recesivo con una prevalencia de 1:2.000, podría afectar negativamente a su sensibilidad diagnóstica19,74.
Los polimorfismos que poseen los alelos –638C>A y V53F en las regiones 5′ no codificante y codificante del gen MPO se asocian con una mayor actividad mieloperoxidasa, por lo que éstos podrían ser determinantes genéticos para el riesgo de padecer enfermedad cardiovascular75.
Las estatinas disminuyen la concentración plasmática de la proteína C reactiva y la mieloperoxidasa en pacientes con síndrome coronario agudo, hecho que puede explicar los beneficios que experimentan los pacientes tratados con este grupo de medicamentos76. Asimismo, en un experimento realizado en cerdos, se ha probado que la administración de un antagonista del receptor de endotelina disminuye el tamaño del infarto. El efecto cardioprotector de esta sustancia se debe a una inhibición de la acumulación de los leucocitos en el miocardio o inhibición de su activación. Tal inhibición se manifiesta por una disminución en la actividad mieloperoxidasa77.
Actualmente no existe un principio de medida estandarizado ni hay materiales de referencia certificados para la mieloperoxidasa. Existen varios enzimoinmunoanálisis y recientemente se ha comercializado un quimioluminoinmunoanálisis automatizado64,67,78.
Proteína C reactivaLa inflamación tiene un papel fundamental en todas las etapas de la enfermedad cardiovascular, desde el inicio hasta las complicaciones trombóticas. Por ello, los mediadores de inflamación son unos candidatos prometedores a ser marcadores de esta enfermedad. La proteína C reactiva es probablemente el marcador de inflamación mejor conocido. Desde 1944 se sabe que el plasma de los pacientes que han sufrido un infarto agudo de miocardio presenta una alta concentración de proteína C reactiva79, pero más que la elevación que la concentración de la proteína C reactiva pueda sufrir por la respuesta inflamatoria tras una necrosis cardiaca, interesa su elevación antes de esta necrosis. La concentración de proteína C reactiva se halla más elevada en los pacientes con angina inestable que en los pacientes con angina estable80. Una posible hipótesis al respecto es que la inflamación que subyace en la enfermedad cardiovascular se exacerba en el síndrome coronario agudo y se desestabilizan las placas vulnerables11.
El papel de la proteína C reactiva puede ir más allá de ser un simple mediador de la inflamación, para ejercer un papel proaterogénico. Por este motivo ha sido uno de los componentes biológicos más estudiados en la enfermedad cardiovascular81. La proteína C reactiva se expresa en las lesiones ateroscleróticas, y hay evidencia de que se produce en las células musculares lisas y los macrófagos del ateroma. No obstante, el hecho de que se halle en la placa no implica que sea un agente causal. Diferentes trabajos le han atribuido propiedades proinflamatorias ligadas a la aterosclerosis, como son la inducción de la expresión monocítica de moléculas de adhesión intracelular y vascular del endotelio. También la disminución de la concentración de la óxido nítrico sintasa y la prostaciclina en las células endoteliales, aumentando a su vez la concentración de endotelina 1 (sustancias que regulan la vasodilatación arterial). Además, los monocitos expuestos a la proteína C reactiva aumentan la liberación del factor tisular, estimulando la migración celular y la adhesión a las células endoteliales y la adhesión de lipoproteínas de baja densidad oxidadas. No obstante, se ha puesto en duda estos estudios, pues tales acciones también son atribuibles a otras sustancias inflamatorias presentes en el estudio que contaminaban la proteína C reactiva usada, como el lipopolisacárido bacteriano o la acida. Otro grupo de trabajos que han atribuido un papel proaterogénico a la proteína C reactiva son los que han tratado a esta proteína como objetivo terapéutico. Tal como ya se ha indicado anteriormente, las estatinas reducen sustancialmente la concentración de proteína C reactiva. En los pacientes tratados con este grupo de fármacos, la reducción se ha correlacionado con una disminución del riesgo de sufrir accidentes coronarios graves y ha resultado ser independiente de la concentración del colesterol de las lipoproteínas de baja densidad82–84.
La proteína C reactiva predice, independientemente de otros marcadores, la evolución a corto y largo plazo en pacientes que han sufrido un síndrome coronario agudo sin elevación del segmento ST12. Los cocientes de probabilidades positivos hallados son muy dispares: 0,17–150 para la evolución a corto plazo, y 1,02–157 a largo plazo. La asociación entre concentraciones altas de proteína C reactiva es más fuerte con el riesgo de muerte que con el de eventos cardíacos recurrentes11,85. Tal como sucedía con la mieloperoxidasa, la concentración de proteína C reactiva puede estar elevada sin que lo esté la de troponina T; esta alta concentración es pronóstica de una mala evolución en las siguientes 2 semanas86 y en los siguientes 37 meses87 (tabla 1).
Un aspecto interesante que tener en cuenta es que, dado que la proteína C reactiva se eleva tras la necrosis, resulta especialmente importante conocer el momento en que se realiza la toma de muestra para establecer un pronóstico correctamente. Se ha publicado que ese momento debe ser lo más cercano posible al inicio de los síntomas88.
La proteína C reactiva es un marcador de riesgo ya conocido en la prevención primaria de la enfermedad cardiovascular. Se han publicado numerosos estudios que demuestran una asociación significativa entre concentraciones plasmáticas elevadas del marcador y el riesgo de un primer evento cardiovascular o de un evento cardiovascular recurrente en los pacientes con una enfermedad cardiovascular ya establecida82.
El principio de medición para la proteína C reactiva es la inmunoturbidimetría y la inmunonefelometría, y en el mercado hay muchos procedimientos de medida automatizados. La mayoría de ellos tienen un límite de detección entre 3 y 8mg/l, por lo que no son útiles para predecir el riesgo cardiovascular. Algunos procedimientos emplean un anticuerpo unido a una micropartícula de látex. El tamaño de esta partícula puede estar aumentado a fin de mejorar la sensibilidad metrológica, con lo que se logra medir esta proteína por debajo de 0,3mg/l. Comúnmente, la medida de esta proteína se califica entonces de ultrasensible. Los estándares de todos estos procedimientos deben estar calibrados respecto al material de referencia certificado CRM 47089.
Péptidos natriuréticosSe han identificado cuatro péptidos natriuréticos: dos de origen cardíaco (atrial o A, y cerebral o B), uno de origen endotelial (tipo C) y el péptido tipo D aislado recientemente en serpientes. El péptido natriurético cerebral (BNP) se sintetiza como una preprohormona de 134 aminoácidos (pre-proBNP). Un estiramiento en la pared ventricular activa la escisión de este péptido formándose el propéptido natriurético cerebral (proBNP), de 108 aminoácidos. Éste es sustrato de una proteasa que lo descompone en su forma activa de 32 aminoácidos (BNP) y un fragmento aminoterminal de 76 aminoácidos (NT-proBNP) en una proporción de 1:1. La semivida de este último fragmento es unas 15 veces mayor que la del péptido natriurético cerebral. Ambas sustancias se liberan en mayor cantidad que el péptido natriurético atrial y su fragmento correspondiente en caso de enfermedad, por lo que se han utilizado más como marcadores cardíacos90. El péptido natriurético cerebral se libera mayoritariamente por el miocardio ventricular, aunque su origen puede ser auricular según la cardiopatía91. Su secreción ejerce acciones fisiológicas beneficiosas como una vasodilatación equilibrada, natriuresis e inhibición del sistema nervioso autónomo simpático y del sistema renina-angiotensina-aldosterona92.
El aumento de presión en el ventrículo izquierdo y el incremento de su diámetro que tienen lugar en el remodelamiento tras un infarto estiran la pared de esta cavidad, con lo que aumenta en el plasma la concentración de los péptidos natriuréticos. Pero hay evidencia de que también una isquemia miocárdica puede llevar a este aumento, aunque no se produzca una necrosis. Al parecer, una isquemia transitoria aumentaría el estrés en la pared induciendo la síntesis y liberación proporcionalmente a la extensión de la zona afectada92.
El péptido natriurético cerebral identifica a los pacientes con un síndrome coronario agudo sin elevación del segmento ST que tienen mayor riesgo de morir a corto (para 1 semana se ha descrito un cociente de probabilidades positivo 2,5), medio (para 6 meses un cociente de probabilidad 8,4; para 10 meses, 5,8) y largo plazo (para 3 años, un cociente de 3,6–4,9). También se ha establecido un valor pronóstico para un infarto nuevo o recurrente o insuficiencia cardíaca, aunque este valor es más débil93–96. Tal como sucedía con otros marcadores, este péptido puede tener una concentración plasmática elevada en pacientes con una concentración plasmática normal de troponina cardíaca16. A su vez, el fragmento aminoterminal del propéptido natriurético cerebral es un indicador de la mortalidad: a) a corto término, los pacientes que murieron en las 6 semanas siguientes al síndrome coronario agudo tenían mayor concentración que los que sobrevivieron97; b) también a medio término: para 1 año se ha descrito un cociente de probabilidades positivo de 19,2, y c) largo término: para 4 años, un cociente de probabilidades positivo de 3,0 en pacientes con angina inestable, 5,6 en pacientes con un síndrome coronario agudo sin elevación del segmento ST y 4,7 en pacientes con infarto y elevación de ST96,98 (tabla 1).
Al contrario que otros marcadores, los péptidos natriuréticos se asocian a otros factores de riesgo de mala evolución, como edad avanzada, función renal deteriorada, la presencia de arritmias cardíacas y la existencia previa de una disfunción del ventrículo sistólica o diastólica. No obstante, esta asociación logra integrar en un único marcador diferentes factores de riesgo. En realidad, el marcado valor pronóstico de estos péptidos está relacionado con su baja especificidad98.
Los péptidos natriuréticos se utilizan en el diagnóstico de la insuficiencia cardíaca, ya sea debido a una disfunción ventricular izquierda sistólica o diastólica. Para esta enfermedad posee una sensibilidad diagnóstica del 90% y, dado su alto valor predictivo para un resultado negativo (96%), una concentración baja prácticamente excluye una insuficiencia cardíaca99. En 2004, un comité de expertos publicó una declaración de consenso en la que se emitieron recomendaciones en cuanto al uso del péptido natriurético cerebral en el diagnóstico, el pronóstico, la detección, la monitorización del tratamiento y como agente terapéutico en las enfermedades cardiovasculares100.
Los principios de medida para los péptidos natriuréticos son el enzimoinmunoanálisis, el radioinmunoanálisis, el fluoroinmunoanálisis y el quimioluminoinmunoanálisis. Para ambos péptidos las características metrológicas, el anticuerpo usado y la estandarización de los procedimientos de medida actualmente disponibles en el mercado son diferentes. Por lo tanto, no hay materiales de referencia certificados para ninguno de los dos marcadores. Dado que el laboratorio propietario de la licencia de fabricación del reactivo empleado en la medición del fragmento aminoterminal ha autorizado la fabricación a otros laboratorios, los reactivos son equivalentes y los resultados obtenidos deberían estar armonizados. Si bien los procedimientos de medida disponibles comercialmente para el péptido natriurético cerebral utilizan distintos pares de anticuerpos y diferentes calibradores, al menos los reactivos comercializados por dos laboratorios distintos presentan resultados comparables. Recientemente se ha descrito que el propéptido natriurético cerebral interfiere sustancialmente en la medición de la concentración del péptido natriurético cerebral en varios procedimientos. A su vez, el mismo propéptido interfiere de igual forma en la medición de la concentración del fragmento aminoterminal del propéptido. La Federación Internacional de Química Clínica ha establecido las especificaciones de calidad que deberían cumplir los laboratorios fabricantes de reactivos64,101–103.
Uso de paneles de marcadoresEl síndrome coronario agudo es una entidad clínica compleja en la que intervienen varios factores contribuyentes: ruptura de placa con trombosis aguda, obstrucción mecánica progresiva, inflamación, angina inestable secundaria y vasoconstricción coronaria. En cada paciente el peso específico de estos factores puede variar sustancialmente. La identificación de los más determinantes puede contribuir significativamente a establecer la estrategia terapéutica más adecuada. Asimismo, el riesgo a padecer eventos cardíacos futuros y el de morir también varían en función de la extensión de la necrosis miocárdica, las consecuencias hemodinámicas del infarto y la extensión de la enfermedad cardiovascular13. La aparición de nuevos marcadores que ponen de manifiesto la inflamación, la desestabilización de la placa, su ruptura, la isquemia, la necrosis miocárdica y su disfunción permite identificar la contribución de cada uno de estos procesos en el síndrome coronario agudo19.
Diversos autores han apuntado a la conveniencia de emplear paneles de marcadores en el síndrome coronario agudo. Para el pronóstico de este síndrome, el panel debería combinar un marcador de necrosis cardiaca (troponinas) con uno de estrés hemodinámico (péptidos natriuréticos) o de inflamación (proteína C reactiva). Una concentración elevada de un péptido natriurético o de proteína C reactiva indica un mal pronóstico, aunque no concurra una elevación de la concentración de las troponinas cardíacas13,85–87. Otro posible panel es el que incluye las tres proteínas a la vez: se ha publicado que el riesgo de morir en los siguientes 30 días que un paciente tiene se multiplica por 2 ante la concentración elevada de una ellas, por 5 si son dos las elevadas y por 13 si son las tres. Para otras evoluciones como el infarto agudo de miocardio o la insuficiencia cardíaca en los siguientes 30 días a 10 meses, se han obtenido resultados similares104. La mieloperoxidasa también es un marcador de desestabilización de la placa que tener en cuenta para su uso en el panel junto con una troponina cardíaca67,70. En la actualidad no existen recomendaciones sobre qué intervención debe tener el clínico ante un resultado elevado de la concentración plasmática de un péptido natriurético, proteína C reactiva o mieloperoxidasa, contrariamente a lo que sucede para las troponinas cardíacas. Probablemente en un futuro próximo se defina esta actitud13.
En el diagnóstico del síndrome coronario agudo o la exclusión de este diagnóstico, el panel debería incluir un marcador de isquemia (albúmina modificada por isquemia) y uno de necrosis miocárdica (troponina cardíaca)11,29–32.
ConclusionesActualmente la aplicación clínica de los marcadores del síndrome coronario agudo ya no se limita a confirmar o excluir una necrosis del miocardio. Estos marcadores proporcionan conocimiento de forma no invasiva sobre la causa y las consecuencias de este síndrome para establecer el riesgo de eventos recurrentes y constituyen el objetivo de terapias específicas16.
En el diagnóstico del síndrome coronario agudo, la albúmina modificada por isquemia tiene interés si se usa conjuntamente con alguna de las troponinas cardíacas y el electrocardiograma para descartar la presencia de este síndrome. La proteína fijadora de ácidos grasos-H es un marcador de necrosis de utilidad en el diagnóstico precoz del infarto agudo de miocardio, y es más sensible en las primeras horas que la troponina T, la mioglobina y la isoenzima 2 de la creatina cinasa.
En cuanto al pronóstico de este síndrome, las troponinas cardíacas siguen proporcionando una valiosa información. No obstante, la proteína C reactiva, los péptidos natriuréticos y la mieloperoxidasa complementan el valor pronóstico de aquéllas. Además de las troponinas cardíacas, el ligando soluble CD40 permite la clasificación y la individualización del tratamiento del síndrome coronario agudo.
Actualmente no hay suficiente evidencia para que ningún nuevo marcador sustituya a los que recomiendan las guías de práctica clínica de las sociedades científicas. Por otra parte, no se dispone de procedimientos compatibles con la urgencia médica para algunos de ellos. El uso de paneles fruto de la combinación de los marcadores ya establecidos y los emergentes puede aumentar significativamente el gasto sanitario. Por ello, la implementación de estos paneles debe hacerse utilizando la evidencia científica disponible y tomando como objetivo su contribución a una mejor evolución del paciente13.