En medicina de laboratorio, una interferencia se define como la causa de un sesgo clínicamente significativo en la medición de una magnitud biológica, debido al efecto que ejercen en la medida otros componentes de la muestra o una propiedad de la misma1.
Si la interferencia es producida por un componente de la muestra, se trata de una magnitud de influencia, definida como aquella magnitud que en una medición directa no afecta a la magnitud objeto de la medición, pero que afecta a la relación entre la señal y el resultado de la medición2.
Las magnitudes de influencia pueden ser una fuente de error significativo en las mediciones del laboratorio. Su presencia genera un error sistemático, que puede ser dependiente tanto de la concentración de la magnitud de influencia como de la del objeto de la medición.
Las magnitudes de influencia se clasifican en endógenas y exógenas. Las endógenas son las que están presentes en una muestra en condiciones fisiológicas o patológicas, mientras que las exógenas son componentes ajenos al organismo, como, por ejemplo, fármacos o sus metabolitos, sustancias tóxicas diversas, soluciones parenterales, productos dietéticos, de herboristería, etc. También deben considerarse, como posibles magnitudes exógenas de influencia, los aditivos presentes en los tubos de recogida de muestra (anticoagulantes, activadores de la coagulación, gel y estabilizadores), así como la contaminación que se pueda producir durante los procesos preanalítico y analítico.
El efecto de una interferencia puede dar lugar a un diagnóstico clínico erróneo y a la realización de análisis o exploraciones adicionales inapropiadas, así como a la aplicación de tratamientos innecesarios o potencialmente desfavorables para el paciente3.
En el proceso de validación de los procedimientos de medida, las empresas del diagnóstico in vitro están obligadas por la Directiva Europea 98/79/CE4 a realizar el estudio de las sustancias interferentes que con más probabilidad pueden afectar a la medición de una magnitud. Es responsabilidad del fabricante comunicar toda la información relacionada con las características analíticas de sus procedimientos.
Existen diferentes razones que pueden llevar al laboratorio clínico a realizar un estudio de interferencias: verificar la existencia de una interferencia basada en información obtenida en la bibliografía, evaluar la presencia de una sustancia interferente en la medición de una magnitud, entre otras5,6.
La norma ISO 15189-20137 especifica que el laboratorio debe documentar, cuando proceda, las interferencias analíticas conocidas de un procedimiento de medida.
Objeto y campo de aplicaciónEl objeto de este documento es proporcionar un diseño experimental para el estudio de las interferencias exógenas.
El campo de aplicación es el estudio de interferencias exógenas en magnitudes con valores escalares o cuantitativos. También puede ser aplicable a magnitudes ordinales.
Este documento no es aplicable al estudio de algunas interferencias debidas a componentes endógenos, como, por ejemplo, las interferencias producidas por paraproteínas, anticuerpos heterófilos, autoanticuerpos y anticuerpos humanos antianimal, en algunos sistemas de medida basados en inmunoanálisis. Tampoco es aplicable al estudio de interferencias por contaminación de la muestra por arrastre. El estudio de este tipo de interferencias requiere de otros protocolos que pueden diferir del expuesto en este documento.
Para las interferencias endógenas debidas a hemólisis, ictericia y turbidez de la muestra, la Comisión de Metrología y Sistemas Analíticos ha publicado un documento para su estudio específico8.
El diseño experimental propuesto en este documento está basado en parte en el documento EP7-A21 del Clinical and Laboratory Standards Institute (CLSI) y es una actualización del documento publicado por la Comisión de Interferencias y Efectos de los Medicamentos en el año 19929.
Cuestiones previas al estudioDiversas circunstancias pueden llevar a sospechar de la existencia de una interferencia en la medición de una magnitud: la observación de un resultado aberrante o discrepante respecto a un resultado previo del mismo individuo, una discordancia entre los resultados obtenidos por dos procedimientos de medida para una muestra determinada o una discrepancia entre el resultado y el diagnóstico o el curso clínico.
Antes de atribuir un resultado anómalo a la presencia de algún interferente exógeno, es conveniente revisar todas las variables que puedan originarlo y realizar una serie de acciones:
- •
Repetir la medición y descartar que la causa sea un error aleatorio o un error en el procesamiento de la muestra.
- •
Diluir y reprocesar la muestra. La existencia de diferencias significativas entre el resultado de la muestra diluida (multiplicado por el factor de dilución), y el de la muestra sin diluir, puede indicar la presencia de una interferencia.
- •
Si se tiene disponibilidad, procesar la muestra con un sistema de medida diferente al utilizado.
- •
En el caso de sospechar que la muestra es inadecuada por un posible error preanalítico, considerar la posibilidad de solicitar una nueva muestra y repetir la medición de la magnitud.
- •
En el caso de que sea posible, revisar la historia clínica del paciente, los resultados previos y las prescripciones médicas recientes. Una intervención clínica específica, un cambio o una tendencia en el estado de salud del paciente pueden ser la respuesta al resultado obtenido.
- •
Consultar la literatura en busca de posibles sustancias interferentes que puedan afectar al procedimiento de medida.
- •
Contactar con el fabricante para conocer si ha recibido informaciones parecidas y solicitar su colaboración.
El estudio se basa en la comparación del valor de una magnitud en una muestra sin sustancia interferente, con los valores de dicha magnitud obtenidos cuando se adicionan a la muestra concentraciones crecientes y conocidas de interferente.
El procedimiento de trabajo descrito permite estimar la concentración de la sustancia interferente a partir de la cual se produce la interferencia.
Debido a que la interferencia puede depender de la concentración del analito, el estudio ha de realizarse, al menos, a dos concentraciones diferentes del mismo, siendo una de ellas próxima a los valores de decisión clínica.
En la valoración de la existencia de una interferencia, cada laboratorio debe definir el límite de error máximo admisible a utilizar de acuerdo con sus criterios de calidad y para cada magnitud en particular10. En la industria del diagnóstico in vitro es habitual establecer un intervalo de error relativo máximo admisible de ±10%11,12. Este último criterio ha sido el utilizado en este documento, tanto en la descripción del procedimiento de estudio como en los ejemplos que se exponen.
Diseño experimentalPreparación de las solucionesEs conveniente conocer la máxima concentración que se espera que pueda alcanzar la sustancia interferente en el organismo, con la finalidad de ajustar el diseño experimental a las condiciones esperadas.
La matriz de las soluciones de trabajo se ha de asemejar lo máximo posible a las muestras de pacientes. Por este motivo, el volumen de la solución del interferente en las soluciones de trabajo no debe ser superior al 5%9.
Preparación de la solución concentrada del interferenteLa sustancia potencialmente interferente debe presentar una elevada pureza y, siempre que se pueda, se ha de emplear la forma que más se asemeje a la presente en el organismo humano. Debería evitarse utilizar preparaciones farmacéuticas, ya que estas pueden contener excipientes y conservantes que alteren los resultados.
Se debe escoger un solvente adecuado, tanto para garantizar la máxima solubilidad de la sustancia interferente como para asegurar su miscibilidad en la matriz donde se realiza el estudio de interferencia. Se ha de verificar que el solvente utilizado no produce interferencias con el procedimiento de medida.
Se debe preparar una solución de la sustancia interferente a una concentración 20 veces mayor que la concentración máxima de interferente a estudiar.
Preparación de la solución baseLa solución base debe ser una mezcla de especímenes biológicos. La selección de dichos especímenes se debe hacer en relación con la concentración de la magnitud que se desee estudiar.
Si el estudio se realiza para conocer la existencia de interferencia en concentraciones fisiológicas de una magnitud, la solución base debe proceder de individuos presuntamente sanos, que no reciban ningún tipo de tratamiento farmacológico.
Cuando el estudio se realiza para conocer si la interferencia se produce en concentraciones patológicas de una magnitud, o sobre la medición de la concentración de un fármaco, se han de seleccionar especímenes de pacientes que cumplan cada una de dichas condiciones.
En cualquiera de las dos situaciones, la solución base debe ser una mezcla de especímenes frescos o debidamente conservados (refrigeración o congelación) para garantizar la estabilidad del analito. No debe contener la sustancia interferente en estudio y no debe estar hemolizada, ni ser ictérica, ni presentar turbidez.
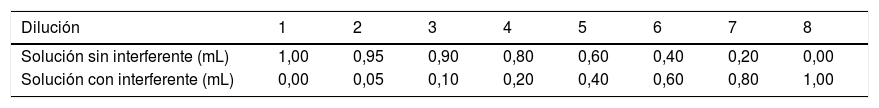
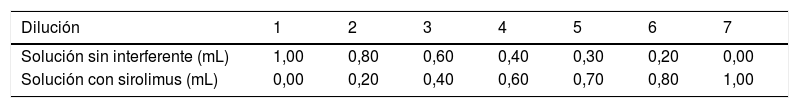
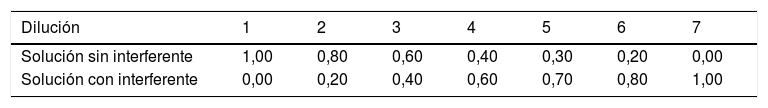
Preparación de las diluciones de interferenteA partir de la solución concentrada del interferente y de la solución base, se preparan 2 soluciones, una sin el interferente y otra con el interferente.
- •
Solución sin interferente: 9,5mL de la solución base+0,5mL del solvente utilizado para la preparación de la solución concentrada de interferente.
- •
Solución con interferente: 9,5mL de la solución base+0,5mL de la solución concentrada del interferente.
A continuación se realizan las diluciones descritas en la tabla 1. En función de las necesidades o limitaciones de algún estudio específico, puede modificarse el número de diluciones y la proporción de la mezcla de soluciones con y sin interferente, aunque se recomienda un número mínimo de 5 diluciones1.
Procedimiento y análisis de los resultados- 1.
Calcular la concentración de sustancia interferente de cada dilución.
- 2.
Medir la concentración del analito en cada dilución, como mínimo por duplicado. Procesar las diluciones de forma aleatoria y en una misma serie analítica.
- 3.
Calcular la media de cada una de las diluciones.
- 4.
Calcular el porcentaje de interferencia [Int (%)] para cada dilución de la siguiente forma:
Int (%)=100×(Cd–C1)/C1siendo Cd la media de concentración del analito en cada dilución con interferente y C1 la media de concentración del analito en la dilución 1, que no contiene el interferente.
- 5.
Preparar una tabla en la que aparezcan en las columnas el número de las diferentes diluciones y en las filas, para cada una de las diluciones, los datos siguientes:
- •
Concentración de la sustancia interferente.
- •
Concentración media obtenida del analito.
- •
Porcentaje de interferencia calculado [Int (%)].
- 6.
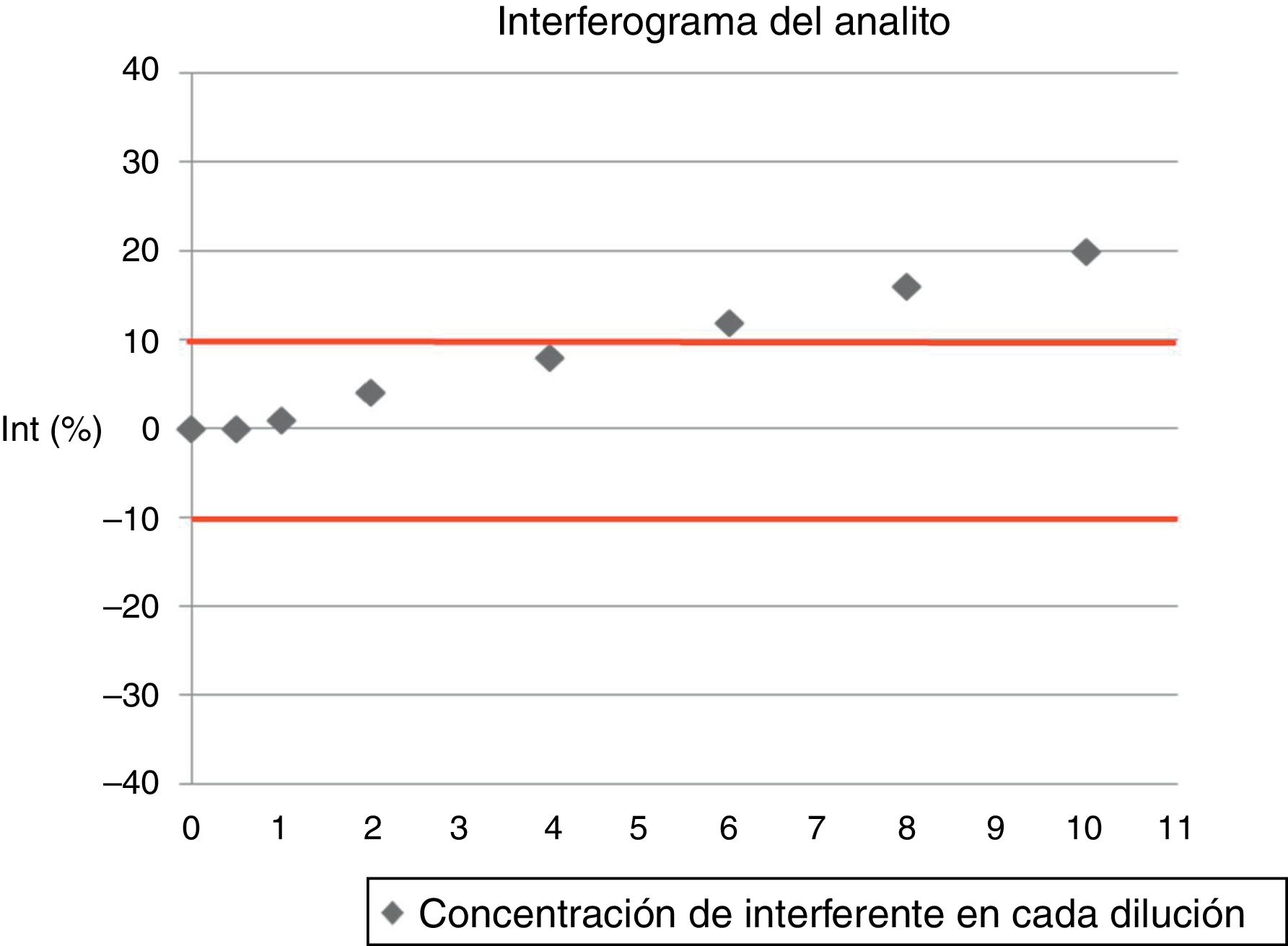
Representar gráficamente en un interferograma (fig. 1) la relación entre el porcentaje de interferencia [Int (%)] y la concentración del interferente.
Figura 1.Ejemplo de un interferograma. Los puntos representan el porcentaje de interferencia [Int (%)] de cada una de las diluciones. El intervalo de error relativo máximo admisible está comprendido entre las 2 líneas rojas. Existe una interferencia a concentraciones de interferente comprendidas entre la dilución 4 y la 6.
(0.09MB). - 7.
Establecer en el interferograma el intervalo de aceptación (intervalo de error máximo admisible) previamente establecido.
- 8.
Evaluar la existencia de interferencia a las diferentes concentraciones de interferente de cada dilución. Establecer la concentración más baja (Ci) del interferente que supera el límite establecido y la de la dilución anterior (Ci-1). Concentraciones del interferente iguales o superiores a Ci interfieren, concentraciones iguales o inferiores a Ci-1 no interfieren. Concentraciones de interferente entre Ci y Ci-1 podrían interferir («zona gris»). La «zona gris» puede reducirse repitiendo el estudio con nuevas diluciones que contengan concentraciones de interferente entre Ci y Ci-1.
En el anexo se proporcionan algunos ejemplos.
Ejemplo 1
Se estudia la posible interferencia del fármaco inmunosupresor sirolimus en la medición de la concentración de everolimus en la sangre, en un sistema de medida que emplea la cromatografía líquida de alta resolución acoplada a la espectrometría de masas en tándem (HPLC-MS/MS).
Preparación de la solución concentrada del interferente (sirolimus)
- a)
Material empleado:
- •
Material de referencia certificado Sirolimus Primary Standard de Cerilliant (Ref: S-015).
- •
Pureza: 98,7%
- •
Formato: un vial que contiene una concentración de sirolimus (en acetonitrilo) de 1,000±0,005g/L.
- b)
Preparación de la solución concentrada del interferente:
- •
Concentración máxima del interferente a estudiar: 50μg/L.
- •
Se prepara una solución acuosa de sirolimus a una concentración de 1,00mg/L a partir del material de referencia certificado.
Preparación de la solución base
La solución base de muestras de pacientes se prepara a partir de una mezcla de sangres de pacientes que han recibido un trasplante renal, que están en tratamiento con everolimus y a los que no se les ha administrado sirolimus. La concentración de everolimus en las muestras está comprendida en el intervalo de 5-10μg/L.
Preparación de las diluciones del interferente:
- •
Solución sin interferente: 9,5mL de la solución base de pacientes+0,5mL de agua.
- •
Solución con interferente: 9,5mL de la solución base de pacientes+0,5mL de la solución concentrada de sirolimus.
A continuación se realizan las diluciones expuestas en la tabla 2.
Resultados
Los resultados obtenidos se muestran en la tabla 3.
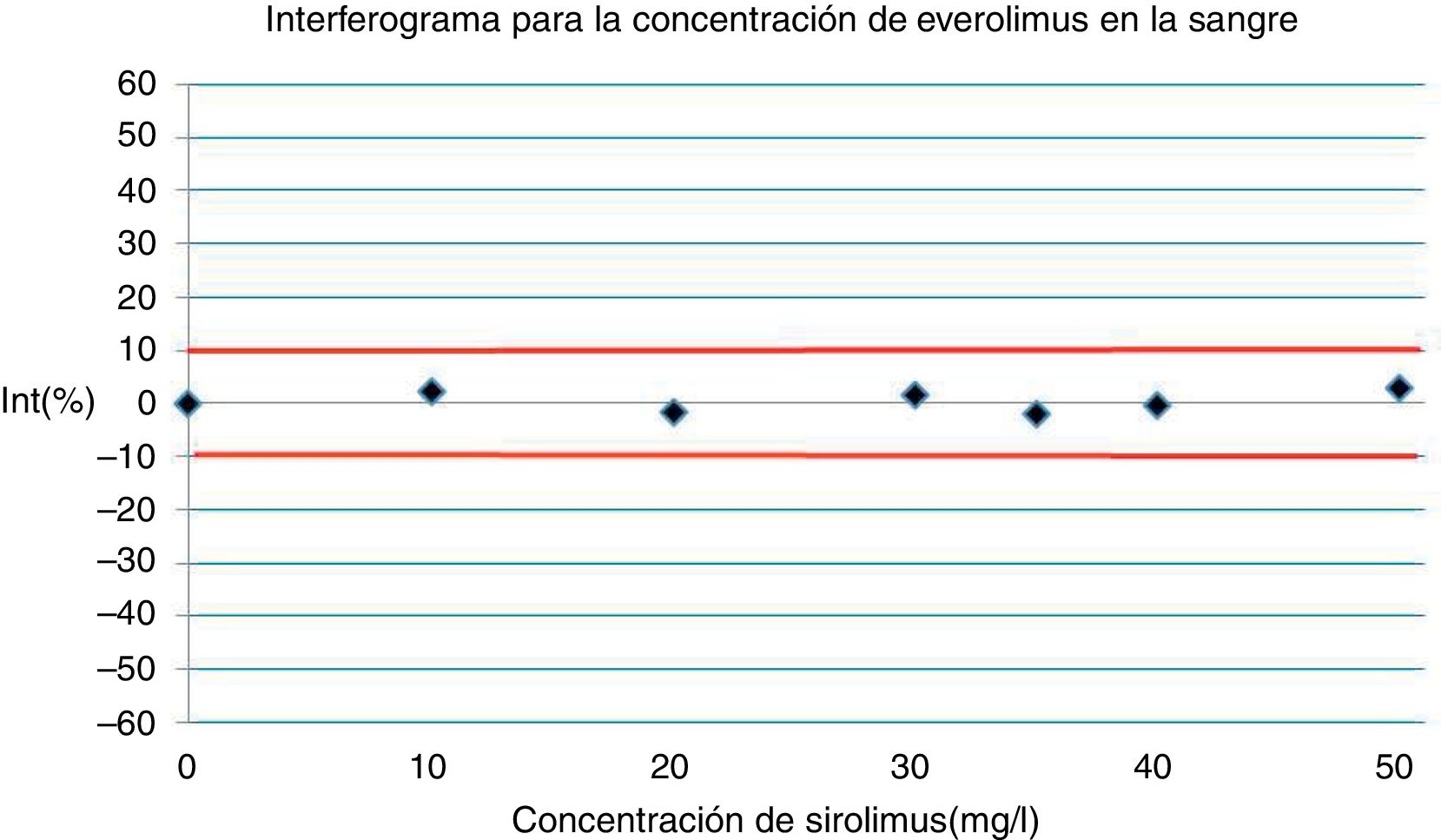
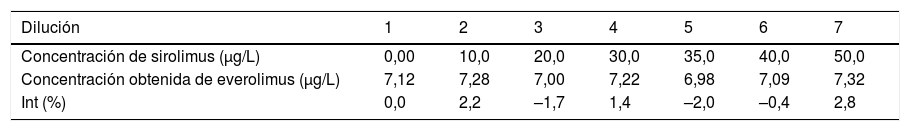
Resultados de la medición de everolimus y cálculo del porcentaje de interferencia para cada una de las diluciones realizadas con el interferente sirolimus
| Dilución | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Concentración de sirolimus (μg/L) | 0,00 | 10,0 | 20,0 | 30,0 | 35,0 | 40,0 | 50,0 |
| Concentración obtenida de everolimus (μg/L) | 7,12 | 7,28 | 7,00 | 7,22 | 6,98 | 7,09 | 7,32 |
| Int (%) | 0,0 | 2,2 | –1,7 | 1,4 | –2,0 | –0,4 | 2,8 |
La representación gráfica de los resultados se muestra en el interferograma (fig. 2), utilizando un intervalo de error relativo máximo admisible de±10%.
A valores≤50μg/L de sirolimus, no se evidencia interferencia de esta sustancia en la medición de la concentración de masa de everolimus en la sangre.
Ejemplo 2
Se estudia la posible interferencia de amoxicilina sobre la medición de la concentración de normetanefrina en la orina en un sistema de medida que emplea la cromatografía líquida de alta resolución con detección electroquímica (HPLC-EQD).
Preparación de la solución del interferente (amoxicilina)
- a)
Material empleado:
- •
Material de referencia certificado Amoxicillin Trihydrate de la Farmacopea Europea (Ref: A0800000).
- •
Pureza: 86,2%.
- •
Formato: un vial que contiene un liofilizado de amoxicilina.
- b)
Preparación de la solución concentrada del interferente:
- •
Concentración máxima del interferente a estudiar: 100mg/L.
- •
Se preparan 5mL de una solución acuosa de amoxicilina a una concentración de 2g/L, pesando 116,28mg del material de referencia certificado y disolviéndolo en 50mL de agua calidad HPLC.
Preparación de la solución base
La solución base de muestras de pacientes se prepara a partir de una mezcla de orinas de pacientes presuntamente sanos y no tratados con amoxicilina, con concentraciones de normetanefrina comprendidas entre 0,5-1,5μmol/L.
Preparación de las diluciones del interferente:
- •
Solución sin interferente: 9,5mL de la solución base de muestras de pacientes+0,5mL de agua.
- •
Solución con interferente: 9,5mL de la solución base de muestra de pacientes+0,5mL de la solución concentrada del interferente (amoxicilina).
Se realizan las diluciones representadas en la tabla 4
Resultados
Los resultados del estudio se muestran en la tabla 5.
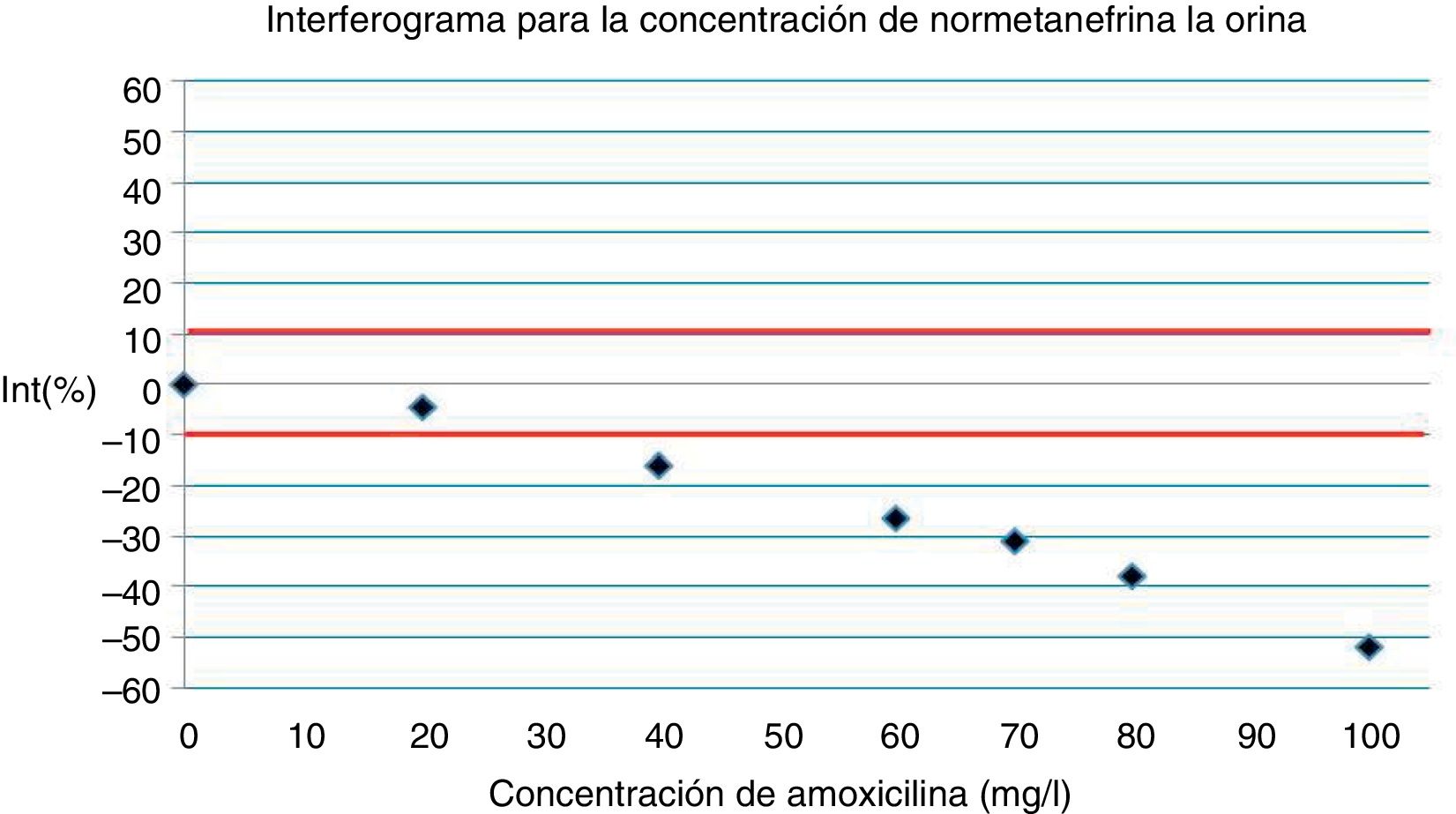
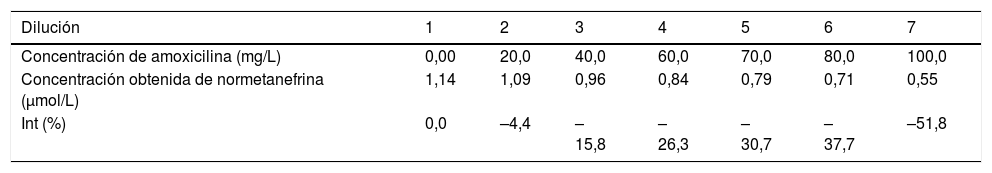
Resultados de la medición de normetanefrina en orina y cálculo del porcentaje de interferencia para cada una de las diluciones realizadas con el interferente amoxicilina
| Dilución | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Concentración de amoxicilina (mg/L) | 0,00 | 20,0 | 40,0 | 60,0 | 70,0 | 80,0 | 100,0 |
| Concentración obtenida de normetanefrina (μmol/L) | 1,14 | 1,09 | 0,96 | 0,84 | 0,79 | 0,71 | 0,55 |
| Int (%) | 0,0 | –4,4 | –15,8 | –26,3 | –30,7 | –37,7 | –51,8 |
La representación gráfica de los resultados se muestra en el interferograma de la figura 3, utilizando un intervalo de error relativo máximo admisible de±10%.
Se concluye que la amoxicilina interfiere en la medición de la concentración de sustancia de normetanefrina en la orina a partir una concentración de amoxicilina comprendida entre 20,0 y 40,0mg/L.




![Ejemplo de un interferograma. Los puntos representan el porcentaje de interferencia [Int (%)] de cada una de las diluciones. El intervalo de error relativo máximo admisible está comprendido entre las 2 líneas rojas. Existe una interferencia a concentraciones de interferente comprendidas entre la dilución 4 y la 6. Ejemplo de un interferograma. Los puntos representan el porcentaje de interferencia [Int (%)] de cada una de las diluciones. El intervalo de error relativo máximo admisible está comprendido entre las 2 líneas rojas. Existe una interferencia a concentraciones de interferente comprendidas entre la dilución 4 y la 6.](https://static.elsevier.es/multimedia/18884008/0000001100000003/v1_201807060854/S1888400817301083/v1_201807060854/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Interferograma mostrando el porcentaje de interferencia [Int (%)] de sirolimus sobre la medición de everolimus en sangre para cada una de las diluciones estudiadas. El intervalo de error relativo máximo admisible está representado por las líneas rojas. Interferograma mostrando el porcentaje de interferencia [Int (%)] de sirolimus sobre la medición de everolimus en sangre para cada una de las diluciones estudiadas. El intervalo de error relativo máximo admisible está representado por las líneas rojas.](https://static.elsevier.es/multimedia/18884008/0000001100000003/v1_201807060854/S1888400817301083/v1_201807060854/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Interferograma mostrando el porcentaje de interferencia [Int (%)] de amoxicilina sobre la medición de normetanefrina en orina, para cada una de las diluciones estudiadas. El intervalo de error relativo máximo admisible está representado por las líneas rojas. Interferograma mostrando el porcentaje de interferencia [Int (%)] de amoxicilina sobre la medición de normetanefrina en orina, para cada una de las diluciones estudiadas. El intervalo de error relativo máximo admisible está representado por las líneas rojas.](https://static.elsevier.es/multimedia/18884008/0000001100000003/v1_201807060854/S1888400817301083/v1_201807060854/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
