Existe gran variabilidad en la capacidad de detección de análogos de insulina e insulinas recombinantes por los inmunoanálisis comerciales para determinación de insulina. Conocer qué preparados de insulina pueden detectar un método, y cuáles no, es necesario para interpretar algunos resultados de laboratorio.
ObjetivoDeterminar la reactividad cruzada de insulina soluble, insulina NPH, glulisina y detemir con los inmunoanálisis de insulina Elecsys/E170 (Roche) y Architect (Abbott).
Material y métodosSe prepararon diluciones (rango 20–1.000 mU/l) de glulisina, detemir, insulina soluble e insulina NPH. Se analizaron con los inmunoanálisis de insulina Elecsys/E170 (Roche) y Architect (Abbott). Se calculó la reactividad cruzada (%) para cada dilución.
ResultadosCon Elecsys/E170 la reactividad cruzada de glulisina y detemir fue < 5% en todas las diluciones; para insulina soluble, el promedio de la reactividad cruzada fue de 120% y para insulina NPH de 106%.
En Architect, el promedio de la reactividad cruzada de glulisina fue del 12,6%; detemir 130% para 20mU/l y > 240% para 100mU/l; insulina soluble 99% e insulina NPH 153%.
ConclusionesElecsys/E170 detecta las 2 insulinas de secuencia humana y no detecta glulisina ni detemir. Architect detecta las insulinas de secuencia humana y el análogo detemir; para glulisina, el promedio de reactividad cruzada es del 12,6%.
La colaboración entre laboratorios que utilizan diferentes inmunoanálisis puede ser útil para aclarar algunos cuadros clínicos de hipoglucemia, en los que se sospecha sobredosis o administración indebida de preparados de insulina.
The large variability in cross-reactivities of recombinant insulin preparations with different commercial assays is noteworthy. It is imperative to know which recombinant insulin preparations a method can detect and which ones it cannot, to interpret certain laboratory results.
ObjectiveTo asses the cross-reactivity of soluble insulin, insulin NPH, glulisina and detemir with insulin inmunoassays Elecsys/E170 (Roche) and Architect (Abbott).
Material and methodsSolutions of glulisine, detemir, soluble insulin and insulin NPH (20 - 1000 mU/L) were prepared and analized with insulin inmunoassays Elecsys/E170 (Roche) and Architect (Abbott). The cross-reactivity percentage was calculated for each solution.
ResultsWith Elecsys/E170, the cross-reactivity of glulisine and detemir was < 5% for all solutions. The cross-reactivity of soluble insulin was 120% and insulin NPH 106%.
With Architect, the cross-reactivity of glulisine was 12,6%; detemir 130% for 20 mU/L and >240% for 100 mU/L; soluble insulin 99% and insulin NPH 153%.
ConclusionsElecsys/E170 detects both preparations of insulin of human sequence but it does not detect gluisine nor detemir. Architect detects both preparations of insulin of human sequence and detemir; for gluisine the average of cross-reactivity is 12,6%.
Colaboration between laboratories employing different immunoassays may be useful to throw light on some hypoglycemia profiles, where overdose or misadministration of insulin preparations is suspected.
Los inmunoanálisis para determinación de insulina en sangre están diseñados para la cuantificación de la concentración de insulina humana en suero o plasma humano. La utilización de preparados de insulina recombinante, y en particular de análogos de insulina, para el tratamiento de la diabetes, plantea la necesidad de conocer su reactividad cruzada con el inmunoanálisis para determinación de insulina que utiliza cada laboratorio. Si bien la determinación de insulina en pacientes diabéticos no forma parte de su control rutinario habitual, esta se solicita, ocasionalmente, en los diabéticos con mal control metabólico que presentan crisis de hipoglucemia1 y también en los casos de sospecha de administración subrepticia de preparados de insulina que pueden ocasionar crisis de hipoglucemia facticia2. En estos casos, cuando se analizan muestras de pacientes tratados con preparados de insulina recombinante, la determinación de insulina en sangre no debe considerarse como una determinación cuantitativa, sino que tiene un valor meramente orientativo en la práctica clínica.
Actualmente, todos los preparados de insulina para el tratamiento de la diabetes que existen en el mercado se obtienen por tecnología recombinante a partir de plásmidos ADN inyectados en Escherichia coli o levaduras. En primer lugar, se desarrollaron la insulina soluble (también denominada regular o cristalina) y la insulina NPH, constituidas por insulina humana biosintética con la misma estructura molecular que la humana. Posteriormente, se desarrollaron los análogos de insulina (lispro, aspart, glargina, glulisina y detemir), modificando la secuencia proteica para conseguir otras propiedades farmacocinéticas, con el objetivo de obtener perfiles glucémicos similares a los fisiológicos. Todos los análogos presentan cambios en la porción C-terminal de la cadena β de la insulina, lo que condiciona su capacidad de unión a los anticuerpos del ensayo, de manera que la cuantificación en suero de estos análogos mediante inmunoanálisis para insulina depende de si los epítopos a los que van dirigidos los anticuerpos del ensayo se encuentran conservados, o no, en estos fármacos.
Existe gran variabilidad en la capacidad de detección de los análogos de insulina por los inmunoanálisis comerciales2. La reactividad cruzada de los análogos de insulina lispro, aspart y glargina ha sido testada en diversos analizadores, observándose diferencias importantes entre los inmunoanálisis comerciales, dependientes, en algunos casos, de la concentración del interferente3–5. También hay datos publicados sobre la reactividad cruzada de la insulina soluble, la insulina NPH y otras preparaciones en el analizador DxI de Beckman6.
Nuestro objetivo es determinar la reactividad cruzada de 4 preparaciones de insulina recombinante, 2 de secuencia humana (insulina soluble e insulina NPH) y 2 análogos de insulina (glulisina y detemir) con los inmunoanálisis quimioluminiscentes para determinación de insulina Elecsys/E170 (Cobas Roche) y Architect (Abbott).
Material y métodosSe utilizaron el inmunoanálisis electroquimiolumniscente Elecsys/E170 para determinación de insulina (reactivo: Insulin Ref. 12017547 122 de Roche Diagnostics) en el analizador Cobas 8000 de Roche y el inmunoanálisis quimioluminiscente de micropartículas (reactivo: Architect Insulin Ref. 8K41 de Abott Laboratories) en el analizador Architect i2000 de Abbott. Ambos métodos utilizan una curva de calibración obtenida a partir de calibradores referenciados a World Health Organization Insulin 1st Internacional Reference Preparation, 66/304. Rango de medida de Elecsys/E170 de 0,2 -1.000mU/l. Rango de medida de Architect de 1-300mU/l. En nuestros laboratorios, el método Elecsys/E170 presenta un coeficiente de variación (CV) interensayo del 3,0% para concentraciones de insulina de 27mU/l y del 2,6% para concentraciones de 83mU/l. Con el método Architect, se obtienen CV del 1,7% con concentraciones de insulina de 37mU/l, CV del 2,0% con insulina 86mU/l y CV del 1,5% con insulina 193mU/l.
Se obtuvieron soluciones madre de 200.000mU/l a partir de las especialidades farmacéuticas comerciales: Apidra® (glulisina), Levemir® (detemir), Insulatard® (insulina NPH) y Actrapid® (insulina regular) mediante dilución con un diluyente de matriz proteica (Multiassay Diluent Ref 03183971 de Roche Diagnostics). A partir de dichas soluciones, se prepararon 2 series de diluciones con concentración 20, 100, 300 y 1.000mU/l para cada tipo de insulina. En una serie, se utilizó como diluyente el mismo que para la solución madre. En la otra, se utilizó como diluyente un suero control comercial (Lipocheck Inmunoassay Plus Control Ref 371 de BioRad Laboratories) valorado en Elecsys/E170 con 22,3mU/l de insulina y en Architect con 18mU/l.
Se prepararon las 2 series de diluciones para evitar algún posible efecto matriz. Ya que el diluyente de matriz proteica no tiene una composición idéntica al suero, lo más adecuado habría sido diluir con suero humano libre de insulina; al no disponer de este, se decidió usar el de concentración más baja de nuestro laboratorio y analizar ambas series para poder comparar los resultados.
Cada una de las series fue analizada, por duplicado, por ambos métodos. Los cálculos de reactividad cruzada para cada dilución se efectuaron a partir de la media de los duplicados considerada como insulina medida.
En la serie con diluyente de matriz proteica se calculó el porcentaje de reactividad cruzada para cada concentración y tipo de insulina exógena como el cociente entre la concentración medida×100/concentración esperada. En la serie de diluciones con suero control, se calcularon las diferencias entre la concentración de insulina medida en cada dilución y la concentración de insulina del control, y el porcentaje de reactividad cruzada para cada concentración y tipo de insulina exógena se calculó como el cociente entre la diferencia×100/concentración de insulina exógena en la muestra. Se considera que existe reactividad cruzada cuando el porcentaje de recuperación es superior al 10%.
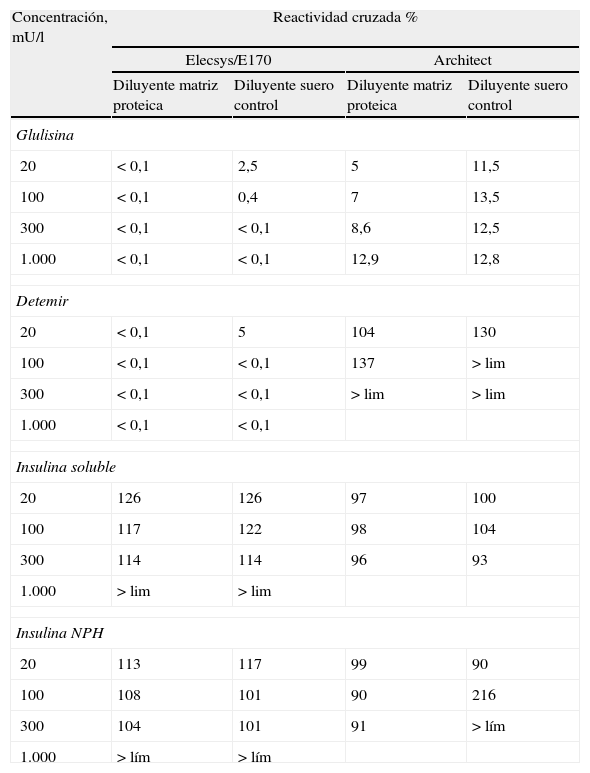
ResultadosEn la tabla 1 se muestran los porcentajes de reactividad cruzada para las diluciones de cada preparado con ambos diluyentes. Los valores de insulina no detectables producen valores de reactividad cruzada inferiores al 0,1%. Los valores de insulina superiores al rango de medida no permiten calcular el porcentaje de reactividad cruzada y aparecen como > lím en la tabla 1.
Reactividad cruzada de análogos de insulinas recombinantes con los inmunoanálisis para determinación de insulina Elecsys/E170 y Architect
| Concentración, mU/l | Reactividad cruzada % | |||
| Elecsys/E170 | Architect | |||
| Diluyente matriz proteica | Diluyente suero control | Diluyente matriz proteica | Diluyente suero control | |
| Glulisina | ||||
| 20 | < 0,1 | 2,5 | 5 | 11,5 |
| 100 | < 0,1 | 0,4 | 7 | 13,5 |
| 300 | < 0,1 | < 0,1 | 8,6 | 12,5 |
| 1.000 | < 0,1 | < 0,1 | 12,9 | 12,8 |
| Detemir | ||||
| 20 | < 0,1 | 5 | 104 | 130 |
| 100 | < 0,1 | < 0,1 | 137 | > lim |
| 300 | < 0,1 | < 0,1 | > lim | > lim |
| 1.000 | < 0,1 | < 0,1 | ||
| Insulina soluble | ||||
| 20 | 126 | 126 | 97 | 100 |
| 100 | 117 | 122 | 98 | 104 |
| 300 | 114 | 114 | 96 | 93 |
| 1.000 | > lim | > lim | ||
| Insulina NPH | ||||
| 20 | 113 | 117 | 99 | 90 |
| 100 | 108 | 101 | 90 | 216 |
| 300 | 104 | 101 | 91 | > lím |
| 1.000 | > lím | > lím | ||
> lím: indica que la insulina medida supera el rango de medida del inmunoanálisis.
Con Elecsys/E170, la reactividad cruzada de los análogos de insulina glulisina y detemir con diluyente de matriz proteica fue < 0,1% en todas las diluciones, para glulisina con diluyente suero control < 0,1-2,5%, y para detemir con diluyente suero control < 0,1-5%. El promedio de reactividad cruzada para la insulina soluble con diluyente proteico y con diluyente suero control fue del 119 y el 121%, respectivamente; para la insulina NPH fue del 108 y el 106%, respectivamente.
En Architect, el promedio de reactividad cruzada de glulisina con diluyente de matriz proteica fue del 8,4% y con diluyente suero control del 12,6%; el promedio de reactividad cruzada de detemir con diluyente de matriz proteica fue del 120% y con diluyente suero control fue del 130% para la dilución de 20mU/l y superior al 240% para la dilución de 100mU/l. El promedio de reactividad cruzada para la insulina soluble con diluyente proteico y con diluyente suero control fue del 97 y el 99%, respectivamente, y para insulina NPH fue del 93 y el 153%, respectivamente.
DiscusiónNuestros resultados con Elecsys/E170 complementan los obtenidos por otros autores para la reactividad cruzada de los análogos lispro, aspart y glargina (< 0,7% en todos los casos)3 y expresan la especificidad analítica del inmunoanálisis Elecsys/E170 para las insulinas de secuencia humana y su falta de respuesta a los análogos de insulina actualmente disponibles.
En Architect, nuestros resultados complementan los obtenidos por otros autores para la reactividad cruzada de las insulinas lispro, aspart y glargina (el 100, el 75 y el 90%, respectivamente)5 y muestran la capacidad de este inmunoanálisis para detectar el análogo detemir y las 2 insulinas de secuencia humana. Respecto al análogo glulisina, su detección es baja en las muestras diluidas con suero control (reactividad cruzada 12,6%) e indetectable en las muestras de glulisina con diluyente de matriz proteica (reactividad cruzada < 10%).
Quizá porque se supone que las insulinas recombinantes de secuencia humana son determinadas como si fuesen insulina endógena por los inmunoanálisis comerciales, existen pocos datos en la bibliografía sobre la reactividad cruzada de dichos preparados en diferentes analizadores. Glenn y Armston miden reactividad cruzada desde el 83,3% para insulina-protamina hasta el 143% para insulina NPH con Beckman Dxl6. Nuestros resultados muestran que tanto Elecsys/E170 como Architect detectan las insulinas recombinantes de secuencia humana con pequeña variabilidad en la reactividad cruzada, excepto para insulina NPH en Architect (rango 90-216%). Dichos resultados están en desacuerdo con los publicados por Heald et al. a partir de datos de un control externo de insulina de UK-NEQAS, con resultados obtenidos por diferentes métodos en 24 laboratorios participantes, en una muestra de suero basal de un individuo sano y otra muestra del mismo suero a la que se añadieron 30pmol/l (= 5mU/k) de Actrapid7. Siendo el principio activo de este preparado insulina soluble (de secuencia humana), lo esperable sería que fuese detectado por la mayoría de los laboratorios, puesto que no se trata de un análogo. Llama la atención que la cantidad de insulina adicionada es muy pequeña y que, además, casi todos los laboratorios participantes obtienen valores indetectables de insulina también en la muestra basal.
La determinación específica de los niveles en sangre de un análogo de insulina requiere un inmunoanálisis específico8,9 u otro método de alta resolución, como la cromatografía líquida/espectrometría de masas en tándem10-12, ambos poco accesibles a los laboratorios clínicos de rutina. La colaboración entre laboratorios que utilizan inmunoanálisis con diferente capacidad para detectar determinados análogos de insulina puede ser útil para aclarar algunos cuadros clínicos confusos, en los que se sospecha incumplimiento del tratamiento, sobredosis o administración indebida de preparados de insulina.
El apartado de especificidad analítica de los folletos informativos de los reactivos para determinación de insulina es incompleto en lo que se refiere a la reactividad cruzada con los preparados de insulina recombinante. Roche apunta la falta de reacción cruzada de su método con los análogos lispro, aspart y glargina; no menciona glulisina ni detemir y tampoco insulina soluble ni insulina NPH. Por su parte, Abbott no incluye ningún preparado de insulina ni análogo recombinante en el apartado de reactividad cruzada de su folleto.
Los fabricantes de reactivos deberían proporcionar y actualizar los datos de reactividad cruzada de los preparados recombinantes de insulina en el folleto informativo correspondiente del inmunoanálisis para insulina, junto con otros relativos a la especificidad analítica, ya que analistas y clínicos necesitan saber qué análogos de insulina se pueden detectar, y cuáles no, cuando se utiliza un determinado ensayo de laboratorio.