Varios miembros de diferentes asociaciones científicas y expertos de la reproducción han actualizado las recomendaciones de estudio genético e inmunológico en las parejas con disfunción en la reproducción con el fin de mejorar la asistencia sanitaria. El estudio se ha considerado altamente recomendable cuando la prueba diagnóstica es relevante para la toma de decisiones, moderada cuando estas han mostrado un resultado poco consistente y baja, cuando el beneficio de la prueba es incierto. Con la indicación de estas recomendaciones obtendremos una información relevante para el diagnóstico, pronóstico y tratamiento de la pareja con disfunción en la reproducción.
In this article several members of diverse scientific associations and reproduction experts from Spain have updated different genetic and immunological procedure recommendations in couples affected by reproductive dysfunction with the goal of providing a set of useful guidelines for the clinic. The laboratory test has been considered as highly recommendable for making clinical decisions when the result of the diagnostic test is relevant, moderately recommendable when the results are of limited evidence because they are inconsistent, and low when the benefit of the test is uncertain. It is expected that these recommendations will provide some useful guidelines for the diagnosis, prognosis and treatment of couples presenting reproductive dysfunction.
El avance en el conocimiento del genoma humano y en la inmunopatología como causas de alteraciones en la reproducción junto al gran desarrollo de las nuevas técnicas de biología molecular, permiten que se pueda analizar un gran número de enfermedades obteniendo una información relevante para el diagnóstico, pronóstico y tratamiento de la pareja con disfunción en la reproducción1. Este conocimiento se está aplicando a individuos/sujetos sintomáticos con la idea de confirmar un diagnóstico, así como para detectar embarazos con un alto riesgo genético de desarrollo de alguna enfermedad hereditaria o individuos asintomáticos con antecedentes familiares que supongan un elevado riesgo de desarrollar una enfermedad genética en un futuro.
Por otro lado, la inmunología reproductiva estudia los cambios en la respuesta inmunológica durante las distintas etapas del proceso reproductivo: fertilización de los gametos, implantación de los embriones en el útero, invasión endometrial y desarrollo de la placenta en las etapas precoces y tardías del embarazo y parto. Sin embargo, quedan numerosos interrogantes sobre cómo la unidad feto-placentaria evita el rechazo por parte del sistema inmunitario materno, siendo hasta ahora el feto considerado como un injerto semialogénico, aunque cada vez se va conociendo más sobre los mecanismos inmunitarios activos de la interfase feto-materna por parte del inmunidad innata y adaptativa que median la tolerancia materna.
La realización de los estudios genéticos o inmunológicos se basa en la historia y características clínicas y los antecedentes familiares de la pareja. La evaluación de la posible causa en cada caso, debe evitar exploraciones y tratamientos innecesarios en pacientes con alteraciones en la reproducción.
Antes de incorporar nuevas pruebas en el diagnóstico a nivel asistencial es imprescindible considerar el impacto sanitario de las enfermedades así como la prevalencia del genotipo, las garantías de eficacia (validez analítica, validez clínica, utilidad clínica), el coste-efectividad, la calidad de las pruebas diagnósticas, la magnitud de la asociación genotipo-enfermedad, la interacción con otros factores de riesgo, el conocimiento sobre las intervenciones preventivas o terapéuticas, el impacto económico de su implementación en los servicios sanitarios y por último, los aspectos éticos, legales y sociales relacionados2.
Varios miembros de diferentes asociaciones científicas y expertos de la reproducción humana (tabla 1) han actualizado las recomendaciones3 publicadas en el 2009 con el fin de mejorar la asistencia sanitaria en estas parejas.
Sociedades científicas participantes
| Asociación Española de Biopatología Médica-Medicina del Laboratorio |
| Asociación Española del Laboratorio Clínico |
| Sociedad Española de Fertilidad |
| Asociación Española de Andrología |
| Sociedad Española de Medicina del Laboratorio |
| Asociación Española de Genética Humana |
| Sociedad Española de Inmunología |
| Asociación Española de Urología |
| Sociedad Española de Ginecología y Obstetricia, sección de esterilidad e infertilidad |
| Expertos en genética clínica de esterilidad |
Las recomendaciones realizadas en este documento se refieren a hombres y mujeres con disfunción reproductiva, ya sea por esterilidad primaria, secundaria o infertilidad.
El objetivo de este documento es ofrecer una revisión actualizada de las recomendaciones para el estudio genético e inmunológico en la evaluación de las parejas con disfunción reproductiva y que desean tener descendencia. Se pretende proporcionar las indicaciones de estudios genéticos e inmunológicos necesarios para determinar la etiología. Se excluye el estudio de las enfermedades mitocondriales y sistémicas que se asocian con alteraciones de la reproducción.
Las recomendaciones van dirigidas a los especialistas sanitarios que en su práctica clínica asisten a las parejas con disfunción reproductiva como ginecólogos, urólogos, genetistas clínicos, andrólogos y especialistas de medicina de laboratorio con el fin de ayudar y estandarizar los estudios de las causas de origen genético o inmunológico.
Consideraciones éticas en genética y reproducciónLos problemas éticos suscitados por las nuevas tecnologías genéticas son diversos y múltiples, aunque todos ellos tienen la característica —en la que conviene insistir— de obligar a un planteamiento doble: la reflexión sobre los conceptos implicados y los valores en juego, y la justificación de la toma de decisiones prudente en los campos de aplicación concretos4,5.
Desde el punto de vista de los principios éticos básicos, el beneficio que pueden ofrecer estas técnicas es el que genera más esperanzas tanto en los profesionales como en la población, ya que parten de la base de evitar un posible daño en la descendencia y promover la mejora de la calidad de vida6. Sin embargo, también entran en consideración los principios de justicia y autonomía, ya que se corre el riesgo de utilizar tecnologías que no son suficientemente seguras, existe el problema de la protección de la confidencialidad, y el acceso desigual entre los pacientes que lo soliciten.
Las nuevas tecnologías genéticas ponen a nuestra disposición los datos obtenidos, que también pueden ser transmitidos a otras personas. En el caso de la donación de gametos, por ejemplo, la información puede implicar a varios sujetos a la vez. Por ello, la confidencialidad de estos datos es uno de los temas más controvertidos, ya que en ocasiones no está claro si debe de prevalecer la privacidad de la persona o el interés común.
Por otra parte, también existe la posibilidad de que la propia persona no desee conocer sus datos, sobre todo en el caso de detectarse la posibilidad de tener una enfermedad que no tenga cura7. Es muy importante destacar que el descubrimiento de una predisposición a padecer una enfermedad no es sinónimo de padecerla con seguridad. El problema subyacente, aquí y en otros temas relacionados con la influencia de los avances en genética en la sociedad, es el de la información. Por ello, en este aspecto desempeña un papel primordial el consentimiento informado. Desde una perspectiva ética amplia se pueden reconocer dos objetivos principales en la teoría del consentimiento informado: promover la autonomía individual y estimular la toma de una decisión racional, esto es, las personas tienen derecho a tener sus propios puntos de vista, a tomar sus propias decisiones y a realizar acciones basadas en los valores y creencias propias8,9.
La información por escrito debe advertir sobre la posibilidad de descubrimientos inesperados y su posible trascendencia para el sujeto, así como sobre la facultad de este de tomar una posición en relación con recibir su comunicación.
Por último, la información por escrito debe contener la advertencia de la implicación que puede tener para los familiares la información que se llegue a obtener y la conveniencia de que el propio afectado, en su caso, trasmita la información a aquello10,11.
Recomendaciones- •
Es necesario que todas las Unidades de Reproducción cuenten con asesoría genética especializada.
- •
En caso de que los pacientes soliciten un test de secuenciación masiva, es necesario explicar detalladamente el estado actual de la ciencia, y ofrecer toda la información actualmente disponible de una forma clara y veraz, explicando todos los hallazgos y firmando el correspondiente consentimiento informado.
- •
No puede asegurarse a los pacientes que no existe peligro de alteración genética en la descendencia aun realizándose el test.
- •
No debe de realizarse publicidad “engañosa” para los pacientes respecto a los test de secuenciación masiva y sus posibles beneficios.
La consulta preconcepcional tiene como objetivo identificar las condiciones médicas y sociales maternas o paternas, en las que sea posible realizar una intervención antes de la gestación con la finalidad de minimizar su impacto sobre la misma.
Deberán ser valorados en una consulta de Genética Clínica las parejas consanguíneas, los varones o mujeres con historia de enfermedad hereditaria o sospecha de la misma y las personas pertenecientes a grupos con una elevada proporción de portadores de mutaciones para determinadas enfermedades hereditarias.
Entre los antecedentes familiares, se consideran susceptibles de evaluación preconcepcional la existencia de varios miembros de la familia con la misma afectación, personas con malformaciones mayores, retraso del desarrollo, discapacidad intelectual o anomalías en el crecimiento (restricción, asimetría del crecimiento o crecimiento excesivo). Es relevante recopilar información sobre familiares afectos de esterilidad, retraso mental, enfermedades musculares progresivas, cataratas tempranas, alteraciones en la coagulación, minusvalías, malformaciones o parálisis al nacimiento. Se debe investigar la consanguinidad de la pareja y los antecedentes familiares, realizando un árbol genealógico de al menos 3 generaciones. En la tabla 2 se indica el cuestionario sobre los antecedentes personales, los antecedentes familiares y la exploración mínima que puede ayudar al estudio de la pareja.
Antecedentes personales, familiares y exploración mínima para el estudio de la pareja en la disfunción reproductiva
| Antecedentes personales mujeres: |
| Malformaciones al nacimiento |
| Desarrollo psicomotor |
| Menarquia |
| Ciclos: duración y características |
| Antecedentes personales hombres: |
| Malformaciones al nacimiento |
| Desarrollo psicomotor |
| Anosmia |
| Edad de aparición de caracteres sexuales secundarios (vello, barba, etc.) |
| Árbol genealógico: |
| Debe comprender 3 generaciones (hijos, hermanos, padres, sobrinos, tíos, primos) anotando enfermedades y malformaciones, así como abortos (especificar espontáneo o inducido) |
| La consanguinidad en la pareja debe reflejarse en el árbol (detectar hermanos 2, 3, 4, etc., generaciones por encima) |
| Debe recoger los antecedentes familiares de menopausia precoz, aborto espontáneo (anotar tiempo de la gestación y el sexo del feto, si se conoce), muerte fetal y muerte neonatal (datos de la autopsia), anomalías congénitas, esterilidad, retraso mental o en el desarrollo, coagulopatías, enfermedades genéticas |
| Exploración mujeres |
| Estatura |
| Aspecto fenotípico: obesidad, etc. |
| Distribución del cabello (occipital) |
| Cuello (tamaño, pterigium) |
| Tórax en escudo |
| Teletelia |
| Distribución del vello |
| Genitales externos |
| Exploración hombres: |
| Estatura, especificando segmento superior/segmento inferior |
| Aspecto fenotípico: eunucoide, obeso, etc. |
| Distribución del cabello (frontal y occipital) |
| Cara alargada |
| Pabellones auriculares (tamaño, despegados) |
| Prognatismo |
| Distribución del vello |
| Ginecomastia |
| Escroto (aspecto y pigmentación) |
| Pene (tamaño, hipospadias, etc.) |
| Testículos (tamaño, consistencia, criptorquidia, varicocele) |
Si se cumplieran criterios clínicos de indicación de estudios cromosómicos, moleculares o inmunológicos se realizarán antes de plantear cualquier tratamiento de reproducción.
Recomendaciones para el uso de las pruebas genéticas e inmunológicasEl uso de las recomendaciones de las pruebas genéticas e inmunológicas se ha clasificado en tres categorías: alta, moderada y baja. Para determinar la fuerza de una recomendación se han valorado las ventajas y los riesgos de la utilización de la prueba diagnóstica, la coherencia y precisión de los resultados, la calidad de la evidencia, carácter directo de las pruebas, los valores y preferencias de las personas afectadas, y los recursos a usar. Se ha considerado altamente recomendable cuando la prueba diagnóstica es relevante para la toma de decisiones, moderada cuando estas han mostrado un resultado poco consistente y baja, cuando el beneficio de la prueba es incierto12 (tabla 3).
Clasificación en el uso de las recomendaciones
| • Alta: existe clara evidencia para recomendar la prueba genética o inmunológica y es relevante para la toma de decisiones |
| • Moderada: existe una limitada evidencia para recomendar la prueba genética y han mostrado un resultado poco consistente |
| • Baja: la evidencia disponible es incierta y no permite hacer recomendaciones a favor o en contra de la prueba genética |
En la estrategia de búsqueda de estudios genéticos se ha incluido los siguientes términos: cariotipo, fibrosis quística, X frágil, trombofilias, microdeleciones del cromosoma Y, FISH en el cromosoma Y, estudio de meiosis en el tejido testicular, fragmentación en el ADN espermático, variación en el número de copias, detención masiva de enfermedades autosómicas recesivas, estudios genéticos en donación de gametos y epigenética. Con respecto a los estudios inmunológicos, los términos de búsqueda fueron síndrome antifosfolípido, hipotiroidismo, enfermedad celiaca, células NK uterinas y en sangre periférica, desregulación de respuestas Th1/Th2 y Th17/Treg, antígenos HLA y genotipo KIR materno y lectina de unión a manosa.
Se consultaron bases de datos electrónicas como MEDLINE, EMBASE, guías clínicas como EAA/EMQN, revisiones sistemáticas y metaanálisis, documentos de consenso y recomendaciones de sociedades científicas en los últimos 10 años.
El trabajo multidisciplinar se inició en noviembre del 2015 mediante una reunión presencial donde se definió el alcance de las recomendaciones y se repartieron los temas por pares según la experiencia y la especialidad de los autores con el fin de realizar una revisión de la literatura científica. Se hicieron circular los temas y se comentaron en el grupo de trabajo en otra reunión presencial y 5 on-line. De esta forma se estableció el documento consenso de “Recomendaciones para el estudio genético e inmunológico en la disfunción reproductiva”. Posteriormente el documento ha sido revisado y avalado por las 10 sociedades científicas participantes.
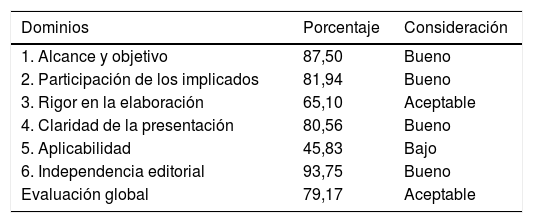
Se realizó la evaluación del documento mediante la herramienta de 23 ítems organizados en los seis mismos dominios, seguidos de la evaluación global, indicado en el instrumento para evaluación de guías de práctica clínica AGREE-II12. En la tabla 4 se expone los resultados. Se ha considerado como puntuaciones de dominio ≥ 80% = bueno; 60-79% = aceptable; 40-59% = bajo; <40% = muy bajo. * = puntaje total del dominio> 60%. Destacamos que la evaluación global del documento ha resultado aceptable y que todos los evaluadores recomiendan este documento para su uso en la práctica clínica.
Evaluación de los dominios
| Dominios | Porcentaje | Consideración |
|---|---|---|
| 1. Alcance y objetivo | 87,50 | Bueno |
| 2. Participación de los implicados | 81,94 | Bueno |
| 3. Rigor en la elaboración | 65,10 | Aceptable |
| 4. Claridad de la presentación | 80,56 | Bueno |
| 5. Aplicabilidad | 45,83 | Bajo |
| 6. Independencia editorial | 93,75 | Bueno |
| Evaluación global | 79,17 | Aceptable |
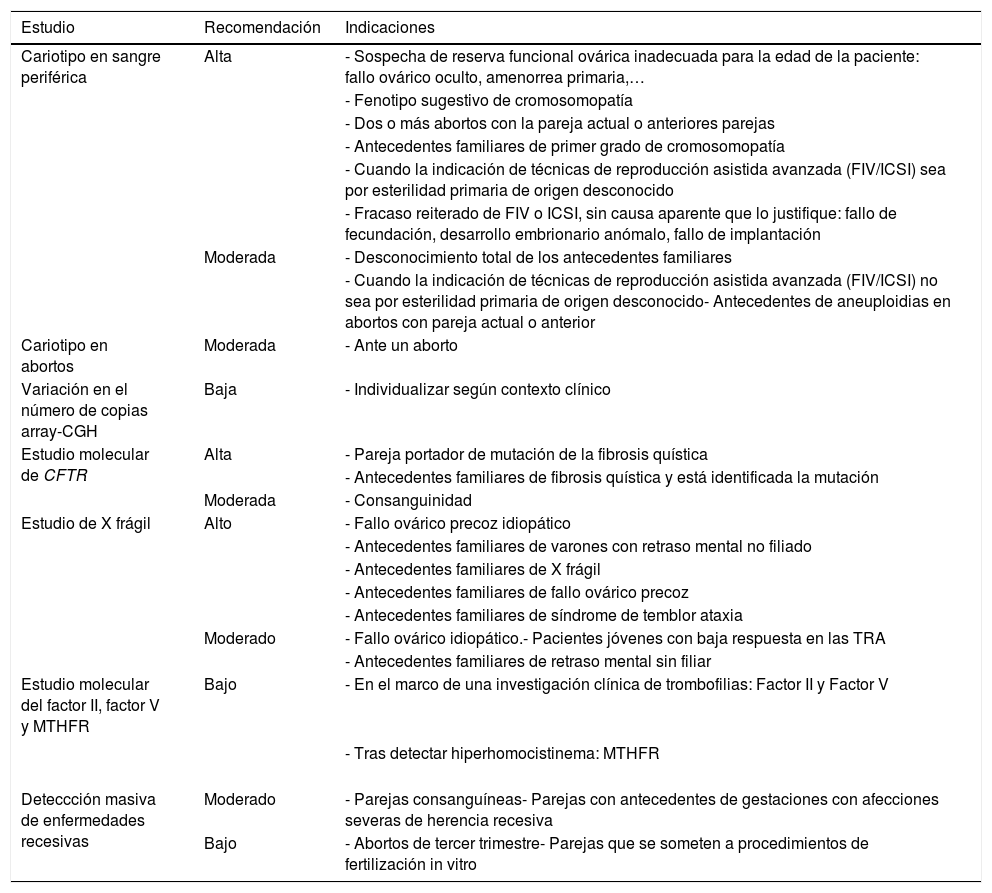
La indicación de las pruebas genéticas como alta, moderada o baja en la mujer con disfunción en la reproducción se ha clasificado en base a la historia clínica de la mujer y se presentan en la tabla 5.
Recomendaciones de estudio genético en la mujer
| Estudio | Recomendación | Indicaciones |
|---|---|---|
| Cariotipo en sangre periférica | Alta | - Sospecha de reserva funcional ovárica inadecuada para la edad de la paciente: fallo ovárico oculto, amenorrea primaria,… |
| - Fenotipo sugestivo de cromosomopatía | ||
| - Dos o más abortos con la pareja actual o anteriores parejas | ||
| - Antecedentes familiares de primer grado de cromosomopatía | ||
| - Cuando la indicación de técnicas de reproducción asistida avanzada (FIV/ICSI) sea por esterilidad primaria de origen desconocido | ||
| - Fracaso reiterado de FIV o ICSI, sin causa aparente que lo justifique: fallo de fecundación, desarrollo embrionario anómalo, fallo de implantación | ||
| Moderada | - Desconocimiento total de los antecedentes familiares | |
| - Cuando la indicación de técnicas de reproducción asistida avanzada (FIV/ICSI) no sea por esterilidad primaria de origen desconocido- Antecedentes de aneuploidias en abortos con pareja actual o anterior | ||
| Cariotipo en abortos | Moderada | - Ante un aborto |
| Variación en el número de copias array-CGH | Baja | - Individualizar según contexto clínico |
| Estudio molecular de CFTR | Alta | - Pareja portador de mutación de la fibrosis quística |
| - Antecedentes familiares de fibrosis quística y está identificada la mutación | ||
| Moderada | - Consanguinidad | |
| Estudio de X frágil | Alto | - Fallo ovárico precoz idiopático |
| - Antecedentes familiares de varones con retraso mental no filiado | ||
| - Antecedentes familiares de X frágil | ||
| - Antecedentes familiares de fallo ovárico precoz | ||
| - Antecedentes familiares de síndrome de temblor ataxia | ||
| Moderado | - Fallo ovárico idiopático.- Pacientes jóvenes con baja respuesta en las TRA | |
| - Antecedentes familiares de retraso mental sin filiar | ||
| Estudio molecular del factor II, factor V y MTHFR | Bajo | - En el marco de una investigación clínica de trombofilias: Factor II y Factor V |
| - Tras detectar hiperhomocistinema: MTHFR | ||
| Deteccción masiva de enfermedades recesivas | Moderado | - Parejas consanguíneas- Parejas con antecedentes de gestaciones con afecciones severas de herencia recesiva |
| Bajo | - Abortos de tercer trimestre- Parejas que se someten a procedimientos de fertilización in vitro |
CFTR: cystic fibrosis transmenbrane conductance regulator; FIV: fecundación in vitro; ICSI: inyección intracitoplasmática de espermatozoides; TRA: técnicas de reproducción asistida.
La frecuencia de las anomalías cromosómicas se sitúa entre un 0,7% y un 0,8% de los recién nacidos vivos13. Las parejas con disfunción en la reproducción han demostrado que tienen una mayor prevalencia de anomalías cromosómicas tanto estructurales o numéricas que la población general. La aneuploidia más frecuente que se asocia a esterilidad en las mujeres es la monosomía del cromosoma X: 45, X (síndrome de Turner), que ocurre como resultado de no hacer disyunción cromosómica en meiosis14.
Las alteraciones cromosómicas constitucionales estructurales o numéricas contribuyen al fracaso en la reproducción, ya sea como causa de esterilidad o de abortos repetidos involuntarios. Estas variaciones pueden no presentar manifestaciones clínicas evidentes y permanecen sin ser detectados a través de múltiples generaciones.
Cariotipo en abortosEl aborto espontáneo es la complicación más frecuente del embarazo, y la causa principal de abortos en el primer trimestre de gestación son las alteraciones cromosómicas. Alrededor del 50 al 60% de todos los abortos involuntarios están asociados con anormalidades citogenéticas, siendo la trisomía la más frecuente, seguidos por poliploidia y la monosomía X15. La detección de anomalías cromosómicas espontáneas en el aborto es importante para conocer las causas de la pérdida del embarazo. La detección de sus padres portadores puede proporcionar asesoramiento genético adecuado para estas familias.
Fibrosis quísticaLa fibrosis quística (FQ) es una enfermedad que se transmite de forma autosómica recesiva, causada por mutaciones en un gen conocido como cystic fibrosis transmenbrane conductance regulator (7q31.2) (CFTR). La prevalencia de afectos es de uno cada 2.500 nacimientos y de portador de uno cada 2516. La base de datos, Leiden Open (source) Variation Database suministra la información sobre las mutaciones de la FQ a través de Internet (http://grenada.lumc.nl/LSDB_list/lsdbs/CFTR)17 Actualmente se conocen más de 3.000 variaciones patogénicas de este gen. La mutación delta F508 es la más prevalente. Las mujeres diagnosticadas de FQ son fértiles. Cuando la pareja de la mujer es portadora de una mutación de FQ, se realizará el cribado de las mutaciones más frecuentes18,19 que detecta entre el 70 al 90% de las mutaciones que se encuentran más comúnmente en el gen CFTR, por lo que el riesgo residual de tener descendencia afectada es menor del 1%, parcialmente evitable mediante secuenciación completa del gen.
Estudio de X frágilLas mujeres portadoras de premutación en el gen fragile X mental retardation 1 (FMR1) tienen riesgo de insuficiencia ovárica prematura (IOP), que se define como menopausia con menos de 40 años20. Se sospecha que una mujer es portadora de esta premutación si tiene antecedentes familiares de mujeres con IOP y de varones diagnosticados de retraso mental o síndrome temblor ataxia.
El gen está situado en el locus Xq27.3. Su expansión inestable o la metilación anormal del gen dan lugar a la supresión de la transcripción del FMR1 y a niveles cerebrales disminuidos de la proteína que codifica, que son los responsables del síndrome de X frágil. El número de repeticiones no se relaciona con el retraso mental asociado al síndrome, sino que aumenta el riesgo creciente de IOP en las mujeres portadoras. Debido a la inestabilidad de la repetición sobre la transmisión de los alelos premutados, las mujeres presentan riesgo de tener niños afectados con síndrome de X frágil21.
Estudio de trombofiliasLa trombofilia hereditaria, como el factor V Leiden, mutación del gen de la protrombina (PT 20210A), y las deficiencias de los anticoagulantes naturales proteína C, proteína S, antitrombina, se asocian con aborto recurrente. La existencia de una relación causal entre la trombofilia hereditaria y el fracaso del embarazo es controvertido22. Esta combinación es más fuerte para las muertes fetales tardías, con más de 20 semanas de gestación, que para las pérdidas recurrentes incipientes. El alto coste de las pruebas sugiere que no debería ser realizada de forma rutinaria en mujeres con aborto recurrente excepto en el contexto de los estudios científicos, es decir, se recomienda estudiarlas cuando existe una historia clínica personal o familiar de tromboembolismo venoso23.
La metilentetrahidrofolato reductasa (MTHFR) (CE 1.5.1.20) es una enzima clave en el metabolismo de un carbono. La enzima cataliza la conversión de 5,10-metilentetrahidrofolato en 5-metiltetrahidrofolato, predominando la forma circulante de ácido fólico. Los polimorfismos del gen MTHFR se asocian con hiperhomocisteinemia. Por lo tanto, la hiperhomocisteinemia se considera como un factor de riesgo para los defectos del tubo neural y de abortos recurrentes. Los niveles de homocisteína varían dependiendo de la ingesta de ácido fólico y de vitamina B12, siendo la evidencia contradictoria en cuanto a la hiperhomocisteinemia como factor de riesgo de aborto recurrente. Por lo tanto, las pruebas genéticas para la mutación MTHFR no deben ser consideradas como parte de la evaluación de rutina para el aborto recurrente24.
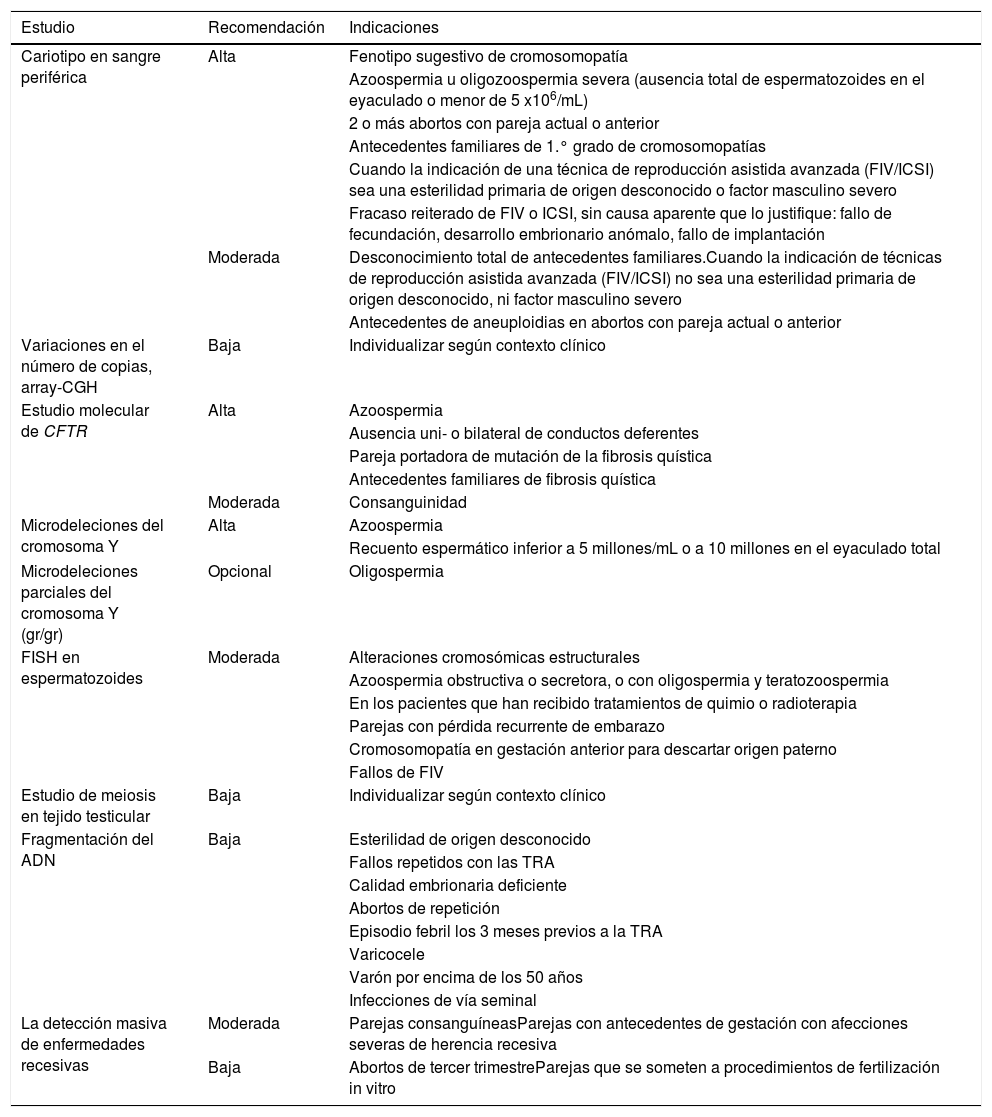
Recomendaciones de estudios genéticos en el varónEl factor masculino de esterilidad está presente hasta en el 50% de las parejas infértiles, por lo tanto cualquier estudio realizado en varones en el marco reproductivo debe ir precedido por un estudio andrológico, que debe incluir al menos la historia clínica, constatando los datos clínicos reflejados en la tabla 1 y el análisis de semen25. Cuanto mayor sea la desviación de la normalidad en el análisis seminal previo, mayor será la probabilidad de encontrar alteraciones genéticas asociadas, mejorando así tremendamente la eficacia de los análisis genéticos.
La indicación de las pruebas genéticas como alta, moderada o baja en el varón con disfunción en la reproducción se ha clasificado en base a la historia clínica y se presenta en la tabla 6.
Recomendaciones de estudios genéticos en el varón
| Estudio | Recomendación | Indicaciones |
|---|---|---|
| Cariotipo en sangre periférica | Alta | Fenotipo sugestivo de cromosomopatía |
| Azoospermia u oligozoospermia severa (ausencia total de espermatozoides en el eyaculado o menor de 5 x106/mL) | ||
| 2 o más abortos con pareja actual o anterior | ||
| Antecedentes familiares de 1.° grado de cromosomopatías | ||
| Cuando la indicación de una técnica de reproducción asistida avanzada (FIV/ICSI) sea una esterilidad primaria de origen desconocido o factor masculino severo | ||
| Fracaso reiterado de FIV o ICSI, sin causa aparente que lo justifique: fallo de fecundación, desarrollo embrionario anómalo, fallo de implantación | ||
| Moderada | Desconocimiento total de antecedentes familiares.Cuando la indicación de técnicas de reproducción asistida avanzada (FIV/ICSI) no sea una esterilidad primaria de origen desconocido, ni factor masculino severo | |
| Antecedentes de aneuploidias en abortos con pareja actual o anterior | ||
| Variaciones en el número de copias, array-CGH | Baja | Individualizar según contexto clínico |
| Estudio molecular de CFTR | Alta | Azoospermia |
| Ausencia uni- o bilateral de conductos deferentes | ||
| Pareja portadora de mutación de la fibrosis quística | ||
| Antecedentes familiares de fibrosis quística | ||
| Moderada | Consanguinidad | |
| Microdeleciones del cromosoma Y | Alta | Azoospermia |
| Recuento espermático inferior a 5 millones/mL o a 10 millones en el eyaculado total | ||
| Microdeleciones parciales del cromosoma Y (gr/gr) | Opcional | Oligospermia |
| FISH en espermatozoides | Moderada | Alteraciones cromosómicas estructurales |
| Azoospermia obstructiva o secretora, o con oligospermia y teratozoospermia | ||
| En los pacientes que han recibido tratamientos de quimio o radioterapia | ||
| Parejas con pérdida recurrente de embarazo | ||
| Cromosomopatía en gestación anterior para descartar origen paterno | ||
| Fallos de FIV | ||
| Estudio de meiosis en tejido testicular | Baja | Individualizar según contexto clínico |
| Fragmentación del ADN | Baja | Esterilidad de origen desconocido |
| Fallos repetidos con las TRA | ||
| Calidad embrionaria deficiente | ||
| Abortos de repetición | ||
| Episodio febril los 3 meses previos a la TRA | ||
| Varicocele | ||
| Varón por encima de los 50 años | ||
| Infecciones de vía seminal | ||
| La detección masiva de enfermedades recesivas | Moderada | Parejas consanguíneasParejas con antecedentes de gestación con afecciones severas de herencia recesiva |
| Baja | Abortos de tercer trimestreParejas que se someten a procedimientos de fertilización in vitro |
Las alteraciones cromosómicas constitucionales son la causa más frecuente de la infertilidad masculina, detectado hasta en el 15% de los hombres con azoospermia. Las alteraciones cromosómicas más frecuentes encontradas en los varones incluyen: alteraciones numéricas (síndrome de Klinefelter, síndrome de XXY, mosaicismos del cromosoma X) y alteraciones estructurales (translocaciones recíprocas, translocaciones robertsonianas, marcadores cromosómicos supernumerarios, inversiones, duplicaciones)26.
Estudio molecular de gen CFTREn las alteraciones en la reproducción de causa masculina debidas a azoospermia obstructiva o ausencia congénita bilateral de los vasos deferentes (CBAVD) se demuestran comúnmente las mutaciones del gen CFTR27. El 99% de los varones adultos con diagnóstico de FQ presenta ausencia bilateral congénita de los conductos deferentes. La CBAVD también se encuentra en el 1-2% de varones estériles sin FQ.
Aproximadamente el 80% de los pacientes con CBAVD son portadores de dos mutaciones CFTR, es decir, heterocigotos compuestos. Los criterios de indicación de estudio molecular del gen CFTR son los siguientes: azoospermia, bajo volumen de líquido seminal (menos de 1,5mL), pruebas bioquímicas características (pH inferior a 7.2, ausencia o disminución de fructosa y de alfa 1-4 glucosidasa), ausencia de vasos deferentes palpables, alteraciones en la ecografía transrectal. Los niveles plasmáticos de hormona foliculoestimulante, hormona luteinizante, y los niveles de testosterona son normales19.
Microdeleciones del cromosoma YLas microdeleciones del brazo largo del cromosoma Y son una de las causas conocidas de esterilidad28,29 estando presentes en el 5-12% de los pacientes azoospérmicos y en el 1-8% en los pacientes oligospérmicos29,30. Existen 3 tipos básicos de microdeleciones completas del cromosoma Y que se clasifican dependiendo de la región afectada en microdeleciones de la región AZFa, de la región AZFb (también llamada P5/proximal P1) y de la región AZFc (b2/b4). Además existen microdeleciones que combinan una pérdida de las regiones de AZFb y de AZFc y que se denominan AZFbc y que a su vez se clasifican en los subtipos P5/distal P1 y P4/distal P1. El tipo más frecuente de microdeleción es la AZFc (∼80%) seguida de la AZFa (0,5–4%), AZFb (1–5%) y de la AZFbc (1–3%)29. El pronóstico de las microdeleciones AZFa, AZFb y AZFbc en pacientes azoospérmicos es malo ya que la posibilidad de recuperar espermatozoides tras TESE puede considerarse nula, por lo que se desaconseja proceder a TESE a estos pacientes29. En contraste, las microdeleciones AZFc del cromosoma Y en pacientes azoospérmicos se suele asociar a una espermatogénesis residual permitiendo recuperar espermatozoides tras TESE o micro-TESE en el ≈50-80% de los casos. Además de las microdeleciones completas existe también la microdeleción parcial de la región AZFc, denominada gr/gr, ya que es un factor de riesgo de oligospermia y cuyo estudio puede estar indicado según EMQN en las poblaciones como la española, para las que existe información contrastada de que actúa como factor de riesgo, si bien todavía no se ha alcanzado un consenso general entre los expertos, dejando por tanto su posible estudio como “baja”29,31,32. Cuando se detecta una microdeleción completa es preciso indicar la realización de un asesoramiento genético previo al tratamiento de reproducción asistida (TRA) ya que, en caso de tener éxito con el TRA, la microdeleción será trasmitida obligatoriamente al 100% de los posibles hijos varones y a ninguna de las posibles hijas29.
Hibridación in situ fluorescente en espermatozoidesLa infertilidad masculina severa se relaciona con una inadecuada división meiótica y con un elevado número de espermatozoides con aneuploidias cromosómicas. Este hecho incrementa los casos de muerte embrionaria así como de anomalías fetales33,34.
En el hombre fértil, aproximadamente el 1% de los espermatozoides del eyaculado presentan aneuploidias cuando se evalúan cinco cromosomas (cromosomas 13, 18, 21, X e Y) mediante hibridación in situ fluorescente (FISH)35, que es una técnica de análisis citogenético que permite visualizar cromosomas concretos o secuencias específicas de estos, mediante su marcaje con sondas de ADN unidas a haptenos fluorescentes, permitiéndonos realizar un análisis indirecto del contenido cromosómico de los espermatozoides en interfase procedentes de eyaculado, epidídimo o testículo.
La inyección intracitoplasmática de espermatozoides (ICSI)36 ha facilitado la fecundación, incluso en casos de graves defectos de la espermiogénesis, y algunos grupos han informado de un aumento de la incidencia de anomalías en recién nacidos a través de esta TRA, mientras que otros no observan mayor riesgo con su uso. También se han descrito menores tasas de gestación tras ICSI en pacientes con FISH patológicos, así como un incremento de alteraciones cromosómicas en embriones a los que se les realizó diagnóstico genético preimplantatorio.
Estudio de meiosis en tejido testicularLa recombinación meiótica no solo sirve para generar la diversidad genética, sino también cruces de cromosomas homólogos, lo que facilita la correcta segregación de los cromosomas durante la meiosis. Las anomalías en la frecuencia y en la ubicación de los cruces están relacionadas con la no hacer disyunción de cromosomas homólogos y la producción de gametos aneuploides.
La inadecuada separación de los cromosomas durante la meiosis puede resultar en espermatozoides desequilibrados genéticamente. Si estos gametos participan en la fertilización, el embrión resultante puede ser aneuploide, ya sea trisómico o monosómico. La aneuploidia es la anormalidad cromosómica más común en los seres humanos, ya que se produce en el 5% de todos los embarazos y en el 0,3% de los nacidos vivos37.
Los estudios sobre la constitución cromosómica de los espermatozoides de los hombres infértiles han demostrado que esta población puede tener un riesgo aumentado de producir espermatozoides aneuploides38.
La incidencia de anomalías sinápticas es de un 6 a un 8%, que puede llegar a un 17,6% en varones con una grave oligozoospermia, y al 27% en los hombres normozoospérmicos con uno o más fracasos anteriores de FIV39.
Fragmentación del ADN espermático (DFI)Se estima que entre un 10 - 15% de los varones con disfunción reproductiva presentan espermiogramas normales. Diferentes metaanálisis publicados recientemente coinciden en que parece haber relación entre la fragmentación del ADN espermático y los resultados de las técnicas de reproducción asistida, al igual que sucede con los abortos de repetición40. El término “fragmentación del ADN” hace referencia al ADN desnaturalizado o dañado que no puede ser reparado. Su integridad es crucial tanto para la correcta fecundación como para el adecuado desarrollo temprano y tardío del embrión. El ovocito tiene capacidad para reparar parte del daño producido en el ADN espermático, siempre y cuando sea de hebra sencilla. Existen diferentes técnicas de análisis para la detección de este tipo de alteración. En los últimos años están cobrando mayor importancia aquellas que distinguen entre daño de hebra sencilla (reparable) y daño de hebra doble (irreparable). El problema radica en que existen varias técnicas que miden diferentes procesos y cuyos puntos de corte todavía no están bien definidos. La que mejor grado de predictibilidad ha demostrado hasta el momento ha sido el Ensayo COMETA alcalino41.
La edad avanzada, los hábitos tóxicos, la exposición a sustancias gonadotóxicas (resinas, metales pesados, insecticidas…), pacientes con varicocele, o expuestos a tratamientos de quimio o radioterapia, son más propensos a sufrir un mayor grado de alteración en la fragmentación del ADN espermático.
Existen diferentes estrategias para reducir la fragmentación del DNA: empleo de agentes antioxidantes, disminución del período de abstinencia sexual, o recurrir a técnicas de selección espermática (selección magnética de espermatozoides no apoptóticos o la microespectroscopia de Raman).
Pese a todos estos datos, las principales sociedades científicas ESHRE42 y ASRM43 no recomiendan por ahora el uso rutinario de este tipo análisis dada la disparidad de resultados publicados.
Recomendaciones de estudios genéticos en las mujeres y en los varonesEl tipo de recomendación se presenta en las tablas 5 y 6.
Variaciones en el número de copiasEl array-CGH detecta variantes en el número de copias (microdeleciones y microduplicaciones), analiza todo el genoma en profundidad pero no detecta alteraciones estructurales equilibradas. El análisis de genoma con la técnica de array CGH puede ser capaz de identificar nuevos marcadores genéticos para la infertilidad masculina44. Sin embargo, en la actualidad se considera como recomendación baja dado que la evidencia disponible es incierta y no permite hacer recomendaciones a favor o en contra de la prueba genética, salvo en casos que por la historia clínica esté justificado.
La detección masiva de enfermedades recesivasEl cribado antes de la concepción, junto con el asesoramiento genético de portadores, ha dado lugar a notables disminuciones en la incidencia de varias enfermedades recesivas graves en determinadas poblaciones, incluyendo la enfermedad de Tay-Sachs y la fibrosis quística45. Estos individuos son asintomáticos y tienen un historial familiar negativo para el trastorno. Existen en el mercado varios tipos de pruebas de cribado de enfermedades recesivas que incluyen alrededor de 400 enfermedades o genes recesivos. Dichas pruebas han de ser adecuadas para la población en estudio, dado que la incidencia de las enfermedades de herencia autosómica recesiva varía considerablemente de unas poblaciones a otras46-48.
La prueba se puede realizar simultáneamente en dos situaciones:
- 1.
Parejas que se someten a procedimientos de fertilización in vitro (FIV)49. Las parejas que realizan tratamientos de FIV deben conocer la existencia de estas pruebas y decidir sobre su realización. Así mismo, estas pruebas deben poder realizarse en los donantes de gametos. Se desconoce la eficacia de estos estudios en este grupo de pacientes.
- 2.
Individuos con alto riesgo de trastornos recesivos50. En este grupo se incluyen las parejas consanguíneas o con antecedentes de gestaciones con enfermedades severas de herencia recesiva o abortos de tercer trimestre en las que no se ha podido identificar la causa.
En la población general, no existen datos sobre la efectividad de la detección masiva de enfermedades recesivas.
Recomendaciones de estudios genéticos en donación de gametosSe define el concepto de donación como un hecho voluntario y altruista, que no resulte gravoso para el donante vivo y sin ánimo de lucro, aunque existe, en ciertas ocasiones, una compensación económica por parte de la institución para cubrir gastos y/o inconvenientes en concepto de dietas o ingresos perdidos.
Todas las guías y revisiones consultadas51-54 recomiendan seleccionar los donantes sobre la base del conocimiento de su historia clínica y entrevista personal realizada por un profesional médico responsable y conocedor de la materia. Se debe incidir en puntos relevantes para detectar riesgo en la salud a terceros (transmisión de enfermedades) o para su propia salud.
Actualmente todos las donaciones realizadas en nuestro país están reguladas por el Decreto-Ley 9/201455. Además de realizar test serológicos en el donante y en la pareja receptora, es necesaria que en la evaluación del donante se lleve a cabo una evaluación de la carga genética con relación a la existencia de genes autosómicos recesivos según el conocimiento científico y la prevalencia descrita en la etnia del donante. Además se evaluará del riesgo de transmisión de enfermedades hereditarias conocidas y presentes en la familia. Las diferentes sociedades científicas hablan de la importancia de detectar cualquier alteración genética antes de aceptar a un donante.
La evaluación del donante56 se representa en la tabla 7. Con respecto a la atrofia muscular espinal algunas sociedades defienden realizar el estudio de portadores tanto en donante de ovocitos como de semen, basándose en el impacto que supone en las familias afectadas.
Valoración del donante
| 1. Donantes (mujeres u hombres) |
| - No debe tener enfermedades hereditarias de origen mendeliano |
| - No debe tener malformaciones mayores de causa compleja poligénica, como la espina bífida o malformaciones cardiacas |
| - No debe presentar anomalía en el cariotipo de sangre periférica |
| - No debe tener enfermedades familiares de origen genético, especialmente familiares de primer grado (padres, hermanos e hijos) |
| - Estudio genético del gen CFTR |
| - Estudiar en los grupos étnicos si son portadores de: |
| Judíos: enfermedad de Tay-Sachs, enfermedad de Canavan |
| Afroamericanos: anemia falciforme |
| Procedencia mediterránea: B-talasemia |
| Sudoeste Asiático y China: alfa-talasemia |
| Todos los grupos étnicos: fibrosis quística |
| - Los familiares de primer grado deben estar libre de: |
| Desórdenes mendelianos |
| Malformaciones mayores |
| Anomalías cromosómicas: en este caso es obligatorio realizar un cariotipo al donante |
| Si la historia familiar revela un desorden que se puede estudiar mediante pruebas de laboratorio, y es importante que el candidato donador sea aceptado, entonces será apropiado evaluar ese desorden específico |
| 2. Donantes de semen: |
| - Varón sano y joven |
| - No existencia de retraso mental de etiología desconocida en familiares de primer grado |
| 3. Donantes de ovocitos: |
| - Edad entre 18- 35 años |
Se acepta como donante de gametos, si tras su evaluación, cumple los criterios clínicos y ausencia de alteraciones genéticas en los estudios realizados. Aunque en la actualidad no se suelen hacer otros estudios genéticos más que los indicados en la tabla 7 a los donantes hombres o mujeres, el médico debe de informar a la mujer receptora que técnicamente es posible realizar otros análisis genéticos y que no se hayan realizado y argumentar cuáles son sus limitaciones.
Epigenética y reproducciónActualmente el conocimiento de los mecanismos epigenéticos y el aumento de las evidencias de cómo modificaciones epigenéticas se relacionan con la enfermedad, hace que este campo esté presente en casi todas las áreas de la medicina, incluyendo la reproducción57.
Las modificaciones epigenéticas58 que podrían estar implicadas en reproducción se pueden dividir en dos:
- •
Alteraciones de la impronta.
- •
Alteraciones de la programación epigenética celular.
El primer mecanismo está relacionado con la reproducción asistida desde hace años, dado que hay autores que refieren un incremento de síndromes epigenéticos, tales como el síndrome de Beckwith-Wiedemann, tras técnicas de reproducción asistida, si bien otros autores no lo confirman59.
El segundo mecanismo relaciona enfermedades del adulto en relación con determinados hábitos y estados de nutrición de la madre durante el embarazo. Así, obesidad, diabetes tipo II y enfermedades cardiovasculares estarían relacionadas con alteraciones metabólicas durante el embarazo58,60. Además, en modelos de experimentación animal se ha constatado cómo determinados mRNA de los espermatozoides en respuesta a determinadas situaciones ambientales, pueden modificar epigenéticamente al embrión61.
En cualquier caso, habrá que esperar unos años para que las evidencias etiopatogénicas y sus mecanismos se conozcan ampliamente de forma que puedan entrar como recomendaciones preconcepcionales y/o futuras pruebas de laboratorio60.
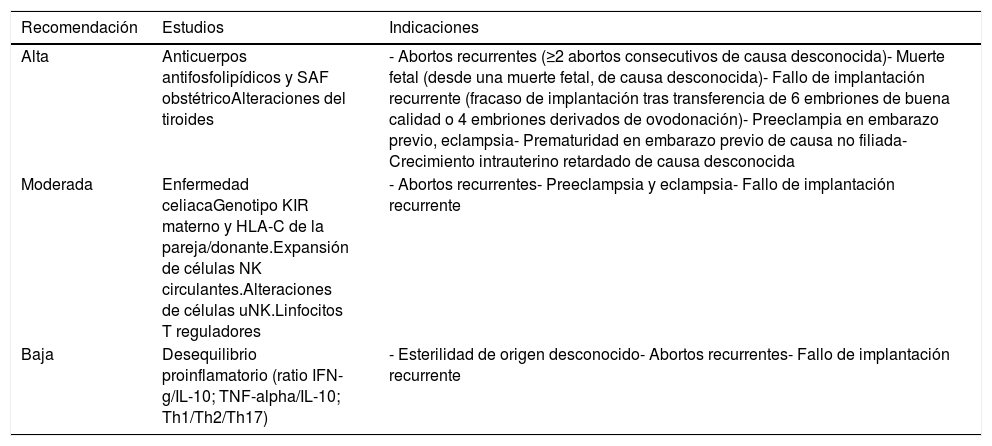
Estudios inmunológicosLas recomendaciones se representan en la tabla 8.
Grado de recomendaciones de estudio inmunológico e indicaciones
| Recomendación | Estudios | Indicaciones |
|---|---|---|
| Alta | Anticuerpos antifosfolipídicos y SAF obstétricoAlteraciones del tiroides | - Abortos recurrentes (≥2 abortos consecutivos de causa desconocida)- Muerte fetal (desde una muerte fetal, de causa desconocida)- Fallo de implantación recurrente (fracaso de implantación tras transferencia de 6 embriones de buena calidad o 4 embriones derivados de ovodonación)- Preeclampia en embarazo previo, eclampsia- Prematuridad en embarazo previo de causa no filiada- Crecimiento intrauterino retardado de causa desconocida |
| Moderada | Enfermedad celiacaGenotipo KIR materno y HLA-C de la pareja/donante.Expansión de células NK circulantes.Alteraciones de células uNK.Linfocitos T reguladores | - Abortos recurrentes- Preeclampsia y eclampsia- Fallo de implantación recurrente |
| Baja | Desequilibrio proinflamatorio (ratio IFN-g/IL-10; TNF-alpha/IL-10; Th1/Th2/Th17) | - Esterilidad de origen desconocido- Abortos recurrentes- Fallo de implantación recurrente |
La distribución de las células inmunológicas en el útero y la expresión de los antígenos (en particular de los antígenos del complejo mayor de histocompatibilidad, HLA) en el trofoblasto son únicos en la gestación y pueden reflejar algunos de los procesos que tienen lugar con el fin de proteger el feto y el trofoblasto en el embarazo normal. Por otra parte, la placenta humana es hemocorial, y la sangre materna (y por tanto, células del sistema inmunitario) se encuentran en contacto directo con tejido embrionario.
Al final del ciclo menstrual (fase lútea), momento en que tiene lugar la implantación embrionaria, siendo la etapa más precoz del embarazo, la mayoría de los linfocitos dominantes en el útero son las células natural killer (uNK), con fenotipo CD56bright, grandes productoras de citoquinas y factores de crecimiento y con baja citotoxicidad NK, esenciales en la invasión del endometrio, en la angiogénesis de las arterias uterinas y en la placentación. Contrasta con las células NK de sangre periférica (pNK) dominantes, que muestran un fenotipo CD16+CD56dim y que son citotóxicas y bajas productoras de citoquinas. En el trofoblasto velloso, que comprende la mayor parte de la placenta, no existe ninguna expresión de moléculas de HLA. En cambio, en el trofoblasto extravelloso, que se localiza en la base del anclaje velloso y del trofoblasto endovascular cerca de las células deciduales inmunocompetentes, existe una expresión de HLA-C, -E y –G (pero no –A ni –B). Las uNK presentan receptores para el HLA-C y –G embrionarios y tanto las HLA-G ligadas a la membrana como las solubles parecen modificar in vitro la citotoxicidad de las células NK y la producción de citoquinas. Además, la placenta parece permitir la trasferencia feto-materna de células inmunocompetentes en ambos sentidos, lo que parece desempeñar un papel importante en el mantenimiento de la tolerancia fetal por parte de la madre.
La composición única de las células inmunológicas y de los antígenos en la interfase materno-fetal ha llevado a distintas hipótesis sobre la interacción entre las células uNK y las moléculas HLA del trofoblasto, como estabilizadoras del embarazo normal. La prueba fundamental del reconocimiento específico de antígenos fetales por parte del sistema inmunitario adaptativo materno ocurre a través de células T reguladoras (Treg) uterinas con el fin de prevenir el rechazo anti-HLA.
Síndrome antifosfolipídicoDesde un punto de vista clínico, los anticuerpos antifosfolipídicos (aFL) se consideran como el factor de riesgo adquirido más frecuente en la pérdida recurrente del embarazo. Es una causa tratable de la pérdida gestacional recurrente, por lo tanto, su diagnóstico y tratamiento pueden evitar complicaciones obstétricas y en el puerperio tanto en la madre como en el feto asociadas con los aFL.
El síndrome antifosfolipídico (SAP) es un trastorno autoinmune sistémico caracterizado por manifestaciones clínicas como trombosis venosas o arteriales, trombocitopenia y/o complicaciones obstétricas. Las complicaciones del embarazo relacionadas con el SAP incluyen tanto complicaciones maternas (preeclampsia/eclampsia) como fetales (pérdida temprana o retardada y crecimiento intrauterino retardado y prematuridad). Los criterios de laboratorio incluyen la presencia de anticuerpos IgG e IgM frente a la cardiolipina (aCL), sus proteínas plasmáticas asociadas, predominantemente anticuerpos IgG e IgM frente a la beta2-glicoproteína (β2GPI) o bien la presencia de anticoagulante lúpico (LA). Los criterios declasificación de SAP incluyen un criterio clínico y un criterio de laboratorio.
Además, hay casos de SAP obstétrico en los que hay una respuesta inflamatoria primaria inducida por los aFL62–66. Algunos pacientes con SAP no tienen evidencias de ninguna enfermedad asociada definida (SAP primario), mientras que en otros pacientes el SAP ocurre en asociación con lupus eritematoso sistémico u otras enfermedades reumáticas o autoinmunes (SAP secundario).
El hipotiroidismo no controladoEl hipotiroidismo se asocia con un amplio espectro de trastornos reproductivos que van desde el desarrollo sexual anormal a irregularidades menstruales e infertilidad. En las mujeres en edad fértil, la autoinmunidad tiroidea es, sin duda, la causa más común de hipotiroidismo y, en la mayoría de los pacientes se encuentran anticuerpos frente a la peroxidasa tiroidea67,68. Los receptores de hormonas tiroideas se expresan en ovocitos humanos69,70, presentando las mujeres con anticuerpos antitiroideos una menor tasa de fecundación, menor tasa de implantación y de embarazo. Un estudio reciente ha puesto de relieve la importancia de los anticuerpos antitiroideos positivos (ATA, antiperoxidasa y antitiroglobulina) con relación a riesgo de aborto tras FIV-TE en comparación con las ATA negativas71, compatible con un estudio previo de esta misma asociación72.
La enfermedad celiaca no conocidaLa enfermedad celiaca es una enfermedad autoinmune que se caracteriza por una respuesta inmunológica al gluten de la dieta, con tasas de prevalencia estimada en adultos de 0,2 al 1% en Estados Unidos y Europa62. Estudios recientes y preliminares asocian la enfermedad celiaca no conocida con aborto recurrente y fracaso de implantación recurrente73.
Alteraciones de células NK uterinas y en sangre periféricaEl fenotipo y función de las células NK en sangre y endometrio es muy diferente como se ha mencionado y numerosas investigaciones en los últimos años se han focalizado sobre el estudio de estas poblaciones en la infertilidad74. Ambas poblaciones expresan diferentes receptores estimuladores e inhibidores en su superficie cuyo balance inducirá una respuesta tolerogénica o bien citotóxica.
Diversos estudios han relacionado alteraciones en el fenotipo de las células uNK con la pérdida gestacional recurrente y morbilidad obstétrica, fundamentalmente preeclampsia y eclampsia75–78. Sin embargo, su valor clínico como predictor de fallo reproductivo es controvertido, debido, entre otros factores, a las variaciones de estas células durante el ciclo79.
Numerosos estudios han relacionado una expansión de las células pNK en comparación con controles normales y mujeres embarazadas con pérdida gestacional recurrente, como un marcador subrogado de posible causa subyacente inmunológica e inflamatoria80–82. Estudios observacionales han propuesto que las células NK CD56+dimCD16+ (citotóxicas) y NKT son un biomarcador pronóstico de fallo gestacional recurrente83,84, aunque se requieren estudios más extensos para su validación.
Desregulación de respuestas Th1/Th2 y Th17/TregEl fallo gestacional recurrente idiopático se ha asociado con desregulaciones de las citoquinas en sangre periférica o en la interfase materno-fetal hacia un perfil proinflamatorio de respuesta T predominante Th1 y Th1785–91 frente a la gestación normal, en la que hay un predominio de citoquinas Th2 y Treg. En la primera parte del embarazo, la población de Treg es tres veces superior en la decidua que en sangre periférica, en la que también se expanden. Se ha asociado la disminución de Treg en la decidua y en sangre periférica con el fallo gestacional recurrente, sugiriendo su relevante papel en el mantenimiento del embarazo y en la supresión de la activación de linfocitos maternos hacia el feto alogénico92–96. Debe tenerse en cuenta que, como en otros estudios de laboratorio, el principal problema actual de estas pruebas es la estandarización de la técnica y el establecimiento de puntos de corte para esta afección.
Antígenos HLA y genotipo KIR maternoLos trabajos de Hiby et al. propusieron que la placentación está regulada por interacciones entre los receptores tipo inmunoglobulina de las células uNK (KIR) maternos y sus ligandos con las moléculas de HLA-C del embrión. La molécula de HLA-C es la más polimórfica de las moléculas HLA expresadas en el trofoblasto extravelloso y esta interacción parece bloquear la citotoxicidad de las células NK frente al trofoblasto. Los KIR expresados en la superficie de células NK pueden ser activadores o inhibidores y el balance entre ambas señales determina la actividad efectora de las células NK.
Combinaciones específicas del genotipo y fenotipo de KIR materno y el genotipo HLA-C de ambos padres son más prevalentes en mujeres con preeclampsia y abortos recurrentes97,98 y lo mismo sucede en parejas con FIR. Esto conlleva una elevada citotoxicidad frente a las células del trofoblasto. Recientemente, numerosos estudios sugieren que determinadas combinaciones del genotipo KIR materno y del HLA-C de ambos padres puede servir como indicador pronóstico de fallo gestacional recurrente aloinmune de fallo de implantación99–105.
Lectina de unión a manosaLa lectina de unión a manosa es una vía de activación del sistema del complemento. La base genética de la deficiencia de lectina de unión a manosa y sus efectos en el embarazo todavía no han sido establecidos, pero recientemente diferentes autores han propuesto que una deficiencia en lectina de unión a manosa puede estar relacionada con problemas reproductivos como corioamnionitis histológica, abortos recurrentes, preeclampsia y prematuridad. Sin embargo, más investigaciones son necesarias para entender la completa implicación que tiene esta deficiencia en la disfunción reproductiva106,107.
DeclaraciónEstas recomendaciones fueron desarrolladas en el marco de las sociedades científicas participantes y de expertos, como un servicio a sus miembros y a la práctica de los médicos. Aunque este documento refleja un tratamiento apropiado que se encuentra en la práctica de la medicina reproductiva, no es la intención de ser el único estándar de la práctica aprobado o que sirva para dictar un curso exclusivo de tratamiento. Pueden existir otras formas de estudiar casos, teniendo en cuenta las necesidades del paciente, los recursos disponibles, y las limitaciones prácticas institucionales o clínicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Artículo publicado previamente en Medicina Clínica. DOI:10.1016/j.medcli.2018.02.008, con el consentimiento de los autores y editores.