La preeclampsia (PE) constituye una de las principales causas de mortalidad materna y perinatal en el mundo. En los países desarrollados, los estudios apuntan a un importante aumento de la incidencia de PE en la última década, en parte, por el aumento de la prevalencia, en la población general, de enfermedades que afectan a la función vascular, como la diabetes, la hipertensión crónica o la enfermedad renal. En el presente documento se lleva cabo una revisión actualizada de la PE. Se describen los criterios diagnósticos y la fisiopatología de la enfermedad. El objetivo principal del documento es revisar los nuevos marcadores bioquímicos que pueden ser de utilidad en la práctica clínica para la predicción y el diagnóstico de la PE, así como los distintos métodos mediante los cuales se puede llevar a cabo su determinación.
Pre-eclampsia (PE) is one of the leading causes of maternal and perinatal mortality in the world. In developed countries, studies point to a significant increase in the incidence of PE in the last decade, partly due to the increase in the prevalence in the general population of diseases that affect vascular function, such as diabetes. chronic hypertension, or kidney disease. An updated review of PE is presented in this article. The diagnostic criteria and the pathophysiology of the disease are described. The main objective of the document is to review the new biochemical markers that may be useful in clinical practice for the prediction and diagnosis of PE, as well as the different methods by which yey can be determined.
La preeclampsia (PE) y la hipertensión gestacional se caracterizan por la aparición de una hipertensión de novo que aparece después de las 20 semanas de gestación. Tal y como aparece recogido en los criterios diagnósticos de la Sociedad Internacional para el Estudio de la Hipertensión en el Embarazo (ISSHP) de 20141, en el caso de la PE, esta hipertensión aparece acompañada por uno o más de las siguientes condiciones de nueva aparición: proteinuria (ratio proteína/creatinina en la orina>30mg/mmol (0,3mg/mg) o>300mg/día o al menos 1g/L (2+) en las tiras reactivas de orina); otras disfunciones orgánicas maternas, tales como insuficiencia renal, alteraciones hepáticas, complicaciones neurológicas, complicaciones hematológicas (trombocitopenia, hemólisis) y disfunciones útero-placentarias (restricción del crecimiento fetal).
La PE constituye una de las 4 grandes causas de mortalidad materna y perinatal en el mundo. Afecta a entre el 2-8% de los embarazos y asocia también altas tasas de morbilidad materna y fetal2. A nivel mundial, es la primera causa de admisión materna en unidades de cuidados intensivos y causa la muerte de 75.000 mujeres al año3,4. Los niños nacidos de madres con PE tienen aproximadamente 2 veces más riesgo de sufrir muerte neonatal, convulsiones o encefalitis neonatal5. Además, la PE es la causa de 300.000 muertes perinatales anuales, a nivel mundial. Cabe destacar, además, que la distribución sociodemográfica de la morbimortalidad materno-fetal asociada a la PE no es homogénea. La proporción de muertes asociadas a la eclampsia es menor en los países desarrollados, Europa y EE. UU., que en aquellos en vías de desarrollo6, debido principalmente al menor acceso a los cuidados prenatales y a la atención hospitalaria. Por lo tanto, el bajo nivel sociosanitario está asociado a mayor riesgo de PE grave2.
En los países desarrollados, los estudios apuntan a un importante aumento de la incidencia de PE en la última década, aunque con un mínimo incremento del riesgo en la morbimortalidad maternofetal, debido a la mejora en los tratamientos médicos7. Este incremento puede explicarse, en parte, por el aumento de la prevalencia, en la población general, de enfermedades que afectan a la función vascular, como la diabetes, la hipertensión crónica, la enfermedad renal o el síndrome antifosfolípido.
En Europa, la PE supone una quinta parte de los ingresos hospitalarios por complicaciones del embarazo8. En nuestro país se estima una incidencia de PE entorno al 1% de las gestantes9, con un aumento de la frecuencia relativa de PE grave respecto a estudios anteriores10.
La mayoría de las PE comienzan con una hipertensión moderada y síntomas no específicos, como náuseas, vómitos, o dolor epigástrico. Estos síntomas clínicos, junto con dolor de cabeza o alteraciones visuales, pueden tener un valor diagnóstico decisivo y alertar al clínico. Se ha de evaluar siempre la gravedad potencial del cuadro clínico, ya que la PE puede complicarse rápidamente y desembocar en una eclampsia o un síndrome de HELLP (del inglés H: hemólisis; EL: enzimas hepáticas elevadas; LP: bajo recuento plaquetario). Se cree, de hecho, que un 10-20% de las PE severas evolucionan a un síndrome de HELLP. La eclampsia, por su parte, aparece en el 1-2% de PE graves y se caracteriza por la presencia de convulsiones tónico-clónicas, no atribuibles a otras causas, durante el embarazo o el posparto reciente3.
Además de estas, existen otras complicaciones graves asociadas a la PE, no solo maternas (como coagulación intravascular diseminada, hemorragia cerebral, edema agudo de pulmón, insuficiencia renal y rotura hepática), sino también fetales (como restricción del crecimiento fetal, bajo peso al nacer, muerte fetal o hemorragia intracraneal)11. Es evidente, por tanto, la importancia del diagnóstico precoz, del estrecho seguimiento y de la capacidad de predicción mediante un cribado optimizado de la PE, incluso tras el parto, puesto que un porcentaje elevado de mujeres con PE presentan un alto riesgo de desarrollar otras complicaciones a largo plazo, como hipertensión crónica, diabetes y procesos asociados a enfermedad cardiovascular12. Sin embargo, el diagnóstico aún se basa en datos clínicos y de laboratorio que son inespecíficos y, en algunos casos, de presentación variable o incluso tardía.
Objeto y campo de aplicaciónEn el presente documento se lleva cabo una revisión actualizada de la PE. Aunque a lo largo del mismo se describen los criterios diagnósticos o la fisiopatología de la enfermedad, el objetivo principal del documento es describir los nuevos marcadores bioquímicos que pueden ser de utilidad en la práctica clínica en la predicción y el diagnóstico de la PE, así como de distintos métodos mediante los cuales se puede llevar a cabo su determinación.
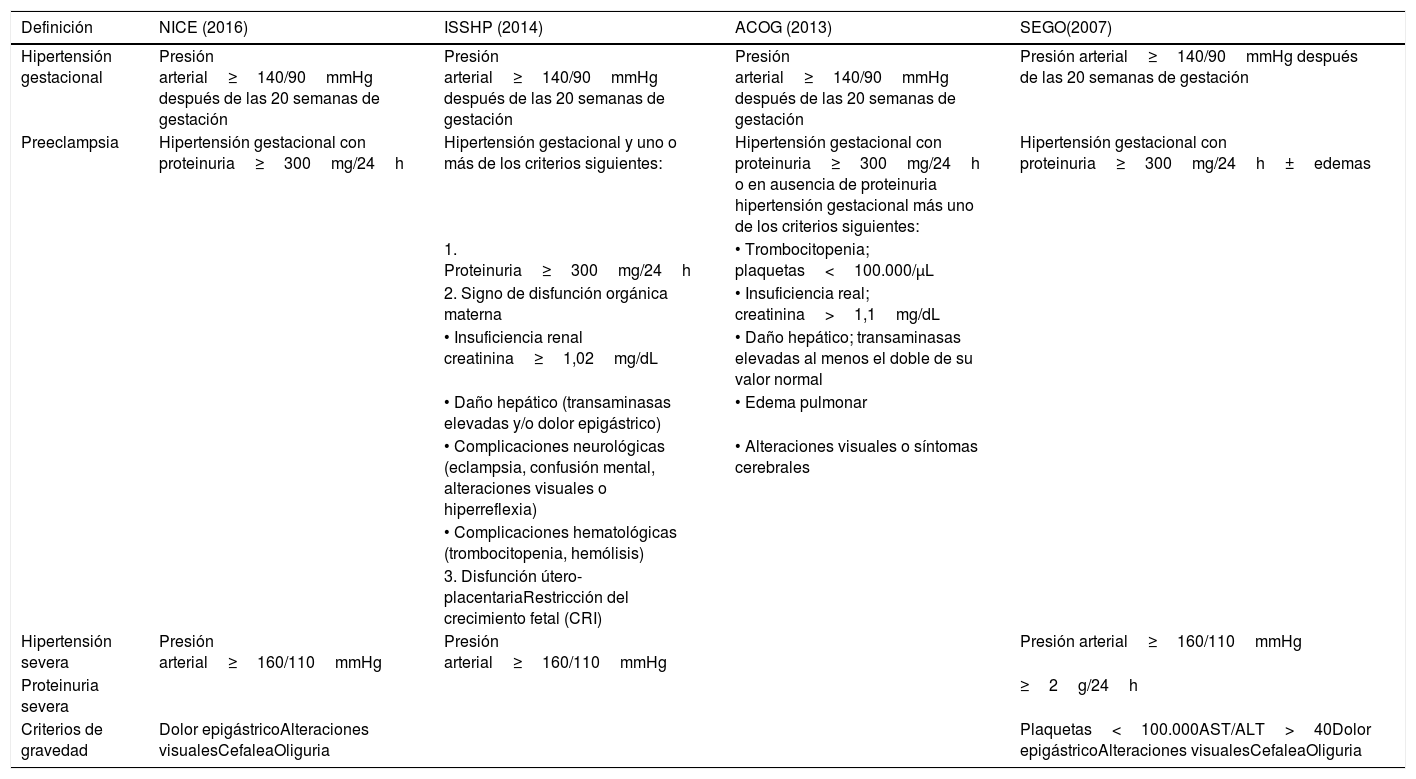
Nuevas definiciones y clasificaciónAtendiendo a nuevos criterios, recientemente se ha comenzado a considerar diferentes formas de PE, lo que dificulta la clasificación, pero abre nuevas posibilidades para evaluar cuál es el manejo óptimo de este grupo de gestantes13. Algunos autores señalan que se puede empezar a hablar de PE grave en presencia de una presión arterial sistólica≥160mmHg y/o una diastólica≥110mmHg asociada a proteinuria, o ante una hipertensión asociada a proteinuria grave (≥2g en orina de 24h) o acompañada de algún signo o síntoma de afectación multiorgánica. Sin embargo, aunque la PE es un desorden multiorgánico, no afecta en la misma medida a todos los órganos, y, de hecho, algunos autores describen incluso que hasta un 10% de las mujeres con PE no llegan a presentar hipertensión14.
Actualmente no existe una clasificación universalmente aceptada de la PE, encontrándose diferencias entre los distintos países y sociedades científicas (tabla 1).
Definición de preeclampsia, comparación internacional
| Definición | NICE (2016) | ISSHP (2014) | ACOG (2013) | SEGO(2007) |
|---|---|---|---|---|
| Hipertensión gestacional | Presión arterial≥140/90mmHg después de las 20 semanas de gestación | Presión arterial≥140/90mmHg después de las 20 semanas de gestación | Presión arterial≥140/90mmHg después de las 20 semanas de gestación | Presión arterial≥140/90mmHg después de las 20 semanas de gestación |
| Preeclampsia | Hipertensión gestacional con proteinuria≥300mg/24h | Hipertensión gestacional y uno o más de los criterios siguientes: | Hipertensión gestacional con proteinuria≥300mg/24h o en ausencia de proteinuria hipertensión gestacional más uno de los criterios siguientes: | Hipertensión gestacional con proteinuria≥300mg/24h±edemas |
| 1. Proteinuria≥300mg/24h | • Trombocitopenia; plaquetas<100.000/μL | |||
| 2. Signo de disfunción orgánica materna | • Insuficiencia real; creatinina>1,1mg/dL | |||
| • Insuficiencia renal creatinina≥1,02mg/dL | • Daño hepático; transaminasas elevadas al menos el doble de su valor normal | |||
| • Daño hepático (transaminasas elevadas y/o dolor epigástrico) | • Edema pulmonar | |||
| • Complicaciones neurológicas (eclampsia, confusión mental, alteraciones visuales o hiperreflexia) | • Alteraciones visuales o síntomas cerebrales | |||
| • Complicaciones hematológicas (trombocitopenia, hemólisis) | ||||
| 3. Disfunción útero-placentariaRestricción del crecimiento fetal (CRI) | ||||
| Hipertensión severa | Presión arterial≥160/110mmHg | Presión arterial≥160/110mmHg | Presión arterial≥160/110mmHg | |
| Proteinuria severa | ≥2g/24h | |||
| Criterios de gravedad | Dolor epigástricoAlteraciones visualesCefaleaOliguria | Plaquetas<100.000AST/ALT>40Dolor epigástricoAlteraciones visualesCefaleaOliguria |
ACOG: American College of Obstetricians and Gynecologists; ISSHP International Society for the Study of Hypertension in Pregnancy; NICE National Institute for Health and Care Excellence; SEGO: Sociedad Española de Obstetricia y Ginecología.
La American College of Obstetricians and Gynecologists (ACOG), en su revisión del año 2013, redefinió la PE ante la evidencia de que el diagnóstico a veces se retrasa en ausencia de proteinuria evidente y el hecho de que la gravedad de la proteinuria no correlaciona con el pronóstico fetal o materno. A partir de entonces, se considera PE toda hipertensión gestacional que, aún en ausencia de proteinuria, asocie ciertos factores de gravedad como trombocitopenia, alteración del perfil hepático, insuficiencia renal (creatinina>1,1mg/dL), edema pulmonar o aparición de alteraciones visuales o cerebrales15.
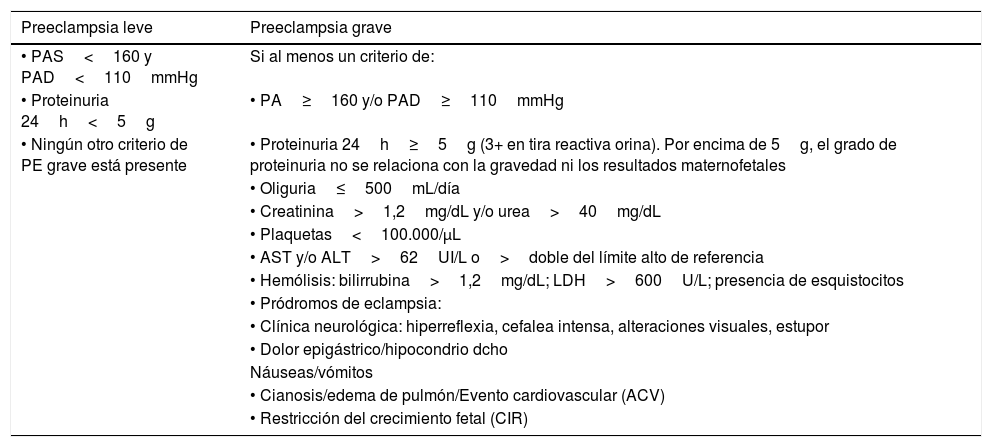
En España, ya en el 2007 la Sociedad Española de Ginecología y Obstetricia (SEGO) publicó de manera más detallada los criterios de clasificación de la PE (tabla 2)16. Así, en función de la gravedad de la hipertensión, se hablará de PE leve, moderada y grave, y según la semana gestacional de presentación de los síntomas maternos, la PE se considera temprana (o precoz) cuando aparece antes de la semana 34 y tardía cuando aparece después de la semana 34 de gestación.
Clasificación preeclampsia, SEGO, 2007
| Preeclampsia leve | Preeclampsia grave |
|---|---|
| • PAS<160 y PAD<110mmHg | Si al menos un criterio de: |
| • Proteinuria 24h<5g | • PA≥160 y/o PAD≥110mmHg |
| • Ningún otro criterio de PE grave está presente | • Proteinuria 24h≥5g (3+ en tira reactiva orina). Por encima de 5g, el grado de proteinuria no se relaciona con la gravedad ni los resultados maternofetales |
| • Oliguria≤500mL/día | |
| • Creatinina>1,2mg/dL y/o urea>40mg/dL | |
| • Plaquetas<100.000/μL | |
| • AST y/o ALT>62UI/L o>doble del límite alto de referencia | |
| • Hemólisis: bilirrubina>1,2mg/dL; LDH>600U/L; presencia de esquistocitos | |
| • Pródromos de eclampsia: | |
| • Clínica neurológica: hiperreflexia, cefalea intensa, alteraciones visuales, estupor | |
| • Dolor epigástrico/hipocondrio dcho | |
| Náuseas/vómitos | |
| • Cianosis/edema de pulmón/Evento cardiovascular (ACV) | |
| • Restricción del crecimiento fetal (CIR) |
Fuente: Protocolos SEGO16.
Sin embargo, la guía National Institute for Health and Care Excellence (NICE), en su revisión del año 2016, continúa manteniendo la proteinuria como factor necesario de PE y no recoge la existencia de una PE atípica, o incompleta, en la que puede no evidenciarse hipertensión o proteinuria11.
En los últimos años, distintos estudios parecen mostrar que hay un mayor grado de disfunción placentaria en la PE temprana, asociada a un mayor riesgo de retraso en el crecimiento fetal que en la PE de presentación tardía y, por tanto, la PE tardía constituiría una entidad clínica menos grave2,17. De hecho, en comparación con las mujeres sin PE, las mujeres con PE temprana tienen 7 veces más riesgo de tener un feto pequeño para su edad gestacional, mientras que en mujeres con PE tardía el riesgo aumenta 3 veces2.
Factores de riesgo y etiologíaLa causa exacta de la PE continúa siendo desconocida, pero está descrito que la disfunción placentaria está en su origen. Los estudios sobre morfología placentaria indican que la PE es una entidad heterogénea de etiología multifactorial. Se sabe que la mala adaptación inmunitaria, la susceptibilidad genética y diversos problemas maternos influyen en la evolución de la enfermedad.
Existen numerosos factores maternos que predisponen a padecer este síndrome:
- •
Nuliparidad
- •
PE en embarazo anterior
- •
Edad<20 años o≥40 años
- •
Índice de masa corporal≥35kg/m2
- •
Etnia afroamericana
- •
Embarazo por técnicas de reproducción asistida
- •
Historia familiar de PE en madre o hermana
- •
Embarazo múltiple
- •
Enfermedades previas: hipertensión arterial, enfermedad renal, diabetes o síndrome antifosfolípido
Además de estos factores, existe otro grupo de factores placentarios, implicados en el desarrollo de la PE, que tiene su base en la disminución de la perfusión placentaria por causas inmunológicas, genéticas de origen paterno, factores ambientales y factores nutricionales.
Estudios recientes también indican que la etiología de la PE temprana y de la PE tardía es distinta, con diferencias en morbimortalidad materna y fetal, así como en los factores de riesgo14,17–19.
Las mujeres con hipertensión crónica tienen hasta 10 veces mayor riesgo de desarrollar una PE temprana. Por el contrario, existe una fuerte asociación entre diabetes y PE tardía, lo que indica una insuficiencia placentaria más frecuente en embarazos de gestantes diabéticas con fetos de gran tamaño5.
FisiopatologíaDesde el punto de vista fisiopatológico, la PE es un estado de marcada vasoconstricción secundario a una disfunción del endotelio vascular, en lugar de la vasodilatación propia del embarazo.
El origen de la PE parece estar en la reducción de la perfusión útero-placentaria, como resultado de la invasión anormal de las arterias espirales por el trofoblasto. La invasión trofoblástica requiere un proceso de vascularización para establecer la red vascular fetomaterna y, finalmente, completar la remodelación de las arterias espirales, a fin de formar la circulación útero-placentaria. El déficit de perfusión y la isquemia placentarias constituyen la alteración fundamental en la PE, por una implantación placentaria insuficiente, pero también en casos de desproporción entre tejido trofoblástico y perfusión sanguínea.
Sin embargo, el fallo en la placentación no es suficiente para explicar la alteración endotelial que origina la PE y el síndrome materno. Esto sugiere una enfermedad en 2 pasos. Inicialmente, debido a la invasión anormal de las arterias espirales por el trofoblasto se establece una deficiente circulación placentaria, que conlleva la subsiguiente hipoxia de la placenta, en la primera mitad de la gestación. Las manifestaciones clínicas de una alteración en el desarrollo trofoblástico aparecen a posteriori en la gestación, cuando los requerimientos nutricionales para el normal desarrollo del feto comienzan a superar la capacidad placentaria para suministrar la cantidad de flujo sanguíneo necesario. En estas condiciones, la placenta reacciona liberando a la circulación una serie de compuestos responsables de la disfunción endotelial sistémica materna, durante la segunda mitad de la gestación, entre los que cabe destacar factores reguladores del equilibrio angiogénico, como la forma soluble de la tirosincinasa 1 (receptor soluble tipo tirosincinasa 1 [sFlt-1]), como se describirá a continuación.
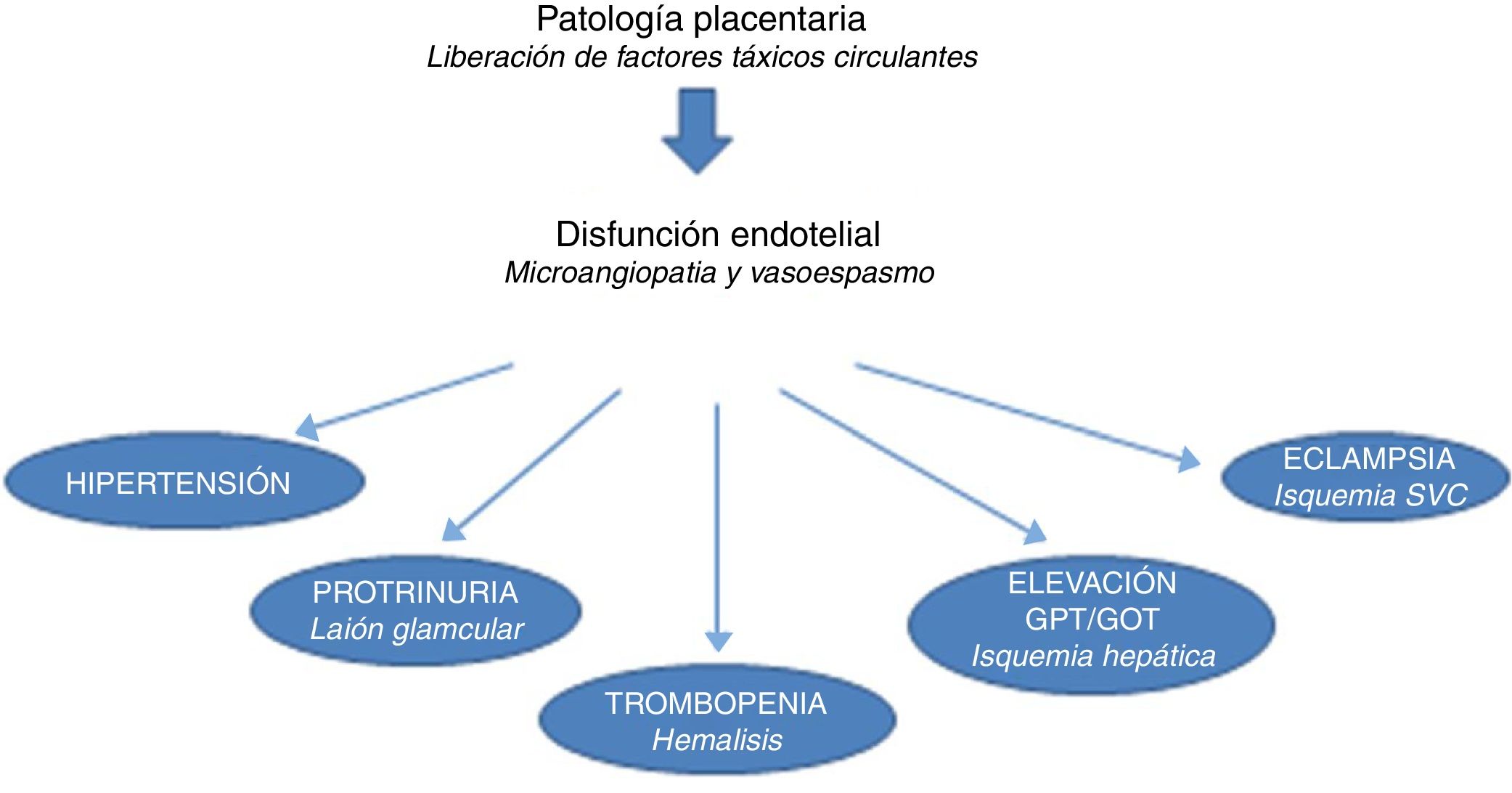
Por este motivo, actualmente, la mayoría de los autores consideran que el punto de convergencia entre las causas maternas y placentarias se produce en la lesión endotelial: los factores de riesgo materno y fetoplacentarios generan estrés oxidativo y disfunción endotelial y llevan al cuadro sistémico, una microangiopatía generalizada y vasoespasmo (fig. 1)16.
El cuadro clínico es desencadenado por la disfunción de las células endoteliales junto a alteraciones vasculares como vasoconstricción, el aumento de la permeabilidad capilar y la agregación plaquetaria. Esto se debe al desequilibrio entre las prostaglandinas vasodilatadoras frente a las vasoconstrictoras, quizá mediado por exceso de producción de citocinas proinflamatorias, y una concentración anormal de los factores angiogénicos y antiangiogénicos.
No obstante, el desequilibrio antiangiogénico/angiogénico no siempre conduce a PE. Se observa alteración de estos biomarcadores en otras formas de disfunción placentaria, tales como retraso de crecimiento intrauterino y abruptio placentae20. Es preciso que exista también una susceptibilidad materna al daño endotelial mantenido. Por otra parte, la PE de comienzo tardío se asocia más a factores maternos de riesgo cardiovascular, hipertensión crónica, enfermedad renal, obesidad, trombofilia y diabetes, que al daño vascular placentario por desequilibrio de factores angiogénicos/antiangiogénicos.
Factores angiogénicos y antiangiogénicosLos factores angiogénicos y antiangiogénicos son moléculas clave en la regulación de los cambios vasculares que se producen en la placentación. Se ha descrito que en la PE se produce un desequilibrio en la producción y liberación de estos factores, que puede dar lugar a las manifestaciones clínicas de la enfermedad.
Factores angiogénicosSe han descrito numerosos factores implicados en el proceso de angiogénesis y de remodelamiento de las arterias espirales uterinas, entre los que destacan 2 componentes clave:
Factor de crecimiento endotelial vascularEl factor de crecimiento endotelial vascular (VEGF) se trata de una familia de moléculas que incluyen las VEGF-A, VEGF-B, VEGF-C, VEGF-D y el factor de crecimiento placentario (PlGF). Poseen 3 receptores tirosincinasa: VEGFR-1 (Flt-1), VEGFR-2 (KDR) y el VEGFR-3 y 2 correceptores no proteincinasa: neuroepitelina-1 y 221.
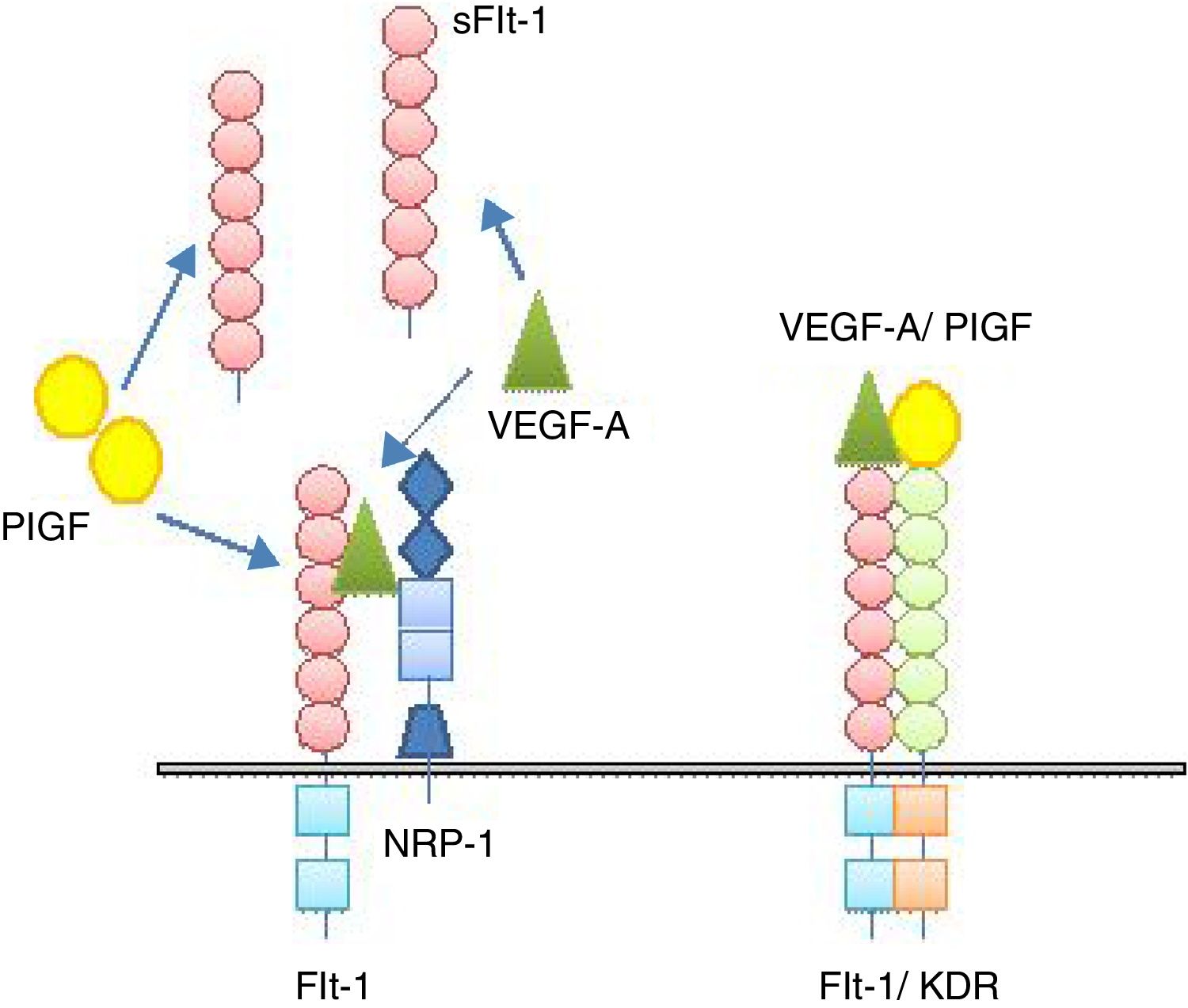
El receptor VEGFR-1 es un receptor de membrana para los factores VEGF-A, VEGF-B y PlGF. Los homodímeros de PlGF se unen a los receptores VEGFR-1 asociados a la neuroepitelina 1; mientras que los heterodímeros constituidos por la unión de las moléculas PlGF y VEGF-A se unen a los receptores diméricos Flt-1/KDR (fig. 2)22.
Interacciones de los factores angiogénicos factor de crecimiento endotelial vascular (VEFG-A) y factor de crecimiento placentario (PlGF) con los factores antiagiogénicos receptor del factor de crecimiento endotelial vascular tipo 1 (Flt-1) y su forma soluble sFlt-1. KDR: receptor del dominio de inserción de quinasa; NRP-1: neuroepitelina 1.
Todos ellos están presentes en la placenta humana y desempeñan un importante papel en la vasculogénesis y la angiogénesis durante el desarrollo placentario.
Factor de crecimiento placentarioPlGF es una glucoproteína dimérica glucosilada que se encuentra primordialmente en el citotrofoblasto de la placenta y en otros tejidos como corazón y pulmón. El gen PlGF, que codifica la proteína, se localiza en el cromosoma 14 humano y está constituido por 7 exones. Se han descrito 4 isoformas proteicas, PlGF-1 (PlGF131), PlGF-2 (PlGF152), PlGF-3 (PlGF203) y PlGF-4(PlGF224) que difieren en su secreción y afinidad de unión al receptor.
No se conoce exactamente la función del PlGF, pero parece desempeñar un papel importante en la regulación de la angiogénesis. Entre los mecanismos propuestos destacan estimular a las células endoteliales vía receptor Flt-1, potenciar la acción de VEGF-A, reclutar monocitos y macrófagos (los cuales tienen un papel crucial en el crecimiento de los vasos sanguíneos) e inducir la secreción de VEGF-A desde los monocitos22.
Factores antiangiogénicosLos factores antiangiogénicos mejor descritos, que intervienen en el inicio y desarrollo de la PE son:
Receptor soluble tipo tirosincinasa 1Se trata de la forma soluble del receptor del factor de crecimiento endotelial vascular-1 (VEGFR-1 o Flt-1), que se produce en respuesta a la hipoxia placentaria. Esta proteína actúa uniéndose al dominio de unión al receptor del PlGF, así como al VEGF-A y VEGF-B con gran afinidad. Inhibe la unión de PlGF a Flt-1 y la unión de VEGF-A a los receptores Flt-1 y KDR y, por lo tanto, disminuye la angiogénesis placentaria.
Recientemente se ha descrito una nueva variante soluble de Flt-1, sFlt-14 que no se encuentra en las células endoteliales y sí aparece en la placenta a término. Así, la expresión de las isoformas solubles de Flt-1 cambia durante el embarazo. sFlt-1 es la forma predominante en el primer trimestre mientras que sFlt-14 es la forma casi exclusiva a término. Se sintetiza especialmente en los sincitiotrofoblastos degenerativos (nudos sincitiales) y su capacidad inhibitoria angiogénica es similar a la de sFlt-123.
En modelos gestantes animales, sFlt-1 promueve hipertensión, proteinuria y endoteliosis glomerular, características clínicas de la PE, lo cual apoya su papel fisiopatológico en dicha entidad24.
Endoglina solubleLa endoglina o CD105 es un correceptor de la superficie celular para las isoformas del factor de crecimiento transformante TGF-β1 y TGF-β3, que se encuentra en abundancia en las células del endotelio vascular y sincitiotrofoblasto. Entre sus acciones se encuentran promover la angiogénesis, diferenciación endotelial y la regulación de la enzima óxido nítrico sintetasa. La forma soluble del receptor (sEng) tiene propiedades antiangiogénicas ya que dificulta la unión de TGF-β a la endoglina y a la señalización intracelular, que contribuyen al desarrollo de la PE25. Las concentraciones séricas de sEng se incrementan en el embarazo normal conforme avanza la edad gestacional. En la PE temprana los valores son más elevados desde la semana 18 de embarazo y la diferencia se incrementa conforme avanza la gestación. Concentraciones elevadas de sEng suero aumentan 8-10 semanas antes de que se manifieste clínicamente la PE y tienen correlación con la gravedad de la enfermedad26,27.
Un estudio reciente, prospectivo y multicéntrico, en el que estudian 47 biomarcadores en embarazadas con sospecha de PE, muestra que el uso de un solo marcador (PlGF, sFlt-1 o endoglina) representa una prueba diagnóstica para determinar si la PE requiere provocar el parto en 14 días o mantener una actitud expectante. En este contexto, biomarcadores como el PlGF, que pueden ser analizados rápidamente, ayudan a estratificar el riesgo de una embarazada con sospecha de PE pretérmino28.
Evolución del factor de crecimiento placentario y receptor soluble tipo tirosincinasa 1 durante el embarazoA lo largo de los últimos años, se han llevado a cabo numerosos estudios centrados en encontrar marcadores bioquímicos que permitan predecir y/o llevar a cabo un diagnóstico precoz de PE. Algunos de los marcadores estudiados son el ácido úrico, marcadores bioquímicos placentarios y fetales como la cistatina C, proteína asociada al embarazo (PAPP-A), proteína placentaria (PP-13), alfa-1 microglobulina o la hemoglobina fetal, y otros potenciales marcadores que se han conseguido gracias al desarrollo de la proteómica, genómica y metabolómica29.
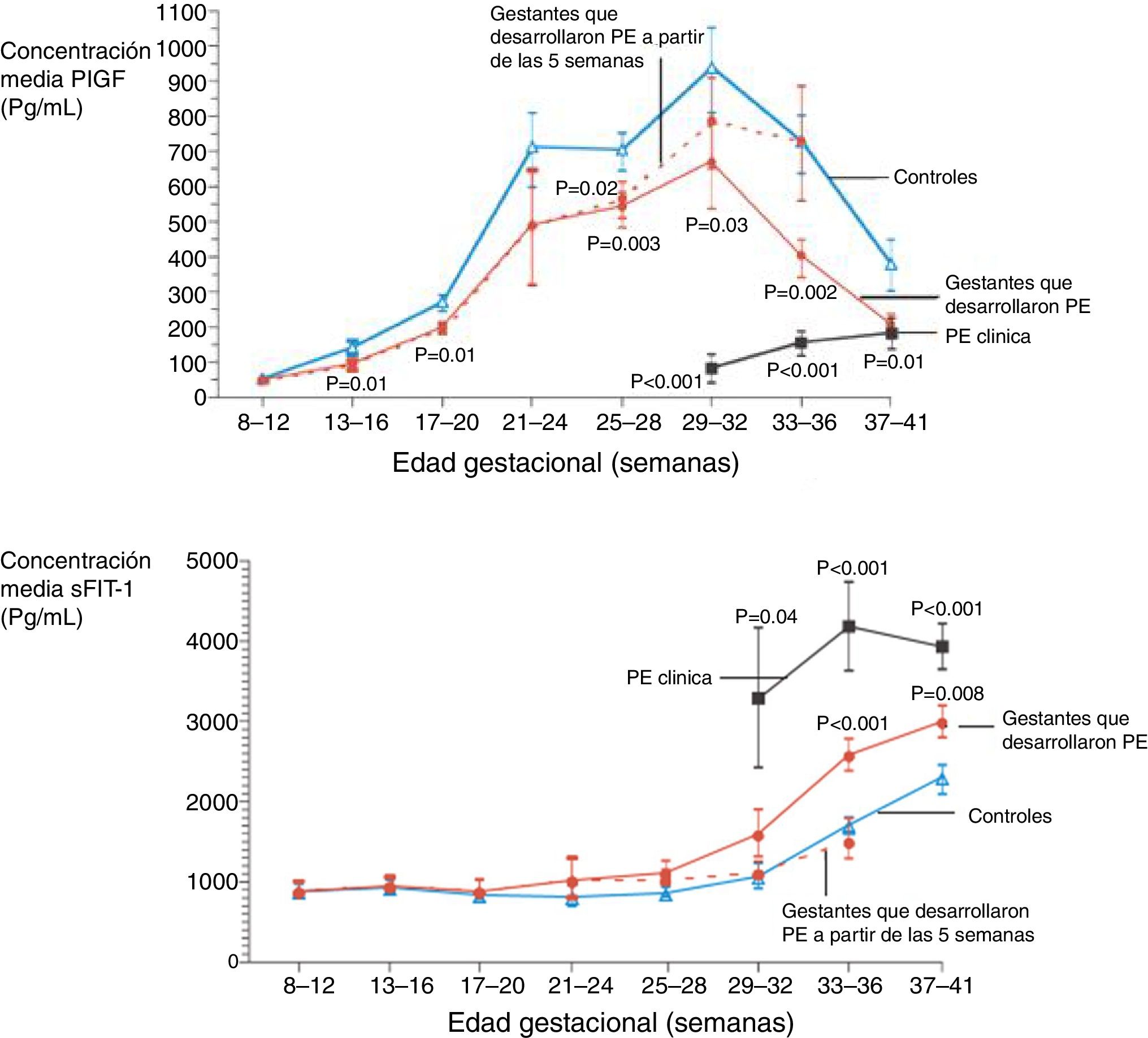
De todos ellos, PlGF y sFlt-1 se han constituido como los principales biomarcadores séricos de PE actualmente, ya que numerosos estudios muestran cambios significativos en sus concentraciones incluso antes del inicio de la PE. Durante el embarazo normal las concentraciones séricas de PlGF aumentan progresivamente durante el primer trimestre, y de forma más acusada en el segundo, alcanzando las concentraciones más elevadas alrededor de las semanas 29-32 de gestación, para posteriormente disminuir. Por el contrario, las concentraciones de sFlt-1 permanecen más o menos estables hasta las semanas 29-32 y luego aumentan rápidamente hasta el parto (fig. 3)30.
Concentraciones medias de factor de crecimiento de placentario (PlGF) y receptor soluble tipo tirosincinasa 1 (sFlt-1) en el embarazo. La línea discontinua de color rojo indica la tendencia de los valores medios observados en mujeres que desarrollaron PE a lo largo de las 5 semanas siguientes a la determinación. Modificada de Levine et al.30.
En gestantes que desarrollan PE y disfunción placentaria se observan concentraciones séricas de PlGF significativamente más bajas desde el final del primer trimestre. Estos valores más bajos se manifiestan más claramente en la fase clínica de la PE temprana en comparación con el embarazo normal (fig. 3).
Las concentraciones de sFlt-1 en gestantes que desarrollan PE se elevan más tardíamente y de forma menos pronunciada. De hecho, el análisis de sFlt-1 no resulta útil para la detección de embarazadas en riesgo de desarrollar PE (cribado). No obstante, a partir de la semana 29, sFlt-1 comienza a elevarse de modo más pronunciado.
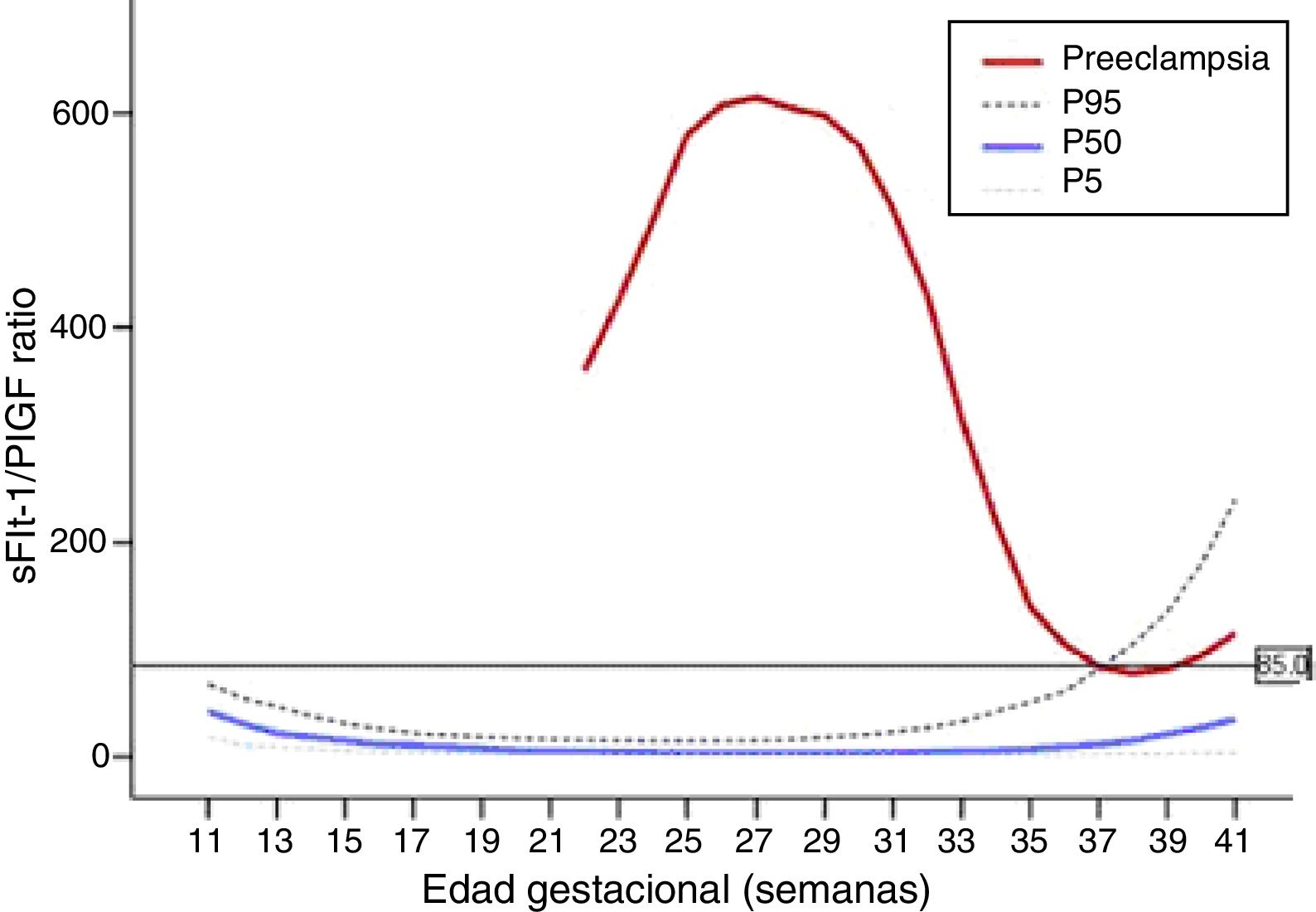
La figura 4 muestra la evolución del cociente sFlt-1/PlGF durante el embarazo. El cociente se eleva en PE, alcanzando la máxima diferencia entre las semanas 26 y 31. Después, el cociente tiende a converger en los embarazos normales y con PE, lo que puede limitar su utilidad clínica20.
Evolución del cociente sFlt-1/PlGF en función de la edad gestacional (en semanas). Se indican la mediana (p50), los percentiles 5 (p5) y 95 (p95) de la distribución del marcador en gestaciones normales, así como una línea roja que refleja la tendencia observada en gestantes con PE. La línea continua horizontal representa el punto de corte considerado de utilidad diagnóstica (ratio=85). Modificada de Herráiz et al.20.
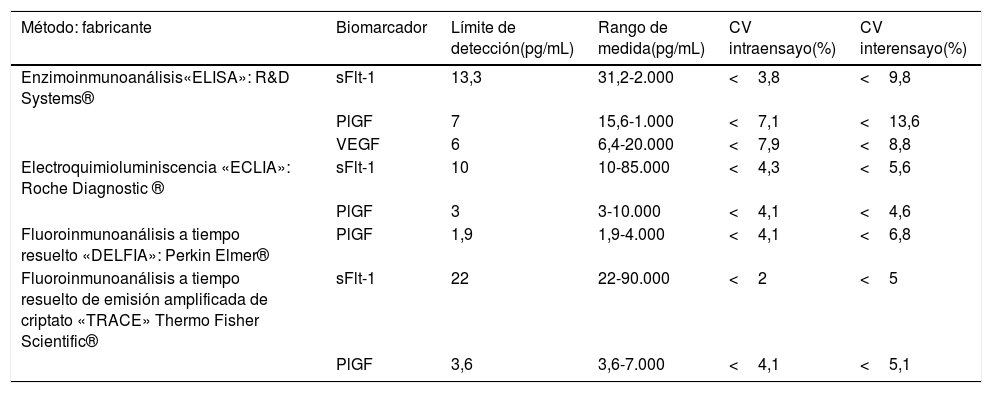
Las primeras publicaciones sobre la utilidad diagnóstica del PlGF y sFlt-1 se realizaron mediante inmunoanálisis manuales ELISA con R&D Systems®. Posteriormente, otros fabricantes desarrollaron otros métodos para plataformas automatizadas que han mejorado prestaciones analíticas como el tiempo de análisis, el rango de medida y la imprecisión, entre otras. Los resultados pueden no ser siempre intercambiables entre diferentes fabricantes, si bien un estudio reciente comparó el método de Roche Diagnostics® con el de ThermoFisherScientific® concluyendo que ambos son similares31.
Las guías NICE70 recomiendan el PlGF, determinado con el método de Triage de Alere®, y el cociente sFlt-1/PlGF, medido con el método del de Roche Diagnostics®, junto con criterios clínicos, para descartar PE en embarazadas con sospecha entre las semanas 20 y 34 de gestación. Sin embargo, actualmente el método Triage de Alere® para PlGF no está disponible por cese en su fabricación. Los métodos DELFIA de Perkin Elmer® para PlGF1-2-3 y el TRACE de ThermoFisher Scientific® para sFlt-1 y PlGF no se recomiendan en el Sistema de Salud del Reino Unido por falta de validación clínica70.
La tabla 3 resume las principales características técnicas de los métodos actualmente disponibles descritas por los fabricantes.
Métodos y fabricantes disponibles, para la determinación del receptor soluble tipo tirosincinasa 1(sFlt-1), del factor de crecimiento placentario (PlGF) y del factor de crecimiento endotelial vascular (VEGF): principales características técnicas
| Método: fabricante | Biomarcador | Límite de detección(pg/mL) | Rango de medida(pg/mL) | CV intraensayo(%) | CV interensayo(%) |
|---|---|---|---|---|---|
| Enzimoinmunoanálisis«ELISA»: R&D Systems® | sFlt-1 | 13,3 | 31,2-2.000 | <3,8 | <9,8 |
| PlGF | 7 | 15,6-1.000 | <7,1 | <13,6 | |
| VEGF | 6 | 6,4-20.000 | <7,9 | <8,8 | |
| Electroquimioluminiscencia «ECLIA»: Roche Diagnostic ® | sFlt-1 | 10 | 10-85.000 | <4,3 | <5,6 |
| PlGF | 3 | 3-10.000 | <4,1 | <4,6 | |
| Fluoroinmunoanálisis a tiempo resuelto «DELFIA»: Perkin Elmer® | PlGF | 1,9 | 1,9-4.000 | <4,1 | <6,8 |
| Fluoroinmunoanálisis a tiempo resuelto de emisión amplificada de criptato «TRACE» Thermo Fisher Scientific® | sFlt-1 | 22 | 22-90.000 | <2 | <5 |
| PlGF | 3,6 | 3,6-7.000 | <4,1 | <5,1 |
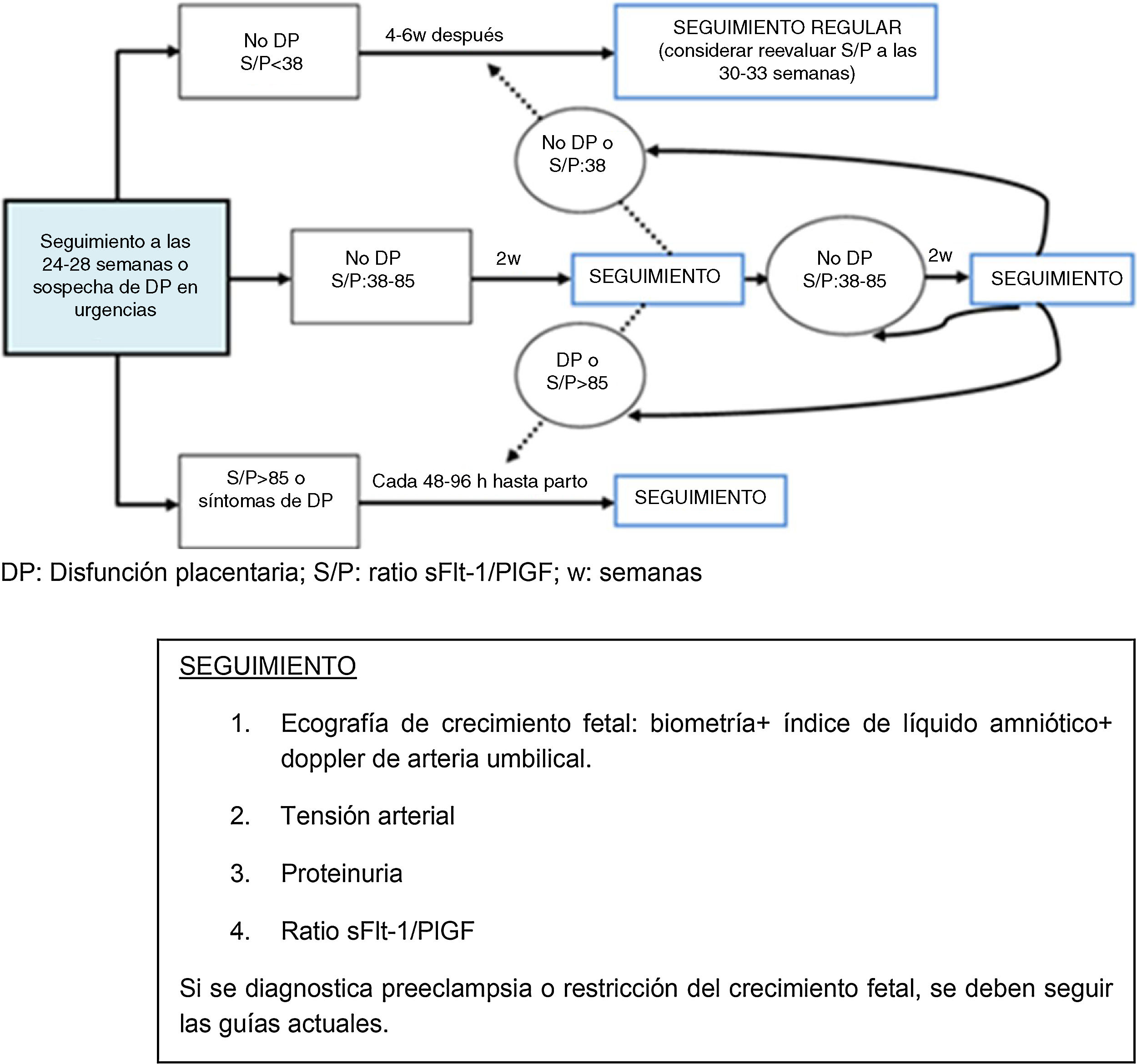
En el algoritmo de la actuación clínica clásica, descrito en 2005 por Sibai et al.32, aún no se consideraba ninguno de estos marcadores para evaluar el riesgo de desarrollar PE. Posteriores evidencias de la utilidad clínica de dichos marcadores, descritas en el apartado anterior, han modificado estos algoritmos de modo que, en los últimos años, se ha intentado diseñar y optimizar modelos de predicción de PE, incluyendo nuevos biomarcadores, capaces de clasificar a las gestantes según su riesgo más allá de los 26 factores maternos reconocidos33. Un ejemplo de estos algoritmos es el propuesto por Herraiz et al.20, en el que incluyen el cociente sFlt-1/PlGF, junto con otros parámetros, para selección de pacientes con riesgo de desarrollar enfermedades relacionadas con la disfunción placentaria (fig. 5). Los modelos basados en antecedentes obstétricos y en riesgo clínicos no han sido capaces de obtener buenos resultados en la predicción de PE, alcanzando escasamente un 30-40% de sensibilidad34,35.
Algoritmo propuesto para la selección de pacientes con riesgo de desarrollar enfermedades relacionadas con la disfunción placentaria. Modificada de Herraiz et al.20.
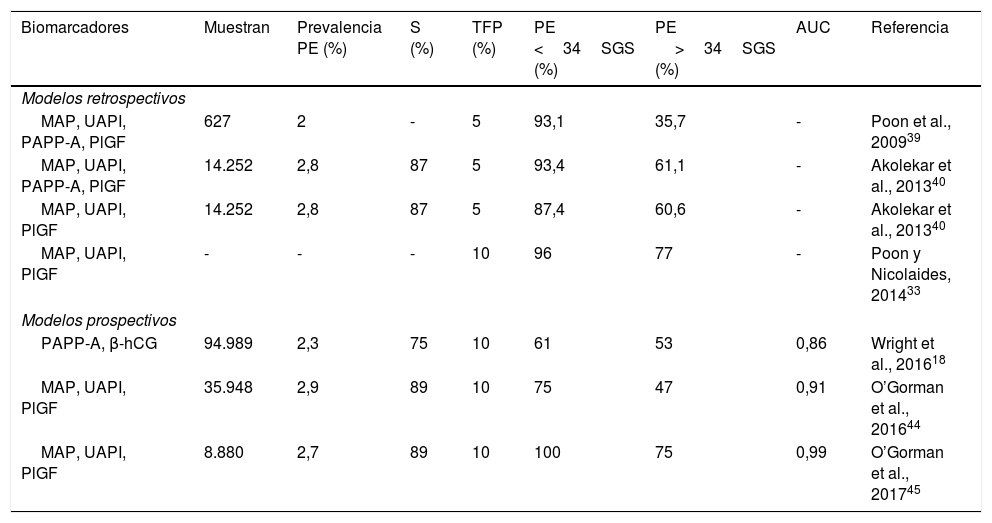
Puesto que el proceso de placentación se completa hacia la semana 20 de gestación, los modelos de predicción de primer trimestre constituyen un verdadero cribado de PE. Los biomarcadores séricos de forma aislada tienen baja capacidad de predicción, siendo el PlGF el que presenta mejores resultados para PE temprana, con una sensibilidad del 56% (IC: 52-61%) y una especificidad del 91% (IC: 89-92%)36. Entre la semana 11 y 13 de gestación la isoforma 1 del PlGF parece sufrir un descenso más marcado y contribuiría mejor a la predicción del riesgo de forma aislada37. La obtención de modelos con mayor sensibilidad y especificidad se alcanza con la combinación de múltiples parámetros: factores maternos, clínicos, marcadores ecográficos Doppler y biomarcadores séricos, siendo el PlGF el más utilizado en combinaciones de primer trimestre (tabla 4)38.
Modelos de predicción en el primer trimestre
| Biomarcadores | Muestran | Prevalencia PE (%) | S (%) | TFP (%) | PE <34SGS (%) | PE >34SGS (%) | AUC | Referencia |
|---|---|---|---|---|---|---|---|---|
| Modelos retrospectivos | ||||||||
| MAP, UAPI, PAPP-A, PlGF | 627 | 2 | - | 5 | 93,1 | 35,7 | - | Poon et al., 200939 |
| MAP, UAPI, PAPP-A, PlGF | 14.252 | 2,8 | 87 | 5 | 93,4 | 61,1 | - | Akolekar et al., 201340 |
| MAP, UAPI, PlGF | 14.252 | 2,8 | 87 | 5 | 87,4 | 60,6 | - | Akolekar et al., 201340 |
| MAP, UAPI, PlGF | - | - | - | 10 | 96 | 77 | - | Poon y Nicolaides, 201433 |
| Modelos prospectivos | ||||||||
| PAPP-A, β-hCG | 94.989 | 2,3 | 75 | 10 | 61 | 53 | 0,86 | Wright et al., 201618 |
| MAP, UAPI, PlGF | 35.948 | 2,9 | 89 | 10 | 75 | 47 | 0,91 | O’Gorman et al., 201644 |
| MAP, UAPI, PlGF | 8.880 | 2,7 | 89 | 10 | 100 | 75 | 0,99 | O’Gorman et al., 201745 |
AUC: área bajo la curva de rendimiento diagnóstico; MAP: presión arterial media materna; PAPP-A: proteína A asociada al embarazo; PE: preeclampsia; PlGF: factor de crecimiento placentario; S: sensibilidad; SG: semanas de gestación; TFP: tasa de falsos positivos; UAPI: índice de pulsatilidad de las arterias uterinas; β-hCG: fracción beta libre de la hormona gonadotropina coriónica.
En 2009, se publicó el primer modelo que combinaba factores clínicos maternos, presión arterial media materna (MAP), índice pulsátil de arteria uterina (UAPI) con proteína A asociada al embarazo en suero (PAPP-A) y PlGF sérico, medido entre la semana 11 y 13 de gestación. Se obtenía una sensibilidad del 93% (IC: 76-98%) y una especificidad del 95% (IC: 94-96%), con una tasa de falsos positivos del 5%, para la predicción de PE temprana39.
En 2013, se comparó la utilidad de un modelo basado en los múltiplos de la mediana (MoM) de MAP, UAPI, PAPP-A y PlGF, medidos entre las semanas 11 y 13, para establecer un punto de corte de alto riesgo de PE en función de la edad gestacional estimada en el momento del parto y la tasa de falsos positivos. Con este nuevo modelo, se obtuvo una sensibilidad de PE temprana (con desenlace de parto antes de la semana 34) del 93,4%, tomando el valor 1:128 como punto de corte para riesgo alto, y asumiendo una tasa de falsos positivos del 5% 40. Los estudios realizados con MoM de múltiples variables como modelo de predicción arrojan una sensibilidad del 94% para PE temprana en poblaciones con una incidencia de PE del 7%. Además, añaden un valor predictivo negativo superior al 98%, que refuerza la idea del coste-efectividad del cribado en el primer trimestre41.
A partir de 2014, los modelos retrospectivos propuestos, sin la inclusión de sFlt-1, obtienen el 96% de sensibilidad de PE temprana, a un punto de corte de 1:100 con PlGF en el algoritmo e incluyendo una tasa de falsos positivos del 10%33.
Otros marcadores de primer trimestre utilizados, como la proteína placentaria 13 de la familia de las galectinas o el receptor sEng relacionado con el factor de crecimiento transformante beta 1, no han sido útiles en la predicción de PE temprana, con datos de sensibilidad inferiores al 60% y con estudios que arrojan resultados discordantes respecto a su utilidad42,43.
Los estudios prospectivos indican que los marcadores mejoran la predicción de PE temprana en comparación con los factores maternos aislados. Así, recientemente, se ha publicado un algoritmo que incluye PAPP-A y la fracción beta libre de la hormona de gonadotropina coriónica humana, medidas entre la semana 11 y 13, con una sensibilidad para PE temprana del 61%18. Cuando se utiliza PlGF, se obtiene mejor sensibilidad para PE temprana, del 75% con una tasa de falsos positivos del 10%, mediante algoritmos que incluyen factores de riesgo materno, UAPI, MAP y los MoM de PlGF. En la predicción de PE a término, en cambio, la sensibilidad baja a un 47%44.
Estudios prospectivos más recientes ya alcanzan una sensibilidad del 100% con modelos combinados para predicción de PE temprana en gestaciones únicas, que incluyen factores de riesgo materno, MAP, UAPI, PAPP-A y PlGF medidos entre la semana 11 y 13 de gestación, asumiendo una tasa de falsos positivos del 10% y obteniendo un área bajo la curva ROC de 0,98745.
Marcadores de predicción emergentes en primer trimestreExisten recientes evidencias en el campo de los microARN circulantes que podrían suponer un nuevo paradigma de los biomarcadores séricos en PE. Así, múltiples estudios han encontrado perfiles de expresión de estos angiomicroARN placentarios asociados a PE46. Destaca un estudio en el que antes de la semana 20 de gestación muestra la expresión diferencial de algunos candidatos (miR-210, miR-141, miR-144 y miR-29a) a marcadores de predicción de PE y de su gravedad47.
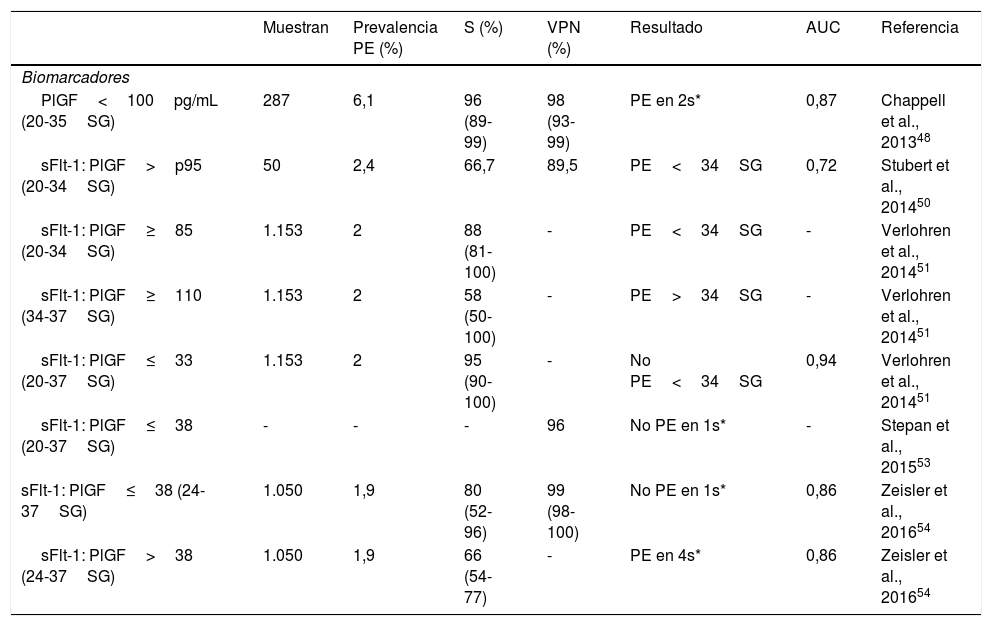
Modelos de predicción de preeclampsia basados en biomarcadores en el segundo y en el tercer trimestre (tabla 5)Debido a que en el segundo trimestre de gestación ya existe una placentación completa y podemos encontrar manifestaciones clínicas de la PE, la relación entre marcadores angiogénicos y antiangiogénicos tiene un papel importante en la predicción de PE y una relevancia clínica que aumenta su aplicabilidad, ya que el poder discriminatorio de sFlt-1 es superior en esta etapa de la gestación.
Modelos de predicción en el segundo y en el tercer trimestre
| Muestran | Prevalencia PE (%) | S (%) | VPN (%) | Resultado | AUC | Referencia | |
|---|---|---|---|---|---|---|---|
| Biomarcadores | |||||||
| PlGF<100pg/mL (20-35SG) | 287 | 6,1 | 96 (89-99) | 98 (93-99) | PE en 2s* | 0,87 | Chappell et al., 201348 |
| sFlt-1: PlGF>p95 (20-34SG) | 50 | 2,4 | 66,7 | 89,5 | PE<34SG | 0,72 | Stubert et al., 201450 |
| sFlt-1: PlGF≥85 (20-34SG) | 1.153 | 2 | 88 (81-100) | - | PE<34SG | - | Verlohren et al., 201451 |
| sFlt-1: PlGF≥110 (34-37SG) | 1.153 | 2 | 58 (50-100) | - | PE>34SG | - | Verlohren et al., 201451 |
| sFlt-1: PlGF≤33 (20-37SG) | 1.153 | 2 | 95 (90-100) | - | No PE<34SG | 0,94 | Verlohren et al., 201451 |
| sFlt-1: PlGF≤38 (20-37SG) | - | - | - | 96 | No PE en 1s* | - | Stepan et al., 201553 |
| sFlt-1: PlGF≤38 (24-37SG) | 1.050 | 1,9 | 80 (52-96) | 99 (98-100) | No PE en 1s* | 0,86 | Zeisler et al., 201654 |
| sFlt-1: PlGF>38 (24-37SG) | 1.050 | 1,9 | 66 (54-77) | - | PE en 4s* | 0,86 | Zeisler et al., 201654 |
| Modelos combinados | TFP (%) | S (%) | Resultado | ||||
|---|---|---|---|---|---|---|---|
| MAP, UAPI, PlGF, sFlt-1 (19-24SG) | 123.406 | 2,2 | 10 | 90-91 | S 67%PE<42SG | - | Gallo et al., 201655 |
| MAP, UAPI, PlGF, sFlt-1 (30-34SG) | 123.406 | 2,2 | 5 | 98 (88-99) | PE<37SG | 0,99 | Tsiakkas et al., 201657 |
| MAP, UAPI, PlGF, sFlt-1 (30-34SG) | 123.406 | 2,2 | 5 | 55 (47-62) | PE>37SG | 0,87 | Tsiakkas et al., 201657 |
AUC: área bajo la curva de rendimiento diagnóstico; MAP: presión arterial media materna; PE: preeclampsia; PlGF: factor de crecimiento placentario; p95: percentil 95; S: sensibilidad; s*: tiempo, en semanas, referido desde la medida del biomarcador; sFlt-1: receptor soluble tipo tirosincinasa 1; SG: semanas de gestación; TFP: tasa de falsos positivos; UAPI: índice de pulsatilidad de las arterias uterinas; VPN: valor predictivo negativo.
En 2013 se realizó un estudio prospectivo multicéntrico que valoraba la capacidad de predicción de PlGF para el desarrollo de PE en el transcurso de las 2 semanas siguientes, en gestantes con sospecha de PE entre la semana 20 y 35 de gestación. Se estimó que valores aislados de PlGF por debajo de 100pg/mL, o del percentil 5, tenían una sensibilidad del 96% para predecir el desarrollo de PE48.
La relación entre sFlt-1 y PlGF, expresada como cociente de sus concentraciones séricas, en combinación con marcadores ecográficos como UAPI constituye un modelo de predicción de PE temprana que ha mejorado la sensibilidad y especificidad en el segundo trimestre49,50.
En 2014 empezaron a proponerse puntos de corte del cociente sFlt-1/PlGF, en población gestante con signos y síntomas de PE entre la semana 24 y 37 de gestación. En esa situación clínica, algunos autores describieron que un cociente superior a 85 antes de la semana 34, o superior a 110 después de dicha semana, podía constituir una indicación para inducir el parto prematuro por PE, con una sensibilidad que oscila entre el 60 y el 96% en función del momento de gestación en que se realice la medida51. Estos hallazgos discrepaban de los obtenidos por otros autores, que veían la necesidad de bajar dichos puntos de corte a valores mucho menores (23 o 45 respectivamente), para conseguir similares sensibilidades52. Posteriormente, en 2015, el grupo de Verlhoren publicó datos más concordantes, asumiendo que con cocientes sFlt-1/PlGF inferiores a 38 se alcanzaba un valor predictivo negativo superior al 96% para PE dentro de la siguiente semana, mientras que valores entre 38 y 85 incrementaban el riesgo de parto pretérmino por PE en las siguientes 4 semanas53.
En estudios prospectivos multicéntricos posteriores se confirmó que la sensibilidad del cociente sFlt-1/PlGF para la predicción de PE en las siguientes 4 semanas era del 66% para el punto de corte superior a 38, obtenido entre la semana 24 y 36 de gestación54.
Se ha sugerido un algoritmo para la estratificación del riesgo entre la semana 18 y 22 de gestación mediante UAPI y la determinación del cociente sFlt-1/PlGF entre la semana 24 y 28 aplicando los puntos de corte anteriormente citados. El seguimiento propuesto se muestra en la figura 5, e incluiría medidas seriadas del cociente en función del resultado obtenido: a los 2-4 días, en caso de un valor superior a 85 o signos clínicos de disfunción placentaria, y cada 2 semanas en caso de obtener un valor entre 38 y 85, si no se evidencian síntomas de dicha disfunción. La reevaluación con el cociente podría demorarse incluso más, hasta las 4-6 semanas, en aquellos casos sin signos de disfunción placentaria que presenten valores inferiores a 3820.
Algunos modelos de cribado en el segundo trimestre, que incluyen sFlt-1 y PlGF junto a MAP y UAPI, sitúan la capacidad de detección de PE por encima del 90% tanto para PE temprana como tardía, cuando se aplican entre la semana 19 y 24 de gestación, aunque con una sensibilidad del 67%55. Otros estudios revelan la necesidad de adecuar la estratificación del riesgo en función de los resultados obtenidos entre la semana 31 y 34 para adecuar el manejo en cada población en las siguientes 4 semanas56.
Los modelos de predicción de PE en estudios de cohortes de etapas tempranas del tercer trimestre incluyen factores de riesgo materno con MAP, UAPI, sFlt-1 y PlGF consiguiendo, en gestantes entre la semana 30 y 34, una tasa de detección del 98% para necesidad de parto antes de la semana 37 y del 49% para parto a término por PE, con una tasa de falsos positivos del 5%57.
Es importante destacar que, debido a la variabilidad intraindividual de PlGF a lo largo del segundo y tercer trimestre de gestación, en todos los modelos de predicción se deben ajustar todas las variables maternas utilizadas en el cálculo de riesgo por métodos bayesianos, para aumentar la eficacia de la combinación de biomarcadores58.
Basados en estudios prospectivos, algunos autores proponen un cribado de PE temprana en 2 etapas, utilizando en semana 11-13 factores maternos y MAP, y en semana 19-24 UAPI y PlGF, consiguiendo tasas de detección del 71-84%, con el 10% de falsos positivos59.
Un metaanálisis reciente sobre la utilización del cociente sFlt-1/PlGF en las estrategias de cribado con 2 puntos de corte, ≤33 y ≥85 para la PE temprana y ≤33 y ≥110 para la PE tardía, muestra una optimización del cociente en la clasificación del riesgo de PE. Sin embargo, se precisan más estudios prospectivos para determinar con qué frecuencia se debe usar el cociente en las embarazadas con riesgo indeterminado60.
Evaluación económicaEn los últimos años se ha estudiado las implicaciones económicas y de recursos que supone la aplicación de los modelos predictivos de PE en las diferentes fases del embarazo.
Meads et al., en un análisis realizado en 2008 en el Reino Unido, incluyendo factores maternos, UAPI, proteinuria, fibronectina total y hormona gonadotropina coriónica, concluyeron que, desde la perspectiva del Servicio Nacional de Salud del Reino Unido, la estrategia de cribado en el primer trimestre no era coste-efectiva dada la mala exactitud de las pruebas utilizadas61.
En 2013, Schnettler et al. observaron que el cociente sFlt-1/PlGF (punto de corte>85) mejoraba notablemente la especificidad diagnóstica frente al modelo clínico estándar (93 vs. 35,7%). Disminuía los diagnósticos falsos positivos de PE del 42,3 al 4% e incrementaba los verdaderos negativos del 23,5 al 61,7%. Su aplicación redujo el coste promedio del manejo habitual de las gestantes con sospecha de PE en 1.215$ por gestante62.
En el mismo sentido, en 2010 Hadker et al. estudiaron el impacto presupuestario de implantar el cociente sFlt-1/PlGF en una cohorte de 1.000 gestantes de Reino Unido63. La incorporación del cociente sFlt-1/PlGF en la atención clínica estándar después de la semana 20 de gestación mejoró la sensibilidad y la especificidad diagnóstica de PE y supuso un ahorro de 945£ por gestante.
Los mismos autores obtuvieron un resultado similar en una cohorte de 1.000 gestantes alemanas que precisaban atención obstétrica por sospecha de PE. La introducción del cociente sFlt-1/PlGF como herramienta diagnóstica mejoró la clasificación de las pacientes y ahorró 637€ por embarazada (941€ vs. 1.571€ de la práctica clínica habitual)64.
Recientemente, Duckworth et al. han publicado un estudio prospectivo donde se analizó el impacto económico de medir PlGF (TriagePlGFAlere, San Diego, CA) en sospecha de PE antes de las 35 semanas. La incorporación de PlGF a las 31 semanas redujo en 582£/gestante el manejo clínico de la PE en las 2 semanas siguientes a la consulta65.
Por otra parte, cuando nos referimos al coste económico de los modelos predictivos de PE en el primer trimestre de embarazo, los resultados son confusos, tanto por el resultado de los análisis de costes como por la propia finalidad del cribado.
En los análisis de coste, Shmueli et al. utilizaron 2 marcadores bioquímicos (proteína placentaria 13 y PlGF) más el índice de pulsatilidad Doppler de la arteria uterina y encontraron que el cribado de PE en el primer trimestre resultó ser coste-efectivo. Los resultados mejoraban conforme se incrementaba la prevalencia de PE y/o disminuía el coste del cribado66.
Más recientemente, Zakiyah et al. han realizado una revisión sistemática de las evaluaciones económicas publicadas en lengua inglesa sobre el escrutinio, diagnóstico y curso de la PE, entre1994 y 201467,68. Partiendo de una base inicial de 138 referencias, se quedaron con 3 estudios que se enfocaban en el cribado y/o diagnóstico de PE y cumplían los criterios de inclusión. A pesar de las limitaciones, estos autores consideran importante tener en cuenta estos estudios en la toma de decisiones.
De acuerdo con la bibliografía revisada, parece que la introducción de los nuevos biomarcadores en el diagnóstico y manejo de la PE entre las semanas 20 y 34 de gestación es prometedora; siendo la exactitud y la prevalencia los principales factores de la relación coste-efectividad. Sin embargo, el cribado universal solo parecerá posible cuando, entre otras cosas, se incremente el número de análisis económicos que incluyan la exactitud de los nuevos biomarcadores, las combinaciones de las pruebas integradas en la toma de decisiones médicas, las consecuencias a largo plazo de la PE y se demuestre la efectividad de las estrategias de tratamiento profiláctico.
En el mismo sentido, se sitúan los resultados de los estudios coste-efectividad que NICE ha realizado para la elaboración de su Guía. Tanto el análisis de PlGFTriage (Alere®) como el cociente sFlt-1/PlGFElecsys (Roche®) son más efectivos y menos costosos que la evaluación clínica estándar, en gestantes que se presentan con sospecha de PE entre la 20+0 y las 34+6 semanas de gestación. Cuando la sospecha surge entre las 35+0 y las 36+6 semanas las diferencias se reducen y las ventajas de utilizar estos marcadores no son tan evidentes69. En esta guía se estima que aproximadamente 67.200 mujeres inglesas serán candidatas del análisis de PlGF o sFlt-1/PlGF y que la implementación de la guía conducirá a una reducción de ingresos y estancias hospitalarias. Para una unidad de maternidad de aproximadamente 4.700 nacimientos/año pueden evitarse alrededor de 300 días de ingreso. Además, considera que con una prevalencia de hipertensión gestacional del 13,5%, el ahorro en recursos será de 7,3 millones de libras a partir de los 5 años desde la implementación70.
Una revisión reciente71 muestra que el cociente sFlt-1/PlGF con un punto de corte≤38 es ampliamente aceptado para descartar PE en embarazadas con sospecha clínica de enfermedad y su uso es coste-efectivo. Sin embargo, la evidencia es más limitada con relación al mantenimiento y al pronóstico de embarazadas con un cociente anormalmente elevado.
En relación con la prevención de la PE con aspirina, un metaanálisis72 muestra que la prevención de la PE severa está condicionada con el inicio del tratamiento en≤16 semanas de gestación y con un efecto dosis-respuesta73. Los resultados recientes de ensayos clínicos prospectivos aleatorizados de intervención con ácido acetilsalicílico, como el proyecto ASPRE, muestran la utilidad del PlGF en la identificación de las embarazadas con riesgo elevado de PE pretérmino, en fases tempranas de la gestación. Este estudio ha mostrado que en embarazadas con feto único que se han cribado entre las semanas 11+0 a 13+6 mediante el algoritmo que combina factores maternos, MAP, UAPI, PAPP-A y PLGF puede detectar el 77% de PE pretérmino y el 43% de PE a término con una tasa de falsos positivos del 9,2%74. La administración de 150mg/día desde la semana 11-14 hasta la semana 36 de gestación se ha asociado con una reducción>60% de la incidencia de PE pretérmino respecto al grupo placebo75. En Reino Unido, las guías NICE recomiendan la identificación de las embarazadas con riesgo de PE en base a 10 factores, incluyendo las características maternas y la historia médica y obstétrica. Sin embargo, la sensibilidad es baja, un 39% para una tasa de falsos positivos del 10%. En EE. UU., el ACOG recomienda la utilización de aspirina en embarazadas con historia de PE en más de un embarazo o historia de PE con resultado de aborto antes de las 34 semanas. El cribado de PE con el uso del teorema de Bayes que combina el riesgo a priori de factores maternos con factores biofísicos y bioquímicos es muy superior a los de NICE y ACOG para identificar el grupo que se beneficiaría de la profilaxis con aspirina.
Respecto a la utilidad de los biomarcadores descritos, en otras enfermedades relacionadas con la función placentaria, como el retraso de crecimiento intrauterino retardado no hay evidencia suficiente para establecer puntos de corte específicos para la predicción y el diagnóstico. Tampoco la hay, para distinguir la PE y el crecimiento intrauterino retardado. Finalmente, la utilidad de estos marcadores no ha sido suficientemente estudiada en situaciones especiales como en las gestaciones múltiples, las infecciones congénitas, las anomalías cromosómicas o las malformaciones cardiacas76.
Conclusiones- 1.
La falta de estandarización de los marcadores angiogénicos, y la escasez de estudios prospectivos y de investigaciones que determinasen la mejor combinación predictiva de PE para su aplicación en la práctica clínica han ralentizado el consenso hasta ahora. Aunque la relación sFlt-1/PlGF destacó hace años como el marcador más prometedor, tan solo las guías alemanas lo habían incluido explícitamente77.
- 2.
En mayo de 2016, la guía NICE ya recomienda el uso del PlGFTriage de Alere®, con punto de corte de 100pg/mL, y el valor predictivo de obtener un cociente sFlt-1/PlGF inferior a 38 para descartar PE en gestantes con sospecha que se encuentran entre la semana 20 y 34 de embarazo.
- 3.
Se requiere mayor evidencia para la implementación rutinaria de los marcadores disponibles en algoritmos diagnósticos de PE.
- 4.
Se propone su uso en el cribado de PE ante una sospecha en segundo y tercer trimestre del embarazo, debido al elevado valor predictivo negativo mostrado en recientes estudios prospectivos.
- 5.
Con la evidencia científica que aporta el estudio ASPRE, la aspirina es un tratamiento efectivo en la actuación clínica de la PE cuando se combina con un programa de cribado consistente en el primer trimestre.
Los autores declaran no tener ningún conflicto de intereses.