La enfermedad de Pompe, también denominada déficit de maltasa ácida o glucogenosis tipo ii, es un trastorno metabólico autosómico recesivo caracterizado por un acúmulo anormal de glucógeno lisosomal, causado por la deficiencia de la enzima α-glucosidasa ácida (GAA). Según la edad de inicio y el grado de afectación orgánica, la enfermedad de Pompe se suele subdividir en 2 tipos: neonatal (infantile-onset) y tardío (late-onset).
El diagnóstico clínico se confirma mediante la ausencia virtual (forma infantil) o marcada reducción (forma del adulto) de la actividad enzimática GAA en diferentes muestras biológicas.
Material y métodosEl objetivo de este trabajo consiste en establecer los valores de referencia para la actividad enzimática GAA intralinfocitaria que constituye el método gold standard para el diagnóstico de la enfermedad.
ResultadosLos resultados obtenidos en una población de sujetos control difieren de los publicados en otros trabajos, lo que refleja la importancia de establecer valores de referencia dentro de cada laboratorio.
Pompe disease also called acid maltase deficiency or glycogenosis type ii is an autosomal recessive metabolic disorder characterized by an abnormal accumulation of lysosomal glycogen caused by deficiency of the enzyme acid α-glucosidase (GAA). According to the age of onset and the extent of organ involvement, Pompe disease is usually divided into 2 subtypes: Neonatal (infantile-onset) and adult (late-onset).
The clinical diagnosis is confirmed by the virtual absence (infantile form) or markedly reduced (adult form) GAA enzyme activity in different biological samples.
Material and methodsThe aim of this work is to establish reference values for intralymphocyte alpha-glucosidase acid activity, which is the “gold standard” method for the diagnosis of Pompe disease.
ResultsThe results obtained in a population of control subjects are different from those published in other studies. This reflects the importance of establishing reference values within each laboratory.
La enfermedad de Pompe, sinónimo de deficiencia de maltasa ácida, es también conocida como glucogenosis de tipo II. Esta enfermedad, definida como un desorden de almacenamiento lisosomal, constituye una enfermedad hereditaria autosómica recesiva causada por una mutación en el gen que codifica para la enzima α-glucosidasa ácida (GAA) o maltasa ácida1. Se encuentra situado en el brazo largo del cromosoma 17 (17q25)2 y se han descrito hasta el momento 454 mutaciones diferentes (http://www.pompecenter.nl).
Gracias a esta enzima, el glucógeno acumulado en los lisosomas es degradado completamente a glucosa. El hecho de añadir «ácida» a su denominación hace referencia al entorno ácido existente en el interior del lisosoma, necesario para la actuación enzimática efectiva3,4. En la enfermedad de Pompe, la deficiencia de la GAA bloquea este proceso catabólico y origina un incremento de los depósitos de glucógeno en los lisosomas. Estos adoptan formas inusualmente grandes y alargadas, llegando a ocupar una parte sustancial del contenido de la célula1,5,6. La consecuente enfermedad celular se manifiesta, en las fibras musculares, mediante pérdida de la arquitectura subcelular y ocasionan finalmente una debilidad del músculo esquelético, responsable de gran parte de la sintomatología clínica1,6,7. Estos síntomas incluyen, desde una enfermedad severa caracterizada por miocardiopatía hipertrófica8 o debilidad muscular marcada en la forma de presentación neonatal (letal durante los primeros 2 años de vida), hasta una miopatía progresiva9 con insuficiencia respiratoria en la forma de aparición adulta.
El objetivo de este trabajo consiste en establecer los valores de referencia para la actividad enzimática GAA intralinfocitaria, que constituye el «gold standard» para el diagnóstico de la enfermedad de Pompe1,7, en la población atendida por nuestro laboratorio.
Material y métodosPara la determinación de estos valores utilizamos un grupo de 149 pacientes (92 hombres y 57 mujeres) con una edad media de 38,67 años (valor mínimo un año y valor máximo 72 años) cuyas muestras fueron enviadas al laboratorio del Servicio de Bioquímica Clínica del Hospital Universitario Virgen del Rocío de Sevilla para diagnóstico de otras enfermedades, que resultaron estar ausentes, procedentes de diversos centros repartidos por todo el país.
Actividad enzimática intralinfocitariaSe utilizaron muestras de 10mL de sangre total extraídas con EDTA, enviadas al laboratorio refrigeradas a 4°C, en un periodo no superior a las 24 h desde su extracción.
La determinación de la actividad enzimática requiere, en primer lugar, el aislamiento de los propios linfocitos y una fase posterior de sonicado. El aislamiento de los linfocitos se llevó a cabo a partir de 8mL de la sangre total en tubos para la separación de células mononucleares sanguíneas (BD Vacutainer® CPT™) que poseen una solución de FICOLL™ Hypaque™. Esta metodología nos permite separar los linfocitos mediante gradiente de densidad tras centrifugación a 3.000 r.p.m. durante 30 min a una temperatura de 4°C. La realización de sucesivos lavados de la fracción diferenciada por el gradiente con una solución salina fisiológica nos permite obtener un pellet limpio que se conserva a −80°C hasta la determinación analítica.
Los linfocitos aislados, resuspendidos en un volumen de 500μL de agua bidestilada, se sonican mediante un sistema manual Branson Digital Sonifier durante 10 s a una amplitud de 20% y una temperatura máxima de 26°C obteniéndose, de este modo, una suspensión del contenido enzimático intralinfocitario.
La actividad enzimática intralinfocitaria es dependiente tanto de la cantidad de linfocitos presentes en la muestra como de la concentración de la enzima existente en ellos. Los resultados se expresan en función de la cantidad de proteínas en el concentrado de linfocitos.
La determinación de la actividad enzimática se llevó a cabo según la metodología de Lukacs et al. modificada10, usando como sustrato de la reacción una solución de 4-metil-umbeliferil-α-D-glucopiranósido (4-MUG) 2,8mM. Cada determinación se realizó por duplicado, interpolando los resultados en una curva de calibración construida a partir de diferentes concentraciones de 4-metilumbeliferona (4-MU), el producto fluorescente que se forma en la reacción. Esta curva nos permite establecer la relación entre la intensidad de fluorescencia y la actividad enzimática presente en las muestras.
Se utilizan microplacas de 96 pocillos de 400μL (Greiner Bio-One Fia-Plate, Black) dispensándose en cada uno de ellos 10μL de la solución de linfocitos sonicada y centrifugada. Para cada muestra analizamos la actividad enzimática GAA efectiva utilizando una solución del sustrato en buffer ácido (citrato-fosfato pH 4,3, 0,2M). Previamente, y en cada uno de los pocillos, es añadida una solución de acarbosa 8μM cuya finalidad es inhibir específicamente la actividad enzimática maltasa glucoamilasa (MGA) que pudiese existir en la muestra debido a la presencia de algún leucocito polimorfonuclear que hubiera permanecido tras el proceso de aislamiento de linfocitos11. De este modo, la actividad α-glucosidasa medida es reflejo únicamente de la GAA efectiva.
El sustrato de la reacción (4-MUG) es añadido en los pocillos correspondientes y, tras un tiempo de incubación estipulado (2 h con agitación a 1.000rpm y 37° C), se detiene la reacción mediante la adición de una solución stop consistente en un tampón carbonato-glicina 0,17M a pH 11,0.
La lectura de la microplaca se realiza en un espectrofluorímetro de microplacas de longitud de onda variable Beckman Coulter, modelo DTX880. La longitud de onda de medida fue de: excitación 355nm y emisión de 460nm. El tiempo de lectura fue de 800 ms.
Determinación de proteínas intralinfocitariasPara calcular la concentración de proteínas existente en las muestras y así expresar la actividad enzimática en función de esta, utilizamos el método espectrofotométrico de Lowry et al.12 en microplaca.
CálculosAl no existir actividad MGA en los linfocitos, la actividad enzimática será un reflejo de la actividad GAA total presente en ellos. Esta se calcula mediante interpolación de la fluorescencia de la muestra en la curva construida de 4MU. Como hemos indicado, la actividad enzimática intralinfocitaria depende de la concentración de linfocitos en la muestra y la expresión de la enzima en estas células, por lo que el resultado final ha de quedar expresado en función de la concentración de proteínas de la muestra, calculada también por interpolación en una curva de calibración construida con una solución de albúmina. De esta forma, el resultado final queda expresado en nmol/min/mg proteína. La concentración de proteínas en las diferentes muestras analizadas osciló entre 0,94 y 2,34mg/mL, valores coincidentes con los esperados en soluciones de linfocitos en sujetos normales.
Análisis estadísticoEl análisis estadístico de los datos obtenidos fue realizado mediante el programa de IBM SPSS Statistics versión 19.0.
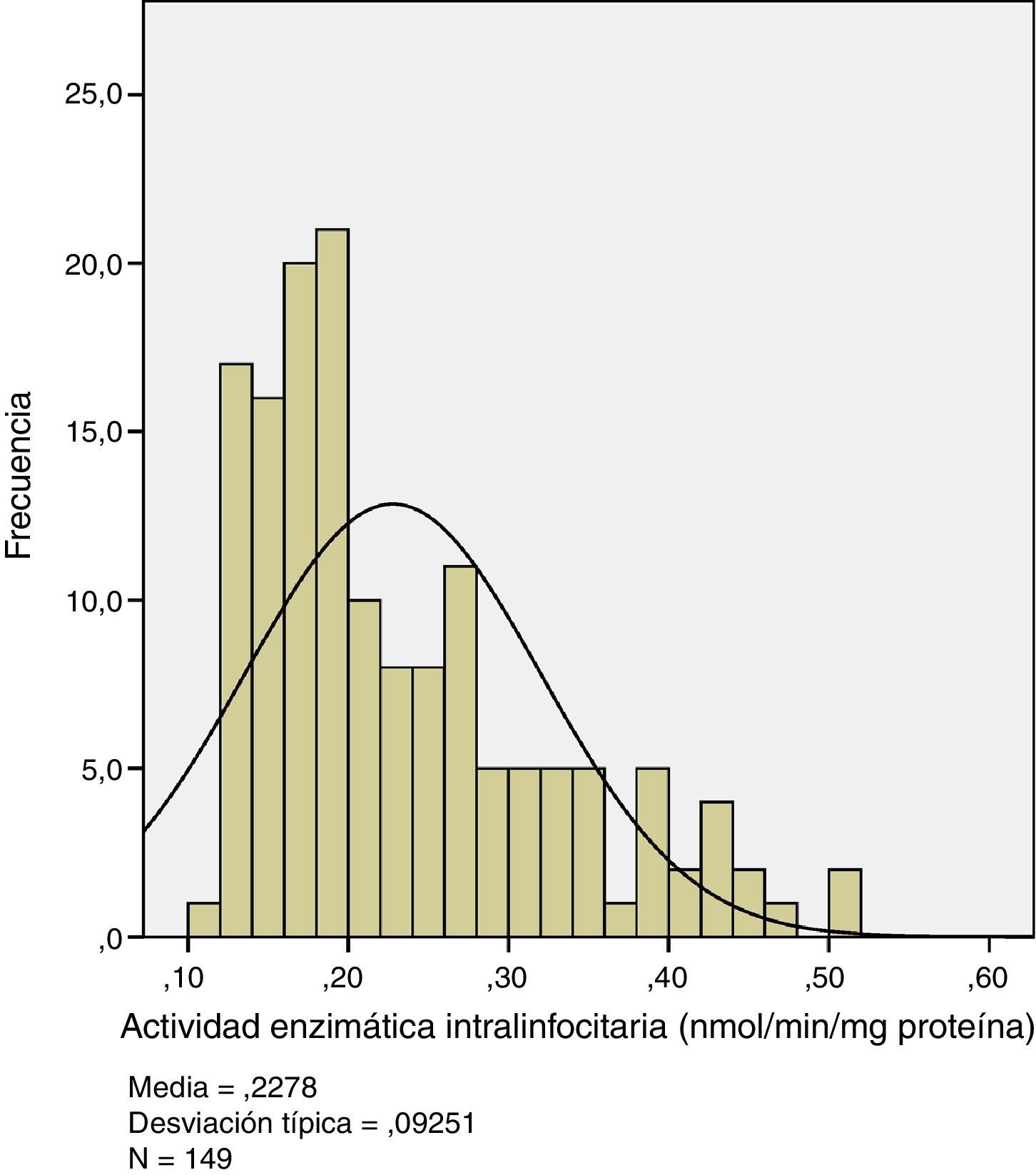
ResultadosLos resultados de la actividad GAA efectiva en linfocitos expresados en nmol/min/mg de proteína se encuentran esquematizados en la figura 1.
A partir de los datos de actividad enzimática, y con objeto de calcular el intervalo de normalidad, seguimos los criterios del Clinical and Laboratory Standards Institute, International Federation of Clinical Chemistry (CLSI/IFCC) que, para la mayoría de las magnitudes biológicas y, usando una población de al menos 120 pacientes13, recomienda usar el intervalo de valores comprendido entre los percentiles 2,5 y 97,5.
Siguiendo estas recomendaciones, los valores de referencia calculados para nuestra población total, incluso separados por sexos, se expresan en la tabla 1. En la tabla 2 se muestran los valores separados por grupos de edad, sin diferencias estadísticamente significativas entre ellos tras la aplicación del test t de Student.
Valores de actividad GAA en los sujetos analizados separados por grupos de edad
| Grupos de edad Percentil | 1-10 a. (n=11) | 11-20 a. (n=13) | 21-30 a. (n=23) | 31-40 a. (n=29) | 41-50 a. (n=37) | 51-60 a. (n=14) | >60 a. (n=22) |
|---|---|---|---|---|---|---|---|
| 2,5 | 0,130 | 0,132 | 0,125 | 0,117 | 0,130 | 0,133 | 0,130 |
| 95,5 | 0,487 | 0,371 | 0,460 | 0,402 | 0,425 | 0,324 | 0,440 |
Valores expresados en nmol/min/mg proteína.
Los resultados obtenidos nos permiten realizar una serie de observaciones entre las que cabe destacar el que nuestros valores difieren, sobre todo, en los límites superiores de normalidad de los publicados con anterioridad10, ya que la metodología empleada es ligeramente diferente, al utilizar acarbosa como inhibidor de la actividad MGA.
Además, no existen diferencias estadísticamente significativas entre sexos ni entre los diferentes grupos de edad estratificados, hecho coincidente con otras publicaciones13,14.
Finalmente, y al tratarse de una metodología de corto desarrollo (2 h de incubación), es un método de gran interés para el estudio de esta actividad enzimática en los laboratorios especializados en el diagnóstico de enfermedades lisosomales en general, y de la enfermedad de Pompe en particular.
Todo ello nos permite concluir la importancia de obtener valores de referencia para cada uno de los parámetros a analizar en la población atendida en nuestro laboratorio. Los datos obtenidos de publicaciones nacionales o extranjeras pueden conducirnos a errores, sobre todo en los valores límites superiores e inferiores del intervalo de referencia, que pueden ser debidos a variaciones étnicas o de localización geográfica.