La hemólisis, ictericia y lipidemia son los principales interferentes que pueden producir errores analíticos en la medición de magnitudes bioquímicas. Muchos analizadores incorporan sistemas de detección de interferentes, sin embargo no suelen estar verificados. El objetivo del estudio es verificar el sistema de medición HIL del analizador Dimension® EXLTM y comprobar la adecuada asignación por el proveedor de los valores de alerta.
Material y métodosSe ha evaluado el efecto de la hemoglobina, bilirrubina y triglicéridos en los resultados, comparando el valor de la magnitud en la muestra sin interferente con los valores obtenidos en la misma muestra con concentraciones crecientes del mismo. Se ha seguido el procedimiento recomendado por la Comisión de Metrología y Sistemas Analíticos de la SEQC. Asimismo, se ha elaborado un algoritmo de cuándo informar la presencia de interferencias (criterios clínicos y técnicos).
ResultadosTodos los resultados de los índices hemolíticos incluyeron la concentración esperada del interferente, para la ictericia hubo ligeras diferencias, mientras que para la lipidemia el analizador proporcionó resultados más bajos de los esperados. En el estudio de los índices de alerta HIL hubo diferencias entre los resultados obtenidos y la información del fabricante. Se presenta el algoritmo para informar la presencia de estas interferencias.
ConclusionesLa incorporación de estos índices de alerta sin una previa verificación de los mismos puede llevar a cometer errores. Una correcta verificación de estos sistemas permitiría detectar la falta de veracidad en la medición de estos interferentes o el inadecuado establecimiento de algunos índices de alerta.
Haemolysis, icterus (bilirubin) and lipaemia (triglycerides) (HIL) are the main interferences that can lead to analytical errors in the measurement of biological substances. Many analysers incorporate interference detection systems, which nonetheless are often not verified. The main objective is to verify the HIL measurement system of the Dimension® EXLTM analyser, and to check the correct assignment of the alert values by the supplier.
Material and methodsThe effect of the haemolysis, bilirubin and triglycerides on the results has been assessed by comparing the value of the quantity in a sample without interference with the values obtained in the same sample with increasing concentrations of interfering substances. The procedure recommended by the Comisión de Metrología y Sistemas Analíticos of the SEQC has been followed. An algorithm to inform of interferences, based on clinical and technical aspects, has been developed.
ResultsAll haemolytic index results included the expected concentration of the interfering substance. Few errors were found for icterus, while for lipaemia the analyser gave results lower than expected. In the study of the HIL alert indexes, differences were found between the results obtained and the information provided by the supplier. Finally the algorithm followed in our laboratory to inform the presence of interfering substances is presented.
ConclusionsThe introduction of these alert indexes without a prior verification of them can lead to potential errors. Proper verification of these systems would enable detecting the lack of trueness in the measurement of the interfering substances or the inadequate establishment of some alert indexes.
En las últimas décadas han disminuido significativamente el porcentaje de errores en los laboratorios clínicos. Aunque las evidencias demuestran que es durante la fase pre- y postanalítica1,2, más que en la fase analítica del proceso de medida, donde se acumulan la mayoría de los errores, las interferencias producidas por sustancias endógenas o exógenas continúan siendo uno de los principales problemas que puede dar lugar a errores que ocasionen efectos perjudiciales para el paciente.
En el laboratorio clínico es importante identificar cuáles son las posibles fuentes de interferencia endógenas de un procedimiento de medida. La hemólisis, la turbidez y la ictericia son los principales interferentes que pueden llevar a errores analíticos en las mediciones de magnitudes relacionadas con el laboratorio clínico3. En el pasado la práctica habitual para evitar el efecto de estos interferentes consistía en la inspección visual de las muestras biológicas para observar el color o turbidez del plasma una vez centrifugadas. No obstante, la creciente incorporación de sistemas de integración y automatización en el laboratorio, como son los elementos automáticos para el tratamiento preanalítico de las muestras, imposibilita la inspección visual de ellas una vez han sido centrifugadas.
Actualmente muchos analizadores incorporan sistemas de detección de interferentes que permiten omitir la subjetividad, arbitrariedad y falta de sensibilidad del procedimiento manual4 y además posibilitan la realización de esta inspección de manera automática. Estos sistemas se denominan índices séricos de hemólisis, ictericia y lipidemia (HIL) y su medición se basa en las características espectrales de la hemoglobina, la bilirrubina y la turbidez respectivamente. La estimación de estos índices se realiza de forma automática en el analizador para cada muestra de suero o plasma a partir de una serie de cálculos realizados con los valores de absorbancia obtenidos en la muestra a unas longitudes de onda determinadas. Las fórmulas de cálculo pueden incluir correcciones para compensar el solapamiento espectral cuando hay más de un interferente presente5. Además, algunos fabricantes de diagnóstico in vitro informan la mínima concentración de interferente (índice de alerta) a partir de la cual se considera que un procedimiento en particular está interferido. Por tanto con la medición de estos índices se persigue un doble objetivo: que el laboratorio tenga información sobre la presencia de estos interferentes en una muestra y la posible influencia que tienen en los resultados de las distintas magnitudes.
El principal problema que plantea el uso de estos sistemas es que no suelen estar sujetos a verificación de estas mediciones y que carecen de controles internos de calidad y de materiales de referencia que permitan su calibración. Además, generalmente no suelen estar sometidos a los programas de mantenimiento preventivos del analizador. A pesar de estas carencias, organismos internacionales recomiendan establecer flujos de trabajo para la detección automatizada de la hemólisis, lipidemia e ictericia, y procedimientos para verificar estos sistemas de medición5,6.
Las interferencias endógenas producidas por estas sustancias suelen ser dependientes del método o del analizador. Aunque en general el fabricante de reactivos incluye en los insertos de reactivos información sobre los estudios de interferencia que ha hecho, desde un punto de vista práctico estas especificaciones deberían ser evaluadas por el usuario final7. El objetivo de este estudio es verificar el sistema de medición de los índices séricos de HIL del analizador Dimension® EXLTM (Siemens Diagnostics), comprobar el adecuado establecimiento de los índices de alerta de los principales procedimientos que usamos en nuestro laboratorio de urgencias y mostrar el algoritmo que hemos establecido para informar estas interferencias tras la incorporación de este analizador al sistema de integración (Aptio® de Siemens Diagnostics) del CORE de nuestro laboratorio.
Material y métodosEl estudio se ha realizado en el analizador Dimension® EXLTM. Este analizador expresa los índices séricos de cada sustancia interferente semicuantitativamente mediante una escala ordinal sin unidades (del 1 al 6). El fabricante informa además de la correspondencia de cada valor de la escala ordinal con un intervalo de concentraciones del interferente8. Estas mediciones no requieren reactivo y cuando se considera que un procedimiento está interferido el analizador puede enviar un mensaje (HIL interf) al sistema informático del laboratorio. La hemólisis se mide bicromáticamente a 405 y 700nm, la ictericia a 452 y 700nm y la lipidemia a 700nm.
En este trabajo se ha procedido en primer lugar a verificar la medición de los tres interferentes por el analizador. Al mismo tiempo se han estimado los índices de alerta de los procedimientos de medida que usamos en el laboratorio de urgencias y para los que el fabricante indica que, según sus estudios, están afectados por dichos interferentes8. Para ello se ha evaluado el efecto de las distintas sustancias interferentes en los resultados de medida, comparando el valor de la magnitud en la muestra sin interferente con los valores obtenidos en la misma muestra con concentraciones crecientes del mismo y se ha seguido el procedimiento recomendado por la Comisión de Metrología y Sistemas Analíticos de la Sociedad Española de Bioquímica Clínica y Patología Molecular9.
Los procedimientos evaluados en cada caso han sido los siguientes:
- •
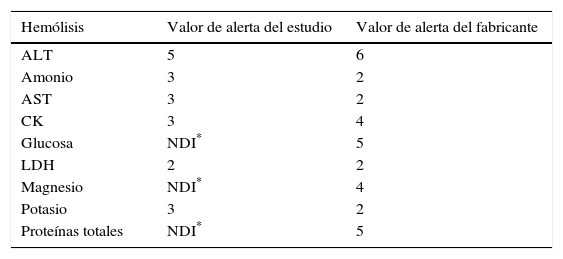
Para estudiar el efecto de la hemólisis: alanina aminotransferasa (ALT), amonio, aspartato aminotransferasa (AST), creatina quinasa (CK), glucosa, lactato deshidrogenasa (LDH), lipasa, magnesio, potasio y proteínas.
- •
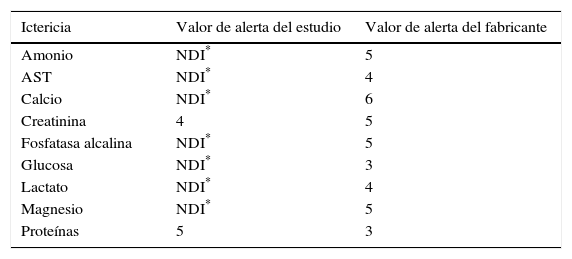
Para estudiar el efecto de la ictericia: amonio, AST, calcio, creatinina, fosfatasa alcalina, glucosa, lactato, magnesio y proteínas.
- •
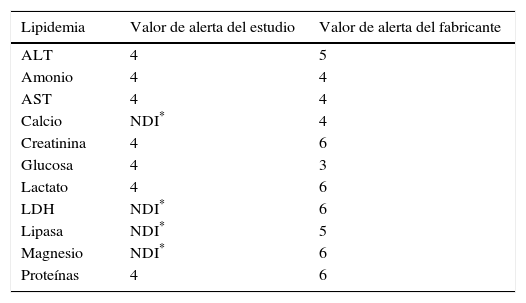
Para estudiar el efecto de la turbidez: ALT, amonio, AST, calcio, creatinina, glucosa, lactato, LDH, lipasa, magnesio y proteínas.
En este estudio las concentraciones máximas estudiadas para cada interferente han sido: hemoglobina 4,9g/l, bilirrubina 30mg/dl y lipidemia, expresado como concentración de triglicéridos, 1.880mg/dl. La solución de hemolizado se ha preparado a partir de una muestra de sangre heparinizada previamente sometida a un proceso de hemólisis. Para la solución de bilirrubina se ha utilizado bilirrubina no esterificada disuelta en NaOH 0,1mol/l. Para la solución de triglicéridos se ha utilizado una solución comercial de Intralipid® al 20%.
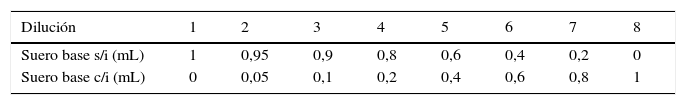
El suero base se ha preparado con una mezcla de sueros de pacientes con una concentración de magnitud cercana a los valores de decisión clínica. Las muestras seleccionadas no estaban hemolizadas ni contenían concentraciones elevadas de bilirrubina ni triglicéridos. A continuación se ha preparado el suero base con y sin interferente de la siguiente manera:
- •
Suero base sin interferente: 9,5mL de suero base+0,5mL de agua.
- •
Suero base con interferente: 9,5mL de suero base+0,5mL de la disolución concentrada del interferente.
Finamente se han realizado las diluciones entre el suero con y sin interferente, obteniendo unas concentraciones esperadas de los interferentes para cada dilución, tal como se indica en la tabla 1.
A continuación se procedió a medir la concentración de cada magnitud en cada una de las diluciones por duplicado. Se procesaron las diluciones de forma aleatoria y en la misma serie analítica. Se anotaron los índices séricos que proporcionó el analizador en cada muestra y se comparó el valor de este, expresado como un intervalo de concentraciones, con las concentraciones esperadas de los interferentes. Se consideró una medición como aceptable cuando el intervalo de concentraciones del índice obtenido en cada muestra contenía la concentración esperada.
Por otro lado, para cada magnitud se calculó la media y el porcentaje de interferencia en cada muestra. El porcentaje de interferencia (Int) se calculó de la siguiente forma: Int=100·(Cd−C1)/C1, siendo Cd la media de los valores de concentración obtenidos para cada dilución con interferente y C1 la media de concentración obtenida para la dilución 1 (sin interferente). Como valor de alerta se estableció el índice obtenido en la muestra en la que el interferente ocasiona un error de medida superior al límite significativo. Se ha elegido 10% como el límite de error significativo que es el mismo usado por el fabricante. Se compararon los valores de alerta que informa el fabricante con los obtenidos en el estudio. A continuación se ha elaborado el algoritmo para informar de la presencia de interferencias en nuestro laboratorio de urgencias, teniendo en cuenta tanto aspectos clínicos como técnicos procedentes de este estudio.
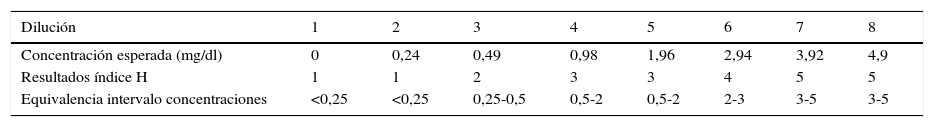
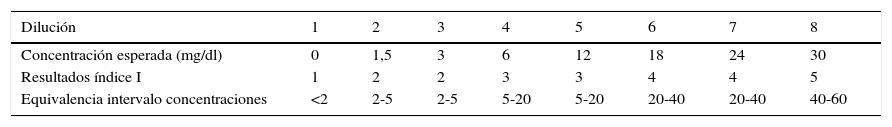
ResultadosLos resultados de los índices de hemólisis, ictericia y lipidemia (expresados en una escala ordinal del 1 al 6) y su equivalencia en intervalos de concentración de hemoglobina, bilirrubina y triglicéridos, se muestran en las tablas 2–4, respectivamente.
Índices de lipidemia (concentración equivalente de triglicéridos)
| Dilución | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|---|---|---|---|---|---|---|---|---|
| Concentración Intralipid® (mg/dl) | 0 | 100 | 200 | 400 | 800 | 1.200 | 1.600 | 2.000 |
| Concentración esperada triglicérido (mg/dl) | 95 | 185 | 276 | 452 | 809 | 1.166 | 1.520 | 1.880 |
| Resultados índice L | 1 | 2 | 3 | 3 | 4 | 4 | 4 | 4 |
| Equivalencia triglicérido Intervalo concentraciones | <25 | 25-50 | 50-200 | 50-200 | 200-600 | 200-600 | 200-600 | 200-600 |
En la verificación del sistema de medición, todos los resultados de los índices hemolíticos que proporciona el analizador incluyen la concentración esperada del interferente. Para la ictericia, se observa en la muestra 8 (concentración máxima de bilirrubina, 30mg/dl) como el resultado que proporciona el analizador está fuera del intervalo aceptable, mientras que en las muestras comprendidas entre la 2 y la 6 el resultado está cerca del intervalo aceptable. Para la lipidemia el analizador proporciona en general resultados más bajos de los esperados, ya que ninguna de las muestras analizadas da un índice superior a 4 (equivalente a entre 200 a 600mg/dl). Sin embargo la concentración equivalente de triglicérido más alta analizada es de 1.880mg/dl y teóricamente el analizador es capaz de medir esta concentración, ya que el índice 6 corresponde a un intervalo equivalente de triglicéridos de entre 1.000 y 3.000mg/dl.
Los valores de alerta de hemólisis, ictericia y lipidemia (expresados en una escala ordinal del 1 al 6) para los distintos procedimientos, tanto los obtenidos en el estudio como los recomendados por el fabricante, se muestran en las tablas 5–7, respectivamente.
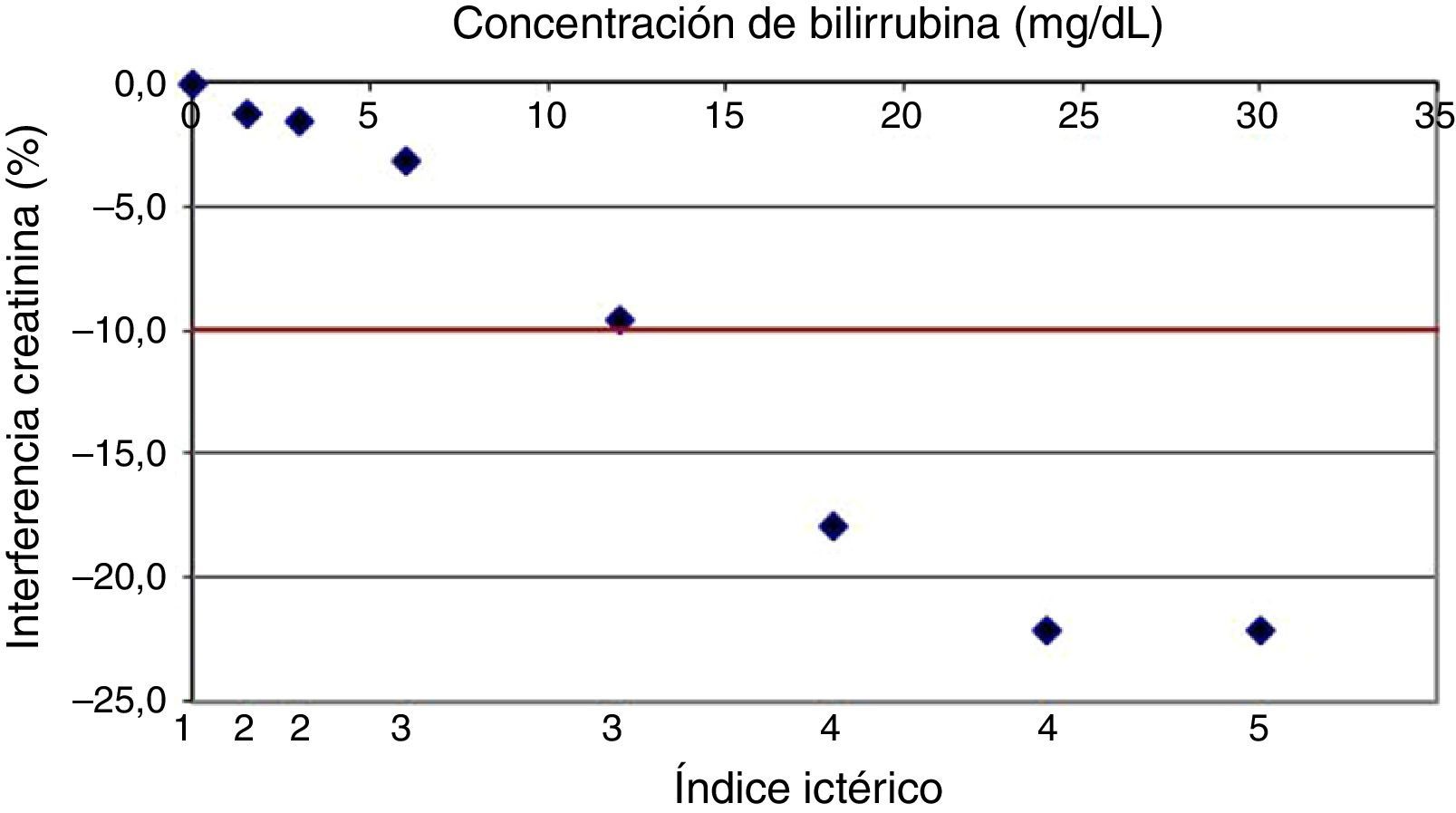
En la figura 1, se muestra el interferograma correspondiente a la creatinina ante concentraciones crecientes de bilirrubina con el objetivo de mostrar de forma gráfica el efecto del interferente en la medición de una magnitud bioquímica y ayudar en la interpretación de los resultados.
Para la implantación del algoritmo se ha utilizado la información recogida en esta verificación del sistema HIL y se ha contado como herramienta con el CentraLink®, que es el sistema informático de de la cadena Aptio de Siemens.
El algoritmo para informar las interferencias es el siguiente:
- •
Medir los índices séricos automáticamente a todas las muestras de suero, plasma y líquidos serosos.
- •
Establecer el error significativo de la interferencia en el 10% para todos los procedimientos. Para ello el analizador usa una tabla interna de equivalencia entre el procedimiento y el grado del interferente.
- •
Diferenciar entre una hemólisis in vivo o in vitro. La fuente de interferencia de la hemólisis debe por tanto ser producida por condiciones preanalíticas inadecuadas. Esto es generalmente difícil de evaluar10 ya que existen más de 50 causas que la pueden provocar, no obstante para agilizar todo el proceso se decidió establecer esta diferenciación solo en base a unos cuantos diagnósticos de pacientes que se encuentran más frecuentemente en el área de urgencias, y en los cuales la hemólisis in vivo es característica de la enfermedad. Así cuando se detecta una posible interferencia por hemólisis los resultados solo se informarán si la muestra viene acompañada por uno de los siguientes diagnósticos: anemia hemolítica autoinmune por anticuerpos calientes, anemia hemolítica autoinmune por anticuerpos fríos (crioglobulinas), síndrome hemolítico urémico y púrpura trombótica trombocitopénica.
- •
Rechazar manualmente el resultado e informar como «muestra hemolizada» si:
- ∘
La LDH tiene un índice hemolítico igual o superior a 2.
- ∘
El amonio, AST, CK e ion potasio tienen un índice hemolítico igual o superior a 3.
- ∘
La ALT tiene un índice hemolítico igual o superior a 5.
- ∘
- •
Informar todos los resultados de creatininas significativamente interferidos por muestras ictéricas (índice igual o superior a 4), ya que lógicamente esta interferencia siempre está relacionada con un origen fisiopatológico.
- •
Añadir automáticamente a las creatininas interferidas por la ictericia el comentario «Esta muestra tiene concentraciones elevadas de bilirrubina que pueden ocasionar disminuciones en el resultado de la concentración de creatinina de hasta el 20%».
- •
Revisar manualmente de forma visual las muestras con concentraciones elevadas de bilirrubina (índice igual o superior a 4) para verificar que el valor del índice hemolítico no está falsamente aumentado.
Se decidió no implantar este sistema en el caso de los índices de alerta de la lipidemia por la diferencia entre los resultados obtenidos en el estudio y los proporcionados por el fabricante.
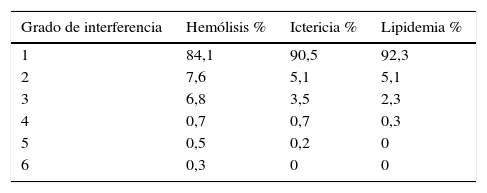
En la tabla 8 se recoge el porcentaje de muestras de suero y plasma detectadas a lo largo de un año (145.000 muestras) en nuestro laboratorio, para cada uno de los distintos grados de interferencia.
Porcentaje de muestras detectadas en el laboratorio para cada uno de los grados de interferencia
| Grado de interferencia | Hemólisis % | Ictericia % | Lipidemia % |
|---|---|---|---|
| 1 | 84,1 | 90,5 | 92,3 |
| 2 | 7,6 | 5,1 | 5,1 |
| 3 | 6,8 | 3,5 | 2,3 |
| 4 | 0,7 | 0,7 | 0,3 |
| 5 | 0,5 | 0,2 | 0 |
| 6 | 0,3 | 0 | 0 |
Porcentaje de muestras de suero y plasma detectadas a lo largo de un año (145.000 muestras) en nuestro laboratorio, para cada uno de los distintos grados de interferencia.
Los resultados obtenidos en el estudio de veracidad muestran que en el caso del índice de lipidemia el fabricante del analizador debería revisar el sistema de medición para que sea capaz de medir correctamente este interferente. La existencia de materiales de control con concentraciones conocidas del interferente podría ser útil para verificar en determinadas circunstancias estos sistemas de medición. Asimismo también sería conveniente disponer de materiales de calibración preferentemente con referencia a materiales certificados con el objeto de poder calibrar estos sistemas. Los resultados obtenidos en la evaluación del sistema de medición son compatibles con los obtenidos en un estudio reciente hecho con materiales de control específicos para estos índices11. La próxima implantación por parte de la SEQC de un programa piloto de evaluación externa de la calidad de estos índices podría ayudar en el objetivo de mejorar la calidad analítica de estos sistemas de medición.
Esta parte del estudio tiene una debilidad y es que se ha verificado el sistema para medir estos tres interferente de manera separada, existiendo el problema de que altas concentraciones de una de estas sustancias puedan interferir en la medición de las otras no habiéndose estudiado este aspecto. De hecho el fabricante informa que muestras muy lipémicas pueden afectar al resultado de hemólisis e ictericia dando resultados más altos de los reales o que muestras con concentraciones muy altas de bilirrubina pueden afectar al resultado de la hemólisis dando un índice más alto8. Muestras con concentraciones muy elevadas de ictericia y lipidemia deberían examinarse siempre manualmente para confirmar los resultados de los otros interferentes.
En el estudio de los índices de alerta de la hemólisis para la glucosa, magnesio y proteínas no se detectó interferencia en el intervalo de concentraciones estudiado de hemoglobina a pesar de que el fabricante sí que las informa. Asimismo para el amonio, AST y potasio se detecta una interferencia menor a la informada, mientras que para la LDH el valor de alarma coincide con el del fabricante y para la CK y la ALT la interferencia se produce a concentraciones más bajas de hemoglobina. Por lo tanto, excepto para la CK y la ALT, en general los resultados de este estudio muestran que los procedimientos están menos afectados por la hemólisis que lo que indica el fabricante.
En el estudio de los índices de alerta para la ictericia se observa que la interferencia para la creatinina se produce con un índice de alerta de 4 y no de 5 como informa el fabricante. Este hecho es importante ya que implica que hasta el 1% de las muestras de nuestro laboratorio sufren esta interferencia y no el 0,2% que consideraríamos si usásemos el índice del fabricante. Además, las proteínas tienen interferencia a partir de un índice de 5, el cual no se observa prácticamente nunca en nuestro laboratorio.
En la evaluación de los índices de alerta de la lipidemia la interferencia significativa en todos los procedimientos estudiados se ha producido a partir de la muestra 5. Como en este intervalo de concentraciones del interferente el analizador no lo cuantifica adecuadamente y no es posible distinguir entre sus distintas concentraciones (las muestras 5, 6, 7 y 8 dan un índice de 4 independientemente de la concentración de lípidos de la muestra), consideramos que los índices de alerta obtenidos en el estudio tienen escasa validez y no se deberían aplicar en la práctica clínica.
La incorporación de los analizadores de urgencias al sistema de automatización Aptio del CORE de nuestro laboratorio supuso la automatización de la centrifugación de las muestras y esto resultó en una pérdida de la capacidad de inspeccionar visualmente las muestras para detectar la presencia de interferencias. Este hecho junto con la necesidad de aportar objetividad y rapidez hizo patente la necesidad de establecer un algoritmo que permitiera decidir cuándo debían anularse los resultados, qué comentarios debían añadirse a las pruebas y cuándo se debían revisar manualmente las muestras. Este algoritmo ha sido consensuado con los clínicos de urgencias de nuestro hospital, es dinámico y puede estar sometido a cambios ante los distintos escenarios que se encuentran en su aplicación. Uno de los objetivos primordiales a la hora de su implantación fue que la carga de trabajo para los técnicos de laboratorio de urgencias fuese lo más baja posible.
La implantación del algoritmo de los índices séricos supuso un aumento del número de muestras que eran informadas como hemolizadas. Así, por ejemplo, para el potasio se pasó de informar un 3,5% de muestras como hemolizadas, con la inspección visual, a un 8,8% tras la implantación de este sistema. Este elevado porcentaje generó un aumento de las quejas por parte de los clínicos solicitantes de manera que para disminuir el impacto que esto generaba se decidió modificar, de acuerdo con ellos, el algoritmo en los siguientes puntos:
- •
Informar el resultado de amonio, AST, CK y potasio en aquellas muestras con un índice de hemólisis de 3, que constituían un 6,8% del total de las muestras.
- •
Añadir automáticamente a estos resultados el comentario siguiente: «Muestra ligeramente hemolizada. Este grado de hemólisis puede generar aumentos de hasta el 20% del parámetro señalado».
Mediante este sistema se ha disminuido hasta el 1,5% el número de muestras a las que se anula el resultado por estar hemolizadas, de manera que en aquellas con un bajo grado de hemólisis se da el resultado junto con la información del efecto que puede ocasionar esta hemólisis. Con respecto a los errores producidos por las interferencias es importante evaluar el efecto real que ellos tienen en el propio paciente. En un laboratorio de urgencias es especialmente importante valorar si es mayor la repercusión del error detectado, siempre que este además es informado, o el problema que plantea la solicitud de una nueva muestra que haga que se prolongue el tiempo de respuesta, lo que puede ser muy perjudicial especialmente en pacientes críticos.
Como se ha mostrado el algoritmo de actuación se basó en su mayor parte en procesos y reglas automáticas entre los que se encuentran:
- •
La captura por el sistema informático del laboratorio de los índices HIL obtenidos en el analizador.
- •
La captura de la alarma correspondiente a los índices de alerta.
- •
La adición de los comentarios a los resultados.
Solo se ha dejado al trabajo manual de los técnicos el rechazo de los resultados interferidos significativamente que ya están previamente señalados, la verificación del diagnóstico para descartar las hemólisis in vivo y la revisión manual de las muestras con concentraciones elevadas de bilirrubina.
Los avances surgidos en el campo de la automatización en el laboratorio clínico han permitido incorporar a los sistemas de integración y automatización del laboratorio elementos para el tratamiento preanalítico de las muestras como son las centrífugas, destaponadores, deselladores, etc. La automatización preanalítica aporta una indudable ventaja al eliminar procesos con escaso valor añadido, los cuales pueden conllevar riesgos biológicos además de ser fuente de un elevado número de errores, pero a la vez supone un inconveniente a la hora de detectar la posible existencia de interferentes en las muestras. Este problema se puede solucionar mediante la medida de los índices séricos en los propios analizadores y el establecimiento de un adecuado sistema de información de estas interferencias.
La incorporación de los índices de alerta de interferencias, sin una previa verificación de los mismos, puede llevar a cometer errores ya que estos sistemas adolecen de dos problemas principales: por un lado no siempre miden adecuadamente los interferentes (en este estudio se observa especialmente en la lipidemia) y además los valores de alerta que ofrecen no siempre están adecuadamente establecidos. Una correcta verificación de estos sistemas permitiría detectar la falta de veracidad en la medición de alguno de estos interferentes o el inadecuado establecimiento de algunos índices de alerta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.