El shock séptico es una enfermedad altamente letal y prevalente. La disfunción circulatoria progresiva causa hipoperfusión tisular e hipoxia, evolucionando eventualmente a disfunción multiorgánica y muerte. La reanimación temprana puede revertir estos mecanismos patogénicos, restaurando el suministro de oxígeno y la función orgánica. Existe alta heterogeneidad entre los determinantes de la disfunción circulatoria en el shock séptico, los algoritmos actuales aportan un enfoque gradual y estandarizado para la realización de la reanimación.
Esta revisión aporta el fundamento patofisiológico y clínico que se esconde tras ANDROMEDA-SHOCK-2, un ensayo controlado aleatorizado multicéntrico continuado, cuyo objetivo es comparar una estrategia de reanimación personalizada basada en la fenotipificación clínica y la evaluación de la perfusión periférica, en comparación con el estándar de cuidados, en la reanimación temprana del paciente con shock séptico.
Septic shock is a highly lethal and prevalent disease. Progressive circulatory dysfunction leads to tissue hypoperfusion and hypoxia, eventually evolving to multiorgan dysfunction and death. Prompt resuscitation may revert these pathogenic mechanisms, restoring oxygen delivery and organ function. High heterogeneity exists among the determinants of circulatory dysfunction in septic shock, and current algorithms provide a stepwise and standardized approach to conduct resuscitation.
This review provides the pathophysiological and clinical rationale behind ANDROMEDA-SHOCK-2, an ongoing multicenter randomized controlled trial that aims to compare a personalized resuscitation strategy based on clinical phenotyping and peripheral perfusion assessment, versus standard of care, in early septic shock resuscitation.
El shock séptico es un síndrome complejo, con una mortalidad estimada del 40%1, y altas tasas de ocupación en las unidades de cuidados intensivos, lo cual determina un gasto significativo de atención sanitaria2. Se estima que 11 millones de personas mueren cada año de sepsis, con una distribución desigual a nivel mundial3.
Dentro de la patogenia del shock séptico, la hipoperfusión progresiva juega un papel esencial, que determina la incapacidad general para aportar oxígeno para sostener el metabolismo celular, generando hipoxia tisular, disfunción orgánica múltiple y, eventualmente, la muerte4.
El tratamiento de este síndrome es complejo, y se enfrenta a una ventaja estrecha de oportunidad de revertir los mecanismos patogénicos que determinan los resultados adversos5. La reanimación hemodinámica puede desactivar este círculo vicioso, mejorar el suministro de oxígeno y restaurar la función orgánica. Sin embargo, si la reanimación no se realiza juiciosamente, tiene el potencial de causar daño por sobrereanimación6, perpetuando la disfunción orgánica, y añadiendo morbilidad a los pacientes críticos7.
Desde los años 90, se han propuesto estrategias diferentes para optimizar el proceso de reanimación en los pacientes con shock séptico. Dichas estrategias han evolucionado a la luz de la evidencia fisiológica y clínica acumuladas. Los pioneros en la protocolización del manejo del shock, tales como Hayes et al., se centraron en optimizar el gasto cardiaco y otras variables macrohemodinámicas, como medio de restaurar la perfusión tisular8. Posteriormente, Rivers et al. y Bakker et al. probaron protocolos centrados en las variables relacionadas con la perfusión tales como la saturación del oxígeno venoso central (ScvO2) o el lactato, para mejorar los resultados con resultados prometedores9,10. Esto último se convirtió en el objetivo estándar durante la última década. En el ensayo ANDROMEDA-SHOCK, el tiempo de relleno capilar (CRT) fue validado como objetivo nuevo de reanimación, mostrando superioridad sobre el lactato en varios aspectos11.
Sin embargo, todos estos protocolos se basan en cuidados comunes, secuenciales y estructurados para una enfermedad altamente heterogénea. Además, los determinantes relativos de la disfunción circulatoria (p. ej., hipovolemia, vasoplejía o disfunción miocárdica) pueden variar de un paciente a otro, determinando fenotipos hemodinámicos ciertos12. Por tanto, existe el riesgo de perder la ventana de oportunidad para las intervenciones efectivas y, por otro lado, de someter a los pacientes a intervenciones potencialmente inefectivas tales como la administración de fluidos a los pacientes con vasoplejía predominante.
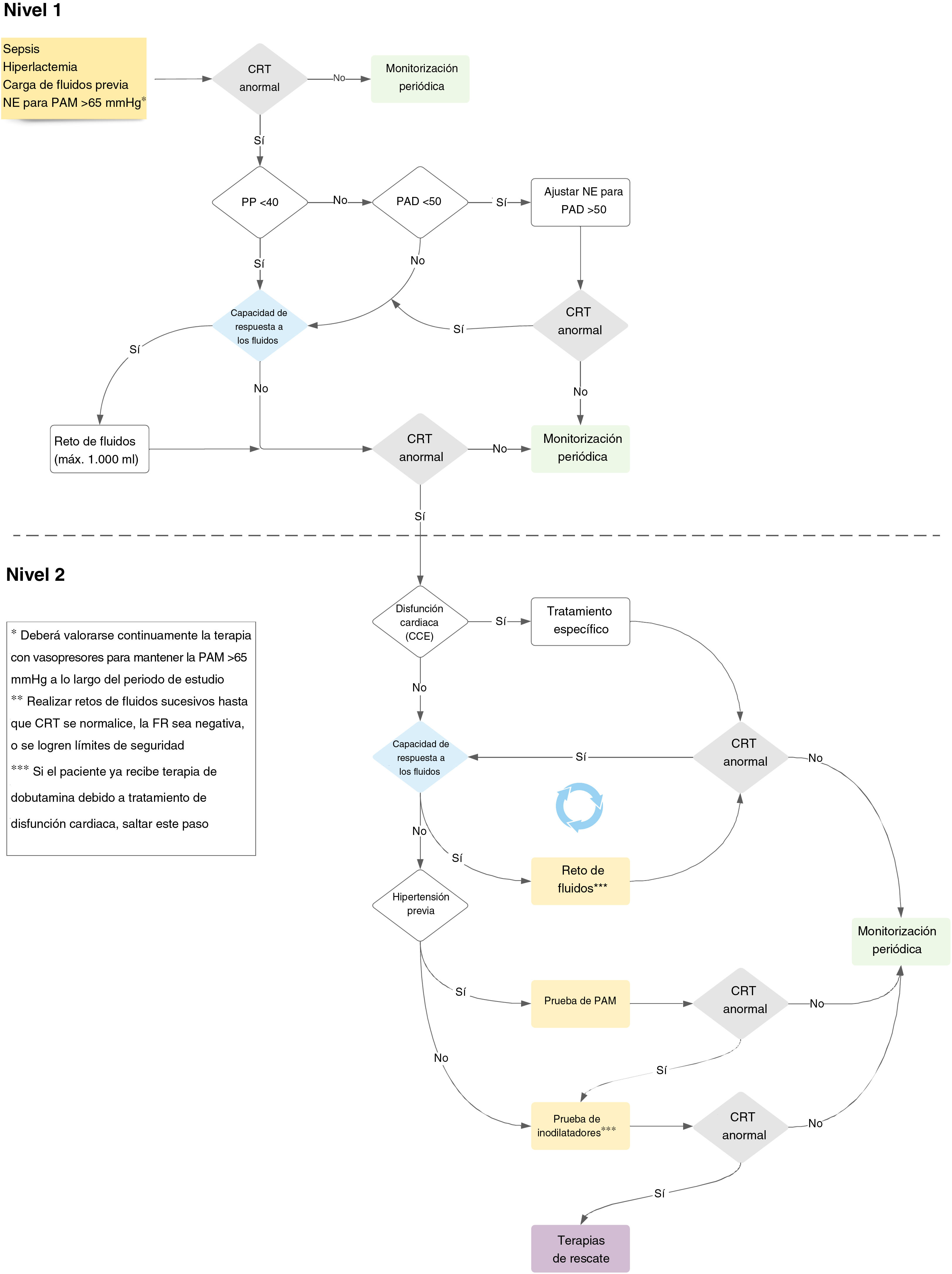
El estudio ANDROMEDA-SHOCK-2 (A2) es un ensayo clínico aleatorizado cuyo objetivo es comparar una estrategia de reanimación basada en fenotipos hemodinámicos y la normalización de la perfusión periférica frente al estándar de cuidados en los pacientes con shock séptico13. La estrategia propuesta es un esfuerzo multidimensional que trata de personalizar la reanimación temprana en el shock séptico, utilizando herramientas simples disponibles a pie de cama, con un sólido antecedente fisiológico (figs. 1 y 2, tabla 1). El objetivo de esta revisión es explorar el fundamento fisiológico y clínico para el algoritmo de manejo propuesto en A2.
Tiempos de evaluación de la capacidad de respuesta a los fluidos y reto de fluidos a lo largo del protocolo del estudio
| Tiempos del protocolo de la evaluación de FR | Alternativas de la toma de decisión | Características clave |
|---|---|---|
| Nivel 1 | FR+ Reto de fluidos | - Máximo de dos retos de fluidos de 500ml (1.000ml totales) |
| CRT anormal | FR− Evaluación de la función cardiaca | |
| Presión de pulso <40mmHg | ||
| Nivel 1 | FR+ Reto de fluidos | - Máximo de dos retos de fluidos de 500ml (1.000ml totales) |
| CRT anormal | FR− Evaluación de la función cardiaca | |
| Presión de pulso >40mmHg | ||
| PAD>50mmHg | ||
| Nivel 2 | FR+ Reto de fluidos | - Retos sucesivos de 500ml |
| CRT anormal | FR− | - Reevaluación periódica de CRT, estatus de FR y congestión venosa |
| No disfunción de VI o VD | HTA: Prueba de vasopresores | |
| = | No HTA: Prueba de dobutamina | |
| = |
CRT: tiempo de relleno capilar; FR: respuesta a los fluidos; HTA: hipertensión arterial; PAD: presión arterial diastólica; VI: ventrículo izquierdo; VD: ventrículo derecho.
El territorio cutáneo carece de control de flujo autorregulatorio y, por tanto, la caída del flujo sanguíneo sistémico o de la presión de perfusión, y la subsiguiente activación del sistema simpático, puede alterar la perfusión cutánea en los estados de shock14. Esto puede evaluarse dinámicamente mediante la evaluación de la perfusión periférica15. Los estudios observacionales han reflejado que la perfusión periférica anormal tras una reanimación inicial o avanzada está asociada a un incremento de la morbilidad y mortalidad en el shock séptico16,17. De hecho, el excelente pronóstico asociado a la recuperación del CRT, su simplicidad y rápida cinética de recuperación18, su disponibilidad en los contextos con recursos limitados, así como su capacidad de sustitución en paralelo por la perfusión hepatoesplácnica19, son motivos sólidos para considerar el CRT como objetivo principal de la reanimación con fluidos en los pacientes con shock séptico. Además, existe evidencia reciente de la correlación entre el CRT y los índices microcirculatorios sublinguales20, y su rápida respuesta a la maniobra de elevación pasiva de la pierna o la carga de fluidos21.
La reanimación centrada en el CRT se asoció a una menor mortalidad (34,9 frente al 43,4%), efectos beneficiosos en la disfunción orgánica, y menor intensidad del tratamiento en el ensayo ANDROMEDA-SHOCK11, hecho que fue confirmado por un análisis bayesiano subsiguiente22. Algunos análisis post hoc del ensayo ANDROMEDA-SHOCK confirman además la relevancia de la monitorización del CRT. En primer lugar, los pacientes con CRT normal basal exhibieron una menor mortalidad significativa a 28 días, en comparación con aquellos con CRT anormal (27 frente al 43%; p=0,001)23. Por ello, parece que el CRT basal podría definir fenotipos de severidad en el shock séptico, mientras que al menos el 25% de los pacientes con CRT normal podrían evitar eventualmente la exposición a la reanimación excesiva. En segundo lugar, entre los pacientes con CRT normal a las 2h, aquellos originalmente asignados al brazo guiado por lactato continuaron la reanimación por protocolo cuando el índice de lactato continuó siendo anormal, en comparación con el brazo guiado por CRT, en quienes se interrumpió la reanimación. Los primeros recibieron un número de intervenciones de reanimación significativamente mayor, tales como bolos de fluidos, y fármacos vasoactivos, y exhibieron una mortalidad considerablemente mayor (40 frente al 23%; p=0,009)24.
El impacto y la aplicación inmediata a nivel mundial de la reanimación centrada en el CRT hace que la investigación complementaria sea una tarea urgente. La novedad clave de A2 es la combinación de una estrategia centrada en CRT y la fenotipificación hemodinámica clínica que pueda ayudar a personalizar la reanimación inicial, con efectos adicionales potenciales economizadores de fluidos13.
Presión de pulsoLa presión de pulso (PP) hace referencia a la diferencia entre las presiones sistólica y diastólica. De acuerdo con el modelo de Windkessel de 3 compartimentos, la PP vendrá determinada por el volumen de eyección, la distensibilidad arterial total y la impedancia característica aórtica25. Desde inicios del siglo XX, diferentes investigadores han tratado de estudiar la correlación entre la PP arterial y el volumen de eyección, lo cual demuestra que la PP puede rastrear adecuadamente dicho volumen de eyección26,27. De hecho, las derivaciones matemáticas de este modelo suministraron la base para los monitores del gasto cardiaco basados en el análisis del contorno del pulso28. Caben destacar otras situaciones patofisiológicas que producen contornos de la onda de pulso anormales y alteran la PP, que incluyen estenosis aórtica, ductus arterioso patente y regurgitación aórtica29.
Por ello, la PP se convierte en una ventana sencilla para evaluar la función cardiaca y sus interacciones con el sistema vascular, sin necesidad de monitorización avanzada del gasto cardiaco, que no siempre está disponible a pie de cama30. La PP se incrementa normalmente con la edad, debido a los cambios de la impedancia aórtica, pero en términos generales, una PP<40mmHg es claramente baja, y refleja un descenso del volumen de eyección que podría explicarse bien por el descenso de la precarga o bien por una disfunción cardiaca severa.
En el protocolo del estudio ANDROMEDA-SHOCK-2, la PP se convierte en la primera evaluación hemodinámica esencial para categorizar seguidamente a los pacientes con CRT anormal en fenotipos amplios, de acuerdo con sus valores13. Esta simple variable hemodinámica determina el rastreo subsiguiente de la reanimación divergente. Por tanto, si un paciente presenta una baja PP, se prueba la capacidad de respuesta a los fluidos (FR) (ver más adelante), pudiendo administrarse hasta 1.000ml como reto de fluidos durante las intervenciones de primer nivel. Por el contrario, una PP normal junto con una baja presión arterial diastólica (PAD) representa una vasoplejía predominante y, en este contexto, deberá perseguirse una PAD mínima mediante el incremento de vasopresores (ver más adelante).
Presión arterial diastólicaLa PAD en individuos sanos viene determinada principalmente por el tono vascular y la frecuencia cardiaca, permaneciendo casi constante desde la aorta ascendente a los vasos periféricos. Por ello, la baja presión diastólica en los vasos refleja vasodilatación sistémica, siempre que la válvula aórtica sea competente. En los pacientes mayores, la menor presión diastólica está asociada al incremento de la tasa de episodios cardiovasculares31. La PAD, además de ser un marcador del tono arterial, representa la presión de entrada para la perfusión coronaria, especialmente el subendocardio ventricular izquierdo32. Una baja PAD (menor a 50mmHg) puede alterar la perfusión miocárdica33. En una cohorte de pacientes con enfermedad de las arterias coronarias, la baja PAD se asoció a mayores tasas de episodios cardiovasculares y mortalidad.
En los pacientes con shock séptico, la PAD inferior a 50mmHg es un factor predictivo temprano de la mortalidad intrahospitalaria, pudiendo considerarse un objetivo terapéutico34. Por tanto, la evaluación del tono vascular a través de la severidad de la hipotensión diastólica tiene implicaciones importantes para las decisiones terapéuticas y la administración temprana de los agentes vasoactivos para restaurar prontamente la perfusión tisular, a la vez que se evita la administración de fluidos inefectiva. Por otro lado, en los pacientes con shock séptico en los que existe una gran proporción de pacientes con enfermedad de las arterias coronarias, la baja PAD incrementa el riesgo de isquemia miocárdica, que puede asociarse a un descenso del volumen de eyección y a una mayor alteración de la perfusión tisular y microcirculación35. Esto se vuelve especialmente cierto en el caso de la taquicardia, (ya que normalmente se produce en el shock séptico), donde se produciría una PAD mayor de lo normal, ya que el descenso del tiempo diastólico previene unos menores valores de PAD34,36. Por tanto, si se presenta taquicardia y la PAD es baja, la vasoplejía debe ser un determinante relevante, pudiendo ser un signo para el ajuste de la terapia vasopresora33,37.
ANDROMEDA-SHOCK-2 será el primer ensayo que pruebe si la corrección de una PAD baja en los pacientes con shock séptico (fenotipo vasopléjico) mejorando la administración de vasopresores, está asociada a la recuperación de la perfusión tisular.
Evaluación sistemática de la capacidad de respuesta a los fluidosLa capacidad de FR puede entenderse generalmente como la capacidad del corazón para incrementar el gasto cardiaco tras administrarse un bolo de fluidos38. Esto solo ocurrirá si el corazón está situado en la parte pronunciada de la curva de Frank Starling (dependencia de la precarga). En la literatura han surgido métodos diferentes de evaluación de la capacidad de RF a pie de cama, que bien pueden incrementar reversiblemente la precarga, a través de la interacción cardiopulmonar (es decir, la variación de la PP) o bien inducir una movilización de 300ml de sangre desde el compartimento de volumen no estresado al estresado (es decir, elevación pasiva de la pierna)39.
La administración de fluidos efectiva durante los estados de shock incrementa la presión de relleno sistémica media, incrementando el retorno venoso y, eventualmente el gasto cardiaco. Lamentablemente, solo el 40-50% de los pacientes ingresados en la unidad de cuidados intensivos (UCI) tienen capacidad de RF40. Por ello, perseguir la administración de fluidos sin probar capacidad de respuesta a los mismos, podría poner en riesgo de congestión venosa a un número considerable de pacientes, sin lograr el objetivo previsto de incrementar el gasto cardiaco. A pesar de su fondo fisiológico sólido, y de ser recomendado por las guías actuales, las pruebas de capacidad de FR no se utilizan rutinariamente. En el estudio FENICE, el 43% de los clínicos no utilizaron ninguna prueba para predecir la capacidad de FR, y solo el 20% utilizó variables dinámicas41.
Como hemos mencionado previamente, se han propuesto diferentes pruebas de capacidad de FR en la literatura, con grados variables de especificidad y sensibilidad, y aplicabilidad en contextos clínicos particulares42. Probablemente, el escenario más difícil es el los pacientes con respiración espontánea, donde las interacciones cardiopulmonares son altamente impredecibles, e impiden el uso de pruebas tales como la variación de la PP o la variación del volumen de eyección43.
Dos ensayos controlados aleatorizados (ECA) recientes han integrado la evaluación sistemática de la capacidad de RF en su algoritmo de reanimación y aportan ideas a su valor clínico. El ensayo FRESH comparó el estándar de cuidados y la guía de administración de fluidos a través de la evaluación dinámica de la capacidad de RF (maniobra de elevación pasiva de la pierna), con el objetivo de lograr un menor equilibrio de fluidos a las 72h44. En dicho ensayo, el 42% de los pacientes del grupo intervención presentó un estatus de la capacidad de FR+ al ser incluidos en el estudio. Solo el 12% de los pacientes de la capacidad de FR+ mantuvo un estatus persistente durante el periodo de estudio, y el 18% tuvo estatus de la capacidad de FR− persistente durante las primeras 72h. El grupo intervención recibió menos fluidos (−1,37 [−2,53 a −0,21]; p=0,021), y tuvo menores necesidades tanto de terapia de reemplazo renal como de ventilación mecánica invasiva44.
El ensayo ANDROMEDA-SHOCK integró la evaluación sistemática de la capacidad de RF en su algoritmo de reanimación, con un enfoque pragmático de selección de las pruebas, de acuerdo con el contexto clínico45. Un análisis post hoc de este ECA que explora esta cuestión demostró que en el 82% de los pacientes era factible la evaluación de la capacidad de FR y, de este grupo, el 70% tenía estatus positivo de la capacidad de FR en el momento de la inclusión en el estudio. Al igual que el ensayo FRESH, el estatus de la capacidad de FR+ fue evanescente a lo largo del periodo de reanimación. Los pacientes con estatus de la capacidad de FR− recibieron 1.500ml menos que el grupo de la capacidad de FR+, pero lograron sus parámetros predefinidos de reanimación en una proporción similar. Esto aporta evidencia de la seguridad de retener los fluidos en un contexto de la capacidad de FR−40.
En A2, se perseguirá la evaluación sistemática de la capacidad de RF mediante múltiples pruebas dinámicas en el grupo intervención. En este sentido, la administración de fluidos debe responder a un desencadenante jerárquico de la reanimación, es decir, una señal de hipoperfusión tisular que pueda corregirse mediante el incremento del gasto cardiaco. La evaluación sistemática de la capacidad de FR es la piedra angular sobre la que se establece la optimización con fluidos en la sepsis. La capacidad de FR sería una prueba preceptiva antes de cada carga de fluidos y, siempre que cambie el perfil hemodinámico del paciente, bien debido a la evolución de la sepsis, o debido a las terapias utilizadas. Este enfoque posibilitará la individualización segura de la fluidoterapia, evitando la sobrecarga de fluidos en el shock séptico (tabla 2).
Perspectivas sobre personalización hemodinámica y ventajas potenciales presentes en el ensayo ANDROMEDA-SHOCK-2
| Perspectiva de personalización | Ventajas potenciales |
|---|---|
| Evaluación de la presión de pulso | La baja PP se utiliza como subrogado del volumen de eyección bajo, identificando así un patrón hemodinámico clave.Vías divergentes: administrar fluidos si la capacidad de FR+ o evaluar la función cardiaca si la capacidad de FR−. |
| Objetivo de PAD mínima | La baja PAD se utiliza como subrogado para vasoplejía como patrón hemodinámico clave.El incremento de PAD puede mejorar la perfusión y la función ventricular.Evitar fluidos innecesarios en pacientes predominantemente vasopléjicos. |
| Evaluación sistemática de la capacidad de respuesta a los fluidos | Identificar a los pacientes que incrementarán el GC con reto de fluidos.La evaluación periódica puede ayudar a identificar la variabilidad característica a lo largo de la reanimación. |
| Fluidos de primer nivel | Se considera un máximo de 1.000cc de fluidos antes de realizar ecografía focalizada a pie de cama, evitando la congestión perjudicial potencial en los pacientes con disfunción cardiaca. |
| Ecografía focalizada a pie de cama | La evaluación ecográfica se centra en los pacientes en quienes fracasan las intervenciones de reanimación, racionalizando el recurso.Es necesario identificar prontamente la disfunción izquierda o derecha, e iniciar terapias específicas, de ser necesario.Continuar la administración de fluidos con un umbral de seguridad desde la perspectiva cardiaca. |
| Prueba de PAM | En pacientes previamente hipertensos, el incremento transitorio de la PAM puede identificar a los pacientes en quienes mejora la perfusión tisular, y en quienes no.Puede estratificarse a los pacientes en virtud de la respuesta, y evitar efectos adversos potenciales del uso inadecuado o excesivo de catecolaminas si el incremento de PAM fuera inútil. |
| Prueba de dobutamina | Administración transitoria de bajas dosis de dobutamina para mejorar la perfusión tisular.De no demostrarse un efecto clínico, se interrumpe la administración de dobutamina, evitando los efectos perjudiciales potenciales. |
| CRT objetivo | Rápida respuesta cinética a las intervenciones de reanimación.Evitar las intervenciones de reanimación excesivas.Si el CRT basal es normal, no se expone a los pacientes a intervenciones de reanimación adicionales, garantizándose la monitorización periódica. |
CRT: tiempo de relleno capilar; FR: respuesta a los fluidos; GC: gasto cardiaco; PAD: presión arterial diastólica; PAM: presión arterial media; PP: presión de pulso.
Tradicionalmente, la disfunción ventricular izquierda ha sido descrita como un fenómeno tardío en la evolución del shock séptico, pero la evidencia actual no respalda esta idea, variando ampliamente la incidencia en la literatura46,47. La identificación de patrones ecocardiográficos combinados con variables hemodinámicas en una cohorte de pacientes con shock séptico temprano ha permitido la identificación de cinco fenotipos bien definidos: hiperdinámico, hipovolémico persistente, disfunción ventricular izquierda, disfunción ventricular derecha y reanimación adecuada12. Estos fenotipos diferentes reflejan diversas combinaciones de alteraciones del retorno venoso, inotropismo y acoplamiento ventricular-arterial, pudiendo variar con el tiempo como respuesta a las maniobras terapéuticas. Su identificación tiene implicaciones pronósticas y terapéuticas48.
De hecho, la identificación de los pacientes con disfunción ventricular izquierda o derecha severa antes de la administración de más fluidos, o de combinaciones vasoactivas, puede impedir la sobrecarga de fluidos y permitir un manejo más racional que pueda incluir inótropos, posición prona, o ajuste de PEEP, dependiendo de los hallazgos. Por otro lado, el conocimiento de que cerca del 40% de los pacientes de shock séptico (fenotipos hiperdinámico e hipovolémico persistente) tiene situaciones en las que el uso indiscriminado de dobutamina puede asociarse a efectos adversos severos, subraya la relevancia de evaluar debidamente la función cardiaca en los pacientes que no responden al manejo inicial del shock séptico12.
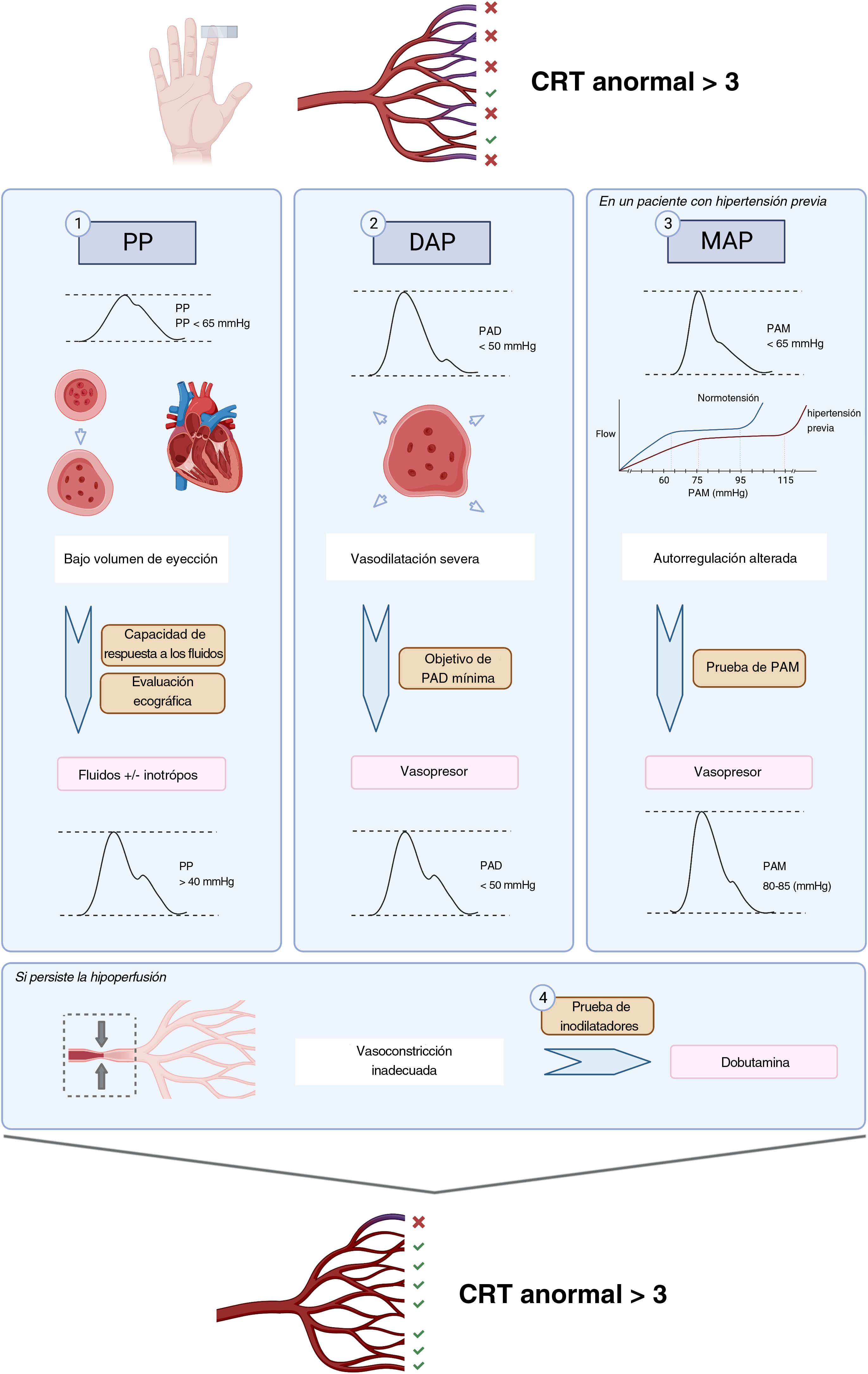
La evaluación ecocardiográfica de la función sistólica izquierda es difícil, debido a la dependencia de situaciones de carga, frecuencia cardiaca, efecto de las maniobras de reanimación y el tiempo de evaluación. La fracción de eyección ventricular izquierda (LVEF) es un parámetro clásico y universalmente utilizado, aunque su sensibilidad es menor a la de otras técnicas tales como la deformación longitudinal global mediante rastreo de manchas49. El cambio del área fraccional (FAC) medido en el eje corto del plano paraesternal al nivel de los músculos papilares presenta una buena correlación con la LVEF y su valor pronóstico. La integral de la velocidad respecto al tiempo (IVT) medida mediante Doppler pulsado en el tracto de salida del ventrículo izquierdo es un buen parámetro subrogado del volumen sistólico, ya que el diámetro del tracto de salida es constante. Sus valores normales se sitúan entre 16 y 20cm50–52. En línea con este concepto, el estudio A2 define la disfunción ventricular izquierda mediante la asociación de la depresión de la función sistólica medida por el FAC, y un bajo volumen de eyección, según lo evaluado por IVT (figs. 1 y 2). No trata de distinguir la disfunción sistólica asociada a la sepsis de la disfunción sistólica preexistente, sino identificar a aquellos pacientes que requieren un manejo específico fuera de protocolo.
Los parámetros de la función sistólica del ventrículo derecho (TAPSE, S’, FAC) presentan las mismas limitaciones que en el izquierdo, impidiendo la anatomía completa del ventrículo izquierdo el cálculo de la fracción de eyección ventricular derecha con el equipo convencional. Una propuesta reciente ha sido definir el fracaso ventricular derecho sobre la base de sus características patofisiológicas: presencia de dilatación del VD asociada a la elevación de la presión venosa central (PVC) como parámetro subrogado de las presiones de relleno elevadas53. La aplicación de esta definición ha sido explorada en diversos estudios, así como el valor del umbral patológico de la PVC que guarda relación con una mayor morbilidad y mortalidad54,55. En A2, la disfunción ventricular derecha se define como la combinación de la dilatación severa del VD (ratio del área VD/VI≥1) y una PVC> 8mmHg (fig. 2). Para la consideración definitiva de la presencia de fallo ventricular derecho es necesario tener en cuenta la interacción con los parámetros ventilatorios tales como la presión intratorácica excesiva o los altos niveles de PEEP.
El uso preceptivo de ecocardiografía en las fases tempranas de la reanimación es una de las piedras angulares del protocolo ANDROMEDA-SHOCK-2. Representa la primera medida de las intervenciones de Nivel 2, debiendo realizarse cuando fallan las intervenciones de Nivel 1 para normalizar el CRT. El objetivo primario en este punto es descartar la disfunción ventricular izquierda severa o el fallo ventricular derecho, situaciones que pueden exigir un manejo específico fuera de protocolo. Sin embargo, otros hallazgos pueden ser relevantes para el ajuste del tratamiento más allá del periodo de intervención de 6h.
Prueba de la presión arterial mediaEn la fase temprana del shock séptico, los mediadores proinflamatorios circulantes inducen tanto un descenso del tono vascular arterial, que origina una caída de la presión arterial media (PAM), como también una dilatación venosa que genera una hipovolemia relativa con el consiguiente descenso de la presión de relleno sistémica media, precarga y gasto cardiaco. El descenso del flujo de sangre sistémico y de la presión de perfusión (PAM) puede alterar gravemente la perfusión tisular y la oxigenación celular4,56. Por tanto, una prioridad esencial de la reanimación hemodinámica es la restauración de los valores mínimos de la PAM. El uso racional de vasopresores tiene como objetivo mejorar la PAM a la vez que se minimizan los episodios adversos tales como arritmias o episodios isquémicos57.
En muchos pacientes, en condiciones normales, en órganos con capacidad autorregulatoria, cuando la PAM desciende por debajo de los límites de la autorregulación, entre 60-65mmHg, la perfusión orgánica se vuelve dependiente de la presión58. En los pacientes con hipertensión crónica, estos umbrales de autorregulación viran hacia la derecha, por lo que es mayor el límite inferior de su autorregulación59,60. Además, en la sepsis, la reactividad vascular se ve alterada debido a los cambios en la producción de óxido nítrico y la liberación de mediadores vasoactivos a nivel regional en los tejidos. Esta alteración cambia los umbrales de la autorregulación al alza, elevando los niveles de PAM necesarios para preservar la presión de perfusión efectiva. Sin embargo, no está claro si esos límites autorregulatorios específicos son para cada paciente individual y, por tanto, se desconoce el valor óptimo de la PAM11.
La recomendación de la guía Surviving Sepsis Campaign para mantener una PAM de al menos 65mmHg5, se basa en los resultados de 3 ECA más recientes sobre el objetivo más adecuado de PAM en los pacientes con shock (SEPSISPAM, OVATION, y 65 Trial)57. Dichos estudios probaron el impacto de objetivos más elevados de PAM frente a las recomendaciones estándar sobre resultados mayores, sin hallar diferencia alguna en cuanto a mortalidad. Sin embargo, en el ensayo SEPSISPAM, el subgrupo de pacientes hipertensos crónicos asignados al objetivo de PAM más alto requirieron menos terapia de reemplazo renal59. Richards-Belle et al. realizaron una revisión sistemática y un metaanálisis de estos ECA para evaluar si la exposición a los vasopresores de los pacientes con shock estaba asociada al incremento de la mortalidad (3.496 pacientes), no encontrándose diferencia significativa. Sin embargo, el riesgo de arritmias puede guardar correlación con dosis más altas de vasopresores61.
Algunos territorios, es decir como los esplácnicos, musculoesqueléticos y tejidos cutáneos, muestran una autorregulación limitada del flujo sanguíneo, lo cual los hace más susceptibles a la hipoperfusión en situaciones con reducción de la PAM58. Además, la remodelación de las arteriolas secundaria a la hipertensión origina estenosis proximal funcional en el lecho vascular. Cuando desciende la PAM en áreas con respuesta autorregulatoria, aun cuando los umbrales podrían ser superiores en pacientes hipertensos, el lecho distal tiene una cierta capacidad de dilatación, a fin de mantener un flujo sanguíneo adecuado62. Por contra, en aquellos territorios con respuesta autorregulatoria limitada, la perfusión depende completamente de la PAM.
Entonces es posible que en el subgrupo de pacientes crónicamente hipertensos en situación de shock y disfunción microcirculatoria pueda ser beneficiosa una PAM más elevada59. De manera característica, el shock séptico persistente se asocia a anomalías microcirculatorias en las que una característica relevante es la heterogeneidad microvascular. Ello determina respuestas variables a los cambios de la presión de perfusión. De hecho, un estudio emblemático realizado por Dubin et al. encontraron que los cambios de la perfusión del lecho vascular sublingual causados por un incremento de la PAM en los pacientes sépticos dependen principalmente del estado basal de la microcirculación62. Solo aquellos pacientes que inicialmente tuvieron alterada la microcirculación mejoraron esta y, por el contrario, las dosis más altas de norepinefrina podrían alterar eventualmente el flujo microcirculatorio en los pacientes con microcirculación basalmente preservada. Ello significa que, eventualmente, el equilibrio entre el incremento de la presión de perfusión sistémica puede compensarse por una vasoconstricción excesiva de las arteriolas precapilares en algunos pacientes.
Para determinar el beneficio o riesgo de incrementar los niveles de la PAM en pacientes individuales con hipoperfusión persistente, se propuso una prueba de PAM en el ensayo ANDROMEDA-SHOCK. Suponiendo que el CRT es un subrogado adecuado del flujo microcirculatorio, en pacientes previamente hipertensos con CRT anormal persistente se indujo un incremento transitorio de PAM a niveles de 80-85mmHg, reevaluándose el CRT una hora después. Este nivel de PAM se mantuvo solo en los pacientes que normalizaron la variable, lo cual ocurrió en el 40% de los casos. Esta misma estrategia será utilizada en A2.
Prueba de la dobutaminaLa administración de dobutamina, un análogo sintético que actúa sobre los receptores adrenérgicos alfa-1, beta-1 y beta-2, durante la reanimación por shock séptico, es una cuestión controvertida. Las guías Surviving Sepsis Campaign más recientes ofrecen un bajo nivel de evidencia con una recomendación para el uso de dobutamina, limitando este a los pacientes con disfunción ventricular y signos de hipoperfusión persistente, a pesar de la reanimación con fluidos adecuada5. En una encuesta reciente realizada por intensivistas europeos, dobutamina fue el único fármaco inotrópico utilizado en las situaciones de shock, mientras que el 22% de los respondedores lo utilizaron en casos de shock con signos persistentes de hipoperfusión, incluso en ausencia de disfunción ventricular63.
Los estudios fisiológicos han explorado el impacto de la dobutamina en ambas variables microcirculatorias y macrohemodinámicas. En algunos estudios, dobutamina, a través del incremento del transporte de oxígeno, estuvo asociada a la mejora de los niveles de lactato y al pH de la mucosa gástrica64,65. Otras experiencias demostraron una mejora de la perfusión de las vellosidades intestinales y la microcirculación sublingual, sin cambios en cuanto a gasto cardiaco o presión arterial66. Sin embargo, otros estudios en contextos clínicos o experimentales aportaron resultados contradictorios.
No existen estudios clínicos que muestren un beneficio directo de dobutamina en los resultados centrados en el paciente, y la evidencia disponible es altamente heterogénea. En los estudios ProCESS, ARISE y ProMISE se comparó la terapia early goal-guided therapy (EGDT) con el estándar de cuidados67. Aunque el número global de pacientes tratados con dobutamina fue bajo, su uso fue considerablemente superior en los brazos de EGDT (ProCESS 5,7 frente al 1%, ProMISE 18,1 frente al 3,8% y ARISE 15,4 frente al 2,6%). Dichos estudios no encontraron diferencias entre los dos grupos de tratamiento en términos de mortalidad. Algunos informes han mostrado signos de mortalidad incrementada en los pacientes tratados con dobutamina (60,2 frente al 49,4%; OR: 1,55; IC 95%; 1,01-2,37; p=0,044)68, mientras que otros han favorecido la combinación de norepinefrina y dobutamina69,70.
Dada la respuesta heterogénea a la dobutamina, es relevante caracterizar adicionalmente qué subconjunto de pacientes sépticos puede beneficiarse potencialmente de su uso. La ecocardiografía es una herramienta importante no solo para evaluar la función ventricular previa a su administración, sino también para monitorizar la respuesta y el seguimiento71. Teniendo este objetivo en cuenta, se realizó un estudio en 23 pacientes con sepsis a quienes se administraron dosis incrementadas de dobutamina, de 2,5 a 10μg/kg/min. El volumen sistólico se incrementó en la mitad de los pacientes, con un mayor incremento en el grupo con disfunción ventricular. De igual modo, no se observó mejora de la microcirculación en este estudio, excepto en el grupo con la mejor densidad de capilares perfundidos72. Un estudio reciente en el que se agruparon pacientes con shock séptico, de acuerdo con los parámetros ecocardiográficos y clínicos, podría servir de ayuda adicional a este empeño12. Por tanto, identificar a los pacientes con patrones cardiovasculares específicos, tales como disfunción ventricular izquierda o derecha, podría ayudar a objetivar el uso de dobutamina, a la vez que se evita en estados de tipo hipovolémico o hiperdinámico (que representaron el 40% en este ensayo).
De igual modo, como en el ensayo ANDROMEDA-SHOCK, y considerando la evidencia contradictoria sobre sus efectos microcirculatorios y macrohemodinámicos, el estudio ANDROMEDA-SHOCK-2 propone el uso de dobutamina como prueba de inodilatador, durante la última parte del algoritmo de reanimación. En pacientes con función ventricular normal y CRT persistentemente alterado, se inicia tratamiento con dobutamina a dosis bajas (2,5-5μg/kg/min), reevaluándose el CRT transcurrida 1 hora. De no existir mejora de la perfusión tisular, se interrumpe la infusión de dobutamina, manteniéndose de otro modo.
ConclusiónEl ensayo ANDROMEDA-SHOCK-2 probará una estrategia multidimensional para personalizar la reanimación temprana en el shock séptico, utilizando herramientas simples disponibles a pie de cama, junto con un fondo fisiológico sólido. Los pilares del algoritmo propuesto son el uso de CRT como objetivo y la fenotipificación hemodinámica, que incluye el análisis combinado de la PP y la PAD para decidir sobre intervenciones futuras en los pacientes con hipoperfusión persistente. Los pacientes con PP baja frente a normal serán manejados de manera diferente, bien eligiendo la evaluación de capacidad de RF y bolos potenciales de fluidos en el primer caso, frente a incrementar la dosis de vasopresores para obtener una PAD mínima en el segundo. Además, la reevaluación sistemática y repetida del estatus de la capacidad de FR, así como la limitación de los bolos de fluidos hasta un máximo de 1l antes de realizar una ecocardiografía básica formal para descartar una disfunción cardiaca severa, puede ayudar a evitar la administración de fluidos potencialmente dañina. Por último, el uso de pruebas de PAM o dobutamina en los pacientes, que no responden a intervenciones previas, puede mejorar también el ratio riesgo/beneficio de estas intervenciones vasoactivas. La suma de todas estas intervenciones fisiológicamente adaptadas puede aportar la mejor oportunidad de personalizar la reanimación temprana en el shock séptico, maximizando las probabilidades de una reperfusión rápida y, al mismo tiempo, reduciendo el riesgo de una sobrecarga o reanimación excesiva con fluidos. Los resultados de ANDROMEDA-SHOCK-2 definirán si la personalización de la reanimación en el shock séptico con el uso de herramientas clínicas simples puede mejorar los resultados relevantes en esta situación grave.
Hospital Universitari y Politecnic La Fe, Valencia: Paula Carmona, Iratxe Zarragoikoetxea, Marta López Cantero, Daniel Pérez Ajami, Pedro José Martínez, Miguel Ródenas, José García Cantos, Clara Pascual, Silvia Polo, Alvaro del Mazo, Victoria Johanensen, Cristina López Forte, Maria Jesús Montero, Esther Perez Sancho, Ana Vidal y Azucena Pajares.
Hospital Universitario de Cruces, Baracaldo, Vizcaya: Iñaki Bilbao Villasante, Covadonga Peralta y Gonzalo Tamayo.
Hospital Universitario 12 de Octubre, Madrid: Adriana Calderón Barajas, Claudia Olea Vielba, Víctor Zarza Fernández de Alegría, Meta Levstek, Álvaro Ramiro Ruiz, Javier Silva García, Carolina Lugo Duarte, Eloísa López López, Matilde González Serrano, Ana Hermira Anchuelo, Raquel García Álvarez, David Benguría Puebla, Aída Fernández García, Isabel de la Calle Gil, Patricia Pascual Cambero, Miguel Saiz Sánchez-Buitrago y M. Isabel Real Navacerrada.
Hospital General Universitario Gregorio Marañón, Madrid: Silvia Ramos Cerro, Patricia Piñeiro Otero, Isabel Solchaga Sánchez, Mercedes Power Esteban, Alberto Calvo García y Sergio García Ramos.
Hospital Universitario de La Princesa, Madrid: Fernando Ramasco, Rosa Méndez, Sheila Santidrian, Jesús Nieves-Alonso, Carlos Puga, Luis Gómez-Arredondo, Juan de Ancos, Sonia Expósito, Esther García-Villabona, Carmen Vallejo, Mar Orts, Cárlos Figueroa, Julia Hernando, David Arribas, Jara Torrente, Alejandro Suarez de la Rica, Carlos Román, Amadea Mjertan, David Cordón, Andrés v.Wernitz, Iñigo Guerra y Ana Martínez-Molina.
Clínica Universidad de Navarra, Pamplona, Navarra: Marc Vives, Ariel Duilio González, Iñigo Rubio, Carmen Cara, Pablo Montero, Carmen Sala, Carmen Garau, Marta Luque, José Antonio Fernández, Leire Goñi, Elena Cacho, Raquel Callejas, Ricardo Calderón, Francisco Hidalgo, Gemma Echarri, Luis López, Pablo Monedero, Cristina Honorato, Antonio Martínez y Rafael Moncada.
Hospital Universitario Vall d’Hebron, Barcelona: Antonio Barbara Ferreras, Alfonso Gómez Felices y Miriam de Nadal.
Hospital General Universitario de Elche, Alicante: Ana Pérez Carbonell, José Javier García Romero, Maria Mercader y Jaime Miralles.
Hospital Clínico Universitario de Valencia: Sara Martínez Castro, Gerardo Aguilar Aguilar, Esther Romero Vargas, José Antonio Carbonell, Martina Savino, Eduardo Passariello, Pablo Lorenzo, Alba Montoya y Rafael Badenes.
Complejo Hospitalario Universitario de Orense: Ariadna Rodriguez Rodriguez, Raquel Ruido Dacal, Eva Villar Arcay, Leticia Gómez Viana, Milagros Cid Manzano y María Concepción Alonso Gonzalez.
Hospital Universitario Ntra. Sra. de Candelaria, Santa Cruz de Tenerife: David Domínguez García, Alberto Vera González, Daniel Piñero Prieto, Adrián Díaz Fernández, Lucía Pazos Otero, Raúl Hernández Bisshopp, Israel, Amador García, Carola Guillén Iranzo, Amelia González Beltrán, Luis Alejandro Soto Jáquez, Irina Paula Rodríguez González, Liuva Pereira Esmoriz, Marina Sánchez Navas-Parejo y Gabriela Noemí González Chiale.
Hospital Universitario de Móstoles, Madrid: Raquel Fernández-García, Diana Marcela Narváez Cubillos, Rocío Ayala Soto, Saúl Vélaz Domínguez y Pablo Oliver Fornies.
Hospital Universitario Central de Asturias, Oviedo, Asturias: Alberto de Juan Álvarez, Natalia Pérez de Arriba, Lorena Varela Rodríguez y María Cristina Iglesias Fernández.
Hospital General Universitario de Ciudad Real: Francisco Javier Redondo-Calvo, Remedios Moreno, Tatiana Cuesta, Ruben Villazala, Victor Baladron, Jorge Redondo, Omar Montenegro, Patria Faba, Juan Valencia, María Gracia Villanueva, Manuel Valbuena, Ana López-Olio, María Molina, Aránzazu Pérez, Fernando Garvayo y Alejandro Sánchez.
Complejo Hospitalario Universitario de Albacete: Delia Parreño Bueno, Luisa María Charco Roca y José María Jiménez Vizuete.
Hospital Clinic. Uci Quirúrgica, Barcelona: Jordi Mercadal Mercadal, Luigi Zattera, Ana Fervienza Sánchez, Enric Barbeta Viñas, Amalia Alcón Rodríguez, Guido Muñoz Rojas, Albert Carramiñana Domínguez, Juan Perdomo Linares, Ramsés Marrero García, María Elena del Rio Morales, Ricard Mellado Artigas y Andrea Palomeque Flores.
Hospital del Mar, Barcelona: Adela Benítez-Cano, Ramón Adalia, Jesús Carazo, Hugo Rivera-Ramos, Marta Antelo-Adran, Isabel Ramos, Lorena Rivera, Antonio Ferraroni y Leire Larrañaga.
Hospital Universitario de Cáceres: Fernando García- Montoto Pérez, Inés Maria Parejo Cabezas, José Ignacio Hermoso, Manuel Francisco Mirón Rodríguez, Guillerma Pardo Romero, José Ramón Serrano Santano, Maria Pilar Caldera Miguel, Leticia Charro Hidalgo, Pedro de Alonso Andrés, Francisco Pablo Bueno Villalba, Diana Araujo Rodríguez y Valentín Moreno Carbonell.
Hospital Can Misses, Ibiza: Manuela Santos Parralo, Walter Andres Ramirez Lajones, Elena Uson Garcia y Gaspar Tuero Leon.
Hospital General Universitario Doctor Balmis, Alicante: María Galiana Ivars, Mariia Spirina, Úrsula Toral Toral, Santiago Pardines Rico, Carlos Ferrero Coloma, Francisca Eugenia Fornés, Alba Moscardó Descalzo, Manuel Romero Torres y Jaime Rodríguez Tallero.
Hospital Universitario Ramón y Cajal, Madrid: Pilar Cobeta Orduña, David Pestaña, Nilda Martínez Castro, Alberto Balvis Balvis, Diego Gil Mayo y Tommaso Bardi.
Hospital Ribera POVISA, Vigo, Pontevedra: M. Sonsoles Leal Ruiloba, Alberto Pintos Chamadoira, Paola Escáneo Otero, Maria Artiaga Canda y Benigno Rodríguez Estévez.
Hospital General Universitario de Valencia: Carolina Ferrer Gomez, Alvaro Cervera Puchades, Javier Hernández Laforet, Jaume Puig, Tanya Gabaldón y Jose Tatay Vivo.
Hospital Universitario de Gran Canaria Dr. Negrín: Oto Miguel Padrón Ruiz, Sergio López Ruiz, Antonio Arencibia Almeida, Nazario Ojeda Betancor y Aurelio Rodríguez Pérez.
Complejo Asistencial Universitario de León: Eva María Higuera Miguélez, María Merino García, Rafael Gonzàlez De Castro, José Miguel Marcos Vidal, Sergio Marcos Contreras y Cristina García Pérez.
Hospital Universitario Río Hortega, Valladolid: Cesar Aldecoa, Jesús Rico Feijoo, Eugenio Ruiz, Almudena Rodriguez, Isabel García, Laura Vaquero, Alicia Bordell, Rocío Perez, Irene Garcia y Alba Diaz.
Hospital General Universitario de Castellón: Ignacio Catalán Monzón, Enver Rodríguez Martínez, Lluís Tormo Rodríguez, Mª Lidón Mateu Campos y Laura Galarza Barrachina.
Hospital Universitario Puerta de Hierro, Madrid: Cristina Ferreras, María Casado, Alejandra Del Campo y Reyes Iranzo.
Complejo Hospitalario Universitario de Pontevedra: Marina Varela Durán, Eva María González Babarro, Santiago Domínguez Fernández, Loreto Vidal Castro, Pilar Díaz Parada.
Hospital Clínic de Barcelona (Área de Vigilancia Intensiva): Adrián Téllez Santoyo, Pedro Castro Rebollo, José María Nicolás Arfelis, Sara Fernández Méndez, José-Ramón Alonso-Viladot, Carolina Sánchez-Marcos, Adrià Carpio-Blasco, Victor Gil-Espinosa y Daniel Nicolás Marco Prats.
Hospital Universitario Virgen de la Arrixaca, Murcia: Julio Padilla Rodríguez. Piedad Martínez Gil. Giovanni Alessandro Ercole y Carlos García Palenciano.
Hospital del Meixoeiro, Vigo, Pontevedra: Adriana Rial Veloso, Gustavo Illodo Miramontes y M. Elena Vilas Otero.
Los autores declaran no tener ningún conflicto de intereses.