La causa de la pandemia COVID-19 es la infección por coronavirus tipo 2 del síndrome respiratorio agudo grave (SARS-CoV-2). Las formas graves de la enfermedad se presentan predominantemente en adultos de edad avanzada o en individuos con comorbilidades médicas subyacentes como enfermedad cardiovascular, hipertensión, diabetes mellitus, enfermedad pulmonar crónica y enfermedad renal crónica. La razón de la letalidad de COVID-19 es una sepsis viral. Esta disfunción orgánica del huésped es causada por una respuesta inflamatoria desregulada y potencialmente mortal que inicialmente tiene complicaciones pulmonares graves1,2. Por lo tanto, hay una disfunción endotelial generalizada que conduce al síndrome de disfunción orgánica múltiple.
La evidencia emergente sugiere que algunos pacientes pueden responder a la COVID-19 con una «tormenta de citoquinas» desproporcionada, a la que se denomina linfohistiocitosis hemofagocítica secundaria (HLH)3,4. Sin embargo, no es un mero problema cuantitativo, y la respuesta inflamatoria desregulada es un mejor término cuya definición es funcional, no solamente un umbral concreto de citoquinas. Tiene que existir una disfunción orgánica asociada para considerarse una respuesta patológica5. Actualmente, aunque hay algunos datos prometedores, no hay pruebas suficientes para apoyar la recomendación de un tratamiento eficiente y específico para los pacientes con COVID-196. Mientras que numerosos tratamientos antivirales están bajo investigación, su uso exclusivo puede no ser suficiente para controlar la respuesta inflamatoria desregulada mencionada. Por lo tanto, es de creciente interés buscar alternativas que puedan desempeñar un papel inmunomodulador, eliminando o reduciendo la formación de citoquinas, disminuyendo así el daño inflamatorio del tejido, especialmente el daño pulmonar7 e intentando disminuir la mortalidad. Aquí, una técnica óptima de purificación de la sangre podría desempeñar un papel clave8.
El protocolo CONVEHY® (suplementos en línea 1, 2, 3) fue desarrollado por el Grupo de Investigación de Hiperfiltración para controlar la respuesta inflamatoria desregulada (RID) y la tormenta de citoquinas a través de la inmunomodulación en pacientes con choque séptico9. La RID puede ser desencadenada por varios eventos, incluyendo infecciones virales como COVID-19, y puede tener diferentes efectos sistémicos sobre el glicocálix endotelial aparte de las consecuencias renales: vasodilatación, extravasación de fluidos y micro-agregación plaquetaria. Se deben considerar estrategias de inmunomodulación que impliquen la eliminación de mediadores inflamatorios en pacientes que presenten una respuesta deficiente a los tratamientos10.
La membrana oXiris®5 (BaxterTM, Illinois, EE. UU.) es un sulfonato de acrilonitrilo con una superficie tratada con polietilenimina (PEI) y heparina anclada (AN69-ST-heparina anclada). Es un hemofiltro con la capacidad de eliminar las interleuquinas (IL) factor de necrosis tumoral alfa (TNF-α), factor inhibidor de la migración (MIF), el antagonista del receptor de interleuquina-1 (IL1-ra), la proteína de caja 1 del grupo de alta movilidad (HMGB-1), lipopolisacáridos (LPS), factores de crecimiento de fibroblastos (FGF21, FGF23), factores de complemento (C3a, C5a) y el inhibidor del activador de plasminógeno tipo 1 (PAI-1), además de endotoxinas. Su capacidad para eliminar moléculas está relacionada con su carga eléctrica, y por tanto de su punto isoeléctrico. Aunque la experiencia clínica es limitada en COVID-1911-13, oXiris® ha demostrado en un ensayo clínico unicéntrico aleatorizado y doble ciego su eficacia purificadora y una disminución en la necesidad de vasoactivos en la sepsis bacteriana14. El sistema Prismaflex™ (BaxterTM, Illinois, EE. UU.) se utiliza junto con oXiris®. CONVEHY® utiliza una dosis de citrato en una etapa específica del proceso, en este caso adaptada específicamente a la COVID-19. La capacidad de adsorción disminuye con el tiempo debido a la saturación de la membrana y los reemplazos de la misma se programan cada seis horas a discreción del médico. También la membrana se puede dejar como un hemofiltro si sólo se requiere apoyo renal en ese momento. Recientemente se publicaron los resultados preliminares del uso del protocolo CONVEHY®, donde se puede encontrar una comparación de los resultados antes y después de la inclusión del citrato9.
El dominio de unión al receptor pico (spike, S en inglés) del SARS-CoV-2 (DUR) se une al receptor ACE2 a través de una notable red de interacciones hidrófilas. Múltiples enlaces y dos puentes salinos se pueden encontrar en la interfaz de este complejo, con múltiples residuos de tirosina que forman los enlaces de hidrógeno con el grupo hidroxilo polar15,16. Debido a las características hidrófilas e hidrófobas mencionadas, es posible que el SARS-CoV-2 pueda adherirse a la membrana oXiris®17,18. Se estudió una eliminación similar por adsorción en otros virus ARN como la hepatitis C y el virus del Ébola, con plasmaféresis de afinidad por la lectina19.
La membrana oXiris® recibió la autorización de uso de emergencia (AUE) por la Food and Drug Administration (FDA) de los Estados Unidos para tratar a pacientes con COVID-19 confirmado. Está destinado a tratar a los pacientes adultos para reducir los niveles proinflamatorios de citoquinas, que tienen cualquiera de las siguientes condiciones:
- •
Lesión pulmonar aguda temprana/SDRA temprana.
- •
Enfermedad grave.
- •
Enfermedad potencialmente mortal, definida como:
- -
Insuficiencia respiratoria
- -
Choque séptico y/o
- -
Disfunción o fallo de múltiples órganos.
Al ser un virus ARN (ácido ribonucleico), afecta directamente a la función inmunomoduladora de las mitocondrias mediante la modificación de los receptores de señalización antiviral mitocondrial (MAVS), evitando así la síntesis de interferón de la respuesta inmunitaria innata. Otras interleuquinas también pueden ser moduladas de la misma manera20.
Si la respuesta inflamatoria se puede controlar a tiempo, el sistema inmunitario puede ser capaz de fabricar anticuerpos y superar la infección21. La misma estrategia es utilizada por nuestro grupo en el escenario de choque bacteriano, aunque en este caso facilitamos y damos tiempo a la acción de los antibióticos, considerando además si la causa raíz puede ser controlada o un tratamiento invasivo necesita ser aplicado. El uso de altas dosis de citrato puede ser beneficioso al compararlo con el uso de heparina con la membrana oXiris® debido a:
- 1.
Mayor eficiencia de la membrana –hay menor activación de leucocitos y plaquetas y por lo tanto menos saturación22 y una mayor durabilidad al máximo rendimiento.
- 2.
El PEI de fábrica no termina de saturarse con el purgado inicial de heparina sódica; hay más PEI disponible para la adsorción;
- 3.
El efecto negativo impredecible de la heparina en pacientes con choque séptico y daño isquemia-reperfusión, que podría causar inflamación y microtrombos en la microcirculación23 y tener efectos desastrosos en pacientes con COVID-19. De hecho, la afectación por microtrombos en la microcirculación ha sido descrita en las necropsias24;
- 4.
El citrato, como sustrato del ciclo respiratorio, puede actuar a nivel mitocondrial, mejorando las alteraciones metabólicas y manteniendo activos los complejos respiratorios, evitando así la apoptosis25;
- 5.
El citrato puede reanimar a las mitocondrias y su función respiratoria e inmunomoduladora20.
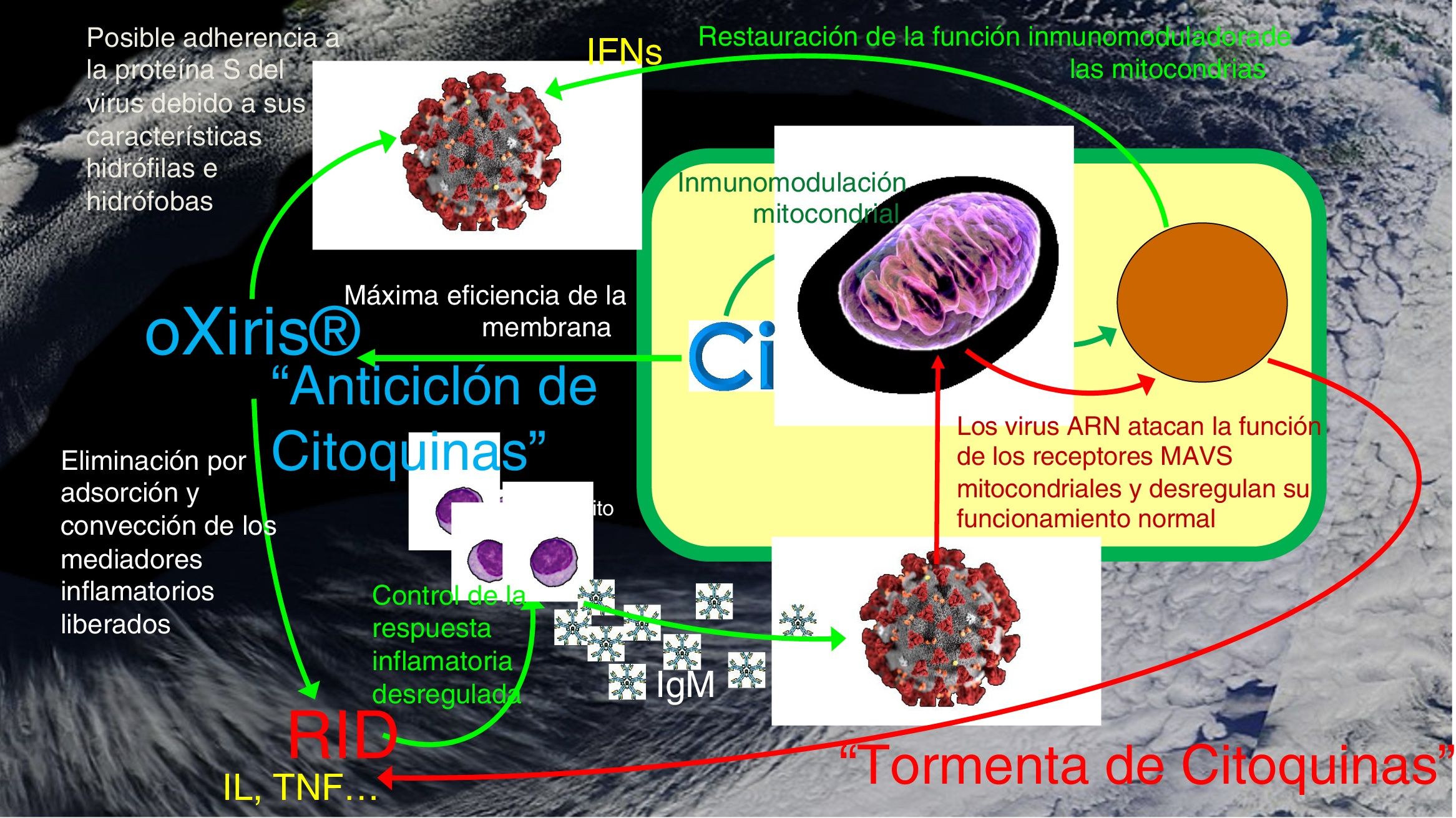
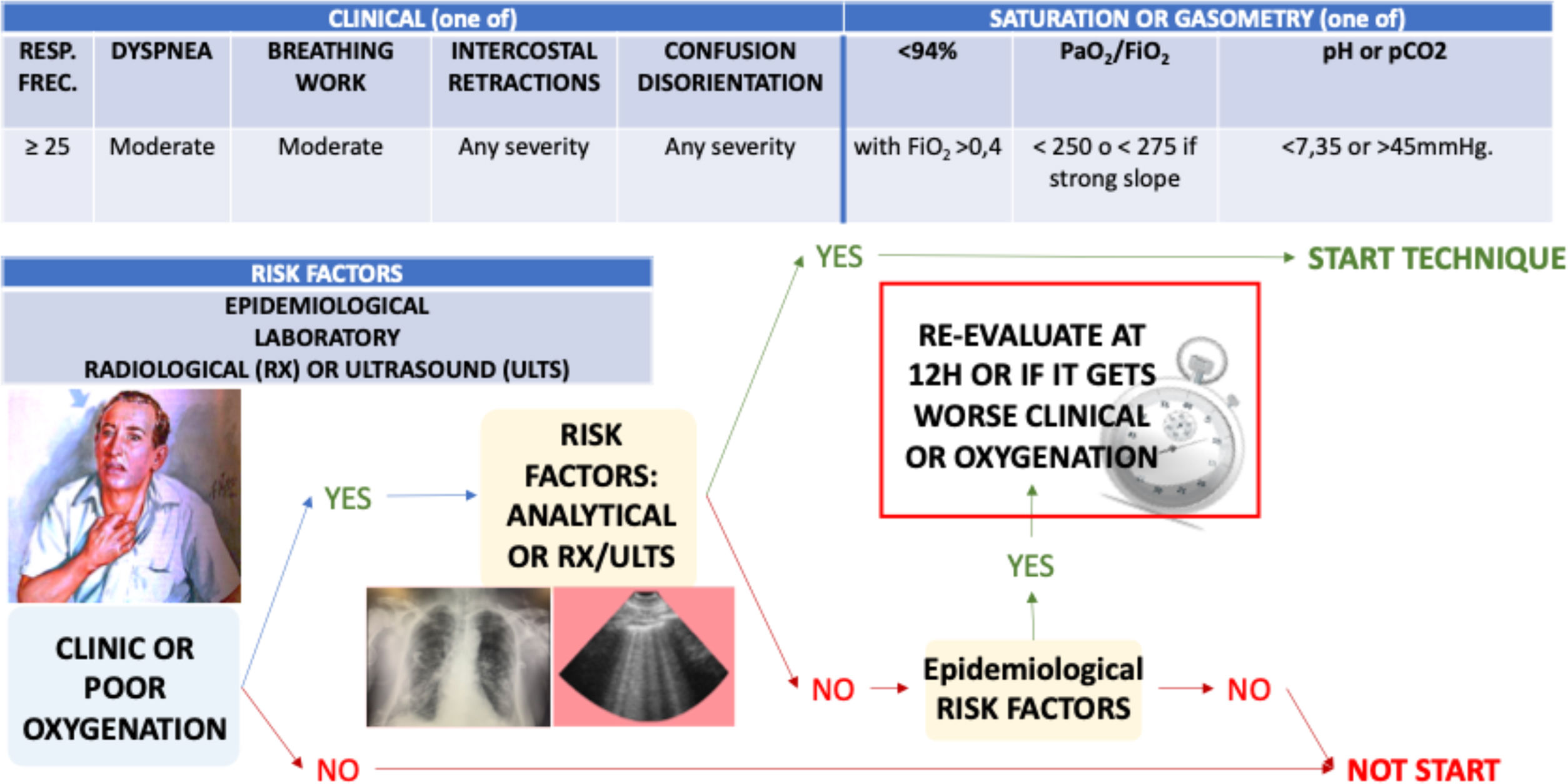
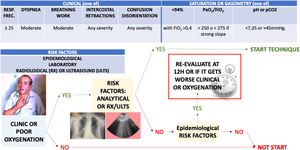
Entendemos que combinando una estrategia adsortiva de limpieza eficaz con oXiris®, con una convección controlada que ayuda a la eliminación de las moléculas inflamatorias, junto con el efecto del citrato en las mitocondrias, se puede lograr una recuperación más rápida y mejor del resultado del paciente. Esta opinión se opone a otros enfoques de soporte solo renal (fig. 1). En pacientes con COVID-19 el momento de inicio de la técnica puede ser decisivo y por ahora debemos basarnos en factores de riesgo epidemiológicos y clínicos para este fin (fig. 2 y tabla 1).
Estrategia combinada de inmunomodulación del protocolo CONVEHY®. oXiris® = única marca comercial de la membrana de Acrilonitrilo 69-Superficie Tratada Heparina Anclada. Ci = citrato. ARN = ácido ribonucleico. RID = Respuesta Inflamatoria Desregulada. IFNs = Interferón. IL = interleuquina. TNF = factor necrótico tisular. IgM = immunoglobulina M. Flecha roja curvada = reducción o deterioro. Flecha verde curvada = activación o mejora.
Indicación de Técnica de Inmunomodulación Temprana para COVID-19 (Early Immunomodulation Technique for COVID-19, EIT-C19): pacientes o con clínica manifiesta, o con mala oxigenación, que tienen o una radiografía o ecografía pulmonar y/o una analítica afectadas por COVID-19. Atención especial en el subgrupo con factores de riesgo epidemiológico. Ver árbol de decisión.
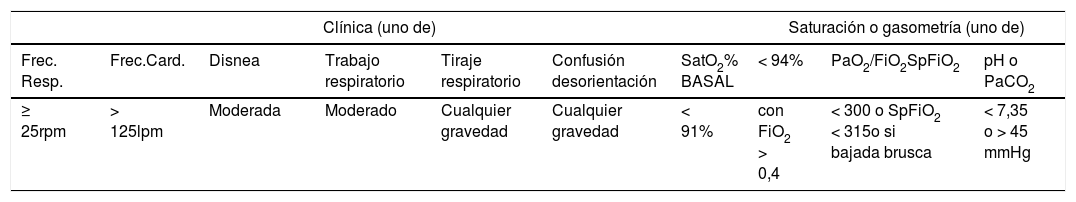
Factores de riesgo de enfermedad grave
| Clínica (uno de) | Saturación o gasometría (uno de) | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Frec. Resp. | Frec.Card. | Disnea | Trabajo respiratorio | Tiraje respiratorio | Confusión desorientación | SatO2% BASAL | < 94% | PaO2/FiO2SpFiO2 | pH o PaCO2 |
| ≥ 25rpm | > 125lpm | Moderada | Moderado | Cualquier gravedad | Cualquier gravedad | < 91% | con FiO2 > 0,4 | < 300 o SpFiO2 < 315o si bajada brusca | < 7,35 o > 45 mmHg |
| Epidemiológicos | Laboratorio | Radiológico o ecográfico |
|---|---|---|
| > 65 años | Dímeros D > 1.000 ng/mL | Infiltrados multilobulares. |
| Enfermedad pulmonar previa | CPK > 2 veces valor basal | Líneas B («Berticales») fijas difusas anchas fusionadas (se mueven con pleura) Signo de la cascada. Pulmón «Blanco».Pleura engrosada, irregular.Parches pulmón sano y enfermo.Consolidación subpleural. |
| ERC mod-sev | PCR >100 mg/L | |
| DM HbA1c > 7,6% mal controlada | LDH >500 U/L | |
| HTA no controlada | Troponina elevada | |
| Enfermedad cardiovascular | Ferritina > 1.000 ug/L | |
| Trasplantado u otra inmunodepresión | Linfopenia < 500/mm3 | |
| VIH con valores de CD4 < 500/mm3 |
Frec. Resp.= frecuencia respiratoria. rpm= respiraciones por minuto. Frec. Card.= frecuencia cardíaca. lpm= latidos por minuto. FiO2= fracción inspirada de O2. PaO2/FiO2= relación entre la presión parcial de oxígeno en la sangre arterial y la fracción de oxígeno inspirado. SpFiO2= relación entre la saturación periférica de oxígeno y la fracción de oxígeno inspirado. PaCO2= presión parcial de dióxido de carbono en la sangre arterial.
CPK= creatina-fosfocinasa. ERC mod-sev= enfermedad renal crónica moderada- severa. PCR= proteína C reactiva. DM HbA1c= hemoglobina glicosilada en pacientes con diabetes mellitus. LDH= lactato deshidrogenasa. HTA= hipertensión arterial. VHI= virus de la inmunodeficiencia humana. CD4= linfocitos CD4 o linfocitos T4.
CONVEHY® COVID-19 se ha concebido como un protocolo de uso temprano o una técnica de rescate. Su objetivo ser un anticiclón para la tormenta de citoquinas, y así restaurar una función inmune adecuada. Su eficacia podría guiar su uso en los centros de diálisis y las unidades de cuidados críticos, para tratar a tantos pacientes como sea posible.
FinanciaciónLos autores no han recibido ninguna financiación.
Conflicto de InteresesRafael García-Hernández ha realizado un trabajo de consultoría y conferencias en hospitales financiado por Baxter SL.
Coautores del GRUPO CONVEHY® RESEARCH:
- 1.
Rafael García-Hernández. Especialista en Anestesiología y Reanimación. Coordinador de la Unidad de Reanimación Postquirúrgica. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 2.
María Isabel Espigares-López. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 3.
Reyes Gámiz-Sánchez. Especialista en Anestesiología y Reanimación. Especialista en Medicina Interna. Coordinadora de la Unidad de Reanimación Postquirúrgica. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 4.
Francisco Miralles-Aguiar. Especialista en Anestesiología y Reanimación. Especialista en Medicina Intensiva. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 5.
Francisco Javier Arroyo Fernández. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 6.
Miguel Ángel Moguel-González. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 7.
Gonzalo García-Benito. Especialista en Anestesiología y Reanimación. Especialista en Medicina Interna. Servicio de Anestesiología y Reanimación. Hospital Universitario de Salamanca. España.
- 8.
María Victoria García-Palacios. Especialista en Medicina Preventiva. Servicio de Medicina Preventiva. Hospital Universitario Puerta del Mar. España.
- 9.
Manuel Samper. Especialista en análisis clínicos. Servicio de Análisis Clínico. Hospital Universitario Puerta del Mar. España.
- 10.
Beatriz Gómez Tapia. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 11.
Patricia Martín Falcón. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 12.
Pablo Jorge-Monjas. Especialista en Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid. España.
- 13.
Carlos Márquez Rodríguez. M.D., Ph.D. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 14.
Encarnación Meléndez Leal. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 15.
Anabel Carnota Martín. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 16.
Aurora Piña Gómez. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 17.
Iván Ramírez Ogalla. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 18.
Estefanía Cabezuelo Galache. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 19.
Carmen Fernández Mangas. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 20.
Carmen Fernández Riobó. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 21.
Manuel Muñoz Alcántara. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 22.
Manuel Mato Ponce. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 23.
Francisco J Pérez Bustamante. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 24.
Antonio Pérez Pérez. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 25.
José Ramón Ferri Ferri. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 26.
Ángela Gonzálvez Galinier. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 27.
Pedro De Antonio del Barrio. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 28.
María Borrego Costillo. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 29.
Elena Borreiros Rodríguez. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 30.
Irene Delgado Olmos. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 31.
Ana Martínez-Almendro Fernández. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 32.
Paula Lozano Hierro. Médico Interno Residente de Anestesiología. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 33.
Isidoro Jiménez Pérez. Enfermero especialista en hemofiltración. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 34.
Carlos García Camacho. Enfermero perfusionista. Servicio de Cirugía Cardiovascular. Hospital Universitario Puerta del Mar. España.
- 35.
Antonio Pernia Romero. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 36.
María Jesús Sánchez del Pino. Departamento de Biomedicina, Biotecnología y Salud Pública. Bioquímica. Universidad de Cádiz. España.
- 37.
Manuel Antonio Rodríguez Iglesias. Departamento de Biomedicina, Biotecnología y Salud Pública. Bioquímica. Universidad de Cádiz.
- 38.
Eduardo Tamayo Gómez. Especialista en Anestesiología y Reanimación. Hospital Clínico Universitario de Valladolid. España.
- 39.
Gerardo Aguilar. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología. Consorcio Hospital General Universitario de Valencia. España.
- 40.
Manuel E. Herrera Gutiérrez. Especialista en Medicina Intensiva. Unidad de Cuidados Intensivos. Hospital Regional Universitario Carlos Haya. España.
- 41.
Luis Miguel Torres Morera. Especialista en Anestesiología y Reanimación. Jefe de servicio. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
- 42.
Enrique Calderón Seoane. M.D., Ph.D. Especialista en Anestesiología y Reanimación. Servicio de Anestesiología y Reanimación. Hospital Universitario Puerta del Mar. España.
Todos los autores han hecho contribuciones sustanciales en cada uno de los siguientes aspectos: la concepción y el diseño del estudio, o la adquisición de datos, o el análisis y la interpretación de los datos, el borrador del artículo o la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.