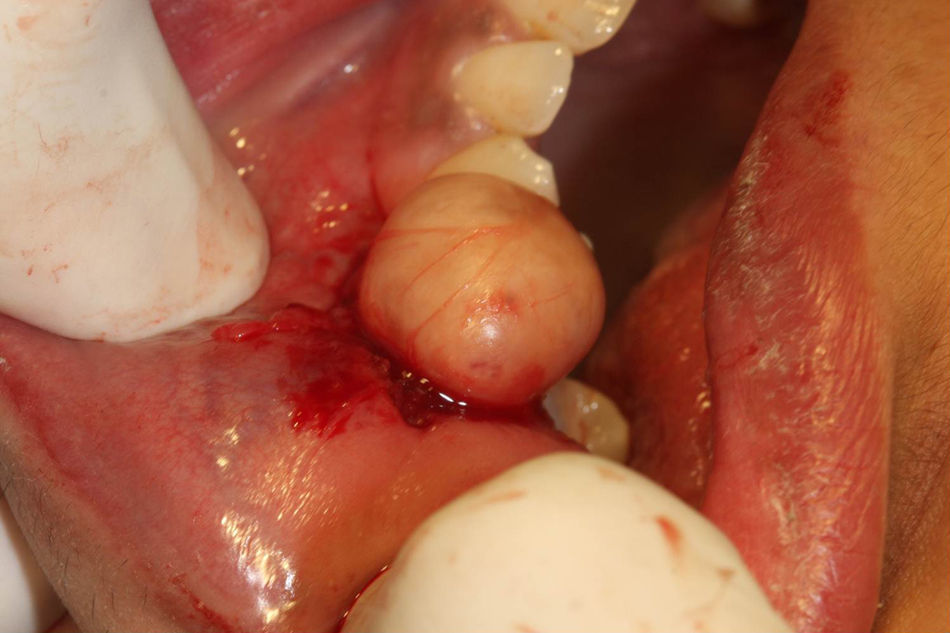
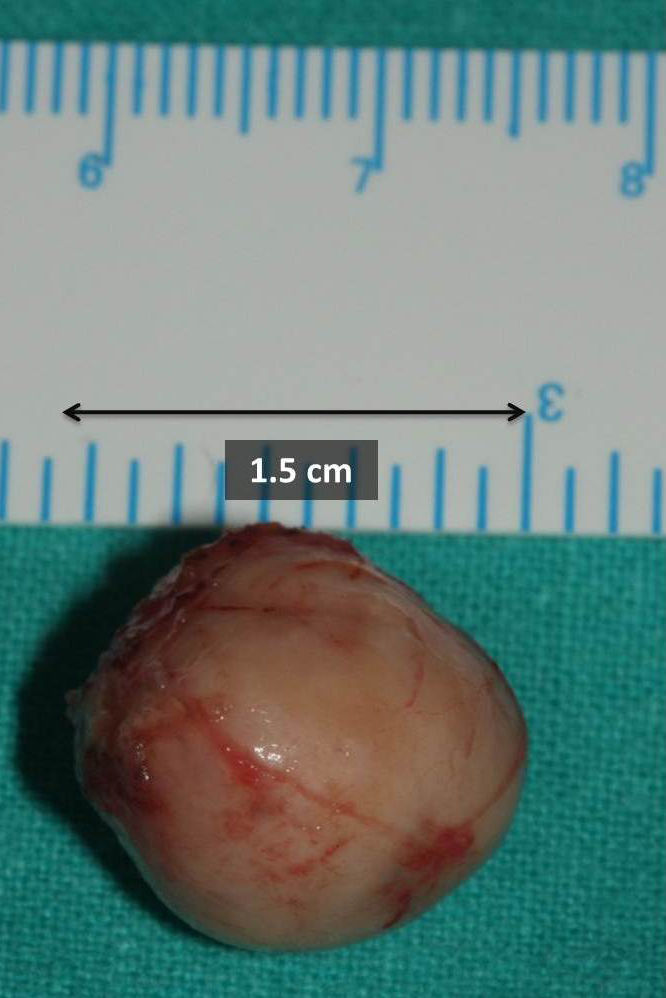
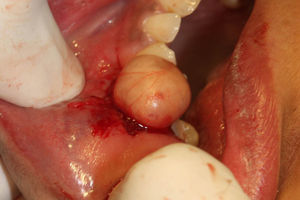
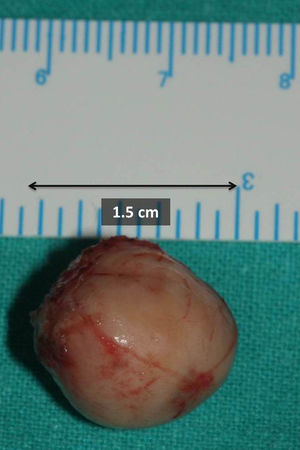
Ante la sospecha de benignidad en el estudio citológico, informado como tumor de bajo grado de hábito mioepitelial compatible con mioepitelioma, se realizó tumorectomía simple mediante abordaje intraoral e incisión en mucosa yugal derecha respetando la salida del conducto de Stenon. Macroscópicamente, en la sala operatoria, se observa una lesión de aspecto anacarado, redondeada, bien delimitada, encapsulada y con un diámetro mayor aproximado de 1,5cm (fig. 1). El exámen anatomopatológico definitivo de la pieza quirúrgica informó de una tumoración bien encapsulada y circunscrita, compuesta por estructuras tubulares recubiertas de células epiteliales que se tiñen de citoqueratina revestidas por numerosas células de estirpe mioepitelial. Hallazgos compatibles, tras estudio inmunohistoquímico revelando la doble población celular (fig. 2.), con el diagnóstico de carcinoma epitelial-mioepitelial de glándula salivar menor. Al ser catalogada como una neoplasia de bajo grado de malignidad, bien diferenciada (grado histológico G1) y circunscrita (fig. 3), con bordes quirúrgicos libres, clasificación histológica pT1NxMx y con ausencia de invasión venosa, linfática y perineural, se decidió seguimiento estrecho sin empleo de terapias adyuvantes. La paciente permanece asintomática 6 meses después de la intervención sin signos de recidiva ni extensión locorregional ni a distancia.
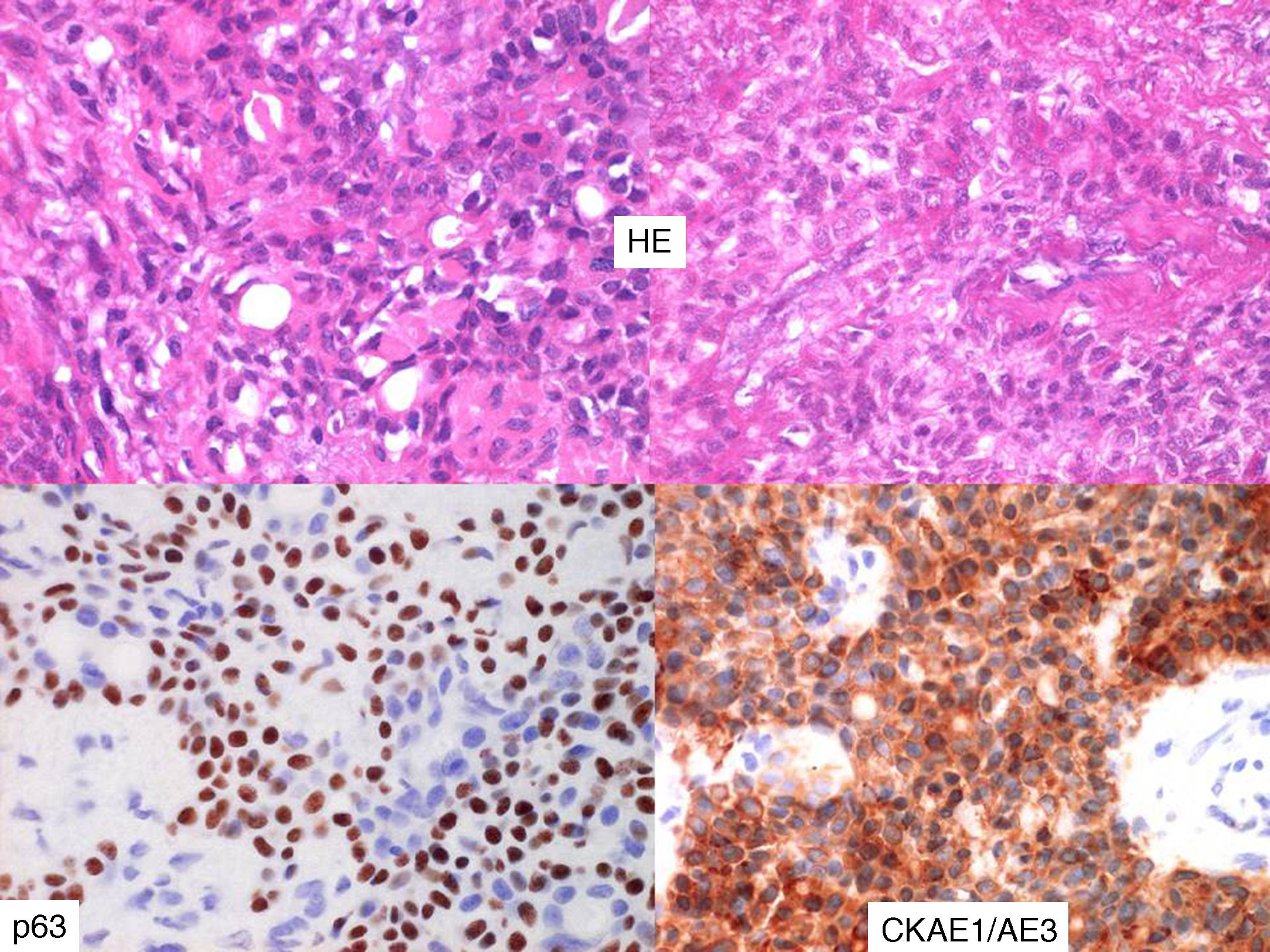
Microfotografía mostrando estructuras ductus-like con doble patrón celular. Obsérvese que ambos componentes, interno epitelial y más externo mioepitelial, son revelados claramente mediante el empleo de marcadores inmunohistoquímicos, CKAE1/A3 y p63, respectivamente.(Tinción hematoxilina-eosina, CK AE1/A3 y p63, magnificación x400).
El carcinoma epitelial-mioepitelial es una rara neoplasia de las glándulas salivales con un bajo grado de malignidad. Su incidencia, en comparación con el resto de tumores que afectan a la región glandular, es baja, siendo informado en la literatura valores inferiores al 1%5,7. Conocido desde 1956 con otras denominaciones (adeno-miopitelioma, adenoma de células claras, adenoma tubular solido, etc.)4, fue descrito por primera vez por Donath et al en 19721 siendo catalogado posteriormente en 1991 como una nueva entidad por la Organización Mundial de la Salud (OMS)2. Su aparición generalmente ocurre en la glándula parótida (hasta en un 80%)5,8, describiéndose también en otras localizaciones: glándulas submandibular (10%), glándulas salivares menores (10-15%) y glándulas seromucosas del tracto digestivo superior e inferior4.
La localización más relevante como glándula salival menor parece ser el paladar6, aunque también se han informado casos afectando al seno maxilar, glándula lagrimal, cavidad nasal, tráquea y lengua6,9,10. Suele presentarse en edad adulta con un pico de incidencia en la 6.ª década de la vida, habiéndose publicado casos en edad infantil5. Existe una ligera predilección por el sexo femenino8 con un ratio aproximado de 2:14.
Su aspecto morfológico sigue planteando dudas en cuanto a su etiología11. Donath et al postuló que podría deberse a que las células de origen procedían de los ductos intercalados1, y según numerosos autores, motivo de la integración de ambos componentes, epitelial y mioepitelial, en este tipo de lesiones11.
En cuanto a su diagnóstico, las pruebas de imagen, tanto la tomografía computarizada (TC) como la resonancia magnética nuclear (RMN), son inespecíficas y no ayudan a diferenciar al CEM de otras patologías neoplásicas de las glándulas salivales11. De igual modo, la dificultad del diagnóstico citológico mediante PAAF, técnica empleada en el estudio inicial de cualquier patología tumoral benigna o maligna de las glándulas salivales, también ha sido informada. El limitado número de casos informados, la escasa familiaridad con las características citopatológicas de esta entidad8 unido a la variabilidad del componente celular aspirado mediante PAAF, complican la obtención de un diagnóstico preciso. La biopsia incisional está inicialmente contraindicada de forma rutinaria en las glándulas salivales por la posibilidad de producir siembra tumoral, siendo el diagnóstico definitivo obtenido mediante estudio final de la pieza quirúrgica. Su apariencia histológica es característica, pudiendo en ocasiones existir variaciones morfológicas que hagan que se produzcan solapamientos con otros tipos de tumores salivales4. Al microscopio electrónico puede encontrarse su particular composición formada por un doble recubrimiento celular consistente en una capa interna de células ductales epiteliales y una capa externa de células mioepiteliales, orientando de este modo el diagnóstico6. El estudio inmunohistoquímico demostrando su peculiar fenotipo de patrón bifásico permite realizar el diagnóstico definitivo de CEM4,6,9. Dentro de la variedad de marcadores que se pueden emplear, algunos estudios señalan a las citoqueratinas AE1/AE3 y CAM 5.2 como las más selectivas para realzar el componente interno epitelial y el P63, vimentina y actina de músculo liso (AML) para el componente externo mioepitelial. La proteína S100 permitía señalar la invasión perineural4. El índice de proliferación celular Ki-67, considerado por algunos autores de utilidad en estimar la posibilidad de recurrencias, es desechado por otros al no obtener resultados acordes a lo esperado. Seguramente el escaso período de seguimiento y el limitado número de casos impida llegar a alguna conclusión significativa. Seethal et al señala que no presentó ninguna recurrencia en su serie en ninguno de los pacientes con un índice de proliferación Ki-67 menor de 10%4. El diagnóstico diferencial del CEM incluye tumores dominados por células claras como mioepiteliomas, carcinomas de células acinares, carcinomas mucoepidermoides y tumores metastásicos de células claras e incluso carcinoma adenoide quístico debido a su doble recubrimiento con estructura ductus-like6, al igual que adenoma polimórfico y adenocarcinomas polimorfos de bajo grado8. La lesión puede aparecer encapsulada o con mínima invasión, sin presentar en estos casos recurrencias en algunas series, pudiendo considerarse, por tanto, este patrón de crecimiento como de un comportamiento menos agresivo4.
Aunque suele presentarse como una patología de bajo grado de malignidad4,5 han sido descritos casos de desdiferenciación o alto grado de malignidad de forma infrecuente4. De igual modo, su tasa de recurrencia se ha informado elevada en la literatura4,6 variando de un 23 a un 80%4, siendo los primeros 5 años donde se produce la mayor parte de las recurrencias6. La incidencia de metástasis permanece variable según los estudios, señalándose porcentajes tan variables para metástasis cervicales como de un 5% en algunas series4 y de hasta un 25% en otras. Seethala et al informa en sus resultados una baja incidencia de metástasis a distancia en torno a un 2%4 aunque en otros artículos se habla de hasta un 9,8%6 afectando a riñón, pulmones o incluso cerebro. De igual modo, el porcentaje de pacientes que fallecen por la enfermedad ofrece resultados dispares, de un 40%, en algunos estudios, a tan solo un 5% en otros4. Estas diferencias podrían explicarse debido a mayores tasas de recurrencias, metástasis y muertes en pacientes con CEM con características histológicas más agresivas y por la falta de tratamiento coadyuvante (QT y RT) cumplimentado en estudios con menores tasas de afectación postoperatoria4.
Los factores más importantes considerados en la literatura como relevantes en predecir la posibilidad de recurrencia son el estado de los márgenes, la invasión vascular y linfática, la necrosis tumoral y la anaplasia mioepitelial4, sin embargo, ni la desdiferenciación, el alto índice de proliferación Ki-67, la actividad mitótica, el tamaño tumoral ni la invasión peineural, son considerados factores que impacten en la supervivencia4, aunque no todos ellos son compartidos por otros autores7.
No existe consenso respecto al tratamiento óptimo para el CEM6,8. De forma rutinaria se ha considerado de elección el tratamiento quirúrgico con márgenes. Esta opción de tratamiento suele plantearse frecuentemente a posteriori, tras el diagnóstico anatomo-patológico definitivo de tumor maligno de las glándulas salivales, una vez realizada la enucleación simple o tumorectomía de una lesión sospechosa de benignidad. Tal circunstancia se ve favorecida por el hecho de que, inicialmente, la biopsia incisional prequirúrgica diagnóstica en tumores de glándulas salivares mayores como menores no está indicada. Afortunadamente, en la mayoría de los casos se trata de lesiones de bajo grado de malignidad. Otras opciones terapéuticas como la radioterapia (RT), empleada como coadyuvante en casos de márgenes dudosos3 o para prevenir recurrencias, o la quimioterapia (QT), han sido relegados a un segundo plano. Sin embargo, en los últimos años se han descrito casos de pacientes tratados exclusivamente con RT9 o combinación de QT más radioterapia con obtención de buenos resultados sin recidiva10. El CEM aunque es un tumor de bajo grado de malignidad puede presentar características histológicas agresivas, con capacidad para recurrir frecuentemente, metastatizar en ocasiones a distancia y causar la muerte4. Dada la posibilidad de recurrencia tardía (incluso mayor de 20 años), el seguimiento a largo plazo es obligatorio3
ConclusiónEl carcinoma epitelial – mioepitelial, aunque representa una patología de aparición infrecuente de las glándulas salivales, debe tenerse en cuenta en el diagnóstico diferencial de cualquier tumoración a nivel glandular con patrón bifásico Sus características en cuanto a recurrencia y capacidad metastásica obligan a la realización de un tratamiento agresivo, con exéresis completa y vigilancia estrecha, incluso, de por vida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.