El sangrado perioperatorio en ocasiones conduce a transfusiones sanguíneas no exentas de complicaciones y riesgos, con un alto gasto sanitario. Entre otros métodos de prevención, el tratamiento con ácido tranexámico (TXA) ha mostrado ser efectivo en la disminución de las pérdidas sanguíneas quirúrgicas y especialmente en el postoperatorio inmediato. Al respecto, los estudios que lo han evaluado en cirugía ortopédica muestran su eficacia y seguridad, administrado por vía tanto intravenosa como intraarticular. Las dosis habituales por vía intravenosa evaluadas oscilan entre 10 y 20mg/kg, o en dosis fijas de 1 a 2g, mientras por vía intraarticular varía entre 250mg y 3g. El TXA como antifibrinolítico tiene un potencial efecto trombótico y está contraindicado en aquellos pacientes con riesgo o antecedentes de trombosis. Su administración por vía tópica podría ser más segura aunque se precisan estudios que lo confirmen.
Perioperative bleeding may require blood transfusions, which are sometimes not without complications and risks, with the subsequent increase in health care costs. Among other prevention methods, treatment with tranexamic acid (ATX) has shown to be effective in reducing surgical blood loss, especially in the immediate postoperative period. In this regard, studies evaluating ATX in orthopedic surgery show that it is effective and safe when administered intravenously or intra-articularly. The usual evaluated intravenous doses range between 10mg/Kg and 20mg/kg or a fixed dose of 1g to 2g; while intra-articularly, it varies between 250mg and 3g. ATX, as an anti-fibrinolytic has a potential thrombotic effect, thus it is contraindicated in those patients at risk or with a history of thrombosis. Its topical administration may be safer, but studies are needed to confirm this.
El envejecimiento progresivo de la población en las sociedades occidentales ha comportado un aumento de la patología degenerativa articular. Como consecuencia de ello, el número de cirugías protésicas de sustitución ha aumentado considerablemente, sobre todo en pacientes de edad avanzada1. Asimismo, en la última década se ha producido un incremento significativo de cirugías protésicas en pacientes jóvenes, debido a la adquisición de una mayor experiencia quirúrgica del cirujano y del personal sanitario implicado, así como a la mejora en las técnicas utilizadas y a una mayor supervivencia del implante protésico2. Sin embargo, la cirugía protésica es un procedimiento que no está exento de complicaciones3. Entre las complicaciones inmediatas más habituales de la cirugía protésica destaca el sangrado perioperatorio, el cual comporta a menudo la necesidad de transfusión sanguínea.
En la artroplastia total de cadera las pérdidas sanguíneas intraoperatorias pueden llegar a ser de entre 1.000 y 2.000mL. En cambio, en la artroplastia total de rodilla el sangrado intraoperatorio es escaso por el uso del manguito de isquemia. No obstante, la liberación de la isquemia al final del procedimiento quirúrgico en la cirugía de rodilla da lugar a un aumento de la actividad fibrinolítica4, que provoca en el postoperatorio inmediato el efecto contrario o de rebote con un aumento importante del sangrado. Así pues, al igual que en la prótesis total de cadera, la implantación de una prótesis total de rodilla puede provocar una pérdida postoperatoria de hasta 2.000mL de sangre5, lo que obliga en muchas ocasiones a realizar transfusiones en un porcentaje muy alto de los pacientes6. Aunque la tendencia actual por parte de los especialistas sanitarios sea la de restringir el número de transfusiones7, en muchas ocasiones estas son inevitables, especialmente en los casos en los que se interviene con unas cifras de hemoglobina preoperatoria inadecuadas. En un estudio retrospectivo8, en pacientes intervenidos de prótesis total de rodilla y cadera, el 69% de los pacientes transfundidos presentaron una concentración plasmática de hemoglobina preoperatoria inferior a 13g/dL, mientras que solo fueron transfundidos el 13% cuando la concentración plasmática de hemoglobina preoperatoria fue superior a 15g/dL.
Actualmente se prefiere individualizar la atención al paciente y minimizar la indicación de la transfusión sanguínea alogénica en ortopedia, lo que se denomina «patient blood management»9. Así, se considera el uso de diferentes opciones terapéuticas para obtener los mejores resultados clínicos y una menor dependencia de los productos sanguíneos alogénicos, con la finalidad de reducir los riesgos que conllevan10, ya que ello se asocia con un aumento de la incidencia de infecciones nosocomiales de la herida quirúrgica y o de neumonía, produciendo un aumento de la estancia hospitalaria y de los costes por paciente11.
La importante variabilidad en las tasas transfusionales entre diferentes centros lleva a afirmar que todavía hay margen para optimizar el empleo de los hemoderivados12.
Una de las posibles opciones farmacológicas preventivas del sangrado quirúrgico es el uso perioperatorio del ácido tranexámico (ATX). El objetivo de este trabajo es realizar una revisión global del uso del ATX como profiláctico del sangrado en cirugía ortopédica.
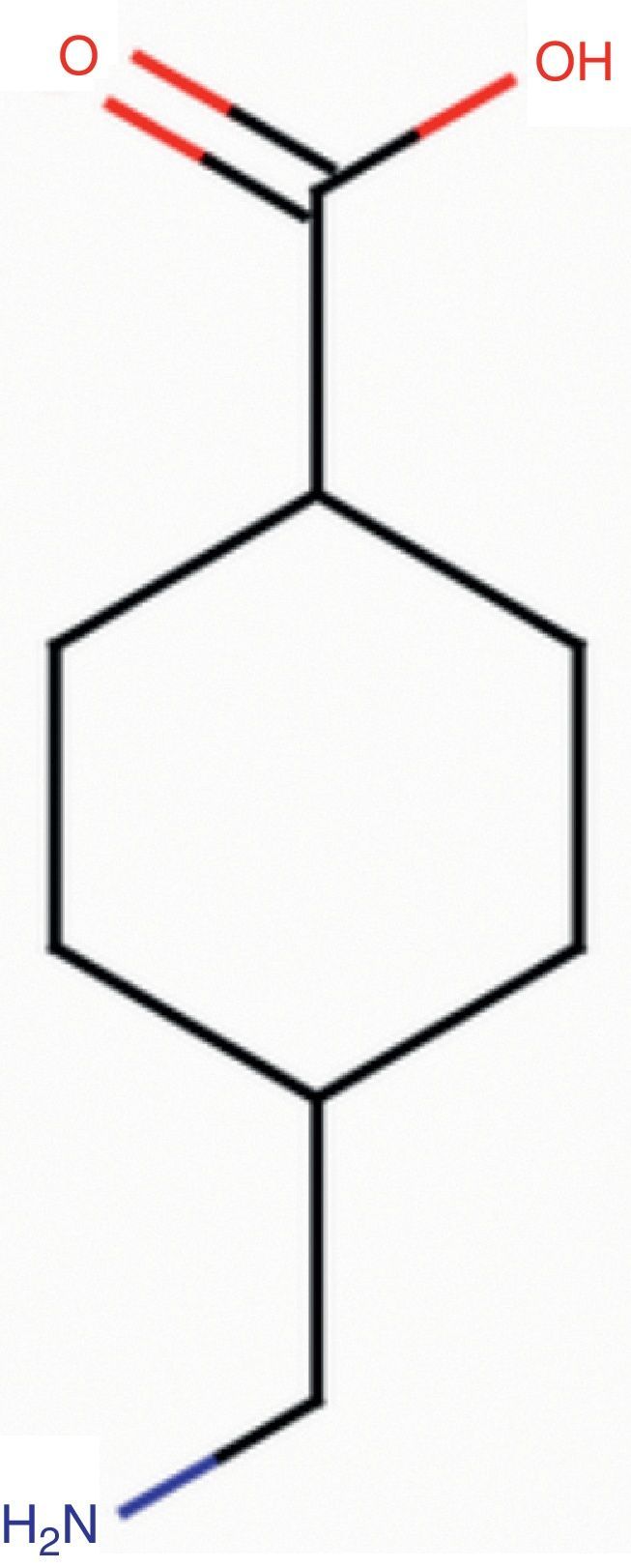
Ácido tranexámico: estructuraEl ATX es un derivado sintético de la lisina con actividad antifibrinolítica pura (fig. 1).
Ácido tranexámico: mecanismo de acciónEl ATX frena el sistema fisiológico de la fibrinólisis, evitando la degradación de la fibrina. El ATX actúa uniéndose al enlace de la lisina del plasminógeno, esencial para la unión con la fibrina13. Con ello el ATX impide que la fibrina se una al complejo formado por el activador tisular del plasminógeno-plasmina y se degrade la fibrina14. Otro posible efecto es de protección de las plaquetas, basado en su efecto antiplasmina y en la inhibición del factor de activación plaquetario15.
En la cirugía protésica de rodilla el uso de ATX puede ser de utilidad, ya que la fibrinólisis es estimulada por el trauma quirúrgico y además se potencia por el uso del torniquete durante la intervención4.
Indicaciones y dosificación autorizadasEl ATX está comercializado en España con el nombre de Amchafibrin® (Rottapharm, Italia). Las indicaciones de uso autorizadas son el tratamiento y la profilaxis de las hemorragias asociadas a una fibrinólisis excesiva como intervenciones quirúrgicas de próstata o del tracto urinario, cirugía ginecológica o trastornos de origen ginecológico u obstétrico. El ATX también está indicado en la cirugía dental, de nariz o de garganta, cirugía torácica, cardiovascular y abdominal, en la hemorragia gastrointestinal y en las inducidas por un fármaco fibrinolítico. No se incluye entre las indicaciones autorizadas el uso de ATX en la cirugía ortopédica y traumatología16.
Las dosis autorizadas vía intravenosa son de 0,5-1g (1-2 ampollas), entre 2 y 4 veces al día16.
Datos farmacocinéticosEn los estudios publicados, la vía de administración más usada del ATX en cirugía ortopédica y traumatología es la intravenosa. Otras especialidades quirúrgicas como obstetricia-ginecología, cirugía cardíaca, otorrinolaringología, maxilofacial y estomatología, han evaluado también el ATX por vía oral e incluso por vía tópica, consiguiendo una reducción de las pérdidas hemáticas cercanas al 50%17–21.
Los parámetros farmacocinéticos del ATX son conocidos cuando se administra por vía intravenosa, aunque no ocurre así cuando se administra por vía tópica a nivel intraarticular y/o en tejidos blandos periarticulares. No obstante, se está desarrollando un ensayo clínico en cirugía protésica de rodilla con el objetivo secundario de establecer la farmacocinética del ATX tópico22.
La vida media del ATX por vía intravenosa es de 2h23. Después de una dosis de 15mg/kg, su concentración plasmática permanece por encima de la concentración plasmática eficaz necesaria para inhibir la fibrinólisis (13μg/mL) de 4 a 6h24,25. Por otro lado, el ATX penetra fácilmente en las grandes articulaciones, alcanzando en el líquido articular una concentración comparable a la plasmática a los 15min de su administración intravenosa26. Su eliminación se produce por vía renal.
Interacción con otros medicamentosEl ATX puede interferir con otros medicamentos que influyen en la hemostasia, potenciando sus efectos o disminuyéndolos. Especialmente se ha de evitar asociar su administración con estrógenos y anticoagulantes16.
Ácido tranexámico en la cirugía ortopédica y traumatología: eficacia y posologíaEn el ámbito de la traumatología, se han realizado numerosos ensayos clínicos que prueban que el ATX, a las dosis evaluadas, es eficaz y seguro. Un ensayo clínico aleatorizado en el que participaron 274 hospitales en 40 países, y que incluyó a 20.000 pacientes que sufrieron un traumatismo con una pérdida sanguínea importante, mostró que 1g de ATX administrado en 10min seguido de una perfusión de ATX de 120mg/h durante 8h reducía de manera significativa la mortalidad por todas las causas y las muertes debidas al sangrado en comparación con placebo27.
Los resultados de los trabajos publicados tanto en cirugía de prótesis de cadera28–33 como en reemplazamientos primarios34,35 como en revisiones de prótesis totales de rodilla36, y de escoliosis de columna37,38 junto con algunos metaanálisis30,39–42 sugieren que la aplicación del ATX disminuye significativamente las pérdidas hemáticas y el número de pacientes transfundidos.
La eficacia de la administración vía tópica o intraarticular del ATX también se ha evaluado en cirugía ortopédica, a dosis que han oscilado entre 250mg y 3g43–46. Los estudios muestran que igualmente el ATX tópico disminuye las pérdidas sanguíneas intraoperatorias, con un efecto dosis dependiente.
Se ha publicado recientemente una actualización de la guía de consenso sobre alternativas a la transfusión de sangre alogénica, denominada «Documento Sevilla»47. Este documento sugiere el empleo de ATX en cirugía ortopédica, con una recomendación débil apoyada por evidencias de calidad alta (2A). La guía de la Sociedad de Anestesiología Europea mantiene esta misma recomendación del uso del ATX en la cirugía ortopédica y establece la pauta de dosificación del ATX intravenoso de 20 a 25mg/kg de peso corporal11.
Sin embargo, los ensayos clínicos que han evaluado el ATX son heterogéneos en cuanto a la pauta de dosificación. Las dosis evaluadas en los estudios publicados en cirugía protésica tanto de rodilla como de cadera según los autores oscilan entre 10 y 25mg/kg en una, 2 o 3 dosis intravenosas. Algunos autores, con el fin de evitar errores de cálculo y una posible iatrogenia de la administración del ATX según el peso corporal del paciente, aconsejan dosis intravenosas fijas de 1 a 2g de ATX.
Seguridad del ácido tranexámicoEl ATX está contraindicado en pacientes con antecedentes de trombosis arterial o venosa, condiciones fibrinolíticas que siguen a una coagulopatía de consumo, insuficiencia renal grave, historia de convulsiones y/o en casos de hipersensibilidad al mismo. El ATX no se debe administrar por vía intraventricular, intratecal o intracerebral. Además, la administración intravenosa debe realizarse lentamente, y su dosificación debe ajustarse según los niveles en sangre de creatinina en los pacientes con insuficiencia renal leve o moderada. Por último, siempre deben ser investigados los factores de riesgo de enfermedad tromboembólica en el paciente para valorar el uso del ATX16.
Debido al potencial efecto protrombótico del ATX por vía intravenosa, en los estudios de investigación publicados hasta el presente, en general, se excluyen los pacientes con antecedentes de episodios tromboembólicos o con un riesgo de tales eventos. No obstante, en el ensayo clínico CRASH27,48, que incluyó a pacientes con traumatismo grave y riesgo de sangrado amenazante para la vida, no se excluyó a los pacientes con riesgo de trombosis. Los resultados de las variables de seguridad de este estudio mostraron que el ATX reducía significativamente los eventos trombóticos fatales y no fatales (razón de riesgos: 0,69; intervalo de confianza al 95%: 0,53 y 0,89; p=0,005) y la incidencia de trombosis arterial (razón de riesgos:0,58; intervalo de confianza al 95%: 040 y 0,83; p=0,003). El número de eventos trombóticos venosos fue similar al grupo tratado con placebo (razón de riesgos:0,83; intervalo de confianza al 95%: 0,59 y 1,17; p=0,295).
Dos metaanálisis recientes, uno centrado en la eficacia y seguridad de pacientes sometidos a cirugía ortopédica y otro que evalúa la seguridad en pacientes sometidos a cirugía cardíaca, muestran que el uso del ATX no aumenta las complicaciones trombóticas49,50.
Por otro lado, es necesario un tratamiento alternativo en los pacientes que presentan contraindicación para recibir ATX por vía intravenosa. La aplicación intraarticular del ATX es segura y eficaz según algunos estudios43. No obstante, no hay estudios farmacocinéticos que muestren las concentraciones plasmáticas en sangre cuando se administra por esta vía. En el supuesto de que los niveles en sangre fuesen mínimos, probablemente el riesgo de trombosis también lo sería y se podrían ampliar sus indicaciones. Por tanto, queda un campo abierto para futuros estudios.
CostesEl coste de la administración de 2g de ATX es significativamente inferior al coste de la administración de una sola unidad de sangre, ya que representa unos 2€ frente a unos 300€ de la transfusión sanguínea.
Estudios publicados recientemente muestran que el ATX es coste-efectivo, especialmente porque disminuye el número de transfusiones sanguíneas y el gasto en farmacia51–53.
ConclusionesLos estudios realizados con ATX en cirugía ortopédica muestran que es eficaz y seguro si se utiliza adecuadamente. Extender su indicación a cirugía ortopédica es una medida útil de ahorro transfusional y de costes.
Nivel de evidenciaNivel de evidencia v.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interésEl Dr. Aguilera, el Dr. Jordán y la Dra. Martínez, participan o han participado como investigadores principales en varios ensayos clínicos que evalúan la eficacia y seguridad del ácido tranexámico en la prevención del sangrado perioperatorio de la cirugía ortopédica. Dichos estudios han recibido financiación de convocatorias competitivas del Ministerio de Sanidad y Consumo.