Una complicación frecuente tras una artroplastia total de cadera es el sangrado, y para reducirlo se utiliza el ácido tranexámico (TXA) intravenoso. Recientemente se han publicado los beneficios de su aplicación tópica. Consideramos necesario realizar un estudio que justifique qué vía de administración resulta superior.
Material y métodoEstudio prospectivo, controlado, aleatorizado en 2 brazos realizado entre febrero de 2017 a febrero de 2018. En el grupo A se administró 15mg/kg TXA intravenoso y en el B 2g TXA intraarticular. Se evaluó los valores de hemoglobina y hematocrito a las 24-72horas, volumen de sangre drenado, volumen de sangre perdida, transfusiones y complicaciones.
ResultadosFueron incluidos 78 pacientes, 31 con tratamiento intravenoso y 47 intraarticular. La hemoglobina descendió 3,15±1,64g/dl en 24horas y 3,75±1,56g/dl en 72horas en el grupo intravenoso, el hematocrito descendió un 10,4%±4,17% en 24horas y 11,85%±4,15% en 72horas. En el intraarticular se observó una caída de hemoglobina de 3,03±1,30g/dl en 24horas y de 3,22±1,2g/dl en 72horas y el hematocrito descendió 10,66%±3,6% y 12,11%±3,29% en 24 y 72horas (p>0,05). El drenaje medio en 24horas fue 195,80ml en el grupo A frente a 253,93ml en el grupo B (p>0,05) y a las 48horas 225,33ml en el grupo A y de 328,19ml en el grupo-B (p=0,009). En el grupo intravenoso perdieron una media de 1.505ml de sangre frente a 1.280ml del grupo intraarticular. Fueron necesarias un 5,1% de transfusiones. No tuvimos complicaciones secundarias.
ConclusionesLas diferentes vías de administración del TXA en la artroplastia total de cadera tienen un efecto similar en la reducción del sangrado postoperatorio sin evidenciar un incremento de complicaciones.
One of the most frequent complications after a total hip arthroplasty (THA) is bleeding, intravenous tranexamic acid (TXA) is used to reduce it. We considered it necessary to carry out a study to clarify which administration route is superior.
Material and methodProspective, controlled and randomized study in 2 arms carried out between February 2017 and February 2018. 15mg/kg of intravenous TXA were administered in group-A and 2gr of intra-articular TXA in group-B. The values of haemoglobin and haematocrit were evaluated at 24h-72h, blood loss volume, drained blood volume, transfusions and complications.
Results78 patients were included, 31 with intravenous treatment and 47 with intra-articular. The decrease of haemoglobin in the intravenous group was 3.15±1.64g/dl in 24h and 3.75±1.56g/dl in 72h, the haematocrit decreased by 10.4±4.17% in 24h and 11.85±4.15% in 72h. In the intra-articular group there was a haemoglobin fall of 3.03±1.30g/dl in 24h and 3.22±1.2g/dl in 72h and the haematocrit fell by 10.66±3.6% and 12,11±3.29% in 24 and 72h (P>.05). The mean drainage in 24h was 195.80ml in group-A versus 253.93ml in group-B (P>.05) and in 48h it was 225.33ml in group-A and 328.19ml in group-B (P=.009). The intravenous group lost an average of 1,505ml of blood compared to the 11,280ml of the intra-articular group. In 5.1% of the cases, transfusions were necessary. We had no secondary complications.
ConclusionsThe different routes of administration of TXA in THA have a similar effect in the reduction of postoperative bleeding. There was no evidence of an increase in complications.
La artroplastia total de cadera representa una de las intervenciones más comunes en el tratamiento del dolor osteoarticular de cadera secundario a artrosis o a la necrosis ósea avascular de la cabeza femoral. Una de las complicaciones más frecuentes de la cirugía es el gran sangrado intraoperatorio, que se prolongará postoperatoriamente. Estudios previos muestran rangos de pérdida sanguínea que oscilan entre 1.188ml a 1.651ml1,2. Además, se ha visto que entre un 10% y un 38% de los pacientes intervenidos de artroplastia precisan de un promedio de 2 unidades de concentrados de hematíes para minimizar la caída de la hemoglobina y el hematocrito3,4. Toda transfusión sanguínea alogénica no está exenta de riesgos, y además de incrementar los costes, aumenta significativamente las complicaciones. Por ejemplo, las infecciones postoperatorias, la estancia hospitalaria, la mortalidad o retrasa la recuperación física5.
Han sido empleadas muchas estrategias para reducir el sangrado postoperatorio y el número de transfusiones tras una cirugía protésica, incluidas la donación autóloga, la hipotensión intraoperatoria controlada, la anestesia regional, el uso de sistemas recuperadores de sangre, la eritropoyetina o agentes antifibrinolíticos. El ácido tranexámico (TXA), comercializado como Amchafibrin®, cuenta con la máxima potencia y menor número de complicaciones dentro de los antifibrinolíticos. Su administración inhibe la activación del plasminógeno a plasmina, al bloquear el sitio de unión de la lisina, y previene la degradación de fibrina6,7.
Estudios previos en cirugía ortopédica y en cirugía cardiovascular han demostrado que el TXA reduce el sangrado posquirúrgico y el número de transfusiones alogénicas respecto a un grupo control en el que se utiliza una hemostasia rutinaria7,8. Además, no ha incrementado el número de eventos tromboembólicos, ni de infecciones quirúrgicas4,9. Sin embargo, la mayoría de estos estudios prospectivos y aleatorizados o de metaanálisis se han centrado en la efectividad, eficacia y seguridad del ácido tranexámico, sin precisar la vía de administración óptima10–12. Recientemente se ha publicado el beneficio de la aplicación tópica de TXA, por su facilidad de administración, proporcionando una concentración máxima en el sitio quirúrgico con un bajo efecto sistémico10. Así, consideramos necesario realizar un estudio que justifique qué vía de administración, tópica o intravenosa, resulta superior, a la par que segura, en la reducción del sangrado postoperatorio tras una artroplastia primaria de cadera. Para ello evaluaremos 2 parámetros independientes, como son el volumen de sangre drenado y la pérdida sanguínea total, que tiene en cuenta la necesidad de transfusiones. Presumimos que la aplicación tópica (intraarticular) de TXA tras el cierre reduce el sangrado postoperatorio y ayuda a mantener estable los valores hemodinámicos tanto como su uso intravenoso. El objetivo secundario ha sido analizar si alguna de las vías de administración reduce en mayor medida el número de transfusiones sanguíneas alogénicas y la incidencia de posibles eventos tromboembólicos.
Material y métodoDiseñoSe realiza un ensayo clínico fase IV, prospectivo y aleatorizado en 2 brazos, realizado en el Hospital Universitario Doctor Peset de Valencia tras la aprobación por el comité ético de investigación clínica. En el grupo A (brazo A) se administran 15mg/kg de TXA intravenoso los 15-20minutos previos del fin de la intervención quirúrgica. En el grupo B (brazo B) se administran 2 gramos de TXA en 100ml de suero salino fisiológico intraarticular a través del redón, una vez se ha cerrado la herida, seguido del clampaje del redón durante 2horas.
La dosis de TXA utilizada está basada en estudios previos según la práctica clínica habitual13,14.
No requerimos de grupo control, puesto que existe suficiente bibliografía ya publicada que demuestra la utilidad y seguridad del uso del TXA como antifibrinolítico en la reducción del sangrado postoperatorio, estando ya comercializado como Amchafibrin®.
Población a estudio y tamaño muestralEl estudio se realiza en pacientes intervenidos de manera electiva de artroplastia total de cadera por coxartrosis o necrosis ósea avascular en el periodo comprendido desde febrero de 2017 a febrero de 2018.
Dado que en el momento en que se inicia el trabajo no existen publicaciones que describan la diferencia del uso del TXA vía intravenosa o intraarticular tras una prótesis total de cadera, para el cálculo del tamaño muestral se ha utilizado un criterio temporal.
Todos los pacientes que cumplen los criterios de inclusión son aleatorizados por demanda de intervención de manera consecutiva en 2 grupos o brazos, el grupo A, que recibe tratamiento intravenoso de TXA más la hemostasia rutinaria, y el grupo B, que recibe tratamiento intraarticular además de la hemostasia rutinaria. Durante el estudio el cirujano ortopédico y el anestesista no permanecen cegados debido a la diferente vía de administración del ácido tranexámico. Sin embargo, todo el seguimiento posterior se realiza homogéneamente y de manera estandarizada para los 2 grupos.
Criterios de selecciónCriterios de inclusiónSe han incluido todos los pacientes con edad comprendida entre los 18 y 85 años a los que se les ha implantado una prótesis total de cadera por coxartrosis primaria o por necrosis ósea avascular. Además, los pacientes deben haber firmado el consentimiento informado para la intervención quirúrgica y para participar en el estudio, y tener una analítica reciente donde se confirme la normalidad en el recuento de plaquetas, INR y tiempo de protrombina.
Criterios de exclusiónSe han eliminado del estudio todos los pacientes con alergia al ácido tranexámico, rechazo a participar en el estudio, artropatía secundaria (artritis reumatoide, artritis postraumática, artritis psoriásica), enfermedad cardiovascular (infarto agudo de miocardio, fibrilación auricular, angina, insuficiencia cardíaca grado 3-4, cirugía cardiaca previa), enfermedad cerebrovascular (ictus, accidente isquémico transitorio y cirugía vascular), enfermedad tromboembólica (trombosis venosa profunda [TVP] y tromboembolismo pulmonar [TEP]), alteraciones de la fibrinólisis y coagulopatías (si INR>1,4, plaquetas<150.000x109/l, tiempo protrombina>1,4), insuficiencia hepática y/o renal, tratamiento con anticoagulantes 7 días previos a la intervención quirúrgica, rechazo a hemoderivados, complicaciones intraoperatorias (anestésicas o quirúrgicas), participar en otro ensayo clínico y tener valores de hemoglobina preoperatoria<12g/dl.
Variables a estudioSe han recogido las variables sociodemográficas de los pacientes (edad en el momento de la intervención, sexo, peso, altura e índice de masa corporal), antecedentes médicos, valoración preanestésica y variables relativas a la intervención (como el tipo de anestesia empleada, el abordaje empleado, el tiempo quirúrgico, los días de ingreso y la lateralidad). Como variables clínicas principales se han recogido los valores de hemoglobina y hematocrito preoperatorio y postoperatorio (a las 24h y 72h), la hemoglobina más baja registrada durante el ingreso, el volumen de sangre del paciente (anexo 1), la pérdida total de sangre (anexo 2), la pérdida oculta de sangre (anexo 3) y el volumen del drenaje a las 24 y 48horas (mililitros). Además, se han recogido como variables secundarias el número de unidades de sangre transfundidas y las complicaciones de la intervención (evolución de la herida con infección o necrosis, TEP, TVP o exitus).
Protocolo quirúrgico del centroTodas las intervenciones han sido realizadas por un equipo de cirujanos ortopédicos con experiencia en artroplastia primaria de cadera. En todos los pacientes se han implantado modelos no cementados.
En la inducción anestésica se ha administrado profilaxis antibiótica intravenosa según el protocolo del comité de infecciones del hospital. Durante toda la cirugía se realiza la hemostasia con electrocoagulación de los vasos sangrantes. Tras la intervención colocamos un drenaje con vacío del número 12 que se retira a las 48horas. En caso de administrar el TXA vía tópica (grupo B) este se introduce a través del redón, una vez ha sido cerrada la herida, y permanece clampado durante 2horas. En los pacientes a los que se les administra el TXA intravenoso (grupo A) el redón se abre tras colocar el vendaje compresivo. A las 6horas de finalizar la intervención quirúrgica los pacientes reciben el tratamiento profiláctico de eventos tromboembólicos con bemiparina de bajo peso molecular que se mantiene durante 30 días.
Todos los pacientes ingresados siguen el mismo protocolo de transfusión sanguínea basado en la guía de transfusión perioperatoria del National Institutes of Health Consensus Conference15. Indicando la transfusión de unidades de hematíes cuando el paciente tiene valores de hemoglobina inferiores a 8g/dl, o con valores inferiores de 10g/dl si asocia enfermedad cardiopulmonar y clínica de anemización, definida como síncope, fatiga, palpitaciones o mareo.
Las posibles complicaciones como eventos tromboembólicos son anotados y recogidos durante su estancia hospitalaria. Al alta, todos los pacientes son citados en consultas externas a las 3 semanas de la intervención, donde nuevamente se reevalúan las posibles complicaciones.
Recogida de datosLa recogida de datos de los pacientes se ha realizado de manera estandarizada y homogénea para los 2 grupos. Los datos se han recogido en el postoperatorio por otro equipo diferente de cirujanos. Se han registrado los valores de hemoglobina y hematocrito a las 24 y a las 72horas tras la cirugía, los volúmenes de sangre drenada cada día, la realización o no de transfusión sanguínea, y una serie de variables demográficas citadas previamente. En esta fase de evaluación se ha cegado el análisis. Además, se evita el sesgo de confusión al tratarse de resultados objetivos.
Análisis estadísticoEn primer lugar se ha realizado un análisis descriptivo donde las variables continuas con distribución normal se describen como media±desviación estándar (DE) y las de distribución no normal o no gaussiana como mediana (máximo-mínimo). Por otro lado, las variables cualitativas se describen como frecuencia y porcentaje. Para la comprobación de la distribución de normalidad de la variable se ha aplicado el test de Kolmogórov-Smirnov. Para estudiar la asociación entre variables cualitativas se ha utilizado la prueba de Chi cuadrado. Para estudiar la diferencia entre medias se ha utilizado la prueba de la «t» de Student, U de Mann-Whitney o ANOVA dependiendo de las condiciones de aplicación. En todas las pruebas se han considerado estadísticamente significativas las diferencias con p<0,05. El análisis informático se ha realizado con el programa SPSS 22.0.
Aspectos éticosEste trabajo se ha desarrollado tras la aprobación del comité ético del Hospital Universitario Doctor Peset, siguiendo las recomendaciones de la Declaración de Helsinki de 1964. Se ha obtenido consentimiento informado firmado de todos los pacientes incluidos.
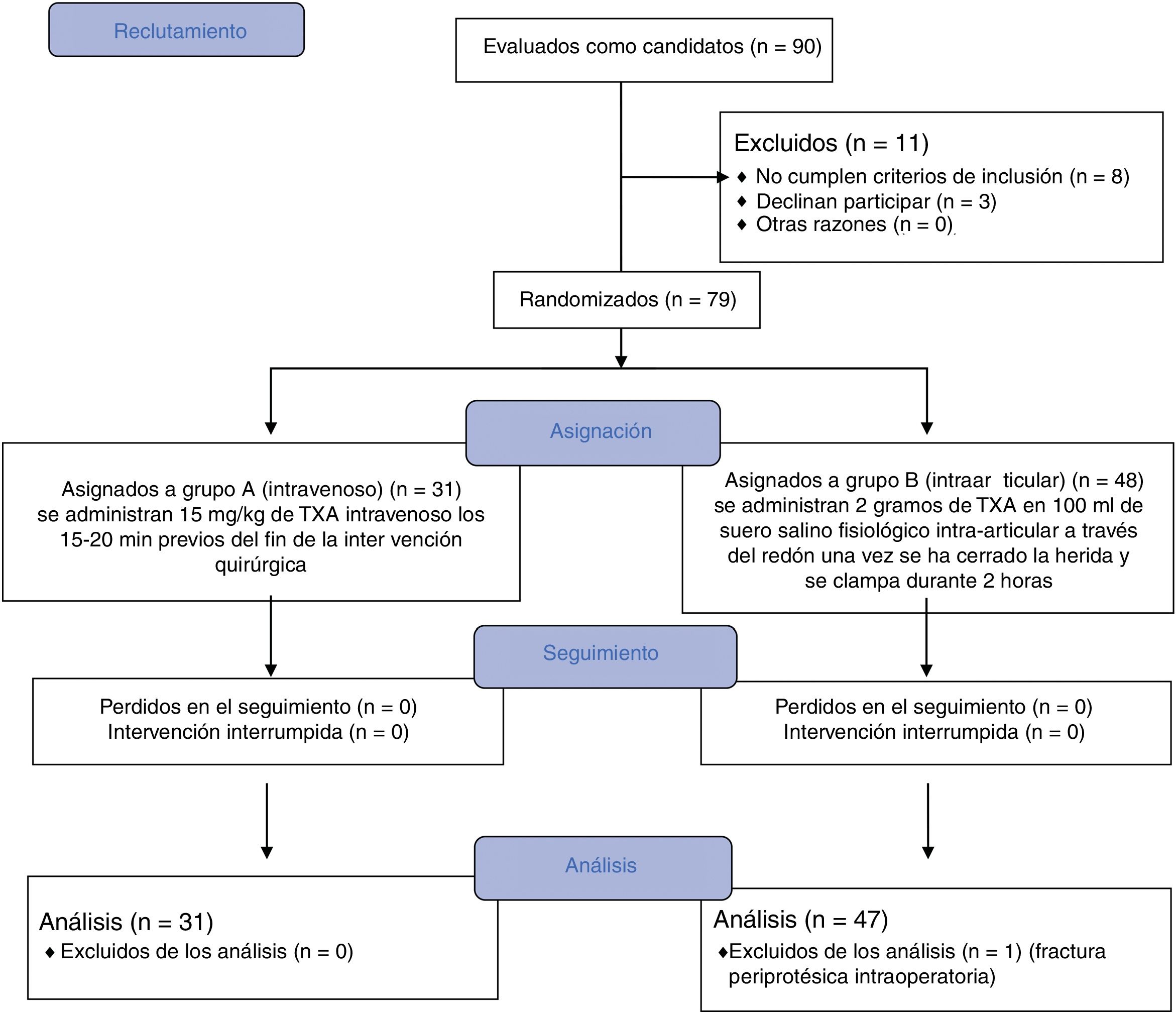
ResultadosEntre febrero de 2017 y febrero de 2018 se han incluido en el estudio 90 pacientes programados para artroplastia primaria de cadera. De este grupo inicial, 12 pacientes se han excluido del estudio, 8 por no cumplir los criterios de inclusión, 3 por rechazar participar y un caso fue excluido durante el seguimiento al comprobar que se había producido una fractura iatrogénica que requirió de transfusiones intraoperatorias. El análisis final se ha realizado en 78 pacientes, 31 de ellos aleatorizados en el grupo A que recibe el tratamiento intravenoso y 47 pacientes en el grupo B que recibe el TXA intraarticular (fig. 1).
No se han encontrado diferencias significativas en cuanto a edad, sexo, índice de masa corporal o clasificación de la American Society of Anesthesiologists16 (tabla 1). Se ha recogido y evaluado la comorbilidad asociada a la intervención quirúrgica, encontrando en un 66,66% de los pacientes (52 casos) enfermedades crónicas como la hipertensión arterial, la diabetes mellitus y la dislipemia en tratamiento.
Descriptivo de la muestra en función de la administración de TXA
| Global (n=78) | Grupo TXA_IV (n=31) | Grupo TXA_IA (n=47) | Valor de pa,b | |
|---|---|---|---|---|
| Edad (media+DE) | 63,14±12,22 | 62,74±11,95 | 63,40±12,51 | 0,817 |
| Sexo mujer, n (%) | 35 (44,9) | 13 (41,9) | 22 (46,8) | 0,672 |
| IMC | 28,47±3,91 | 28,52±3,98 | 28,44±3,91 | 0,925 |
| ASA n (%) | ||||
| 1 | 11 (14,1) | 3 (9,7) | 8 (17,0) | |
| 2 | 59 (75,6) | 24 (77,4) | 35 (74,5) | |
| 3 | 8 (10,3) | 4 (12.9) | 4 (8,5) | 0,581 |
ASA: American Society of Anesthesiologists; DE: desviación estándar, IMC: índice de masa corporal; n: número.
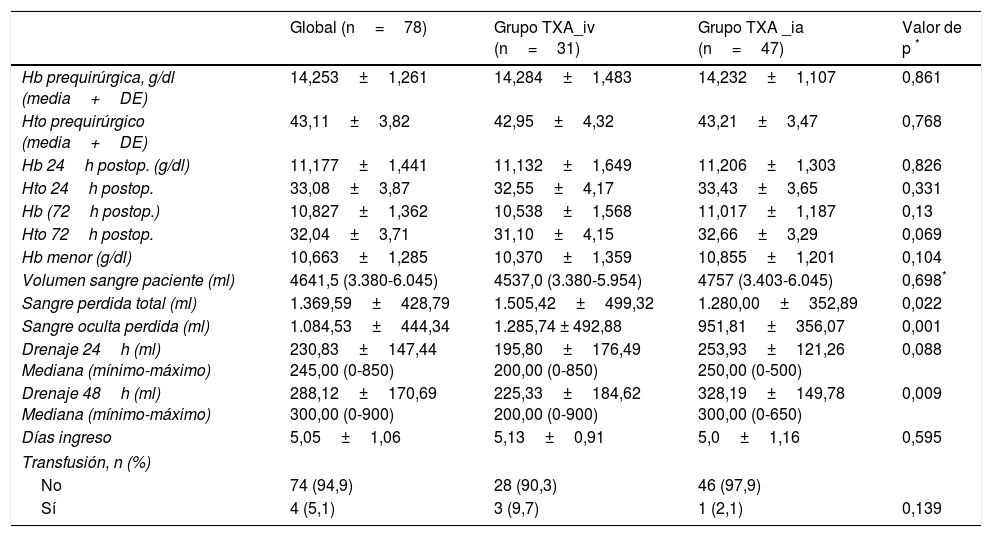
Los valores de hemoglobina y hematocrito preoperatorio han sido similares en ambos grupos. El descenso de la hemoglobina y el hematocrito medio tras la intervención también ha sido similar. En el grupo A donde se administró el TXA intravenoso, partíamos de una Hb media preoperatoria de 14,28g/dl, con una caída media a las 24horas de 3,15±1,64g/dl y de 3,75±1,56g/dl a las 72horas. El hematocrito sufrió una bajada media del 10,4%±4,17% a las 24horas y de 11,85%±4,15% a las 72 horas. En el grupo B, de administración intraarticular, partíamos de 14,23g/dl de Hb media y se observó una caída media de 3,03±1,30g/dl a las 24horas y de 3,22±1,2g/dl a las 72horas. El hematocrito descendió un 10,66%±3,6% y un 12,11%±3,29% a las 24 y 72horas respectivamente. Los valores medios más bajos registrados de hemoglobina han sido de 10,3g/dl para el grupo A y de 10,8g/dl para el grupo B. No se han encontrado diferencias significativas entre ambos grupos para ninguno de los valores estudiados (tabla 2).
Niveles de drenaje y niveles de hemoglobina Hb () y hematocrito (Hto) pre y posquirúrgico. Mediana (mínimo y máximo)
| Global (n=78) | Grupo TXA_iv (n=31) | Grupo TXA _ia (n=47) | Valor de p * | |
|---|---|---|---|---|
| Hb prequirúrgica, g/dl (media+DE) | 14,253±1,261 | 14,284±1,483 | 14,232±1,107 | 0,861 |
| Hto prequirúrgico (media+DE) | 43,11±3,82 | 42,95±4,32 | 43,21±3,47 | 0,768 |
| Hb 24h postop. (g/dl) | 11,177±1,441 | 11,132±1,649 | 11,206±1,303 | 0,826 |
| Hto 24h postop. | 33,08±3,87 | 32,55±4,17 | 33,43±3,65 | 0,331 |
| Hb (72h postop.) | 10,827±1,362 | 10,538±1,568 | 11,017±1,187 | 0,13 |
| Hto 72h postop. | 32,04±3,71 | 31,10±4,15 | 32,66±3,29 | 0,069 |
| Hb menor (g/dl) | 10,663±1,285 | 10,370±1,359 | 10,855±1,201 | 0,104 |
| Volumen sangre paciente (ml) | 4641,5 (3.380-6.045) | 4537,0 (3.380-5.954) | 4757 (3.403-6.045) | 0,698* |
| Sangre perdida total (ml) | 1.369,59±428,79 | 1.505,42±499,32 | 1.280,00±352,89 | 0,022 |
| Sangre oculta perdida (ml) | 1.084,53±444,34 | 1.285,74 ± 492,88 | 951,81±356,07 | 0,001 |
| Drenaje 24h (ml) Mediana (mínimo-máximo) | 230,83±147,44 245,00 (0-850) | 195,80±176,49 200,00 (0-850) | 253,93±121,26 250,00 (0-500) | 0,088 |
| Drenaje 48h (ml) Mediana (mínimo-máximo) | 288,12±170,69 300,00 (0-900) | 225,33±184,62 200,00 (0-900) | 328,19±149,78 300,00 (0-650) | 0,009 |
| Días ingreso | 5,05±1,06 | 5,13±0,91 | 5,0±1,16 | 0,595 |
| Transfusión, n (%) | ||||
| No | 74 (94,9) | 28 (90,3) | 46 (97,9) | |
| Sí | 4 (5,1) | 3 (9,7) | 1 (2,1) | 0,139 |
DE: desviación estándar; n: número.
Los valores de drenaje medio en las primeras 24horas han sido de 195,80ml en el grupo A de aplicación intravenosa frente a 253,93ml recogidos en el grupo B de aplicación intraarticular. A las 48horas, previo a la retirada del mismo, en el grupo A se ha registrado un drenaje medio de 225,33ml respecto a los 328,19ml drenados en el grupo B, existiendo una asociación estadísticamente significativa (p=0,009) en los valores recogidos a las 48horas. Si analizamos el volumen de sangre del paciente y calculamos la pérdida sanguínea total tras la intervención quirúrgica vemos que se perdieron 1.505,42±499,32ml en el grupo intravenoso, mientras que en el grupo intraarticular la pérdida fue de 1.280,00±352,89ml, constatando una asociación estadísticamente significativa (p=0,022).
La proporción de pacientes que requirió tranfusión fue un 9,7% en el grupo A, mientras que en el grupo B se transfundieron un 2,1% de los casos.
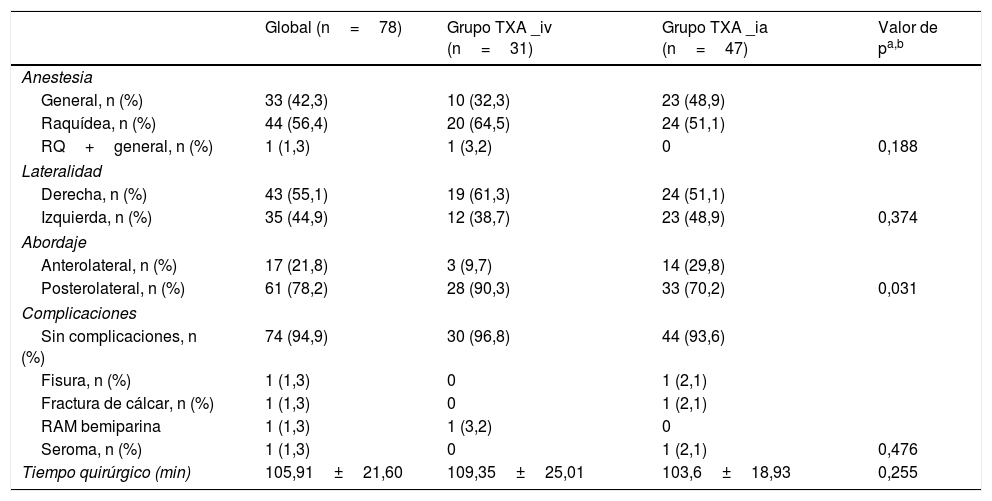
El tiempo quirúrgico y la estancia media hospitalaria fue similar en ambos grupos, sin existir una asociación estadísticamente significativa (tabla 3).
Descriptivo de la muestra en relación con las características de la intervención y en función de la administración de tranexámico (TXA)
| Global (n=78) | Grupo TXA _iv (n=31) | Grupo TXA _ia (n=47) | Valor de pa,b | |
|---|---|---|---|---|
| Anestesia | ||||
| General, n (%) | 33 (42,3) | 10 (32,3) | 23 (48,9) | |
| Raquídea, n (%) | 44 (56,4) | 20 (64,5) | 24 (51,1) | |
| RQ+general, n (%) | 1 (1,3) | 1 (3,2) | 0 | 0,188 |
| Lateralidad | ||||
| Derecha, n (%) | 43 (55,1) | 19 (61,3) | 24 (51,1) | |
| Izquierda, n (%) | 35 (44,9) | 12 (38,7) | 23 (48,9) | 0,374 |
| Abordaje | ||||
| Anterolateral, n (%) | 17 (21,8) | 3 (9,7) | 14 (29,8) | |
| Posterolateral, n (%) | 61 (78,2) | 28 (90,3) | 33 (70,2) | 0,031 |
| Complicaciones | ||||
| Sin complicaciones, n (%) | 74 (94,9) | 30 (96,8) | 44 (93,6) | |
| Fisura, n (%) | 1 (1,3) | 0 | 1 (2,1) | |
| Fractura de cálcar, n (%) | 1 (1,3) | 0 | 1 (2,1) | |
| RAM bemiparina | 1 (1,3) | 1 (3,2) | 0 | |
| Seroma, n (%) | 1 (1,3) | 0 | 1 (2,1) | 0,476 |
| Tiempo quirúrgico (min) | 105,91±21,60 | 109,35±25,01 | 103,6±18,93 | 0,255 |
DE: desviación estándar; n: número; RAM: reacción adversa medicamentosa.
Respecto a las complicaciones, de un total de 78 pacientes intervenidos, únicamente tuvimos 4 casos de complicaciones (2 fracturas en el cálcar, un cuadro de reacción alérgica a la bemiparina y una infección quirúrgica), sin encontrar en el postoperatorio inmediato ni en el seguimiento ninguna complicación tromboembólica ni ninguna complicación secundaria a la vía de administración del TXA (tabla 3).
DiscusiónLa artroplastia total de cadera supone una importante pérdida sanguínea intra y postoperatoriamente. La aparición de una anemia postquirúrgica puede aumentar la mortalidad y morbilidad, incrementar los días de estancia hospitalaria y retrasar la rehabilitación17. Desde hace años se están desarrollando diferentes procesos con el fin de minimizar la pérdida sanguínea, y de este modo evitar la transfusión sanguínea alogénica, una técnica invasiva asociada a importantes complicaciones2. Numerosos estudios reportan las ventajas del ácido tranexámico en la reducción del sangrado postoperatorio8,18,19. El interés en la administración tópica del TXA ha crecido en los últimos años debido a su aplicación directamente en la zona quirúrgica con una acción local que minimiza sus efectos secundarios sistémicos10,20,21. Cuando el tranexámico se aplica por vía intravenosa se distribuye intracelular y extracelularmente hasta alcanzar su concentración máxima a los 5-15minutos, aumentando su riesgo de producir complicaciones tromboembólicas10,22,23. En nuestro ensayo clínico aleatorizado se ha demostrado que no hay diferencias estadísticamente significativas en la administración tópica de 2g de ácido tranexámico frente al tratamiento estandarizado de 15mg/kg por vía intravenosa, en cuanto a la caída de hemoglobina y hematocrito, pérdida sanguínea y necesidad de transfusiones. En un reciente metaanálisis publicado se obtienen resultados similares a los nuestros en cuanto a la reducción de sangrado y minimización de transfusiones23. Sin embargo, a diferencia de nuestros resultados observan que en el grupo de administración intravenosa existe una menor caída de la hemoglobina, sin poder asegurar la superioridad de esta vía, pues probablemente guarde relación con datos insuficientes.
Son numerosos los estudios que han demostrado la no inferioridad de la vía intraarticular frente a la administración estándar intravenosa tras una prótesis total de rodilla4,12–14, incluso algunos autores aconsejan la administración intraarticular como la más efectiva, al ser una administración directa y sencilla, que se puede aplicar en pacientes con contraindicaciones del uso sistémico de TXA, dado que su absorción desde la articulación es clínicamente poco significativa24. En la cadera son escasas las publicaciones encontradas que hablan de diferencia estadísticamente significativa en la disminución de sangrado según la vía de administración, y las pocas encontradas defienden el uso intravenoso25,26. En nuestro trabajo encontramos resultados muy parejos, pero siempre con una menor pérdida de sangre total y una menor caída de la hemoglobina en el grupo intraarticular, hallando en algunos valores una asociación estadísticamente significativa. Así mismo, los pacientes del grupo de aplicación intraarticular recibieron un menor número de transfusiones frente al grupo intravenoso, y aunque no se obtiene un resultado estadísticamente significativo y no podemos confirmar la superioridad de una vía respecto a la otra, esta tendencia constante a obtener mejores resultados con la vía intraarticular hace que nos inclinemos por su utilización en nuestra práctica clínica.
La administración de tranexámico ha demostrado ser una técnica segura, pues no hemos incrementado las complicaciones (TEP, TVP o infecciones profundas). Únicamente un paciente del grupo B desarrolló un seroma que requirió de una limpieza quirúrgica y antibioterapia intravenosa durante 7 días. Sin embargo, la mayoría de autores aconsejan el uso de la vía tópica en pacientes con potencial riesgo de eventos tromboembólicos23.
En cuanto al tiempo quirúrgico no se recoge en la mayoría de publicaciones18, por lo que consideran que puede ser un motivo que influya en la pérdida sanguínea. En nuestro trabajo evaluamos el tiempo quirúrgico del grupo intravenoso (109,35±25,01min) frente al grupo tópico (103,6±18,9min), sin encontrar diferencias estadísticamente significativas.
El presente estudio cuenta con algunas limitaciones. En primer lugar realizamos una aleatorización secuencial excluyendo del estudio a los pacientes con mayores comorbilidades cardiovasculares, es decir, pacientes potencialmente tromboembólicos. Por un lado, el número de casos incluidos en cada grupo no es igual y ha resultado pequeño para poder demostrar una asociación estadísticamente significativa. Por otro lado, en el trabajo han participado diferentes cirujanos que pueden haber generado un sangrado desigual intraoperatorio. Hemos excluido del estudio a los pacientes que precisaron de transfusiones sanguíneas intraoperatorias para evitar posibles sesgos en el control de una población sin complicaciones intraoperatorias. En último lugar, en nuestro centro no se realiza de manera rutinaria un screening de TEP o TVP, por lo que únicamente se ha indicado la eco-doppler cuando ha existido sospecha clínica. Se han podido infravalorar las complicaciones en caso de existir cuadros tromboembólicos asintomáticos. Los puntos fuertes del trabajo son que se trata de un estudio prospectivo, aleatorizado con un equipo de médicos, enfermería quirúrgica y de sala que sigue un riguroso protocolo de actuación y recogida de datos.
El punto de controversia continúa siendo la dosis de tranexámico que debe pautarse. Existen estudios muy heterogéneos en cuanto a la dosificación, que probablemente necesiten de una muestra mayor para obtener resultados válidos. Nuestro estudio utiliza 15mg/kg vía intravenosa y 2g a nivel intraarticular; para calcular la dosis nos hemos basado en pautas similares recomendadas en la bibliografía17.
ConclusiónLas diferentes vías de administración del ácido tranexámico estudiadas en la atroplastia total de cadera primaria (tópica intraarticular versus intravenosa) tienen un efecto similar en la reducción del sangrado postoperatorio. No se ha evidenciado un incremento de las complicaciones con ninguna de las 2 pautas establecidas. Sin embargo, se prefiere la aplicación intraarticular en pacientes con riesgo tromboembólico. Serán necesarios nuevos estudios con mayor número de casos para poder ajustar la dosis óptima de tranexámico.
Nivel de evidenciaNivel de evidencia II.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.