La columna vertebral es la tercera ubicación más frecuente para la enfermedad metastásica, después del pulmón y el hígado. Por otra parte, los tumores óseos más recurrentes son las metástasis, siendo la columna su principal lugar de localización. En este trabajo se realiza una revisión de las diferentes técnicas de imagen disponibles, tanto radiológicas como de medicina nuclear, y de la apariencia morfológica de las metástasis de columna en cada una de ellas. La resonancia magnética (RM) es la mejor modalidad de imagen para la detección de metástasis en la columna. Es importante efectuar el diagnóstico diferencial entre fractura vertebral de causa osteoporótica y patológica. La compresión medular es una complicación grave de la enfermedad metastásica y su valoración mediante imagen a través de escalas objetivas es determinante para la estimación de la estabilidad de la columna y, por consiguiente, para establecer el tratamiento. Por último, se comentan brevemente las técnicas de intervencionismo percutáneo.
The spine is the third most frequent location for metastatic disease, after the lung and liver. On the other hand, the most frequent bone tumors are metastases and the spine is the main location. A review of the different imaging techniques available, both radiological and nuclear medicine, and the morphological appearance of spinal metastases in each of them is performed. Magnetic resonance imaging is the best imaging modality for detection of spinal metastases. It is important to make the differential diagnosis between vertebral fracture of osteoporotic and pathological cause. Spinal cord compression is a serious complication of metastatic disease and its assessment by imaging through objective scales is decisive for estimating spinal stability and therefore establishing treatment. Lastly, percutaneous intervention techniques are briefly discussed.
El cáncer es la segunda causa de muerte en el mundo. La columna vertebral es la tercera localización más frecuente para la enfermedad metastásica, después del pulmón y el hígado. Los tumores primarios son principalmente: mama, pulmón, próstata, tiroides y riñón1, mientras que en 13% de los casos, el tumor primario es desconocido2. Por otra parte, los tumores óseos más recurrentes son las metástasis y la columna es su principal lugar de localización. La mayoría de las metástasis de columna aparecen en pacientes de mediana edad y geriátricos3.
Los tumores de la columna se agrupan clásicamente en tres categorías según su distribución anatómica: extradural, intradural-extramedular e intramedular. La mayoría de las metástasis se encuentran en el compartimento extradural, que comprende la columna ósea y la región epidural. De manera frecuente, se localizan en los cuerpos vertebrales, con habitual extensión a los pedículos. El segmento más afectado es la columna torácica (70%) y con menor recurrencia los segmentos lumbar (20%), además del cervical y sacro (10%)4.
Inicialmente, las metástasis infiltran los cuerpos vertebrales, debido a su composición de médula ósea y alta vascularización, y de allí se extienden al arco posterior. La ruta de diseminación más habitual es la hematógena, siendo menos frecuentes las extensiones directa, linfática y subaracnoidea. La vía venosa, en especial el plexo paravertebral de Batson, parece ser más importante que la vía arterial. Las metástasis arteriales se suelen localizar en la proximidad de los platillos vertebrales, mientras que los tumores que metastatizan a través del plexo venoso epidural de Batson afectan al tercio posterior del cuerpo vertebral. Primero se invade el hueso esponjoso y al progresar la infiltración se invade la cortical, esto último favorece la fractura patológica y la inestabilidad vertebral3.
Las metástasis de la columna pueden provocar dolor axial y limitaciones funcionales, como resultado de fracturas patológicas. También suelen acompañarse de masa de partes blandas que produce compromiso epidural radicular y medular, ocasionando radiculopatía y mielopatía. De los pacientes con metástasis vertebrales, 10% desarrollarán compresión medular5.
MétodosEn este trabajo se realiza una revisión de las diferentes técnicas de imagen disponibles, tanto radiológicas como de medicina nuclear y de las características morfológicas de las metástasis vertebrales en cada una de ellas.
ResultadosLa búsqueda bibliográfica inicial sobre la imagen de las metástasis vertebrales arrojó 1.044 artículos, de los cuales 192 eran revisiones. La mayoría de los trabajos fueron descartados por los siguientes motivos: debido a que se centraban en hallazgos atípicos o poco frecuentes, a que enfatizaban las alteraciones del sistema nervioso central sobre la columna y a que su fecha de publicación no era reciente, puesto que las técnicas de imagen evolucionan rápidamente.
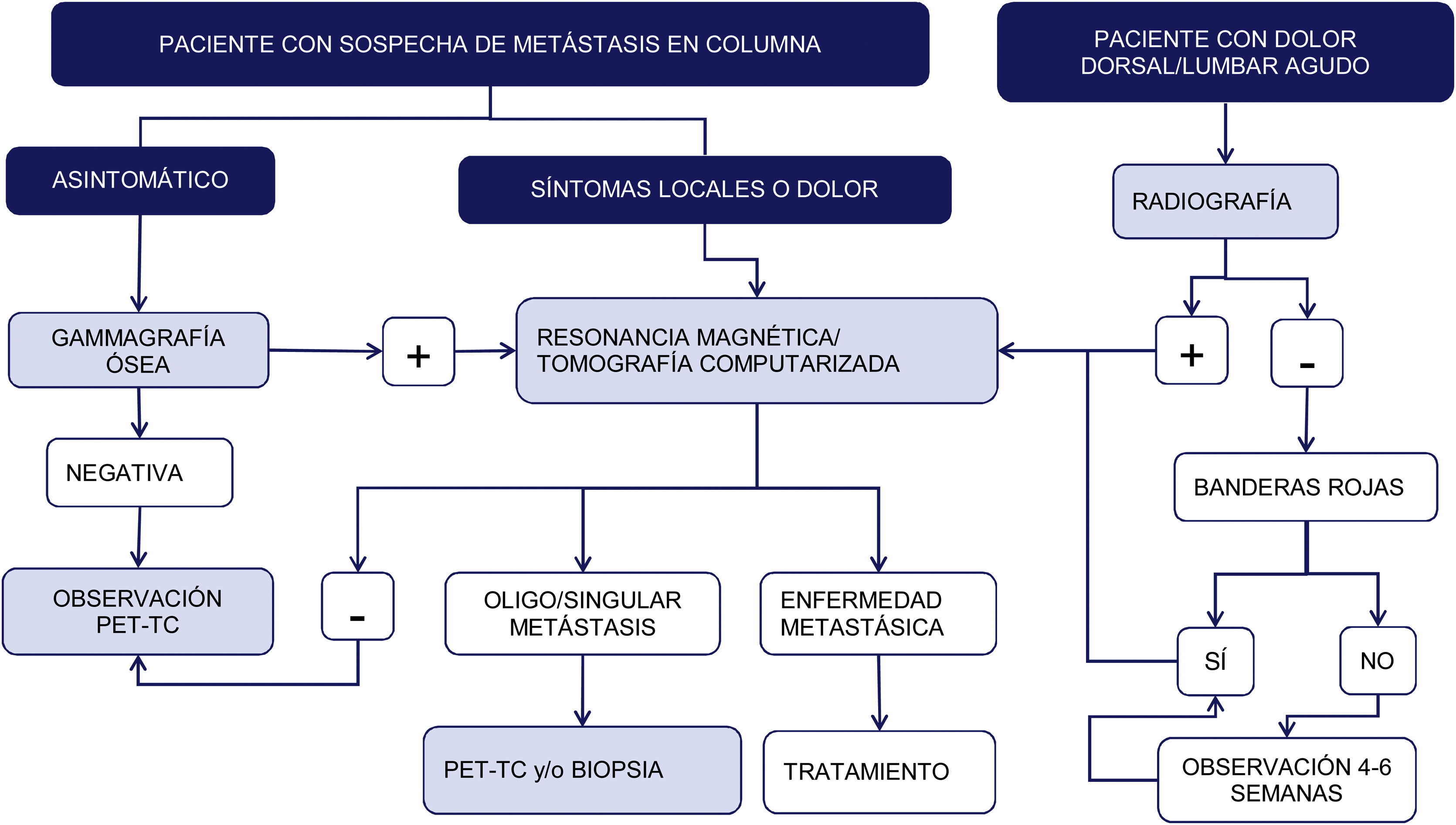
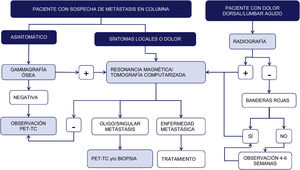
Técnicas de imagen: algoritmo diagnósticoSegún un metaanálisis referente al diagnóstico de las metástasis vertebrales, la resonancia magnética (RM) es la mejor modalidad de imagen para la detección de metástasis en la columna, realizando los estudios tanto por paciente como por lesión. En el mismo se comparó la sensibilidad, especificidad y precisión diagnóstica de la RM con el resto de las pruebas: tomografía por emisión de positrones (PET), tomografía por emisión de fotón único (SPECT), tomografía computarizada (TC) y gammagrafía ósea (GO)6 (fig. 1).
Esquema de algoritmo diagnóstico de las metástasis de columna. Las señales de alerta o banderas rojas son: 1. Sospecha de afectación tumoral; 2. Sospecha de infección; 3. Sospecha de fractura; 4. Dolor de ritmo inflamatorio; 5. Síndrome cauda equina, déficit neurológico progresivo o grave; 6. Lumbalgia con dolor muy importante y que progresa de intensidad y 7. Lumbalgia subaguda o crónica con irradiación radicular con fracaso en el tratamiento.
La radiografía simple (RX) es la primera modalidad de imagen en la aproximación diagnóstica de la patología de la columna, debido a la facilidad técnica para obtener estos estudios, su bajo coste y uso generalizado. Su principal indicación es descartar fractura patológica en pacientes con sintomatología conocida y clínica aguda4. Sin embargo, es poco sensible para la detección precoz de metástasis, con un alto porcentaje de falsos negativos. Se requiere una masa mayor de 1 cm de diámetro y una pérdida de al menos 50% de hueso trabecular para la detección de una lesión lítica, por esta razón no sirve como técnica de screnning1.
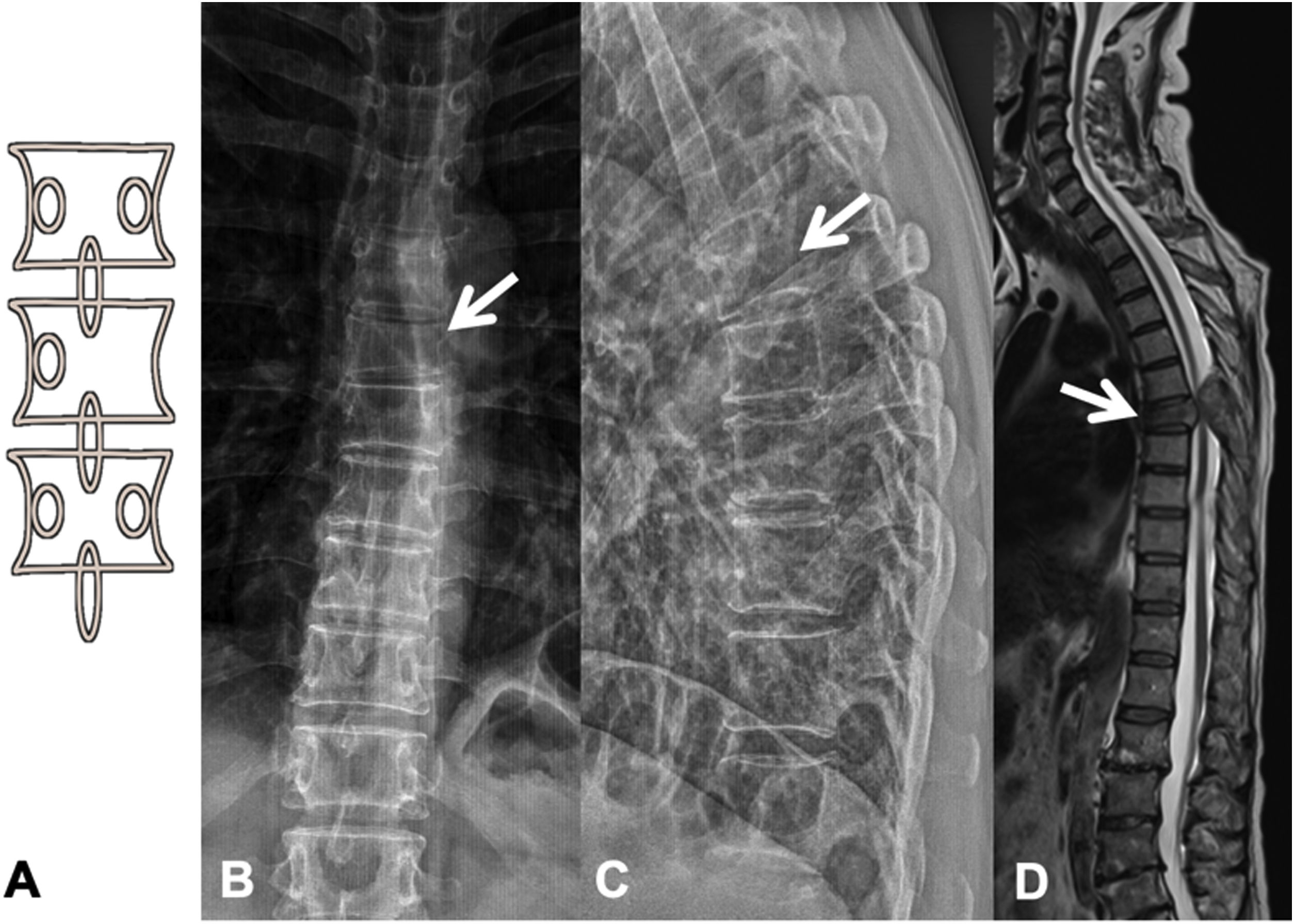
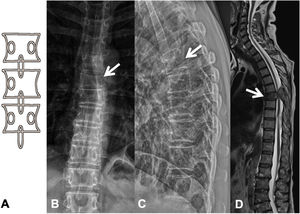
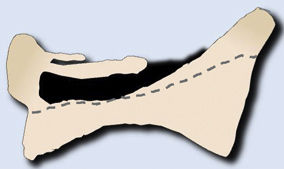
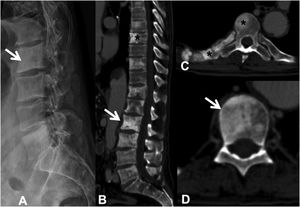
Las metástasis pueden ser osteolíticas (mama, pulmón, colon, tiroides y riñón), blásticas (próstata y neuroblastoma) o mixtas (mama y pulmón). Las más frecuentes son las lesiones líticas puras, se visualizan como pérdida de densidad ósea, que se presentan con patrón geográfico, apolillado o permeativo. La afectación cortical se identifica como un borramiento del contorno del cuerpo vertebral, es un signo muy específico de afectación tumoral y permite evaluar el riesgo de fractura patológica. El riesgo es alto si el tumor destruye 50% de la cortical. Las causas comunes de fractura patológica, en orden de frecuencia decreciente, son las metástasis de mama, pulmón y próstata. El signo del guiño de la lechuza o vértebra tuerta en la proyección anteroposterior de la columna traduce la existencia de una lesión lítica que involucra el pedículo vertebral, característico de metástasis. El cuerpo vertebral representa la cabeza del búho, el pedículo ausente simula el ojo guiñado, el pedículo contralateral normal aparenta el ojo abierto y la apófisis espinosa se asemeja al pico7 (fig. 2).
Fractura patológica dorsal por metástasis de carcinoma de pulmón. A: esquema del signo del «guiño de la lechuza»; B: RX en proyección AP de columna dorsal con acuñamiento vertebral asimétrico T7, más importante en el lado izquierdo, con imagen en vértebra tuerta por lisis del pedículo izquierdo (flecha); C: RX en proyección lateral de columna dorsal con acuñamiento vertebral T7 (flecha); D: RM de columna completa con secuencia sagital potenciada en T2, donde se ve la fractura patológica de T7 con abombamiento del muro posterior, afectación del arco posterior con masa epidural que produce compresión medular (flecha).
AP: anteroposterior; RM: resonancia magnética; RX: radiografía simple.
Las metástasis blásticas se detectan como áreas esclerosas homogéneas o heterogéneas, son más frecuentes en tumores de próstata, gástrico, mieloma y linfoma3. El «signo de la vértebra de marfil» se refiere a un aumento en la opacidad de un cuerpo vertebral, que mantiene su tamaño y contornos, con discos intervertebrales adyacentes conservados. El diagnóstico diferencial incluye metástasis, enfermedad de Paget y linfoma8.
Tomografía computarizadaLa RX es la prueba de imagen inicial, pero debido a la compleja anatomía de las vértebras, la TC multidetector (TCMD) es más útil para evaluar la localización y características de la afectación ósea9. Además, la TC puede reconocer una lesión metastásica ósea hasta seis meses antes que la RX. Es posible realizar reconstrucciones multiplanares 2 D y 3 D, con gran detalle anatómico efectuando una adquisición volumétrica axial de las imágenes con cortes de espesor milimétrico. Aunque la TC proporciona una excelente calidad de imagen y alta resolución espacial, es posible que se pasen por alto lesiones metastásicas sin destrucción ósea significativa, siendo menos sensible y específica que la RM. Además, la destrucción cortical es especialmente difícil de valorar cuando existen cambios osteoporóticos o degenerativos severos6.
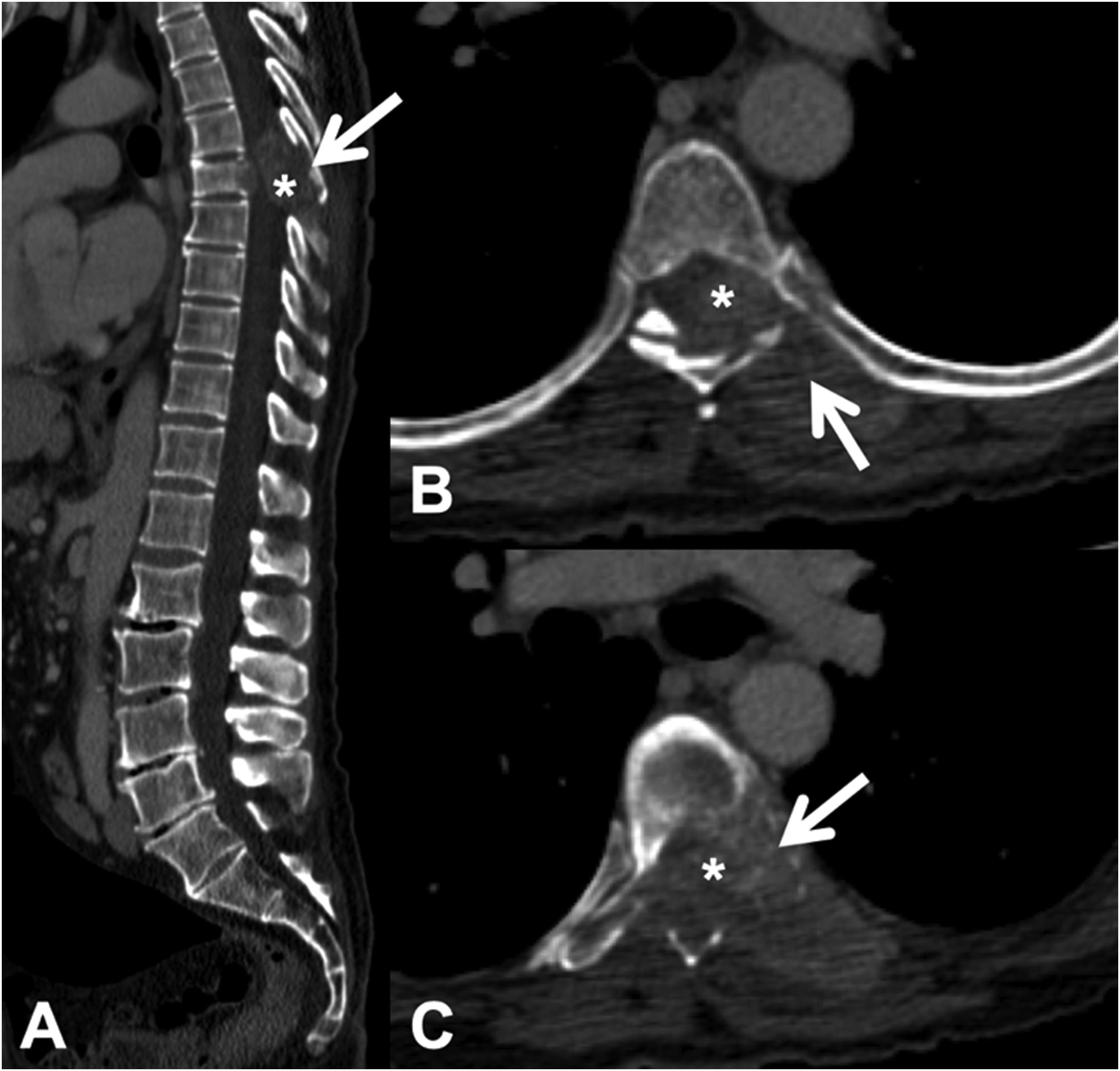
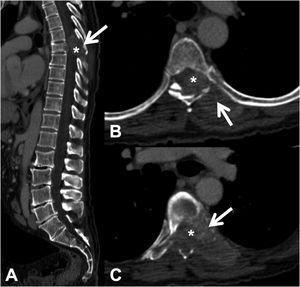
La TC permite detectar la infiltración tanto de la cortical como de la trabécula ósea de las lesiones líticas. También posibilita la detección de componente de partes blandas epidural asociado, que se presenta como una masa epidural que desplaza el saco tecal u ocupa el forámen de conjunción1 (fig. 3).
Fractura patológica dorsal por metástasis de carcinoma de pulmón. TC dorsolumbar con contraste intravenoso. A: reconstrucción 2 D en el plano sagital, donde existe fractura patológica de T7 con abombamiento del muro posterior, afectación del arco posterior (flecha) y masa epidural (asterisco); B y C: cortes axiales a nivel de la lesión, donde existe lesión lítica en cuerpo vertebral, pedículo izquierdo y arco posterior (flecha), con componente de partes blandas epidural y paravertebral que capta contraste e invade el canal raquídeo (asterisco).
TC: tomografía computarizada.
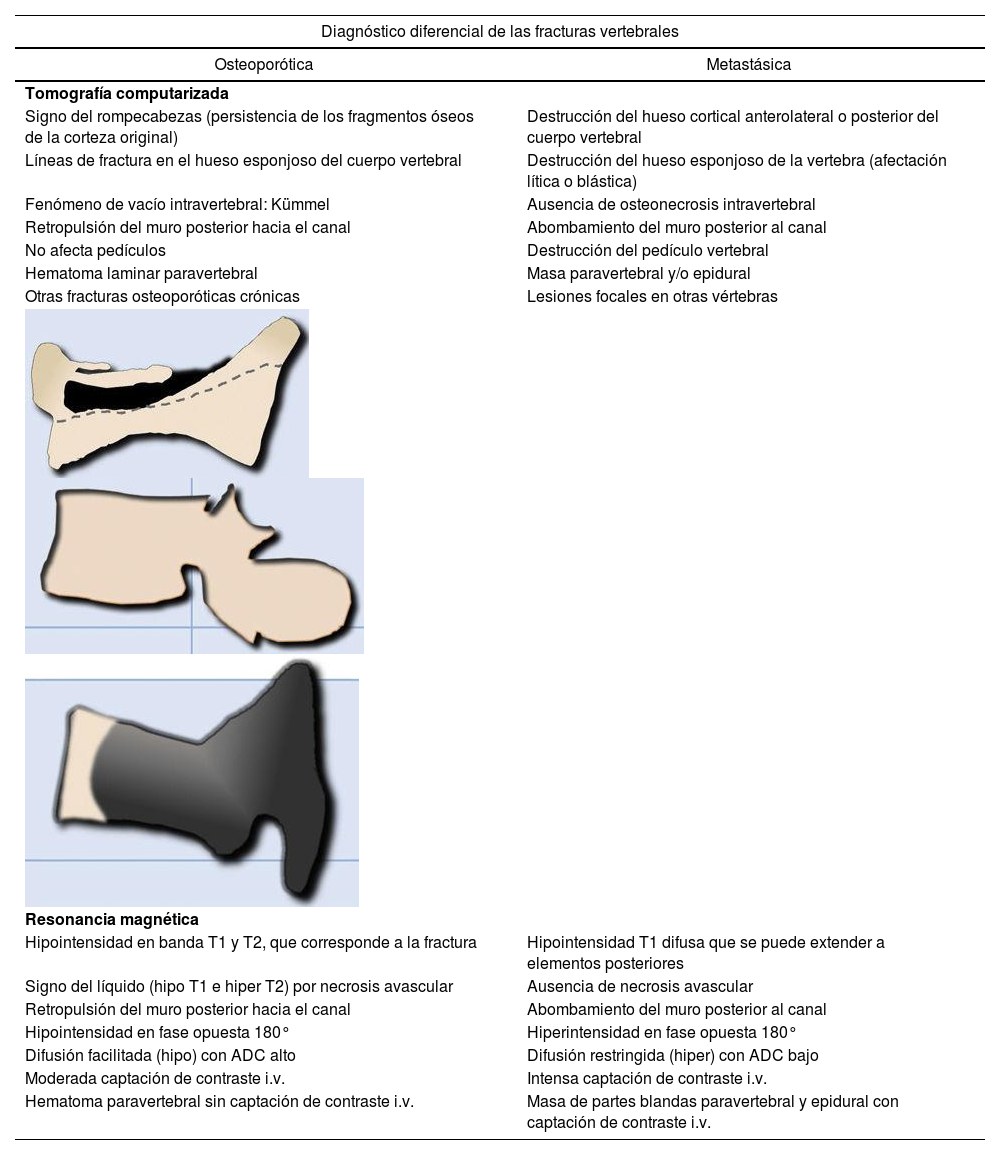
Es difícil distinguir entre fractura vertebral aguda de causa osteoporótica y metastásica, ambas producen dolor y pueden comprimir la médula. Los hallazgos morfológicos asociados a estos dos tipos de fracturas, que permiten el diagnóstico diferencial entre ambas, se resumen la tabla 13,10.
Diagnóstico diferencial de las fracturas vertebrales mediante TC y RM
| Diagnóstico diferencial de las fracturas vertebrales | |
|---|---|
| Osteoporótica | Metastásica |
| Tomografía computarizada | |
| Signo del rompecabezas (persistencia de los fragmentos óseos de la corteza original) | Destrucción del hueso cortical anterolateral o posterior del cuerpo vertebral |
| Líneas de fractura en el hueso esponjoso del cuerpo vertebral | Destrucción del hueso esponjoso de la vertebra (afectación lítica o blástica) |
| Fenómeno de vacío intravertebral: Kümmel | Ausencia de osteonecrosis intravertebral |
| Retropulsión del muro posterior hacia el canal | Abombamiento del muro posterior al canal |
| No afecta pedículos | Destrucción del pedículo vertebral |
| Hematoma laminar paravertebral | Masa paravertebral y/o epidural |
| Otras fracturas osteoporóticas crónicas | Lesiones focales en otras vértebras |
| Resonancia magnética | |
| Hipointensidad en banda T1 y T2, que corresponde a la fractura | Hipointensidad T1 difusa que se puede extender a elementos posteriores |
| Signo del líquido (hipo T1 e hiper T2) por necrosis avascular | Ausencia de necrosis avascular |
| Retropulsión del muro posterior hacia el canal | Abombamiento del muro posterior al canal |
| Hipointensidad en fase opuesta 180° | Hiperintensidad en fase opuesta 180° |
| Difusión facilitada (hipo) con ADC alto | Difusión restringida (hiper) con ADC bajo |
| Moderada captación de contraste i.v. | Intensa captación de contraste i.v. |
| Hematoma paravertebral sin captación de contraste i.v. | Masa de partes blandas paravertebral y epidural con captación de contraste i.v. |
ADC: coeficiente de difusión aparente; i.v: intravenoso; RM: resonancia magnética; TC: tomografía computarizada.
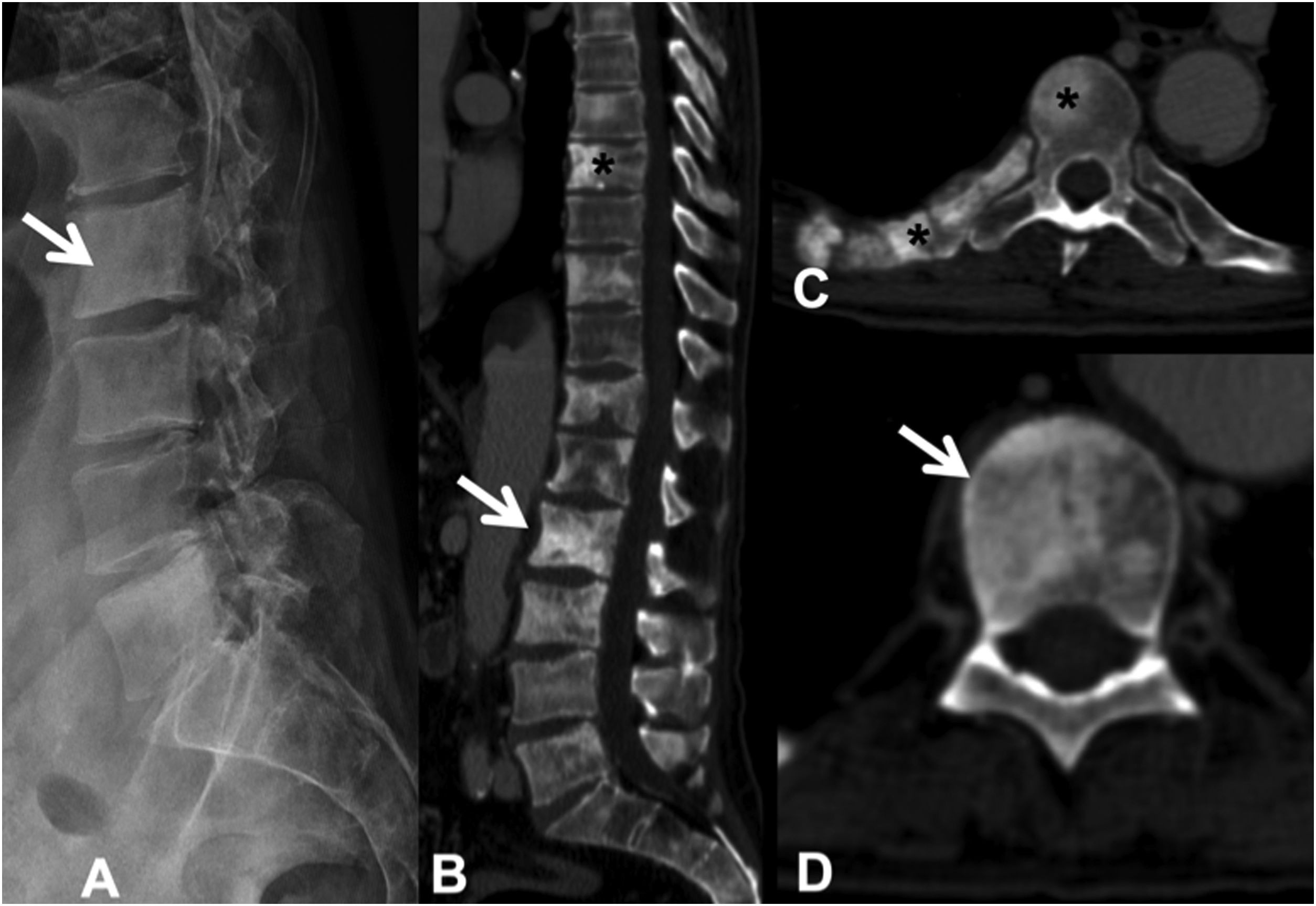
Las lesiones esclerosas son menos frecuentes, son de alta atenuación (aunque menos que la cortical ósea) y heterogéneas, impiden la visualización de las trabéculas y pueden asociar reacción perióstica; es raro que involucren afectación cortical o masa de partes blandas. Es posible diferenciar las metástasis blásticas no tratadas de las enóstosis o islotes óseos, realizando mediciones de atenuación. Las metástasis presentan una atenuación inferior a 885 unidades Hounsfield (HU), mientras que las enóstosis exhiben mayor atenuación, alcanzando los 1.060 HU, esta medición permite un diagnóstico fiable11. El fenómeno de llamarada osteoblástica («flare»), es la aparición de un borde escleroso alrededor de una lesión inicialmente lítica o de lesiones esclerosas no detectadas de manera previa en RX o TC, durante el seguimiento de un paciente oncológico, con otros signos de respuesta parcial al tratamiento. No indica progresión tumoral, sino la curación de lesiones preexistentes12 (fig. 4).
Metástasis blásticas múltiples dorsales y lumbares por carcinoma de próstata. A: RX lateral de columna lumbar, donde se ve algunas de las metástasis esclerosas que existen (flecha); B: TC de columna dorsolumbar con metástasis esclerosas dorsales (asterisco) y lumbares (flecha); C y D: metástasis esclerosas a varios niveles, en arco posterior y costilla derecha (asterisco) y en cuerpo vertebral (flecha).
RX: radiografía simple; TC: tomografía computarizada.
La TC de cuerpo completo es útil en los pacientes con sospecha de metástasis vertebrales para la detección del tumor primario. La TC también sirve para planificar la intervención quirúrgica, así como en la elección del tipo y extensión de la instrumentación4. Es útil para dirigir una biopsia guiada13 o una ablación percutánea y también se usa en la planificación del tratamiento para la radioterapia corporal estereotáctica (SBRT).
Los avances en TC de energía dual (TCED) son prometedores14, a partir del conjunto de datos obtenidos, se puede realizar un posprocesamiento virtual de extrapolación monoenergética, que reduce sustancialmente el artefacto de endurecimiento del haz, producido por el metal y mejora la visualización de la instrumentación y de las estructuras adyacentes. Otro método para disminuir los artefactos metálicos es el uso de algoritmos de segmentación de los datos correspondientes al metal, eliminando los dañados, que se reconstruyen para generar una imagen corregida. El empleo de energía dual con técnica virtual sin calcio para detectar el edema y la infiltración patológica de la médula ósea también permiten aumentar el rendimiento del diagnóstico15.
La mielografía por TC es una técnica útil en aquellos pacientes que no pueden someterse a una RM (marcapasos, claustrofobia, etc.) o debido a presencia de instrumentación metálica que cause artefacto paramagnético importante. Permite la evaluación de la integridad ósea, así como el contenido del saco tecal y tiene el beneficio adicional de posibilitar el análisis de líquido cefalorraquídeo (LCR). Puede caracterizar la compresión de la médula y el grado de bloqueo mielográfico1.
Resonancia magnéticaLa RM se considera la modalidad de imagen de mayor utilidad para evaluar la enfermedad metastásica de la columna vertebral, es más sensible que la RX, la TC y las exploraciones de medicina nuclear. La sensibilidad se debe a que presenta una excelente resolución de contraste entre tejidos; aporta información sobre el número, tamaño y localización de las metástasis, invasión del canal raquídeo, grado de compresión medular o radicular, afectación de las partes blandas adyacentes y de grandes vasos4.
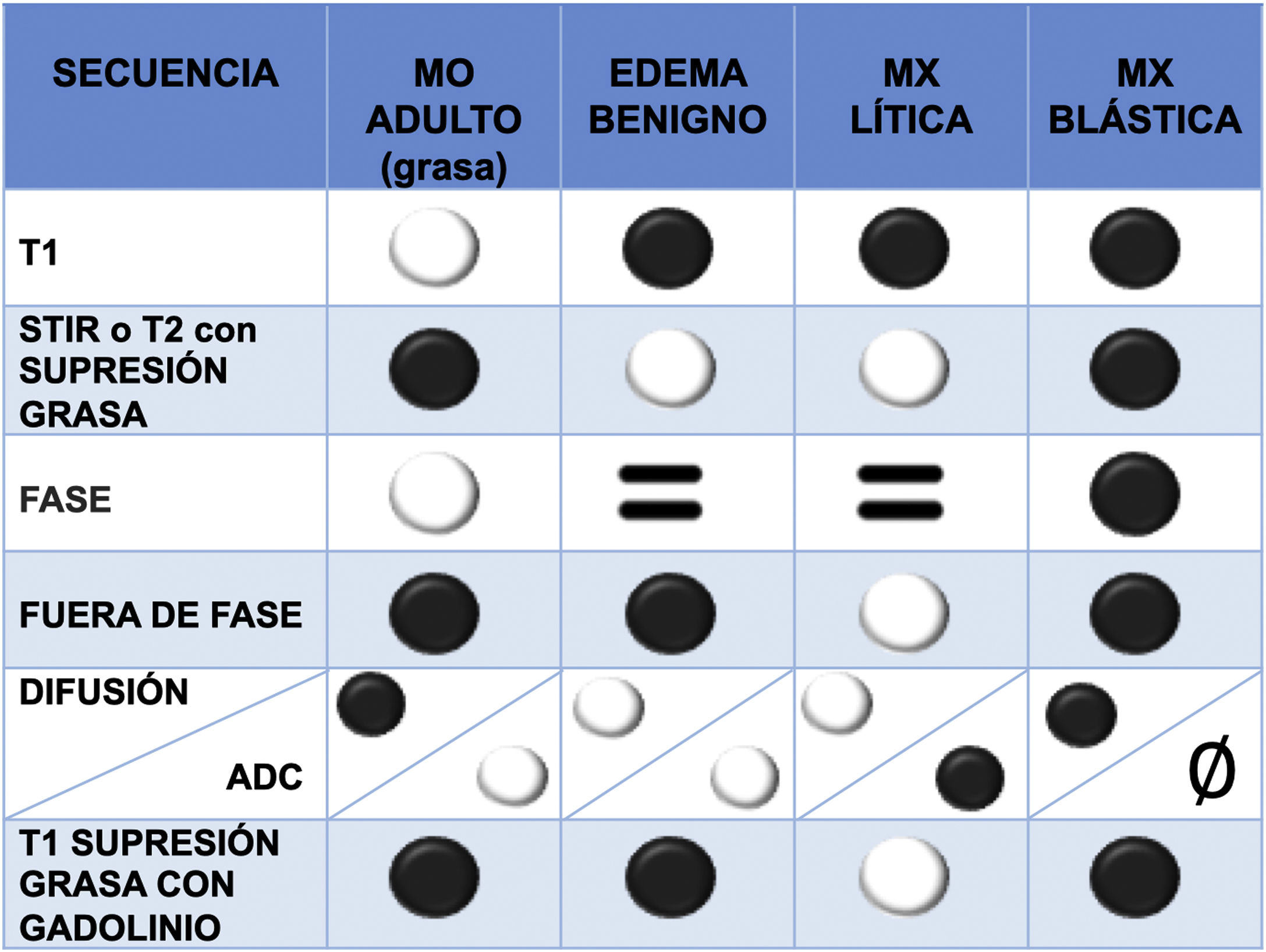
La médula ósea normal contiene tanto grasa como agua (la médula amarilla tiene 80% de grasa y 15% de agua, y la médula roja 40% de grasa y 40% de agua). En los trastornos infiltrativos la grasa desaparece, por lo tanto, son útiles las secuencias que muestran diferencias entre la señal de grasa y agua1. A continuación, se describen brevemente las secuencias más importantes (tabla 2 y fig. 5):
- -
Secuencia T1 espín eco (SE): la médula ósea grasa contiene un alto porcentaje de esta última y muestra una marcada hiperseñal en T1, cualquier lesión focal que infiltre la grasa revela hiposeñal y, por lo tanto, es fácil de detectar. Esto explica por qué la secuencia T1 es muy útil y suele ser la primera en usarse. La médula hematopoyética contiene agua y también grasa, es hipointensa respecto a la grasa, pero hiperintensa en relación con los músculos normales. Las metástasis, por el contrario, presentan una hiposeñal en T1 característica y más marcada respecto a los músculos y los discos intervertebrales16. La infiltración difusa de la médula ósea vertebral produce una hipointensidad de señal tan homogénea que puede crear inicialmente la impresión de un estudio normal, para una adecuada valoración, hay que compararla con la señal de discos y músculos1.
- -
Secuencias potenciadas en T2: las metástasis presentan señal variable en T2, dependiendo si son líticas (hiperintensas, debido a su alto contenido de agua) o blásticas (hipointensas). Las metástasis frecuentemente tienen un borde de señal T2 brillante a su alrededor (signo de halo)17.
- -
Técnicas de supresión de grasa: son múltiples, la más clásica es la secuencia Short Tau Inversion Recovery (STIR) y tiene la ventaja de que es una técnica robusta respecto a secuencias de saturación de grasa más modernas y específicas como la Spectral Presaturation with Inversion Recovery (SPIR) y Spectral Attenuated Inversion Recovery (SPAIR), que son muy susceptibles a los artefactos paramagnéticos por material metálico de instrumentación. Una secuencia moderna y cada vez más empleada es la técnica DIXON, esta permite la saturación específica de la grasa y puede obtener imágenes donde las moléculas de agua y grasa están en fase y en fase opuesta. Esta información se combina matemáticamente para obtener cuatro secuencias: en fase (agua + grasa); fase opuesta (agua – grasa); solo grasa (en fase – fase opuesta) y solo agua (en fase + fase opuesta). Su uso es cada vez más extendido debido a que en la misma secuencia se dispone de una secuencia T2 sin y con saturación de grasa, ahorrando tiempo en la adquisición del estudio. Asimismo, permite un estudio cualitativo y cuantitativo de la composición de la médula ósea. Existe evidencia de que los valores bajos de fracción de grasa de la lesión a estudio se asocian con malignidad, dado que los procesos oncológicos, al sustituir la médula ósea, reducen significativamente su contenido en grasa. En las imágenes en fase opuesta se considera que una pérdida de señal menor de 20% respecto a las imágenes en fase, es diagnóstico de lesión maligna. Por el contrario, una pérdida de señal de más de 20% en las imágenes de fase opuesta en comparación con las imágenes en fase es diagnóstico de lesión benigna18-20.
- -
Imágenes potenciadas en difusión (DW): esta secuencia evalúa la difusión del agua de los tejidos. Los tejidos con mayor celularidad presentan mayor cantidad de membranas intra e intercelulares (es decir, barreras de difusión) y, por lo tanto, mayor restricción de la difusión (hiperseñal) y valores de coeficiente de difusión aparente (CDA) reducidos (hiposeñal). La utilidad de la difusión para diferenciar lesiones benignas de metastásicas en la columna es controvertida, pero, en general, se considera que la evaluación cuantitativa del CDA en los cuerpos vertebrales es un parámetro objetivo y comparable para diferenciar el tejido vertebral maligno del benigno21,22. Además, la secuencia de difusión puede demostrar respuesta al tratamiento. Esta última reduce la celularidad de la lesión y por lo tanto existe menor restricción de la difusión (menor hiperseñal que pretratamiento) y aumento de los valores de CDA23.
- -
Secuencias con contraste intravenoso: son secuencias potenciadas en T1, produciendo hiperseñal en aquellos tejidos vascularizados, como las metástasis líticas. El patrón de realce es variable en las metástasis esclerosas. Se requiere de técnicas de saturación de la grasa para aumentar la visibilidad de las lesiones realzadas, ya que la médula ósea normal es hiperintensa en T1, al igual que las lesiones captantes. La administración de contraste también es muy útil para valorar el componente de partes blandas epidural, el tumor puede diseminarse al espacio epidural anterior sin afectar el ligamento meningovertebral, lo que da como resultado el «signo de la cortina drapeada»1.
- -
RM de cuerpo entero: se usan secuencias potenciadas en T1 y STIR, permitiendo obtener imágenes de todo el cuerpo, que se fusionan en el eje craneocaudal. Representa una nueva alternativa para la detección de enfermedad metastásica, mieloma múltiple y linfoma óseo24.
Comportamiento en señal de la médula ósea (MO) grasa, del edema benigno y de las metástasis (MX) líticas y blásticas en las diferentes secuencias de RM, permitiendo el diagnóstico diferencial entre las mismas
ADC: coeficiente de difusión aparente; STIR: Short Tau Inversion Recovery; RM: resonancia magnética.
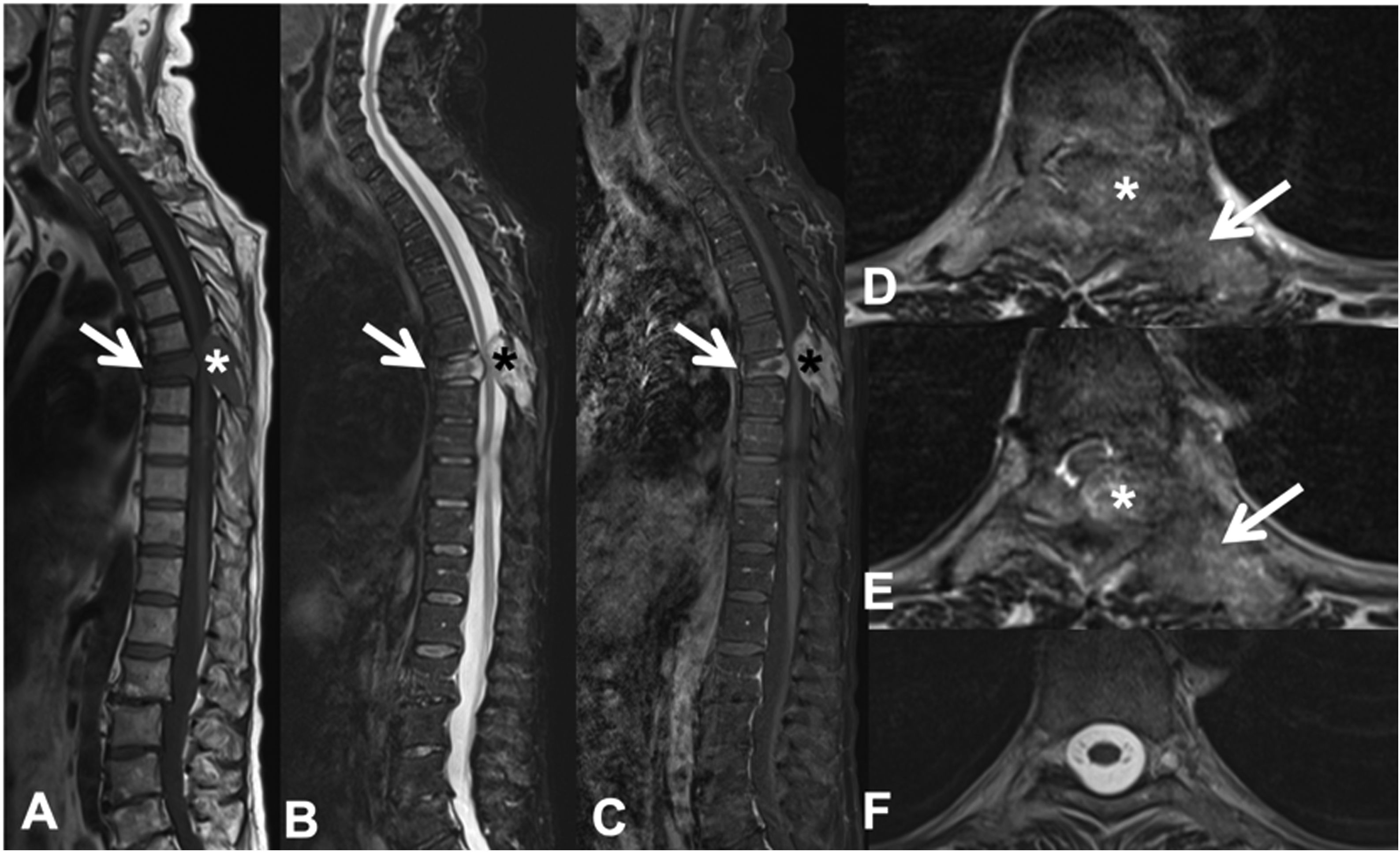
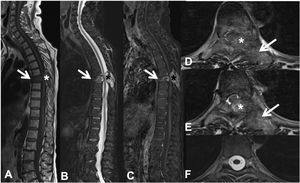
Fractura patológica dorsal en T7 por metástasis de carcinoma de pulmón. RM dorsolumbar con contraste intravenoso. A: secuencia T1 en el plano sagital, donde existe fractura patológica de T7 con abombamiento del muro posterior y señal hipointensa, afectación del arco posterior (flecha) y masa epidural (asterisco); B: secuencia sagital T2 con metástasis hiperintensa; C: secuencia T1 con gadolinio intravenoso y supresión de grasa, la metástasis capta contraste; D y E: secuencia T2 axial con afectación del arco posterior vertebral (flecha) y componente de partes blandas epidural que produce compresión medular (asterisco); F: secuencia T2 axial en corte normal, sin compresión del parénquima medular.
RM: resonancia magnética
El diagnóstico diferencial por imagen de la metástasis del cuerpo vertebral incluiría hemangioma benigno, cambios discogénicos en los platillos vertebrales y discitis-osteomielitis. Los hemangiomas vertebrales suelen ser tumores vasculares benignos bien delimitados, hiperintensos en T1 y de señal variable en STIR, dependiendo de la proporción de elementos grasos y vasculares, y asocian captación de contraste, presentan trabéculas verticales gruesas que asemejan al panal de las RX y TC. Los cambios discogénicos de los platillos vertebrales suelen aparecer a ambos lados del disco. La hernia de disco intravertebral aguda o el nódulo de Schmorl presenta señal de edema (hiposeñal en T1 e hiperseñal en T2/STIR). En la discitis-osteomielitis, hay edema y erosiones de los platillos vertebrales con líquido intradiscal y realce parcheado. Las metástasis óseas normalmente no cruzan el espacio discal de un cuerpo vertebral al siguiente1.
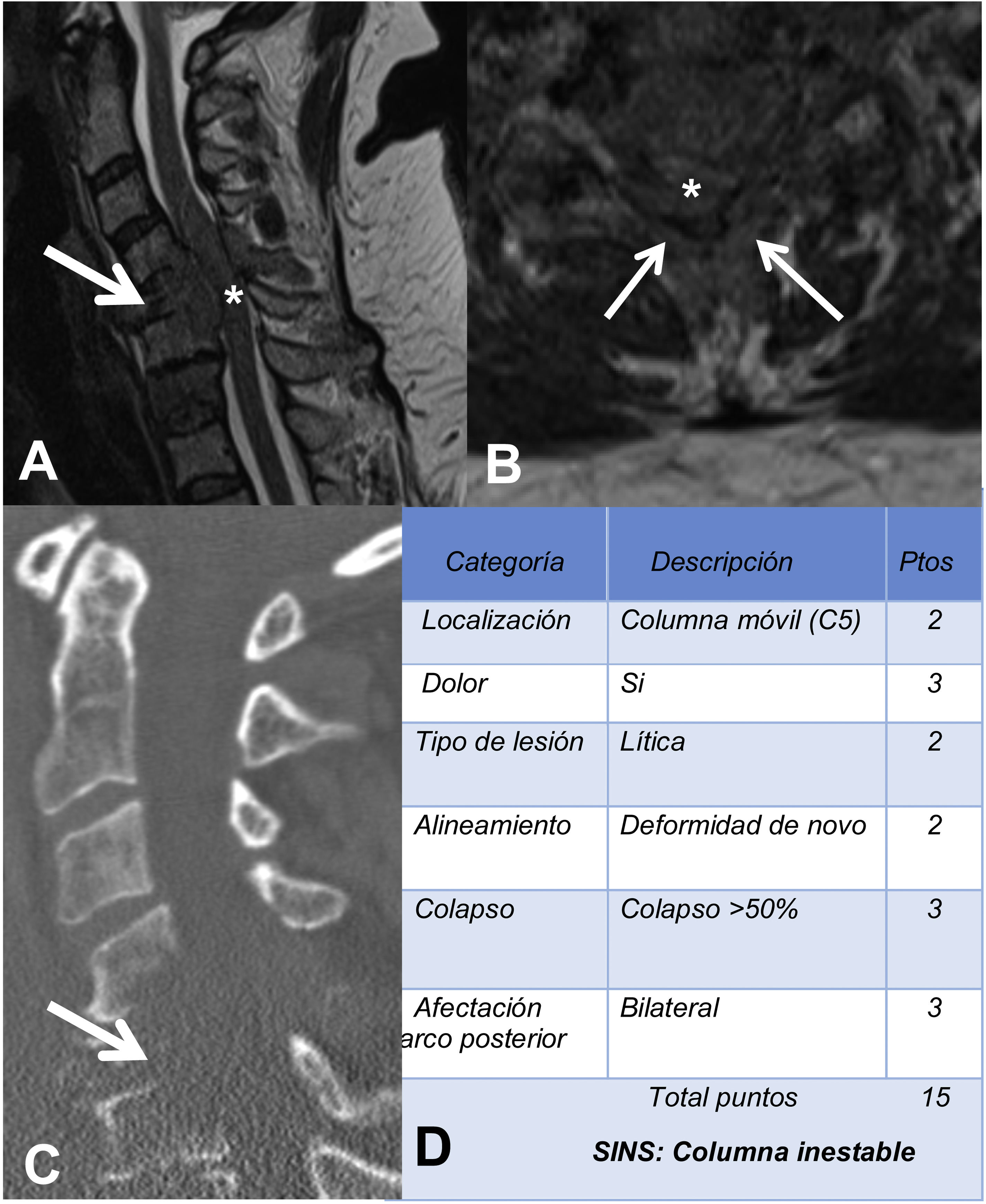
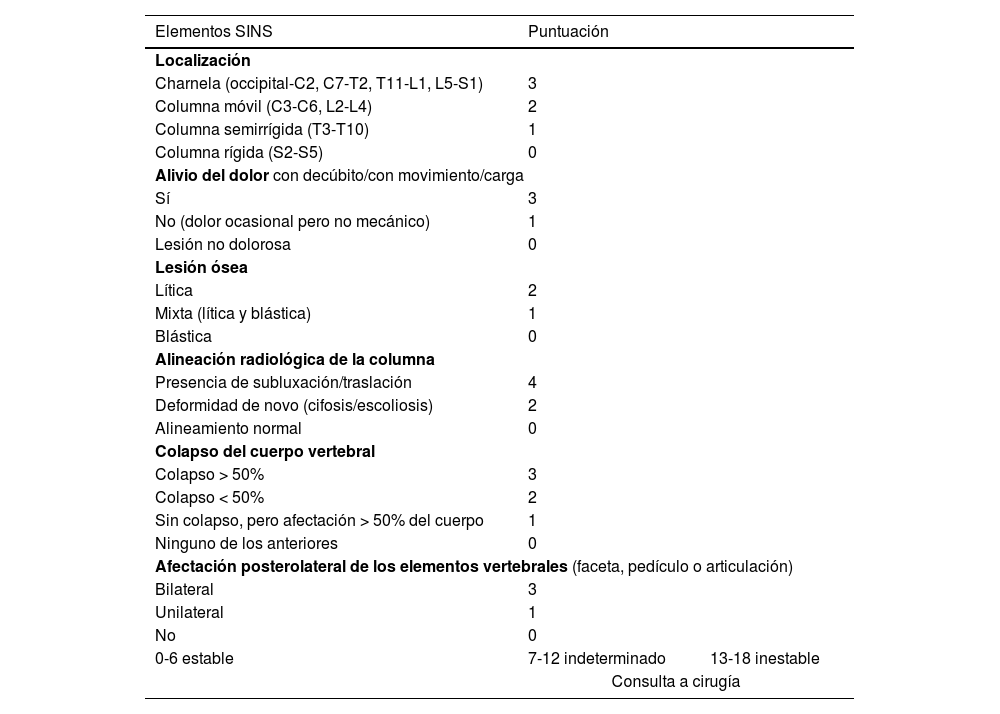
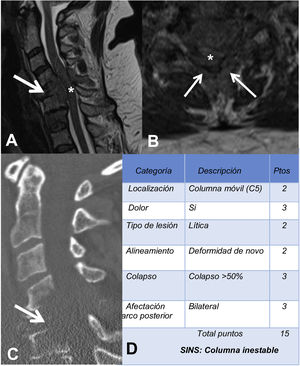
La RM sirve para valorar la posible compresión radicular o medular debida a la fractura del cuerpo vertebral o por componente de partes blandas epidural. El sistema de estadiaje de inestabilidad neoplásica de la columna, Spine Inestability Neoplastic Score (SINS) sirve para determinar la estabilidad de una fractura patológica y es muy útil para la toma de decisiones quirúrgicas. La inestabilidad mecánica es una indicación de estabilización quirúrgica o tratamiento percutáneo con cemento, independientemente de las valoraciones neurológicas u oncológicas. La determinación de la misma se basa casi completamente en imágenes. Esta clasificación es vital para prevenir las consecuencias catastróficas de la inestabilidad en el contexto de la enfermedad metastásica: dolor intenso, pérdida de la función o paresia. SINS califica la estabilidad de la columna sumando cinco componentes radiográficos y uno clínico para crear una puntuación total que va de 0 a 18. Las cinco características radiológicas incluyen la localización de la metástasis en la columna, la alineación de esta, la calidad de la lesión (lítica, esclerosa, o mixta), el grado de afectación y colapso del cuerpo vertebral y la afectación de los elementos posteriores. La única característica de inestabilidad clínica es la presencia de dolor relacionado con el movimiento. Una puntuación SINS alta (de 13 a 18) indica la necesidad de una intervención quirúrgica urgente. La categoría indeterminada (una puntuación de 7 a 12), indica consulta quirúrgica lo más rápido posible. Una puntuación de 1 a 6 sugiere que la columna es estable25 (tabla 3 y fig. 6).
Elementos y puntuación del sistema de estadiaje de inestabilidad neoplásica de la columna (SINS)
| Elementos SINS | Puntuación | |
|---|---|---|
| Localización | ||
| Charnela (occipital-C2, C7-T2, T11-L1, L5-S1) | 3 | |
| Columna móvil (C3-C6, L2-L4) | 2 | |
| Columna semirrígida (T3-T10) | 1 | |
| Columna rígida (S2-S5) | 0 | |
| Alivio del dolor con decúbito/con movimiento/carga | ||
| Sí | 3 | |
| No (dolor ocasional pero no mecánico) | 1 | |
| Lesión no dolorosa | 0 | |
| Lesión ósea | ||
| Lítica | 2 | |
| Mixta (lítica y blástica) | 1 | |
| Blástica | 0 | |
| Alineación radiológica de la columna | ||
| Presencia de subluxación/traslación | 4 | |
| Deformidad de novo (cifosis/escoliosis) | 2 | |
| Alineamiento normal | 0 | |
| Colapso del cuerpo vertebral | ||
| Colapso > 50% | 3 | |
| Colapso < 50% | 2 | |
| Sin colapso, pero afectación > 50% del cuerpo | 1 | |
| Ninguno de los anteriores | 0 | |
| Afectación posterolateral de los elementos vertebrales (faceta, pedículo o articulación) | ||
| Bilateral | 3 | |
| Unilateral | 1 | |
| No | 0 | |
| 0-6 estable | 7-12 indeterminado | 13-18 inestable |
| Consulta a cirugía | ||
Ejemplo de sistema de estadiaje de inestabilidad neoplásica de la columna (SINS). A y B: RM potenciada en T2 con corte sagital y axial de columna cervical, con fractura patológica metastásica de C5 con afectación del cuerpo y arco posterior (flecha) y masa epidural (asterisco), que produce compresión medular; C: TC de columna cervical con reconstrucción sagital, donde se evidencia que la metástasis es lítica; D: tabla de categoría, descripción y puntuación de la lesión.
RM: resonancia magnética; TC: tomografía computarizada.
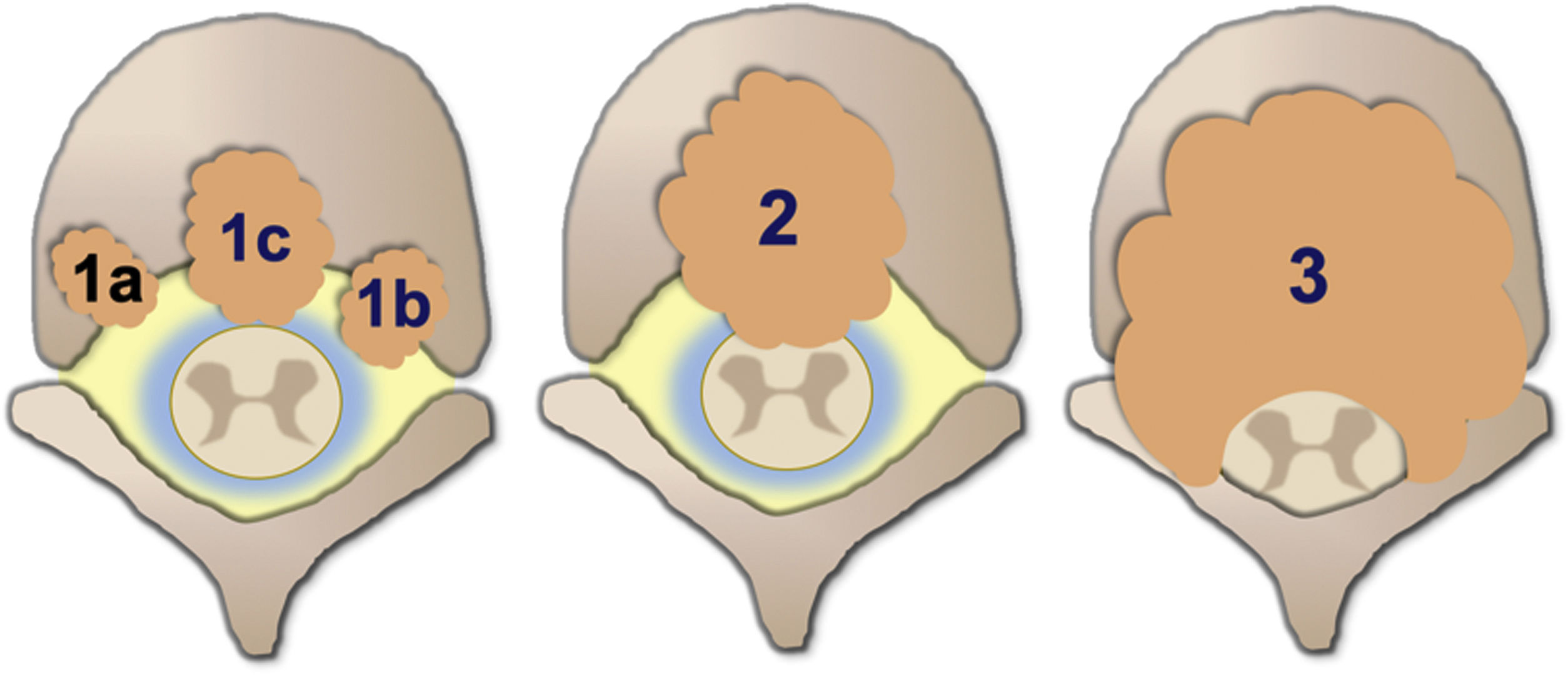
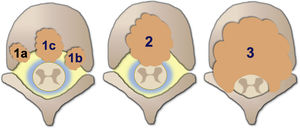
El grado de compresión medular se mide con la escala de compresión epidural de la columna Epidural Spinal Cord Compression Scale (ESCC) de Bilsky et al.26. La ESCC se divide en bajo grado (0 y 1) y alto grado (2 y 3). Los grados son:
Grado 0: solo enfermedad ósea.
Grado 1 a: afectación epidural sin deformación del saco tecal.
Grado 1 b: deformación del saco tecal sin contacto con la médula.
Grado 1 c: deformación del saco tecal con contacto con la médula.
Grado 2: compresión de la médula, con preservación de algo de LCR alrededor.
Grado 3: compresión de la médula, con borramiento completo del LCR.
Las consideraciones neurológicas se centran en el grado de compresión de la médula espinal. El ESCC se usa junto con la evaluación clínica de mielopatía y/o radiculopatía para las decisiones de tratamiento. La clasificación se realiza en imágenes axiales potenciadas en T2, en el lugar de compresión más severa. Si la columna está estable, se considera la radiación para la terapia inicial de la compresión de bajo grado (ESCC grados 0, 1 a, 1 b, 1 c). La compresión de alto grado (grados 2 y 3) requiere una mínima descompresión quirúrgica inicial del espacio epidural, a menos que el tumor sea muy radiosensible o el paciente no tolere la cirugía (fig. 7).
Esquema ilustrativo de los grados de compresión medular con la escala de compresión epidural de la columna (ESCC) de Bilsky et al.26.
La medicina nuclear emplea técnicas de imagen que aportan información funcional sobre la actividad de las células tumorales o metastásicas, mediante la detección de la radiación emitida por los radiotrazadores27,28.
Los radiotrazadores más utilizados para la detección de metástasis vertebrales pueden clasificarse en: agentes osteotrópicos, que detectan la actividad osteoblástica, como el 99mTC-difosfonato de metileno (99mTc-DMP) y el 18F-fluoruro de sodio (18F-NaF); y agentes oncotrópicos, que detectan la actividad metabólica de las células tumorales, como el 18F- fluorodesoxiglucosa (18F-FDG)28.
El 99mTc-DMP es el más usado debido a su efectividad, bajo coste, amplia disponibilidad y dosimetría favorable29. Por otro lado, el 18F-FDG es un radiotrazador empleado de forma generalizada para la detección de lesiones tumorales y metastásicas28-30.
Las técnicas de imagen disponibles son la GO, la SPECT y PET.
La GO sigue siendo la técnica de medicina nuclear más usada para la detección de las metástasis óseas debido a su amplia disponibilidad y bajo coste30,31. Mediante el empleo de 99mTc-DMP, detecta depósitos óseos metastásicos a través del aumento de la actividad osteoblástica, es un marcador indirecto de un proceso oncológico. Por esta razón, se considera la modalidad más eficiente para la detección de metástasis en todo el cuerpo29. Es una técnica muy sensible, que permite la detección temprana de metástasis óseas28. Sin embargo, presenta una baja especificidad, pudiendo conducir a falsos positivos, como lesiones traumáticas e infecciosas27,29. También puede dar lugar a falsos negativos, ya que es poco sensible para identificar lesiones puramente osteolíticas, cuando el recambio óseo es lento o la lesión es avascular29,30,6.
La SPECT detecta actividad osteoblástica utilizando el 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD). Pero a diferencia de la GO, las imágenes se adquieren en tres dimensiones28.
La PET permite adquirir imágenes de la actividad celular mediante la detección de radiación emitida durante la desintegración de positrones. Los radiotrazadores emisores de positrones más empleados para la detección de metástasis óseas son el 18F-NaF o el 18F-FDG28. La PET con 18F-FDG resulta más útil a la hora de distinguir entre lesiones óseas benignas y malignas27,30. Al contrario que la GO con 99mTc- DMP es mucho más sensible para la identificación de lesiones líticas y metástasis medulares, ofrece una resolución espacial superior, mientras que las metástasis blásticas muestran una actividad metabólica más baja y, con frecuencia, no son detectables27,30.
El desarrollo de técnicas híbridas como el SPECT/TC, PET/TC o PET/RM ha permitido fusionar la información funcional de la medicina nuclear con los datos anatómicos proporcionados por técnicas de imagen como la TC o la RM. Así, la confianza diagnóstica aumenta cuando la lesión ósea sospechosa de metástasis acumule radiotrazador28.
La PET es la técnica de medicina nuclear que tiene la mejor sensibilidad6. Además, las técnicas híbridas de PET con TC y RM presentan mayor precisión diagnóstica que únicamente la PET28,31.
En resumen, las técnicas de medicina nuclear son imprescindibles para valorar la actividad de las metástasis vertebrales y presentan una mayor precisión diagnóstica cuando se combinan con la TC y la RM.
Tratamiento percutáneoEl tratamiento percutáneo de las metástasis vertebrales generalmente tiene una intención paliativa, se podría considerar como una opción terapéutica enfocada en el manejo del dolor y únicamente en pacientes seleccionados15,32,33.
El dolor producido por las metástasis vertebrales es complejo. Se presenta en tres escenarios: el primero es el dolor localizado, resultado de la afectación perióstica por la expansión del tumor, el segundo es el dolor radicular, causado por compresión o infiltración de la raíz nerviosa, y el tercero es el dolor axial, asociado con inestabilidad mecánica o fractura patológica del cuerpo vertebral34. Los procedimientos de aumento de la altura vertebral se centran en el manejo del dolor axial o de fracturas patológicas tratadas con radioterapia o con inadecuada respuesta a tratamientos sistémicos y/o analgesia.
Se disponen de varias técnicas, una de las más utilizadas es la cementoplastia u osteoplastia percutánea. Se refiere a la inyección de polimetilmetacrilato (PMMA) en el cuerpo vertebral, en el contexto de una fractura patológica o para prevenir las mismas, favorece la consolidación del hueso dañado y disminuye significativamente el dolor del paciente. La polimerización del PMMA produce una reacción exotérmica transitoria (hasta 80°C), ese aumento de temperatura no resulta en necrosis tumoral en la interfaz hueso-PMMA, por lo que, de forma aislada, no tiene intención curativa32,35,15. Su principal indicación es el manejo del dolor en pacientes con afectación metastásica vertebral, sin extensión al espacio epidural. También se puede realizar en combinación con otras técnicas, como podrían ser las ablativas o la misma radioterapia34,36.
En pacientes seleccionados con oligometástasis y enfermedad ósea limitada, se puede plantear tratamiento curativo. A diferencia del paliativo, los márgenes de ablación en el tratamiento curativo deben extenderse más allá de los del tumor, siempre y cuando no comprometan estructuras vitales32,15. Las técnicas de ablación tumoral consisten en la aplicación directa de agentes físicos o químicos para la destrucción local del tumor en el cuerpo vertebral, entre ellas están la ablación mediante instilación de alcohol y diferentes métodos de termoablación, como la radiofrecuencia, la crioablación, microondas y ultrasonido32,35,15. Este tipo de procedimientos produce debilidad del hueso residual, apareciendo fragilidad y riesgo de fractura, por lo que se suele complementar con cementoplastia u osteoplastia22.
Otro procedimiento de utilidad es la embolización transarterial. Su objetivo es disminuir la vascularización de las metástasis, siendo lo más selectivo posible. Su indicación es minimizar el riesgo de sangrado a la hora de resecar metástasis hipervasculares mediante técnicas quirúrgicas y también disminuir el dolor y el riesgo de sangrado espontáneo en pacientes no aptos para tratamiento quirúrgico37.
Para evaluar la respuesta al tratamiento, se recomiendan escalas de dolor o scores de medición de la calidad de vida. No es necesario el seguimiento por imagen en pacientes con enfermedad metastásica difusa, que han recibido tratamiento paliativo, salvo si aparecen nuevos síntomas. Sin embargo, en aquellos con enfermedad oligometastásica tratados con intención curativa, se recomienda seguimiento para controlar la respuesta tumoral32,35,15.
ConclusionesLa RM es la mejor modalidad de imagen para la detección de metástasis vertebrales. Es importante hacer el diagnóstico diferencial entre fractura vertebral de causa osteoporótica y patológica. La compresión medular es una complicación grave de la enfermedad metastásica y su valoración por imagen a través de escalas objetivas es decisiva para estimar la estabilidad raquídea y, por tanto, para establecer el tratamiento.
Nivel de evidenciaNivel de evidencia I.
FinanciaciónNo se ha obtenido ninguna financiación para este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.