La displasia del desarrollo de la cadera provoca cambios anatómicos que dan lugar a una coxartrosis precoz. La etiología y la patofisiología de la displasia de cadera no se conocen con exactitud, aunque se han determinado factores de riesgo. Se han establecido programas de despitaje neonatal clínicos y ecográficos que lleven a un diagnóstico precoz de esta afección. Un diagnóstico en los primeros meses de vida es fundamental porque permite obtener una cadera normal y evitar la aparición de una coxartrosis precoz. El tratamiento debe conseguir reducir la cadera, evitando la aparición de una necrosis avascular de la cabeza femoral, y normalizar el desarrollo del acetábulo. Existen opciones ortopédicas y quirúrgicas que deben ser conocidas para lograr un éxito en el tratamiento.
Developmental dysplasia of the hip (DDH) causes anatomical changes that cause early coxarthrosis. Although risf factors have been determined, the aetiology and physiopathology remains exactly unknown. Neonatal screening with physical examination and ultrasound have been stablished in order to diagnose this disease early in life. A diagnosis in the first months of life is essential as it enables a normal hip to form and prevent the appearance of early coxarthrosis. Treatment principles are to be able to reduce the hip without provoking avascular necrosis of the femoral head, and to normalize the acetabular development. Knowledge of the orthopaedic and surgical options is essential in order to achieve success in the treatment.
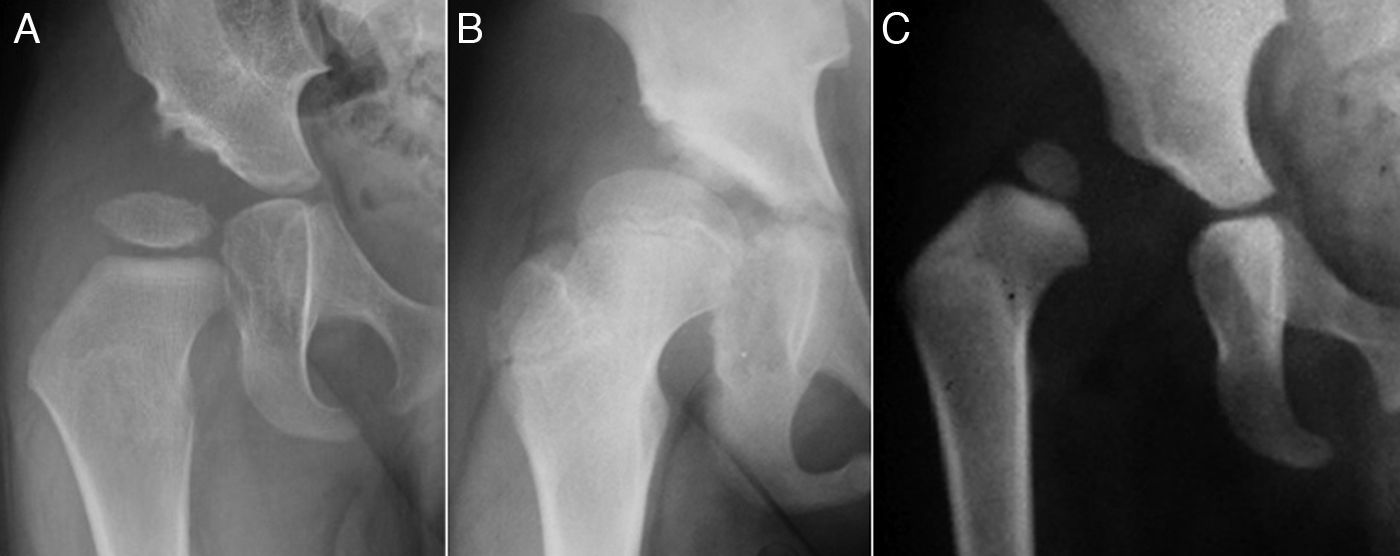
El término displasia del desarrollo de la cadera (DDC) incluye un amplio espectro de alteraciones del acetábulo y del fémur proximal, incluyendo la displasia aislada, la subluxación o la luxación de la cabeza femoral1–4 (fig. 1). En la displasia existe un desarrollo inadecuado del acetábulo, de la cabeza femoral o de ambos, aunque hay una relación concéntrica entre ambas superficies articulares. Sin embargo, en la cadera subluxada, aunque hay contacto entre las dos superficies articulares, la cabeza femoral no está centrada en la cavidad acetabular5. En el caso de la luxación, la cabeza femoral se encuentra completamente fuera del acetábulo6.
AnatomíaLa cadera normalLa cadera está formada por el acetábulo, la cabeza femoral y las partes blandas que comprenden la cápsula articular, el labrum, el ligamento teres o redondo y el tejido pulvinar. El acetábulo es una cavidad hemisférica formada por el cartílago acetabular, el cartílago trirradiado, el isquion y el ilion. El cartílago acetabular se continúa medialmente con el cartílago trirradiado y forman conjuntamente el complejo cartilaginoso acetabular7. Ambos separan el ilion, el isquion y el pubis. El cartílago acetabular forma los 2 tercios externos; mientras que el cartílago trirradiado, el ilion y el isquion forman el tercio medial no articular. El cartílago trirradiado es el responsable del crecimiento del acetábulo y del hueso innominado, manteniendo la relación con el crecimiento de la cabeza femoral8. La concavidad del acetábulo se desarrolla por la presencia de la cabeza femoral convexa9.
En el interior del acetábulo encontramos el pulvinar, tejido fibroadiposo que cubre su parte no articular7. El ligamento redondo (ligamentum teres) une la cabeza femoral al fondo acetabular. En la periferia del acetábulo se implanta el labrum, un fibrocartílago de forma triangular y disposición circunferencial que incrementa la profundidad del acetábulo2. El tamaño relativo del labrum respecto a la cabeza femoral es mayor en la infancia que en la vida adulta, lo cual refleja la importancia del labrum en la estabilidad de la cadera pediátrica2. El labrum se dispone en toda la periferia del acetábulo excepto en la región inferior, donde se encuentra el ligamento transverso. La cápsula articular se inserta en la cara externa del hueso ilíaco, inmediatamente adyacente al labrum.
Por su parte, el fémur proximal está formado al nacimiento solo por cartílago. Un istmo cartilaginoso conecta a lo largo del borde lateral del cuello femoral, las placas de crecimiento femoral y trocantérica. El centro de osificación de la cabeza femoral aparece aproximadamente a los 6 meses de edad, mientras que el centro de osificación del trocánter mayor lo hace a los 5-6 años de edad. Existe una anteversión femoral al nacer que disminuye con el crecimiento. Se ha descrito una anteversión femoral media de 31° al año de vida, que pasa a ser de 15° a los 16 años de edad10. El ángulo cervicodiafisaro también disminuye con la edad, pasando de un valor medio de 136° al año de vida, a un valor medio de 127° a los 18 años de edad4.
La cadera displásicaEn la cadera displásica se producen cambios de magnitud variable, tanto en el acetábulo como en el fémur proximal y en las partes blandas. Las modificaciones ocurren con el tiempo, debido a la edad y a la carga, y conllevan cambios adaptativos en la articulación. Existe un aplanamiento del acetábulo con un aumento del grosor de su suelo óseo. La grasa pulvinar, el ligamento teres, el labrum y la cápsula articular se hipertrofian; y el ligamento transverso se invierte3. La presión anormal de la cabeza femoral luxada o subluxada sobre el labrum provoca una hipertrofia del fibrocartílago y forma tejido fibroso. Este labrum voluminoso se denomina limbus y suele estar evertido y adherido a la cara interna de la cápsula articular3. El labrum también puede estar invertido en una cadera luxada e impedir su reducción.
En algunos casos aparece una cresta en la parte posterosuperior del cartílago articular que se denomina neolimbus y que está formado por un engrosamiento del cartílago hialino acetabular3. El neolimbus surge en respuesta a la presión excéntrica de la cabeza femoral y separa 2 cavidades: la parte más interna corresponde al acetábulo primario, mientras que la parte externa forma parte del llamado acetábulo secundario. Mientras que el acetábulo primario es hipoplásico debido a la ausencia del estímulo de la cabeza femoral9; el acetábulo secundario, formado por el cuadrante posterosuperior del acetábulo, el labrum evertido y la cápsula articular, acoge a la cabeza femoral subluxada3. El neolimbus no es un obstáculo para la reducción y desaparece espontáneamente una vez se haya reducido la cadera.
Respecto al fémur proximal, existe en la displasia de cadera un acortamiento del cuello femoral, una deformidad de la cabeza y un retraso en la aparición del núcleo de osificación secundario11. Aunque la existencia de coxa valga está ampliamente aceptada, algunos autores afirman que ocurre exactamente lo contrario y que el fémur proximal adopta una disposición en varo y no en valgo11. También existe controversia acerca de la presencia o no de una anteversion femoral incrementada12.
EtiologíaPara que ocurra un desarrollo adecuado de la cadera es preciso que la cabeza femoral se encuentre correctamente centrada en el acetábulo y que exista un equilibrio entre el crecimiento de los cartílagos trirradiado y acetabular8,9. Cualquier alteración en este equilibrio, ya sea en el periodo intrauterino o en el posnatal, conducirá a un desarrollo alterado de la cadera9. Dada la poca incidencia de la DDC en fetos abortados antes de la semana 2013, cabe pensar que los problemas ocurran en los últimos meses del embarazo.
La etiología de la displasia del desarrollo de la cadera es multifactorial y se han relacionado factores hormonales, mecánicos y genéticos. La «teoría hormonal» se basa en la influencia que las hormonas sexuales tienen sobre el tejido conectivo de la cápsula articular. Los estrógenos inhiben la síntesis de colágeno y favorecen el entrecruzamiento de sus fibras y la formación de elastina14. Experimentalmente, se ha demostrado como la administración de estrógenos disminuye el contenido de colágeno en la cápsula articular de la cadera, mientras que la progesterona lo incrementa14. Se puede concluir que los estrógenos dificultan la luxación de la cadera, mientras que la progesterona la facilita15. Existe una laxitud articular hormonal en la última parte del embarazo que convierte a este periodo en la etapa fundamental de la teoría endocrinológica15. Sin embargo, no ha podido asociarse la presencia de la DDC con cambios en la concentración de estrógenos en orina, la concertación sérica de beta-estradiol, o la concentración de relaxina en suero o en sangre de cordón umbilical16.
La «teoría mecánica» sostiene que fuerzas persistentemente aplicadas pueden originar una deformidad que ocurre con mayor facilidad en periodos de crecimiento. El feto, por su alta tasa de crecimiento y por su relativa plasticidad, es muy vulnerable a la deformidad13. Las fuerzas deformantes pueden estar provocadas por la musculatura abdominal o uterina; por una postura mantenida, sobre todo en flexión de caderas y extensión de rodillas; o por una disminución del espacio libre para el feto, bien porque el feto sea grande o porque el volumen de líquido amniótico esté disminuido3,13,14.
Factores genéticosAunque no se han realizado estudios adecuados sobre los factores genéticos en la DDC, la concentración familiar de casos descrita en la literatura sugiere una susceptibilidad genética. Se ha descrito un riesgo relativo de 12,1 en familiares de primer grado y de 1,74 en familiares de segundo grado17. Existe una concordancia entre gemelos monocigoticos del 43% que pasa a ser del 3% en el caso de los gemelos dicigóticos. Al margen de la agrupación familiar, la incidencia de la DDC en mujeres duplica a los varones17, lo que puede explicarse, parcialmente, por una susceptibilidad genética, además de por un ambiente hormonal favorecedor o una mayor incidencia de presentación de nalgas. Estos datos ponen de manifiesto la contribución de factores genéticos en la etiología de la enfermedad.
Aunque se desconoce la etiopatogenia exacta de la DDC, se conocen algunos factores de riesgo (tabla 1). Hay factores relacionados con problemas de espacio para el feto, la presencia de oligohidramnios y sus diferentes causas (HTA, síndrome de Potter, etc.)13; un embarazo múltiple o una madre con talla baja. Otros factores están relacionados con un aumento de las fuerzas deformantes: la presentación de nalgas, por la postura mantenida de extensión de rodillas y flexión de caderas18; ser primogénito, puesto que la distensión del útero y la pared abdominal es menor en el primer embarazo13; la cadera izquierda, debido a que la posición intraútero más frecuente es con aducción del miembro inferior izquierdo contra el coxis13; y la presencia de hiperlaxitud ligamentosa. Otros factores de riesgo son el sexo femenino, debido probablemente a un ambiente hormonal favorecedor y a una mayor incidencia de la presentación de nalgas17,18; y los antecedentes familiares de displasia de cadera, consecuencia de una susceptibilidad genética17,18.
Factores de riesgo de la displasia del desarrollo de la cadera
| 1. Presentación de nalgas2. Antecedentes familiares3. Sexo femenino4. Primogénito5. Oligohidramnios6. Elevado peso al nacimiento7. Embarazo múltiple8. Madre de talla baja9. Cadera izquierda10. Hiperlaxitud ligamentosa11. Deformidad del miembro inferior12. Tortícolis13. Pie zambo |
Aunque parece clara la asociación de la DDC con la presencia de tortícolis13, existe controversia en el momento actual respecto a la asociación de la DDC con la presencia de deformidades como el pie zambo o el metatarso aducto19. También se ha discutido la asociación de la DDC con un elevado peso al nacimiento18.
Los factores de riesgo más importantes relacionados con la presencia de alteraciones en la ecografía al nacimiento son la presentación podálica, los antecedentes familiares de la DDC y el género femenino20.
Sin embargo, la mayoría de los niños con DDC no presentan factores de riesgo21 y la mayoría que precisan tratamiento tampoco presentan factores de riesgo20.
Historia naturalEl término DDC abarca un espectro de alteraciones: inestabilidad de cadera, displasia acetabular, subluxación o luxación de la cadera1. La displasia de cadera provoca una inestabilidad de la misma en los primeros meses de vida, que se pone de manifiesto con las maniobras de Barlow o de Ortolani. Se ha descrito una prevalencia de inestabilidad neonatal de cadera del 1-1,5% en los recién nacidos vivos22, y una incidencia de 5 por cada 1.000 varones nacidos vivos y 13 por cada 1.000 mujeres nacidas vivas22.
La mayoría de las caderas inestables en el periodo neonatal se resuelven espontáneamente en las primeras semanas de vida23. Esta resolución espontánea parece ser consecuencia del aumento del tono muscular o de la disminución en la cantidad de relaxina. De hecho, solo el 1,2% de las inestabilidades de cadera neonatal precisan tratamiento24. También se ha demostrado claramente como la mayoría de las alteraciones ecográficas presentes en los primeros días de vida, lo que ocurre en el 6,6% de las caderas exploradas, se resuelven espontáneamente20. Los casos no resueltos espontáneamente son considerados como displasias persistentes. Se ha descrito una tasa de evidencia ecográfica de displasia de cadera persistente a las 6 semanas de vida (y por lo tanto, de necesidad de tratamiento) de 3 por cada 1.000 niños nacidos vivos20 y una tasa de evidencia radiológica de displasia de cadera persistente a los 5 meses de vida de 1,5 por cada 1.000 niños nacidos vivos25.
La displasia persistente del desarrollo de la cadera no tratada conlleva una serie de alteraciones anatómicas que modifican la biomecánica articular, incrementando la tensión sobre una menor área de contacto6. Elevadas presiones articulares mantenidas durante periodos prolongados de tiempo, provocan una degeneración del cartílago articular y conducen a una coxartrosis temprana. La DDC es la causa del 2,6-9,1% de todas la prótesis totales de cadera implantadas a cualquier edad26,27, y el origen más frecuente en pacientes jóvenes (21-29%)22,27. La presencia de subluxación ha demostrado ser el factor más importante, puesto que lleva casi invariablemente al desarrollo de coxartrosis28. La historia natural de la displasia acetabular en ausencia de subluxación es difícil de predecir puesto que desconocemos su incidencia real. Aun así, existe una clara asociación de la displasia acetabular con la coxartrosis22. En los casos de luxación completa, la presencia de un acetábulo secundario es el factor fundamental para el desarrollo de la coxartrosis28. La mayoría de los pacientes que no presentan un acetábulo secundario mantienen un buen rango de movilidad con poca incapacidad funcional. Se desconoce la razón por la cual algunas luxaciones completas desarrollan el acetábulo secundario y otras no. La inestabilidad de la cadera neonatal se asocia con un riesgo 2,6 veces mayor de prótesis de cadera en la etapa adulta joven comparado con las caderas estables al nacimiento22.Los resultados de las escalas de valoración de la cadera son buenos hasta que aparecen cambios degenerativos en la articulación28.
Al margen de la aparición de coxartrosis, los pacientes con una luxación completa unilateral desarrollan una discrepancia de longitud de los miembros inferiores, una marcha inestable, escoliosis postural, deformidad de la cadera en flexión y aducción, y deformidad en valgo de la rodilla ipsilateral que puede provocar dolor y dar lugar al desarrollo de gonartrosis28. Los pacientes con una luxación bilateral desarrollan una hiperlordosis lumbar y una marcha alterada. Existe también una limitación de la abducción de la cadera. Los resultados funcionales de los pacientes con una luxación unilateral o bilateral son parecidas28. No existe asociación entre la altura de la luxación y el resultado de la escala de valoración de la cadera, el desarrollo de un acetábulo secundario, el dolor de espalda o los problemas en la rodilla ipsilateral28.
DiagnósticoEl éxito en el tratamiento de la displasia de cadera implica una reducción anatómica de la articulación y la restauración del crecimiento y el desarrollo normal del acetábulo5. Según avanza la edad del niño, la reducción se dificulta y disminuye el potencial del acetábulo para recuperar su crecimiento, reduciendo por lo tanto, las probabilidades de éxito29. El tratamiento en los primeros meses de vida es fácil y tiene muy buen pronóstico, lo que convierte al diagnóstico precoz en un elemento fundamental en el tratamiento de la DDC.
Inestabilidad de cadera en la etapa neonatalEl diagnóstico precoz se basa en la demostración de una cadera inestable con las maniobras de Barlow y Ortolani23,30. La maniobra de Barlow, consitente en abducir la cadera y empujar hacia posterior para intentar luxar la cadera a posterior, demuestra la presencia de una cadera reducida pero luxable23; mientras que la maniobra de Ortolani, consistente en abducir la cadera y empujar en la zona del trocánter mayor hacia anterior, señala la presencia de una cadera luxada o subluxada, pero reductible30. La maniobra de Ortolani es el procedimiento más útil para detectar una inestabilidad30–33. Se ha establecido un cribado universal de la displasia de la cadera usando el examen clínico como parte del protocolo de exploración física del recién nacido. La precisión del examen clínico incrementa con la práctica, y aún siendo muy fiable en manos de un experto, puede no serlo tanto en manos de una persona inexperta o no especialista. Aunque se ha descrito una incidencia de inestabilidad de cadera neonatal de 5 por cada 1.000 varones nacidos vivos y 13 por cada 1.000 mujeres nacidas vivas22; la incidencia disminuye a uno de cada 2.000 niños nacidos vivos cuando el niño es explorado por un ortopeda infantil experimentado20. Además, el hallazgo aislado de un «clic» de cadera en un recién nacido no se considera patológico34. Por todo ello, se ha recomendado referir a la consulta de ortopedia infantil a todo paciente con una sospecha clínica o con factores de riesgo importantes (presentación podálica o antecedentes familiares).
Clínicamente, también puede observarse una dificultad en la abducción de las caderas. Hay que tener en cuenta, que aquellas caderas luxadas pero irreductibles (como, por ejemplo, las luxaciones teratológicas) no mostrarán una inestabilidad de la cadera en la exploración física, pero sí una dificultad en la abducción de la misma. Por lo tanto, además de las maniobras de Barlow y Ortolani, siempre ha de explorarse la abducción de la cadera.
Godward et al.35 estudiaron los niños menores de 5 años intervenidos quirúrgicamente por una DDC, y describieron como el cribado clínico no fue capaz de detectar la displasia en los primeros 3 meses de vida en el 70% de los casos. Además, se ha descrito que el 92% de los pacientes a los que se les ha implantado una prótesis de cadera como consecuencia de una displasia, no presentaron una inestabilidad de la cadera en la exploración neonatal22. Por lo tanto, se puede concluir que el despitaje clínico neonatal no funciona adecuadamente o que existe una displasia de cadera de aparición tardía que no está presente, al menos clínicamente, en la etapa neonatal. Se ha propuesto la ecografía universal como medio para mejorar la detección neonatal y disminuir la incidencia de diagnóstico tardío que existe con el examen clínico. Sin embargo, ensayos clínicos aleatorizados han demostrado que la ecografía no disminuye la incidencia de diagnóstico tardío36. El consenso actual es realizar una ecografía solamente en aquellos casos donde existan dudas con la exploración física o en los pacientes con factores de riesgo importantes37.
Exploración física tras la etapa neonatalLa prevalencia de inestabilidad de la cadera a la exploración física disminuye tras la primera semana de vida como consecuencia del aumento del tono muscular23. Sin embargo, a medida que el niño crece, incrementa la incidencia de asimetría en la abducción de las caderas25. Si bien la exploración física de la DDC en la etapa neonatal se basa en la demostración de una cadera inestable con las maniobras de Barlow y Ortolani, la limitación de la abducción es el signo clínico más importante en los niños mayores de 2-3 meses de edad, sobre todo si es unilateral38. Otro signo que pueden encontrarse en la exploración física es la discrepancia en la longitud de los miembros inferiores que se manifiesta en el signo de Galeazzi. La asimetría de los pliegues no es un signo muy fiable porque está presente en el 30% de los niños con caderas normales, y sin embargo, no esta presente en todos los niños con DDC1. Una vez iniciada la marcha, el paciente puede presentar cojera o hiperlordosis de la columna lumbar.
Diagnóstico por imagenEcografíaEn cuanto al diagnóstico por la imagen, los métodos más utilizados son la ecografía y la radiografía simple. La ecografía es útil en los primeros meses de vida. Graf39 describió un método de evaluación que se basa en la morfología de la cadera. Se calculan 2 ángulos: el angulo alfa, formado por el ilion y la línea que va desde el promontorio hasta el punto en el acetábulo sin sombra acústica y que corresponde al cartílago tirradiado; y el ángulo beta, formado por la línea que va desde el promontorio hasta la punta del labrum39. Según los hallazgos, clasificaba a las caderas en 4 grupos. Terjesen et al.25 proponen sin embargo, un método de evaluación dinámico que enfatiza la importancia de la inestabilidad y el porcentaje de cobertura de la cabeza. Se ha descrito que la valoración dinámica de la estabilidad de la cadera es la única técnica ecográfica que tiene una relación significativa con el resultado.
No está claro cual es la historia natural de los hallazgos encontrados en la ecografía y si los pacientes con hallazgos patológicos deben ser tratados. Hay que tener en cuenta que el 96% de los casos con alteraciones en la ecografía realizada durante la primera semana de vida se resuelven espontáneamente en las primeras 6 semanas20. Por ese motivo, se recomienda realizar el cribado ecográfico entre la tercera y la sexta semana de vida (tabla 2).
Errores frecuentes del tratamiento
| 1. Tratar una alteración ecográfica leve (cadera inmadura) encontrada en las primeras 2-3 semanas de vida2. Colocar mal un arnés de Pavlik3. Mantener un arnés de Pavlik en una cadera Ortolani-positiva que no se reduce en las primeras 2-3 semanas4. Colocar un arnés de Frejka en una cadera luxada o subluxada5. No realizar una artrografía para controlar una reducción cerrada o abierta6. Realizar osteotomías pélvicas o femorales para reducir una cadera7. No vigilar el desarrollo de la cadera hasta los 4 años de edad |
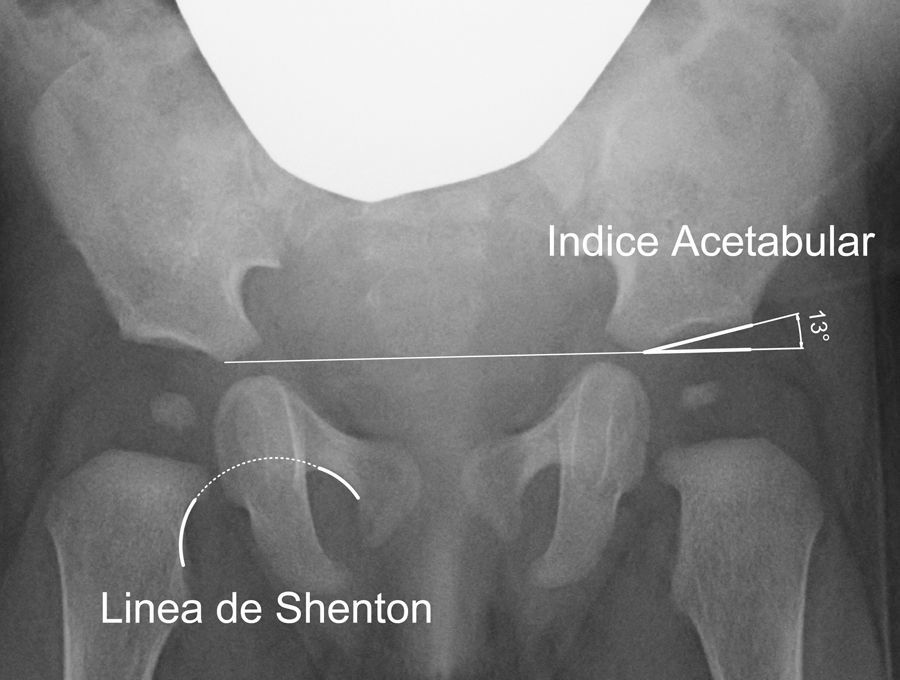
Sin embargo, cuando el núcleo de osificación está presente aparece una sombra acústica que oscurece las estructuras mediales y dificulta la valoración ecográfica de la cadera. La radiografía simple es considerada la prueba de imagen de elección en la DDC por encima de los 4 meses de edad34. Se han descrito una serie de medidas radiográficas para valorar la configuración anatómica del acetábulo: el índice acetabular, el ángulo acetabular de Sharp, el ángulo ACM y el grosor del suelo acetabular40.
El índice acetabular y el ángulo acetabular de Sharp reflejan la inclinación del techo acetabular; mientras que el ángulo ACM es útil para valorar la profundidad acetabular40. Estos ángulos ofrecen en el acetábulo displásico unos valores mayores a los valores normales correspondientes a cada edad, reflejando el aplanamiento del acetábulo29. Existe además un aumento del grosor del suelo acetabular en la DDC.
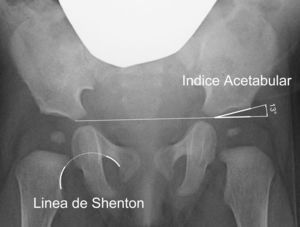
El índice acetabular que mide la oblicuidad del techo acetabular es la medida más utilizada para valorar la morfología acetabular, aunque su valor puede alterarse por la posición de la pelvis40 (fig. 2). El índice acetabular presenta un rango de valores considerados como normales. En general, se considera como normal los siguientes límites superiores: 30° en niños menores de un año; 25° en niños con una edad comprendida entre el año y los 3 años de edad; y 20° desde los 3 años de edad29. Algunos autores consideran patológico todo valor superior a 30°41. Sin embargo, el intervalo de confianza de la variación intraobservador es de ±6°; mientras que el intervalo de confianza de la variación interobservador es de ±5,5°42. Por ese motivo, se considera que la progresión del valor en una serie de radiografías tiene mas importancia que el valor absoluto de una medición aislada42,43.
El ángulo acetabular de Sharp también es útil para valorar la inclinación del techo acetabular40. Se utiliza en pacientes de mayor edad, cuando el cartílago trirradiado esta osificándose y no puede calcularse el índice acetabular.
Existen, además, otras medidas radiográficas que valoran la relación del fémur proximal y el acetábulo, como son la línea de Shenton, el ángulo centro-borde de Wiberg y la cobertura acetabular. La línea de Shenton es el arco formado por el borde inferior del cuello femoral y el borde superior del agujero obturador cuando la cadera se encuentra anatómicamente reducida (fig. 2). La línea de Shenton es la medida más ampliamente utilizada para valorar la relación entre el fémur proximal y el acetábulo, sobre todo a partir de los 2 años de vida40. El ángulo centro-borde de Wiberg refleja la cobertura de la cabeza femoral. En el adulto, los valores superiores a 25° son considerados normales, mientras que los valores inferiores a 20° se consideran patológicos. Sin embargo, entre los 3 y los 17 años de edad se consideran patológicos los valores inferiores a 15°44. El ángulo centro-borde de Wiberg presenta una gran variabilidad durante los primeros 3 años de vida debido a la dificultad para localizar el centro de la cabeza femoral44. En la subluxación de la cadera encontramos una línea de Shenton interrumpida y un ángulo centro-borde disminuido6. Por el contrario, la línea de Shenton está íntegra en la displasia acetabular, aunque el ángulo centro-borde está igualmente disminuido. En la luxación de cadera, la línea de Shenton queda interrumpida al estar la cabeza femoral luxada posterosuperiormente; mientras que no es posible calcular el ángulo centro-borde.
La clasificación de Severin evalúa la displasia acetabular, la deformidad de la cabeza femoral y la subluxación en una radiografía de la cadera en la madurez esquelética45. Esta clasificación tiene una buena correlación con el resultado a largo plazo radiológico, clínico y funcional de la cadera.
TratamientoEl éxito en el tratamiento implica lograr y mantener una reducción anatómica de la articulación y recuperar el desarrollo normal del acetábulo. El tratamiento de la DDC podría resumirse en los siguientes pasos (tabla 3):
- 1.
En primer lugar, hay que conseguir una reducción estable y concéntrica de la cadera evitando complicaciones como la necrosis avascular de la cabeza femoral.
- 2.
En segundo lugar, hay que vigilar con radiografías seriadas el desarrollo acetabular que ocurre tras reducir la cadera. El estímulo que supone la reducción anatómica y estable de la cabeza femoral puede normalizar el acetábulo46. Se ha descrito que la evolución del índice acetabular es el parámetro más fiable para predecir la presencia o no de displasia acetabular residual al final del crecimiento.
- 3.
En tercer lugar, es necesario realizar osteotomías pélvicas y/o femorales en aquellos casos con una displasia de cadera residual. Se considera que el potencial de crecimiento acetabular disminuye de manera importante a partir de los 4 años de edad y con ello la posibilidad de que simplemente la reducción de la cadera consiga normalizar el acetábulo29. Las osteotomías pélvicas se realizan a partir de los 3-4 años de edad con el objetivo de mejorar la configuración del acetábulo. Es un error relativamente frecuente realizar una osteotomía pélvica o femoral con la intención de reducir o estabilizar una cadera.
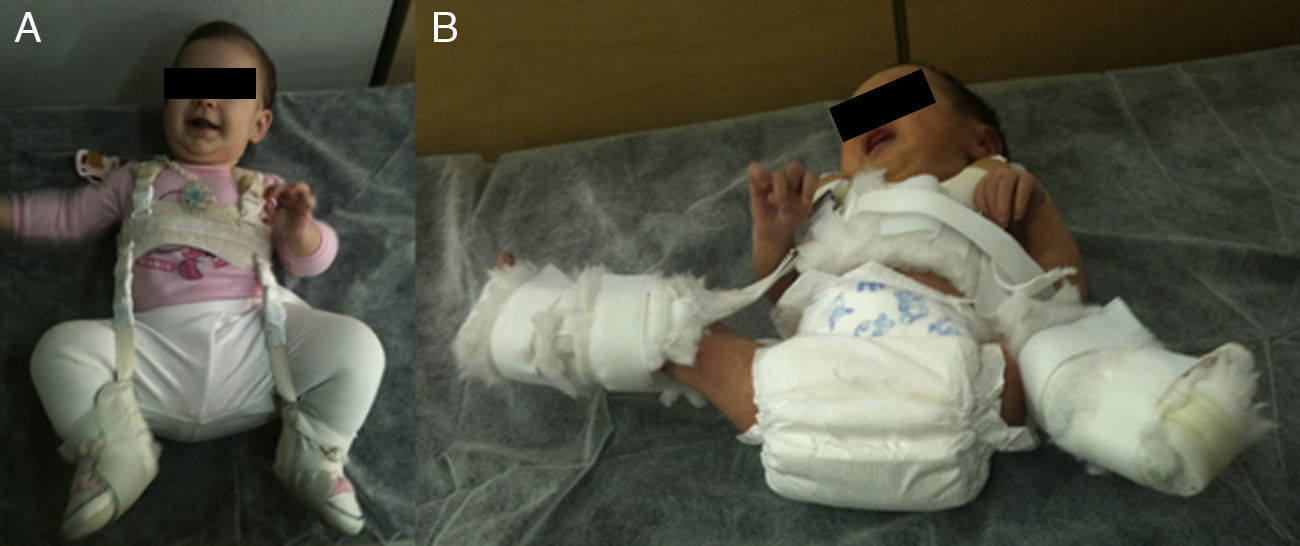
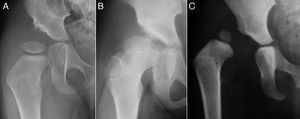
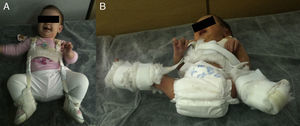
La reducción de la cadera es fácil durante los primeros meses de vida. Además, durante este periodo el estímulo que supone mantener la cadera reducida consigue por si solo normalizar el acetábulo en la mayoría de los casos. Pavlik47 demostró que la flexión de la cadera y de la rodilla provocaba la abducción y reducción espontánea y atraumática de la cadera, manteniendo su movilidad activa y evitando la necrosis avascular de la cabeza femoral. Pavlik, en contraposición con las otras opciones de tratamiento, considera la movilidad activa como el factor terapéutico más importante. El arnés permite la movilidad activa de la cadera en la zona de seguridad, cuyos límites son una abducción mínima por debajo de la cual se produce la reluxación (aproximadamente 30°), y una abducción máxima por encima de la cual incrementa el riesgo de necrosis avascular de la cabeza femoral (aproximadamente 60°). La tasa de éxito del arnés de Pavlik alcanza el 95% en los casos de displasia acetabular o subluxación de la cadera y el 80% en los casos de luxación48. El arnés de Pavlik es el método más utilizado en el tratamiento de la DDC en el niño desde el nacimiento hasta aproximadamente los 6-10 meses de edad, dependiendo de los autores47–49 (fig. 3). A mayor edad, está indicada una ortesis que mantenga una posición fija.
La figura A muestra una niña de 5 meses de edad con un arnés de Pavlik. La tira anterior flexiona la cadera 90°, provocando una abducción de la cadera. La abducción de la cadera viene determinada por la flexión de la cadera y la rodilla, no por la tira posterior, que está diseñada simplemente para que el muslo no caiga en aducción. El arnés permite la movilidad de la cadera en un rango de seguridad. En la figura B se puede ver a un neonato con un arnés mal colocado. La abducción de la cadera es excesiva y está determinada por la tira posterior y no por la flexión conjunta de la rodilla y la cadera. Esta abducción excesiva de la cadera incrementa el riesgo de necrosis avascular de la cabeza femoral.
Se ha descrito en los casos con luxación, una tasa de reducción de la cadera con el arnés de Pavlik del 63 al 92% de los casos48,50. El uso del arnés no debe prolongarse si la reducción de la cadera no ha ocurrido espontáneamente en las primeras 2-4 semanas de tratamiento, puesto que incrementa las incidencias de complicaciones51. La ecografía es útil para confirmar la reducción espontánea, aunque la exploración clínica ha demostrado ser suficiente. Se han descrito una serie de factores asociados con el fallo del arnés de Pavlik para conseguir la reducción: una cadera luxada no reductible con la maniobra de Ortolani, un mayor desplazamiento de la cabeza femoral, la presencia de un labrum invertido, un ángulo beta elevado, un porcentaje de cobertura femoral disminuido, un índice acetabular mayor de 36°, la presentación a partir de la séptima semana de edad o la luxación bilateral52.
Las complicaciones asociadas con el arnés de Pavlik son mínimas, siempre y cuando sea correctamente realizado47. La incidencia de necrosis avascular, la complicación más temible, es casi inexistente47,50. Sin embargo, si el arnés se coloca con una abducción excesiva, la incidencia de necrosis avascular de la cabeza femoral incrementa considerablemente49 (fig. 3). La colocación del arnés con una flexión excesiva puede provocar una luxación inferior o una parálisis transitoria del nervio femoral49. Se han descrito otras complicaciones asociadas con el uso del arnés de Pavlik como son el empeoramiento de la displasia acetabular o la aparición de una parálisis braquial.
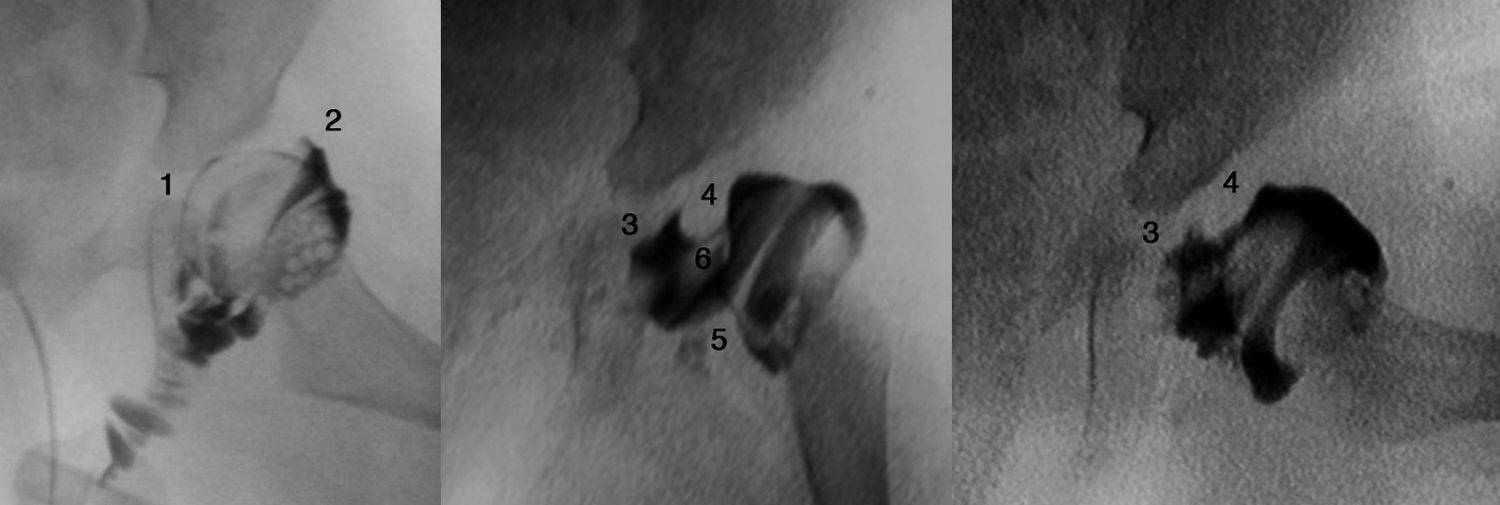
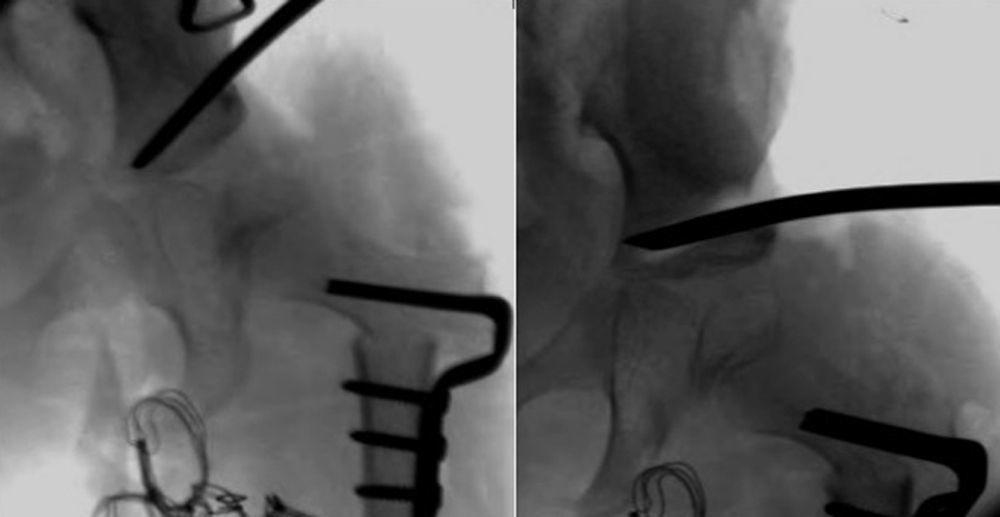
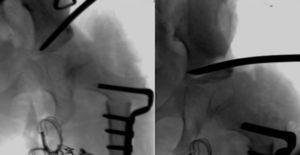
Cuanto mayor es el niño, mayor es la dificultad para conseguir la reducción, por lo que la eficacia del arnés de Pavlik disminuye. La artrografía valora de forma precisa la calidad de la reducción ya que permite visualizar las partes blandas de la articulación y la forma y el tamaño de la parte cartilaginosa del acetábulo y la cabeza femoral53 (fig. 4). La reducción ha de ser concéntrica y estable en una posición funcional. Si en la artrografía no se observa una reducción anatómica, se debe proceder a realizar una reducción abierta liberando los obstáculos intra-articulares y extra-articulares que impidan la reducción: el pulvinar, el labrum, el ligamento teres hipertrófico, el ligamento transverso, el tendón del psoas y la capsula anteromedial3. Las estructuras interpuestas, en el caso de intentar una reducción cerrada en presencia obstáculos, incrementarán la presión sobre la cabeza femoral, incrementando el riesgo de oclusión de los canales cartilaginosos o del drenaje venoso y provocando una necrosis avascular de la cabeza femoral. Es muy importante recordar que el tratamiento con una reducción cerrada en presencia de estructuras interpuestas lleva a un mal resultado a largo plazo e incrementa el riesgo de necrosis avascular53. Por lo tanto, es imperativo realizar una artrografía en aquellas caderas luxadas o subluxadas para valorar la necesidad de una reducción cerrada o abierta.
Artrografía de una cadera. En el caso A puede verse una reducción correcta de la cadera sin acúmulo medial de contraste (1) y con una espina de rosal (2), que se corresponde con el contraste existente entre la cápsula y el labrum. La artrografía del caso B muestra un acúmulo medial de contraste (3), que indica la reducción incorrecta de la cadera, existiendo obstáculos para la reducción: el labrum (4), el tendón del psoas (5) y el ligamento redondo (6). En el caso B esta contraindicado realiar una reducción cerrada de la cadera, siendo necesario realizar una reducción abierta para eliminar los obstáculos anatómicos.
Cuanto mayor es el niño, mas frecuentemente será necesario realizar una reducción abierta. Aunque la reducción es difícil, el potencial de crecimiento del acetábulo sigue siendo elevado, de forma que el estímulo de la reducción concéntrica de la cadera conseguirá normalizar el acetábulo displásico. Una vez lograda la reducción abierta o cerrada, esta se mantendrá mediante un yeso pelvipédico durante 3 meses para lograr la estabilización de la cadera. Este protocolo de reducción bajo anestesia general seguida de inmovilización con una espica de yeso se aplica al inicio de la infancia en los niños que presentan de una luxación no reductible con el arnés de Pavlik.
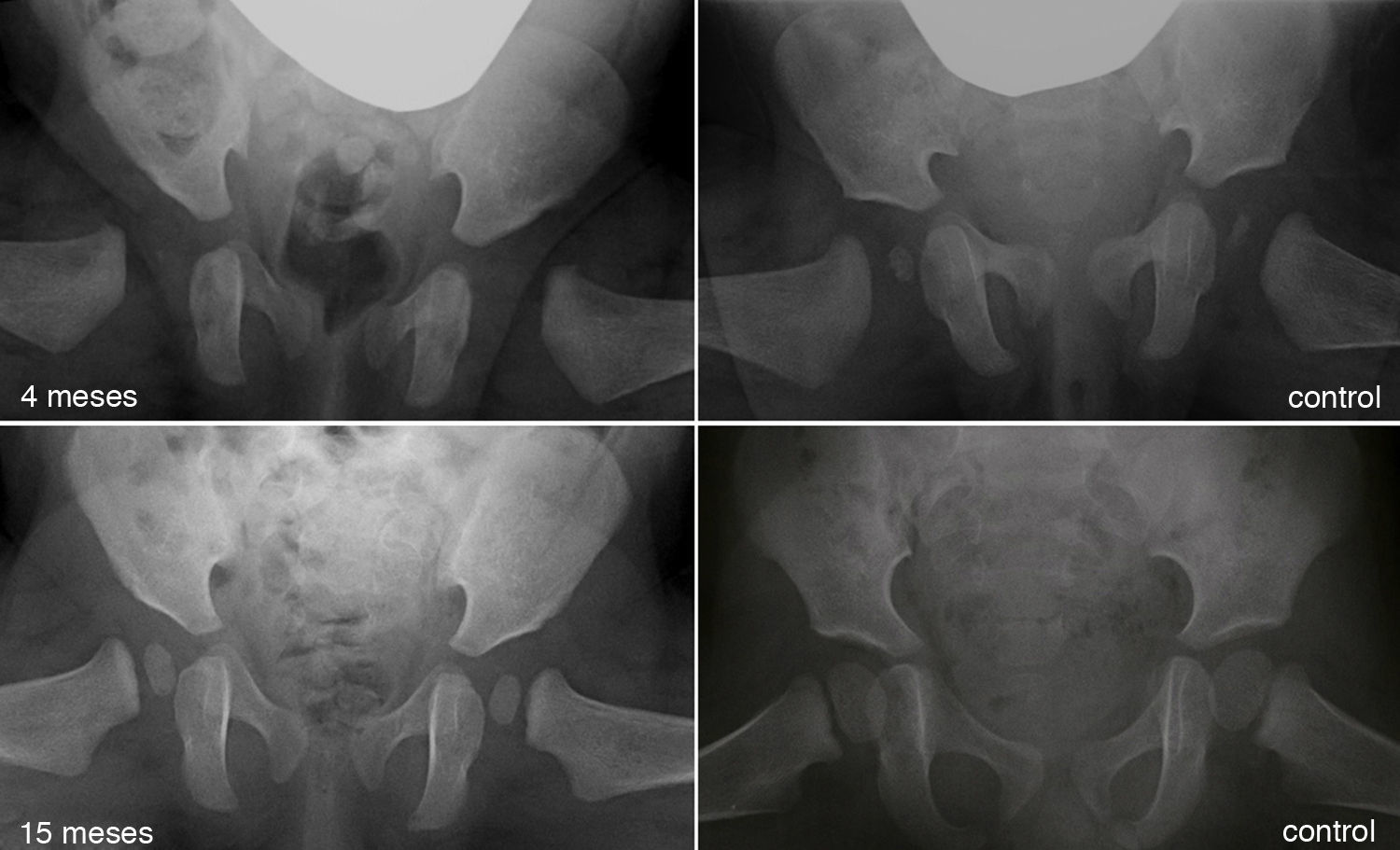
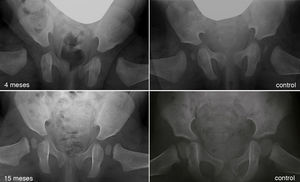
Al avanzar la edad del niño se hace menos probable que la reducción consiga por si sola normalizar el acetábulo displásico29. La prevalencia de «displasia residual» incrementa con la edad a la que se reduce la cadera, independientemente del tipo de reducción54 (fig. 5). Se desconoce el límite de edad a la cual el estímulo que provoca la reducción de la cadera es suficiente para normalizar el acetábulo. Además, independientemente de la edad en el momento de la reducción, el estímulo no siempre es suficiente y la displasia residual puede ocurrir incluso cuando el tratamiento se realiza en los primeros meses de vida. A pesar del gran éxito a corto y medio plazo del arnés de Pavlik, se ha descrito a largo plazo una displasia residual en el 17-19% de los pacientes tratados con este método55. También se ha descrito una displasia residual en el 22-33% de las caderas tratadas con reducción cerrada o abierta54,56,57. Cuando no se normaliza el acetábulo (displasia residual persistente) o no se espera que ocurra debido a la edad, serán necesario osteotomías acetabulares y/o femorales que traten de evitar la aparición de coxartrosis en la vida adulta. El momento adecuado para indicar estos procedimientos está en permanente debate, siendo la edad y la evolución del índice acetabular como el indicador de la remodelación acetabular, los parámetros más fiables para predecir la probabilidad de displasia residual en la madurez esquelética29,54.
Displasia residual tras el tratamiento con el arnés de Pavlik. La imagen del cuadrante superior izquierdo muestra una radiografía anteroposterior de pelvis de un paciente de 4 meses de edad al inició del tratamiento con el arnés. La imagen del cuandrante inferior izquierdo muestra una radiografía anteroposterior de pelvis del mismo paciente a los 15 meses de edad donde se observa una displasia acetabular residual a pesar del tratamiento con el arnés de Pavlik. Las imágenes de la derecha corresponden a una radiografía anteroposterior de una pelvis normal a los 4 meses de edad en el caso del cuadrante superior derecho, y a los 15 meses de edad en el caso del cuadrante inferior derecho.
Las «osteotomías femorales», consistentes en osteotomías varizantes y derrotatorias, se realizan para estabilizar la reducción de la cadera y para estímular el desarrollo del acetábulo58. Su utilización se basa en la supuesta existencia de una anteversión femoral incrementada y una coxa valga, lo cual está en discusión11,12. La anteversión femoral incrementada es la causa más frecuente de recurrencia de la subluxación, y por lo tanto, la osteotomía femoral derotatoria es necesaria en algunos casos para conseguir una reducción estable de la cadera. Además, algunos autores han demostrado que la reducción concéntrica de la cadera seguida de una osteotomía derrotatoria consigue estimular el desarrollo del techo acetabular sin necesidad de varizar el fémur proximal o realizar una acetabuloplastia58. Sin embargo, otros autores creen que la displasia acetabular no puede resolverse siempre con actuaciones exclusivas sobre el fémur proximal59.
Las «osteotomías acetabulares» descritas en la literatura pueden dividirse en 2 grupos: las osteotomías que mantienen el cartílago articular como superficie de contacto entre el acetábulo y la cabeza femoral; y las denominadas osteotomías de salvamento, que no lo hacen. Las primeras se dividen, a su vez, en osteotomías que alteran la orientación (osteotomía de Salter, triple osteotomía de Steel o la osteotomía periacetabular) y osteotomías que alteran la forma (osteotomía de Pemberton, osteotomía de Dega o San Diego).
Las «osteotomías de reorientación» solo mejoran la dirección del acetábulo. Entre estas osteotomías se encuentran la osteotomía de Salter, la osteotomía periacetabular o la triple osteotomía de Steel. Con estas osteotomías se moviliza el acetábulo de forma que se incrementa la cobertura lateral y anterior, disminuyendo al mismo tiempo la cobertura posterior e inferior. Entre las «osteotomías que alteran la forma» encontramos la osteotomía de Dega y la osteotomía de Pemberton. La osteotomía de Dega se efectúa mediante la cortical lateral del ilion y se dirige hacia el cartílago trirradiado, dejando la cortical medial integra, y permite movilizar el techo acetabular, utilizando como bisagra el cartílago trirradiado (fig. 6). La osteotomía de Pemberton comienza en la espina ilíaca antero-inferior, se curva posteriormente hacia la rama ilio-isquiática del cartílago trirradiado y utiliza también como bisagra el cartílago trirradiado. Las osteotomías que alteran la forma consiguen un mayor grado de corrección de la displasia acetabular y una mayor cobertura de la cabeza femoral que la osteotomía de Salter60. Es necesario recordar que las osteotomías fisiológicas no se realizan para reducir o estabilizar una cadera luxada o subluxada, sino solo en aquellas caderas reducidas y estables con el objetivo de mejorar la configuración acetabular.
Respecto a las caderas irreductibles, se pueden realizar osteotomías de salvamento (osteotomía de Chiari y la osteotomía tipo «shelf») con el objetivo de incrementar la cobertura de la cabeza femoral, dar estabilidad a la articulación e incrementar el área de carga del acetábulo. Sin embargo, estas osteotomías no mantienen el cartílago articular como superficie de contacto entre el acetábulo y la cabeza femoral. Se ha demostrado que la cápsula articular interpuesta entre la cabeza femoral y la superficie del ilion movilizada en la osteotomía de Chiari o entre la cabeza femoral y el injerto óseo utilizado en la osteotomía tipo «shelf» sufre una metaplasia y adquiere una estructura que se asemeja al cartílago articular61.
Tampoco las osteotomías acetabulares o femorales consiguen normalizar el acetábulo y evitar el desarrollo de coxartrosis en todos los casos. Thomas et al.62 estudiaron los resultados a largo plazo de la osteotomía de Salter y describieron la implantación de una prótesis de cadera en el 31% de los pacientes que habían sobrevivido más de 40 años tras la cirugía. Además, el 17% presentaban signos radiográficos definitivos de artrosis (grados 3 o 4 de Kellgren y Lawrence) aunque no se les había implantado una prótesis. De igual modo, Steppacher et al.63 describen, a los 20 años del procedimiento, la implantación de una prótesis total de cadera en el 38% de los pacientes sometidos a una osteotomía periacetabular. Gibson y Benson64 describen los resultados a largo plazo de los pacientes que fueron tratados en la infancia temprana con una reducción abierta o cerrada de la cadera y una osteotomía derrotatoria del fémur proximal encontrando a los 21 (16-31) años de edad la presencia de signos artrósicos en el 44% de los casos.
Nivel de evidenciaNivel de evidencia v.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.