Las fracturas de cadera son la causa más frecuente de ingreso hospitalario en los servicios de ortopedia de Europa y suponen un importante problema sanitario. Por ello, es de gran interés identificar factores de riesgo adicionales que nos ayuden a comprender mejor la fisiopatología de estas fracturas y a mejorar nuestra capacidad preventiva.
Existen datos suficientes para apoyar la teoría de la modulación de la masa ósea por la microbiota intestinal (osteomicrobiología); sin embargo, faltan estudios clínicos en humanos que relacionen directamente la microbiota con el riesgo de fractura de cadera.
Material y métodosEstudio observacional, analítico, de casos y controles.
La muestra consta de 50 pacientes y se distribuye de la siguiente manera: 25 pacientes ancianos con fractura de cadera por fragilidad y 25 controles sanos sin fractura. Se analizó la microbiota intestinal mediante extracción de ADN de muestras de heces y secuenciación del ADN ribosómico 16S tras la generación de bibliotecas de genes.
ResultadosLa diversidad alfa reveló una elevación de los estimadores para el nivel taxonómico de clase en el grupo de fracturas de cadera.
Los órdenes Bacteroidales, Oscillospirales, Lachnospirales, Peptostreptococcales-Tissierellales y Enterobacterales fueron los órdenes dominantes en ambos grupos.
En los pacientes con fractura, se observó un aumento porcentual significativo del orden de Bacteroidales (p<0,001) y Peptostreptococcales-Tissierellales (p<0,005), así como una disminución de las del orden Lachnospirales (p<0,001) respecto a los controles.
ConclusionesEste estudio ha encontrado una asociación entre una microbiota específica en pacientes ancianos con fractura de cadera por fragilidad. Estos hallazgos abren la puerta a nuevas estrategias para prevenir las fracturas de cadera. Es posible que la modificación de la microbiota mediante probióticos se revele como un método eficaz para reducir el riesgo de fractura de cadera.
Hip fractures are the most common cause of hospital admission to orthopaedic departments in Europe and they generate a major health problem. Therefore, it is of great interest to identify additional risk factors that will help us to better understand the pathophysiology of these fractures and improve our preventive capacity.
There is sufficient data to support the theory of modulation of bone mass by gut microbiota (osteomicrobiology); however, there is a lack of human clinical studies directly linking microbiota to hip fracture risk.
Material and methodsObservational, analytical, case–control study.
The sample consisted of 50 patients and it was distributed as follows: 25 elderly patients with fragility hip fracture and 25 subjects without fracture. The intestinal microbiota was determined by DNA extraction from stool samples and 16S ribosomal DNA sequencing after generation of gene libraries.
ResultsAlpha diversity revealed an elevation of the estimators for the taxonomic class level in the hip fracture group.
The orders Bacteroidales, Oscillospirales, Lachnospirales, Peptostreptococcales-Tissierellales and Enterobacterales were the dominant orders in both groups.
In patients with fracture, a significant percentage increase in the orders Bacteroidales (p<.001) and Peptostreptococcales-Tissierellales (p<.005) was observed, as well as a decrease in the orders Lachnospirales (p<.001) compared to controls.
ConclusionsThis study has found an association between a specific microbiota in elderly patients with fragility hip fracture. These findings open the door to new strategies to prevent hip fractures. Modification of the microbiota through probiotics may prove to be an effective method to reduce the risk of hip fracture.
Las fracturas de cadera por fragilidad son la causa más frecuente de ingreso hospitalario en los servicios de ortopedia de España y del resto de Europa y, por tanto, se consideran un importante problema sanitario1. Además de tener un impacto significativo en la mortalidad de los pacientes, generan una importante carga social y un elevado coste para los sistemas sanitarios nacionales1.
La osteoporosis es un trastorno sistémico crónico del esqueleto que está mediado por factores inflamatorios y que provoca un aumento de la fragilidad ósea y del riesgo de fractura. La edad, el sexo femenino y los antecedentes de fractura son los principales factores de riesgo clínicos asociados a la fractura2; sin embargo, tienen poco valor predictivo. La medición de la densidad mineral ósea mediante densitometría ósea es el método de elección en la evaluación del riesgo de fractura, pero su baja sensibilidad es una de las razones por las que no se recomienda para el cribado generalizado de la población3. Por ello, es necesario identificar factores de riesgo adicionales que nos ayuden a comprender mejor la fisiopatología de estas fracturas y a mejorar nuestra capacidad preventiva.
El microbioma humano es el conjunto de especies microbianas (microbiota) y sus metabolitos, que están asociados al cuerpo humano. Cada región del cuerpo posee un hábitat que condiciona las especies que habitan en él y que evolucionan en función de la edad y estado fisiológico4. En particular, la microbiota intestinal (MI) se establece en nuestro organismo de manera progresiva desde el nacimiento, alcanza la composición del adulto entre los 2 y 3 años de edad y está constituida por billones de microorganismos de más de 1000 especies, en su mayoría bacterias pertenecientes a los filos Firmicutes y Bacteroidetes4. Por desgracia, muchas de estas no se han logrado cultivar en el laboratorio o siguen sin estar caracterizadas taxonómicamente4.
Se ha demostrado una clara asociación entre el microbioma y distintas afecciones crónicas en humanos, entre ellas: enfermedades inflamatorias del intestino, obesidad, enfermedades metabólicas, desnutrición, trastornos neurológicos, cáncer, y enfermedad cardiovascular5. Sin embargo, no es tan conocida su relación con patologías óseas como la osteoporosis. Existen datos que indican la modulación de la masa ósea por la MI, aunque el mecanismo es complejo y poco conocido5. Diversos estudios experimentales en ratones han evaluado el impacto del microbioma en la estructura y densidad ósea6. Existe evidencia de que la función osteoclástica puede verse alterada en ratones que presentan un microbioma intestinal aberrante, hecho que podría estar relacionado con una alteración del estado inmunológico del hueso de estos animales7. Sin embargo, por el momento solo existen estudios en fase experimental realizados in vitro o en animales modificados, libres de microorganismos. Con todo, en la actualidad hay suficientes datos que apoyan la teoría de la modulación de la masa ósea por la MI (osteomicrobiología)5; sin embargo, faltan estudios clínicos en humanos que relacionen directamente la microbiota con el riesgo de fractura de cadera.
Nuestra hipótesis es que los pacientes con fractura de cadera por fragilidad tienen una MI específica que favorece la perdida ósea y la aparición de la fractura. El presente estudio tiene como objetivo identificar la MI predominante en ancianos con fractura de cadera por fragilidad en comparación con la microbiota presente en individuos sanos mediante la secuenciación del gen 16S ARNr.
Material y métodosSiguiendo la declaración STROBE, se realizó un estudio observacional, analítico de casos-control para identificar eventuales diferencias en la composición de la MI en pacientes ancianos con fractura de cadera por fragilidad en comparación con ancianos sin fractura de cadera. Este estudio fue aprobado por el Comité ético de nuestra institución (CEim 07/19) y se solicitó consentimiento informado a todos los sujetos reclutados.
Muestra del estudioSe incluyeron 50 individuos del departamento de salud que depende de nuestro centro hospitalario. El grupo patológico estaba compuesto por 25 pacientes diagnosticados de fractura de cadera aguda como consecuencia de un traumatismo de bajo impacto o caída desde altura igual o menor a su estatura, que fueron ingresados para someterse a tratamiento quirúrgico. Por otra parte, se reclutaron de la comunidad 25 controles que no presentaban antecedentes de fractura de cadera. En ambos grupos se fijaron los siguientes criterios de inclusión: edad mayor de 70 años, puntuación escala de Barthel≥30 puntos y ausencia de fractura de cadera previa. Se excluyeron los pacientes que habían recibido tratamiento antibiótico en las 2 semanas previas a la inclusión del estudio o tratamiento activo (quimioterapia o radioterapia) para cualquier neoplasia, los que presentaban un deterioro cognitivo moderado-severo considerado como una puntuación≥5 en la Escala de Deterioro Global (GDS por sus siglas en inglés, Global Deterioration Scale) y los sometidos a cirugía u hospitalizados por cualquier motivo en los últimos 3 meses antes de la inclusión en el estudio.
Tamaño muestralPara el cálculo del tamaño muestral se ha asumido arbitrariamente la capacidad de detección del estudio de una odds ratio mayor de 3, por ser esta cifra la comunicada como capacidad predictiva de fractura de cadera que actualmente tiene la densitometría ósea. Con la intención de ser conservadores, se ha asumido que la proporción hipotética de casos con exposición es de un 50% y que hasta un 10% de los controles podrían tener la misma exposición que los casos. Se empleó un nivel de significación alfa de 2 colas de 0,05 y un poder beta de 0,8 en una relación casos y controles de 1:1. La determinación empleada ha sido el método de Kelsey usando el software Open Epi versión 3.03.178 que arroja un resultado de 42 sujetos (21 casos y 21 controles). Asumiendo unas posibles pérdidas del 20%, la muestra final se establece en 50 sujetos de estudio (25 casos y 25 controles).
Variables clínicasSe recogieron las variables demográficas (edad y sexo) en todos los casos. En el grupo de pacientes con fractura se identificó la lateralidad y el tipo de fractura conforme la siguiente clasificación: 1- fracturas subcapitales cuando se producen en la zona del cuello femoral, entre cabeza y macizo trocantérico. 2- fracturas pertrocantéreas cuando el trazo de fractura se encuentra entre trocánter mayor y menor, y 3- persubtrocantéreas, aquellas producidas entre el trocánter menor y los 5cm distales a este. La situación funcional de los casos y controles se obtuvo mediante la aplicación del Índice de comorbilidad de Charlson9, Índice de Barthel10 y la GDS11.
Recolección de las muestrasLa toma de muestras fecales en el grupo casos se obtuvo antes de la cirugía de reparación de la fractura de cadera. El tiempo máximo para realizar la toma de muestras fue de 24h desde que se produjo la fractura para minimizar cambios en la MI como consecuencia de la fractura y el encamamiento. Respecto los controles, se obtuvo de individuos sanos de la comunidad que no presentaban antecedentes de fractura de cadera o de pacientes que se iban a someter a un tratamiento quirúrgico ortopédico en el momento del ingreso. Todas las muestras fecales se adquirieron siguiendo las recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica de 201612. Las muestras fueron obtenidas mediante frotis rectal antes de administrar dosis de antibiótico profiláctico y cada una fue guardada en un bote de 2mL que inmediatamente se congelaron a −80°.
Para la caracterización del metagenoma por secuenciación masiva, se extrajo el ADN de muestras fecales de cada uno de los individuos según los procedimientos ya descritos y publicados por el grupo de Bäuerl et al.13. Brevemente, se parte de 200-300mg de heces utilizando un kit de extracción de ADN en heces Qiagen (QIAgen, Hilden, Alemania), de acuerdo a las instrucciones del fabricante. Este método se modificó al añadir un paso previo empleando un Bead Beater con pulsos de 1min a 2000 oscilaciones por minuto. El ADN se cuantifica empleando el fluorímetro Qubit® (Life Technologies, Grand Island, NY, EE. UU.). El estudio metataxonómico de la microbiota se basó en las regiones variable V3-V4 del gen 16S ARNr mediante PCR, de los que se generaron librerías etiquetadas con identificadores «multiplex” según la plataforma de secuenciación MiSeq (Illumina).
Análisis bioinformático de microbiotaLas secuencias normalizadas y filtradas se analizaron empleando el programa informático MicrobiomeAnalyst (https://www.microbiomeanalyst.ca/)14. Las unidades taxonómicas operativas se generaron por agrupación con un 97% de similitud y fueron alineadas con los genomas completamente secuenciados a partir de bases de datos públicas, como Silva15.
Se estimó la diversidad alfa por distancias mediante las plataformas UniFrac16. Las distancias UniFrac ponderadas (considera la abundancia relativa) y no ponderadas (no considera la abundancia relativa) y los metadatos de las muestras fueron empleados para realizar el Análisis de Coordenadas Principales (PCoA). La diversidad alfa se utiliza para medir la diversidad dentro de una muestra. Las 2 medidas de diversidad alfa más utilizadas son la riqueza (recuento) y la uniformidad (distribución). MicrobiomeAnalyst dispone de los estimadores de α-diversidad Chao 1, Ace, Shannon y Simpson. Los índices de Ace y de Chao 1 evalúan las unidades taxonómicas operativas observadas y tienen en cuenta las especies no observadas en función de las unidades taxonómicas operativas de baja abundancia, de esta manera analizan la riqueza. Los indicadores de Shannon y de Simpson valoran tanto la riqueza como la uniformidad de la muestra.
Para establecer las diferencias de la estructura taxonómica entre grupos de manera cuantitativas como estadísticas, se representaron la mediana de la abundancia para cada grupo bacteriano y la prueba estadística no paramétrica de suma de rangos de Wilcoxon, respectivamente. El procesado multivariante se realizó mediante diferentes programas diseñados en R.
Análisis estadísticoEl análisis de los resultados y la generación de figuras basadas en la información clínico-patológica, los estimadores alfa y la abundancia bacteriana relativa se llevaron a cabo mediante MicrobiomeAnalyst y su paquete estadístico diseñado en el entorno de R (MicrobiomeAnalystR). En todas las muestras fecales se calculó la diversidad alfa que proporciona un resumen de la comunidad microbiana en muestras individuales y puede compararse entre grupos para evaluar el papel de un factor concreto (en este caso la presencia de fractura) en la riqueza (número de especies) y la uniformidad (grado de representación de cada especie) en la muestra17. Se realizó la prueba t de Student y la prueba de suma de rangos de Wilcoxon con una corrección Benjamini-Hochberg (FDR) para comparaciones múltiples. Se fijó una p<0,05 como el límite para establecer las diferencias significativa entre los grupos
ResultadosLos datos demográficos se recogen en la tabla 1. La muestra está compuesta por 32 mujeres (64%) y 18 hombres (36%), con una edad media de 80,9 años (DE±7,7). El 82% de los pacientes tenían una ausencia de deterioro cognitivo (GDS1) mientras que el resto mostraban un leve deterioro cognitivo (GDS2). Según el índice de comorbilidad de Charlson, el grado de afectación patológico fue bajo y la puntuación obtenida fue de 0-1 y 2-3 en 45 y 5 pacientes, respectivamente.
Valores de la edad expresados en media y desviación estándar
| Controles | Casos | |
|---|---|---|
| Edad (años) | 75,8 (3,9) | 84,3 (8,3) |
| Mujer | 15 (60%) | 17 (68%) |
| Lateralidad(D, I, bilateral) | 9, 5, 11(36%, 20%, 44%) | 11, 14, 0(44%, 56%, 0%) |
| Diagnóstico | Coxartrosis 4 (16%) | Fr. subcapital 8 (32%) |
| Gonartrosis 7 (28%) | Fr. pertrocantérea 15 (60%) | |
| Otros 14 (56%) | Fr. subcapital 2 (8%) | |
| GDS | ||
| GDS 1 | 20 (80%) | 21 (84%) |
| GDS 2 | 5 (20%) | 4 (16%) |
| ICC | ||
| 0 | 21 (84%) | 16 (64%) |
| 1 | 2 (8%) | 6 (24%) |
| 2 | 1 (4%) | 1 (4%) |
| 3 | 1 (4%) | 2 (8%) |
GDS: Global Deterioration Scale; ICC: índice de comorbilidad de Charlson.
De acuerdo con los datos de secuenciación de todas las muestras, la MI se clasificó en 10 filos, 15 clases y 29 órdenes. Se registró un total de 2.048.310 taxones bacterianos, de los que 1.039.915 correspondían al grupo control y 1.008.395 al grupo patológico.
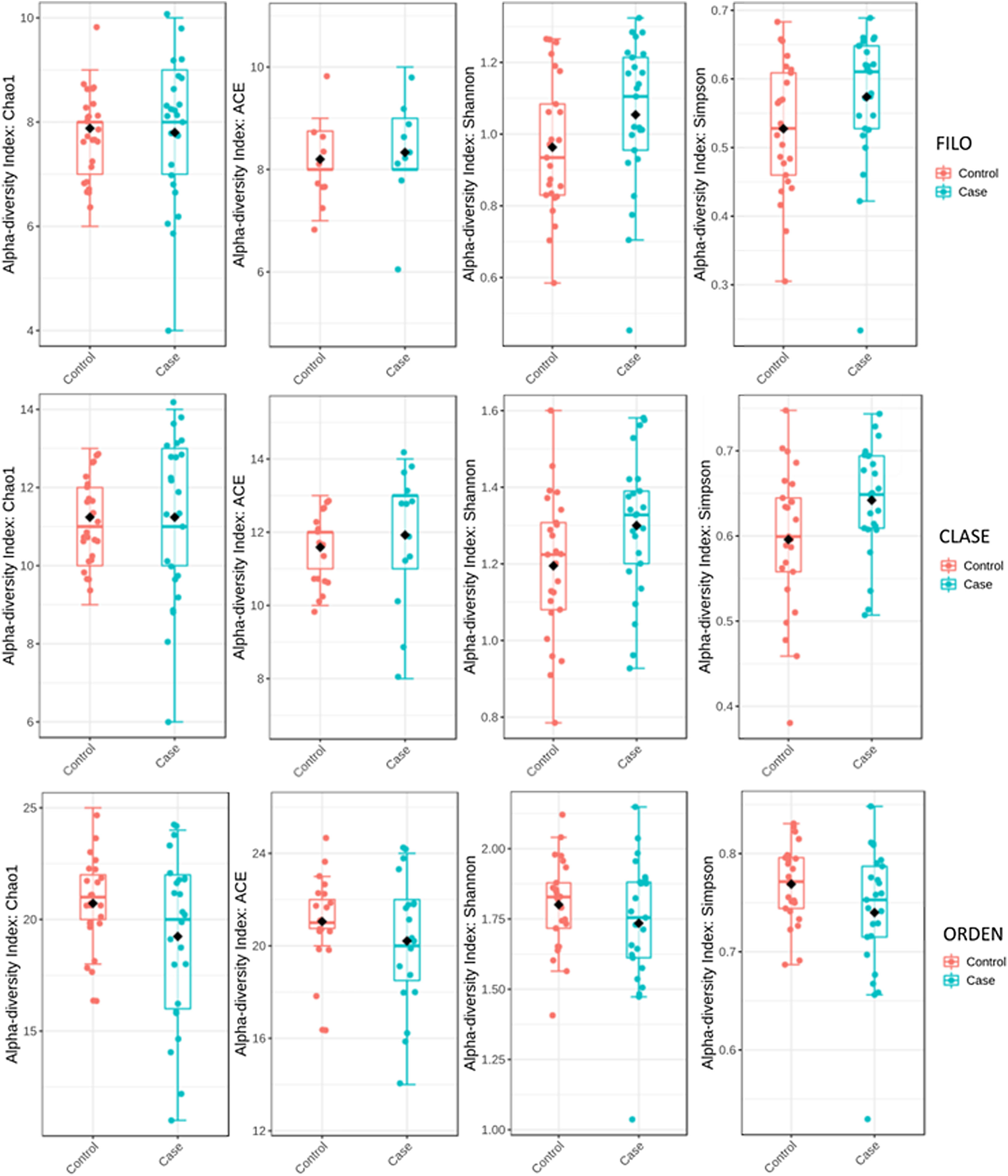
Para determinar la diversidad alfa, se calculó la media del índice de Chao, de Ace, de Shannon y de Simpson. Mediante este procedimiento se consigue definir completamente la diversidad de la comunidad bacteriana de las muestras, de manera que los valores más altos de los estimadores reflejan una mayor diversidad. La información pormenorizada sobre los estimadores se muestra en la tabla 2; se encontraron diferencias estadísticas para el índice de Shannon y de Simpson para los niveles de clase −2,0258 y 2,1596 (p<0,05), respectivamente (fig. 1)
Tras realizar el análisis de significación de abundancia de la comunidad bacteriana intestinal, se objetiva en el nivel de filo (fig. 2) que los grupos de bacterias Firmicutes, Bacteroidota, Proteobacteria y Campilobacterota constituyen los 4 filos dominantes en todas las muestras. Las proporciones medias de Firmicutes/Bacteroidetes son de 2,041 y 1,223 en los grupos de controles y de casos, respectivamente. El resto de filos que constituyen la abundancia total de la comunidad microbiana de ambos grupos se recoge en la tabla 3. Se han encontrado diferencias significativas entre los filos Firmicutes (log 2 median ratio -0,4021 y diferencia de medianas 0,1452; p<0,005) y Bacteroidetes (log 2 median ratio −0,4743 y diferencia de medianas −0,1151; p<0,002) entre el grupo control y el patológico (fig. 3).
Distribución de la abundancia total y relativa (%) de los taxones en el nivel de filo entre ambos grupos de comparación
| Controles | Abundancia | % | Casos | Abundancia | % | ||
|---|---|---|---|---|---|---|---|
| 1 | Firmicutes | 615.167 | 59,16 | 1 | Firmicutes | 478.943 | 47,5 |
| 2 | Bacteroidota | 301.408 | 28,98 | 2 | Bacteroidota | 391.712 | 38,85 |
| 3 | Proteobacteria | 65.935 | 6,34 | 3 | Proteobacteria | 63.418 | 6,29 |
| 4 | Campilobacterota | 22.805 | 2,19 | 4 | Campilobacterota | 27.794 | 2,76 |
| 5 | Verrucomicrobiota | 19.548 | 1,88 | 5 | Verrucomicrobiota | 17.968 | 1,78 |
| 6 | Actinobacteriota | 7.364 | 0,71 | 6 | Fusobacteriota | 16.649 | 1,65 |
| 7 | Fusobacteriota | 4.749 | 0,46 | 7 | Actinobacteriota | 7.871 | 0,78 |
| 8 | Desulfobacterota | 2.519 | 0,24 | 8 | Desulfobacterota | 2.930 | 0,29 |
| 9 | Euryarchaeota | 292 | 0,03 | 9 | Euryarchaeota | 966 | 0,1 |
| 10 | Cyanobacteria | 128 | 0,01 | 10 | Cyanobacteria | 144 | 0,01 |
Árbol de calor que permite representar cuantitativamente (utilizando la mediana de abundancia) y estadísticamente (utilizando la prueba no paramétrica de suma de rangos de Wilcoxon) las diferencias taxonómicas entre las comunidades microbianas. El tamaño y color de los nodos y las aristas se relacionan con la abundancia de los organismos según el filo. El color de cada taxón representa la relación log-2 de las proporciones medianas de lecturas observadas en cada grupo de estudio. Solo se indican los filos bacterianos que muestran diferencias significativas determinadas mediante una prueba de suma de rangos de Wilcox seguida de una corrección Benjamini-Hochberg (FDR) para comparaciones múltiples. Fuente Foster et al.30.
Respecto al nivel de orden, se han detectado un total de 29 órdenes de bacterias diferentes (fig. 4). La abundancia de todos los microorganismos y su porcentaje se recogen en la tabla 4. Las Bacteroidales constituyen la mayor proporción en todas las muestras y 5 órdenes representan los grupos bacterianos más prevalentes. De ellos, en el grupo control, solo 3 órdenes (Bacteroidales, Oscillospirales y Lachnospirales) contribuyen a más de 2 tercios de la comunidad bacteriana. Por su parte, en el grupo patológico, los 3 órdenes Bacteroidales, Peptostreptococcales-Tissierellales y Oscillospirales configuran más del 60% de la muestra (fig. 5).
Distribución de la abundancia total y relativa (%) de los taxones en el nivel de orden entre ambos grupos de comparación
| Controles | Abundancia | % | Casos | Abundancia | % | ||
|---|---|---|---|---|---|---|---|
| 1 | Bacteroidales | 301.408 | 28,98 | 1 | Bacteroidales | 391.712 | 38,85 |
| 2 | Oscillospirales | 261.950 | 25,19 | 2 | Peptostreptococcales-Tissierellales | 149.225 | 14,8 |
| 3 | Lachnospirales | 164.448 | 15,81 | 3 | Oscillospirales | 125.210 | 12,42 |
| 4 | Peptostreptococcales-Tissierellales | 76.405 | 7,35 | 4 | Lachnospirales | 86.264 | 8,55 |
| 5 | Enterobacterales | 57.329 | 5,51 | 5 | Enterobacterales | 61.085 | 6,06 |
| 6 | Lactobacillales | 38.709 | 3,72 | 6 | Veillonellales-Selenomonadales | 36.901 | 3,66 |
| 7 | Campylobacterales | 22.805 | 2,19 | 7 | Lactobacillales | 30.131 | 2,99 |
| 8 | Clostridia_UCG_014 | 20.800 | 2 | 8 | Campylobacterales | 27.794 | 2,76 |
| 9 | Verrucomicrobiales | 19.548 | 1,88 | 9 | Verrucomicrobiales | 17.968 | 1,78 |
| 10 | Christensenellales | 15.140 | 1,46 | 10 | Christensenellales | 17.315 | 1,72 |
| 11 | Veillonellales-Selenomonadales | 14.939 | 1,44 | 11 | Fusobacteriales | 16.649 | 1,65 |
| 12 | Acidaminococcales | 12.717 | 1,22 | 12 | Clostridia_UCG_014 | 15.292 | 1,52 |
| 13 | Fusobacteriales | 4.749 | 0,46 | 13 | Clostridia | 7.284 | 0,72 |
| 14 | Rhodospirillales | 3.838 | 0,37 | 14 | Acidaminococcales | 7.216 | 0,72 |
| 15 | Burkholderiales | 3.618 | 0,35 | 15 | Desulfovibrionales | 2.930 | 0,29 |
| 16 | Bifidobacteriales | 3.147 | 0,3 | 16 | Erysipelotrichales | 2.827 | 0,28 |
| 17 | Erysipelotrichales | 2.909 | 0,28 | 17 | Bifidobacteriales | 2.753 | 0,27 |
| 18 | Clostridiales | 2.774 | 0,27 | 18 | Actinomycetales | 2.356 | 0,23 |
| 19 | Desulfovibrionales | 2.519 | 0,24 | 19 | Coriobacteriales | 1.699 | 0,17 |
| 20 | Clostridia | 2.362 | 0,23 | 20 | Burkholderiales | 1.569 | 0,16 |
| 21 | Actinomycetales | 2.150 | 0,21 | 21 | Corynebacteriales | 1.063 | 0,11 |
| 22 | Monoglobales | 1.768 | 0,17 | 22 | Methanobacteriales | 966 | 0,1 |
| 23 | Corynebacteriales | 1.653 | 0,16 | 23 | Rhodospirillales | 642 | 0,06 |
| 24 | Pasteurellales | 1.150 | 0,11 | 24 | Monoglobales | 628 | 0,06 |
| 25 | Coriobacteriales | 414 | 0,04 | 25 | Clostridiales | 460 | 0,05 |
| 26 | Methanobacteriales | 292 | 0,03 | 26 | Gastranaerophilales | 144 | 0,01 |
| 27 | Peptococcales | 202 | 0,02 | 27 | Pasteurellales | 122 | 0,01 |
| 28 | Gastranaerophilales | 128 | 0,01 | 28 | DTU014 | 118 | 0,01 |
| 29 | DTU014 | 44 | 0 | 29 | Peptococcales | 72 | 0,01 |
Se han encontrado diferencias significativas para los órdenes Oscillospirales (log 2 median ratio 1,4530 y diferencia de medianas 0,1717; p<0,001), Lachnospirales (log 2 median ratio 0,9422 y diferencia de medianas 0,0734; p<0,001), Bacteroidales (log 2 median ratio −0,4743 y diferencia de medianas −0,1151; p<0,001) y Peptostreptococcales-Tissierellales (log 2 median ratio −0,9226 y diferencia de medianas −0,0599; p<0,005) entre el grupo control y el patológico (fig. 6).
Árbol de calor que permite representar cuantitativamente (utilizando la mediana de abundancia) y estadísticamente (utilizando la prueba no paramétrica de suma de rangos de Wilcoxon) las diferencias taxonómicas entre las comunidades microbianas. El tamaño y color de los nodos y las aristas se relacionan con la abundancia de los organismos según el orden. El color de cada taxón representa la relación log-2 de las proporciones medianas de lecturas observadas en cada grupo de estudio. Solo se indican los órdenes bacterianos que muestran diferencias significativas determinadas mediante una prueba de suma de rangos de Wilcox seguida de una corrección Benjamini-Hochberg (FDR) para comparaciones múltiples (Fuente Foster et al.30).
El microbioma humano constituye el segundo genoma de nuestro organismo y puede actuar sobre el sistema inmunitario (osteoinmunología)5, las vías hormonales y la producción de metabolitos bacterianos que actúan como señales para las células óseas18. Los avances en secuenciación genética han permitido analizar muestras bacterianas que antes no se podían cultivar por métodos convencionales en laboratorio. Existen diversos estudios experimentales realizados en ratones, que evalúan el impacto del microbioma en la estructura y densidad ósea7,19. Este estudio es el primero que analiza la composición y la diversidad de la MI en pacientes que han sufrido una fractura por fragilidad ósea de cadera frente a controles sanos. Los hallazgos indican que tanto la estructura como la diversidad bacteriana intestinal se encuentran alteradas en los pacientes con fractura de cadera por fragilidad. Estos hallazgos aportan más evidencia a la relación entre la salud ósea y la MI, y dan apoyo a la existencia de una población microbiana que puede predisponer a la osteopenia y la aparición de fracturas de cadera por fragilidad ósea.
En el grupo con fractura de cadera, la proporción de los filos de Firmicutes disminuyó y la de Bacteroidetes aumentó, encontrando diferencias significativas en ambos filos (p<0,05) respecto el grupo control. Se considera que aproximadamente el 60% de las bacterias intestinales pertenecen a los filos Bacteroidetes y Firmicutes20 y que el mantenimiento de una proporción equilibrada entre ambos filos se ha asociado con la conservación de la homeostasis. En la enfermedad inflamatoria del intestino, se ha demostrado que la proporción F/B se encuentra disminuida21. Ciertas bacterias pertenecientes al grupo de los Firmicutes desempeñan un papel clave en la nutrición y el metabolismo del huésped a través de la síntesis de los ácidos grasos de cadena corta (AGCC), que entre otras propiedades actúan como factores antiinflamatorios. En cambio, los componentes de determinadas bacterias del filo Bacteroidetes, como los lipopolisacáridos y la flagelina, potencian las reacciones inmunitarias a través de la síntesis de citoquinas22. La osteoporosis posmenopáusica presenta numerosos fenómenos que la relacionan con una enfermedad inflamatoria (aumento de citocinas -IL-1, IL-6, IL-17 y TNF-α- y del RANKL)23, de manera que este déficit de estrógenos establece un estado inflamatorio crónico que conduce a la pérdida ósea. Además, el envejecimiento se acompaña de un aumento de la respuesta inflamatoria que provoca una mayor sensibilidad del sistema inmunitario intestinal del huésped hacia patrones moleculares asociados a microorganismos24. De esta manera, se establece una retroalimentación inflamatoria intestinal que puede explicar por qué cambios en la composición de la MI, como los que presentamos, pueden están relacionados en la génesis y/o progresión de enfermedades como la osteoporosis.
De los 29 órdenes de bacterias identificados, 5 presentaron proporciones superiores al 5%. El orden Bacteroidales fue el más abundante y se observó un aumento porcentual significativo (p<0,001) en los pacientes con fractura respecto los controles. No obstante, hay que destacar también, el incremento en la proporción de bacterias Peptostreptococcales-Tissierellales (p<0,005) así como la disminución de las del orden Lachnospirales (p<0,001) en el grupo patológico. Estos resultados tienen especial relevancia pues las bacterias pertenecientes al orden de Lachnospirales están asociadas con el aumento de la producción del AGCC butirato25. Los AGCC son producidos por la MI a partir de la fermentación de los prebióticos y fibra vegetal no digerible por nuestro organismo, y entre otras características pueden aumentar la solubilidad y absorción del calcio a través de la acidificación de la luz intestinal18. Además, se ha demostrado que el butirato es capaz de favorecer la formación ósea y de inhibir la osteoclastogénesis al suprimir la vía de señalización del receptor activador del factor nuclear kB (RANKL) que como se sabe, induce la síntesis de citoquinas proinflamatorias26. Igualmente, los AGCC pueden afectar indirectamente a la osteoclastogénesis regulando el número y la función de los linfocitos Treg en el colon27. Por tanto, los cambios observados en este nivel taxonómico, en especial el aumento de Bacteroidales y descenso de Lachnospirales, indican que existe relación con la reducción de la masa ósea.
El análisis de la diversidad de la microbiota es una herramienta importante para cuantificar la riqueza relativa y el componente bacteriano de una comunidad determinada. En este estudio, la diversidad alfa reveló una elevación de los estimadores para el nivel de clase en el grupo de fracturas de cadera. Estos resultados coinciden son acordes con los encontrados en el único estudio que ha analizado la diversidad de la MI en pacientes con reducción de la masa ósea28 y apoya la idea de que una rica diversidad de la MI puede estar relacionada con la perdida ósea, lo que en algunos casos se ha relacionado con pérdida de homeostasis intestinal.
A pesar de extraer conclusiones relevantes, asumimos que este estudio cuenta con varias limitaciones. Puede parecer que el tamaño de la muestra es pequeño, pero hay que resaltar que es el único trabajo que establece una asociación entre MI y pacientes que han sufrido una fractura de cadera y, además, dentro de la escasa bibliografía que analiza la relación entre MI y osteoporosis en personas, es el que más pacientes registra. El diseño del presente estudio es de casos-control, de modo que los resultados del estudio pueden demostrar asociación, pero no causalidad. Sin embargo, el enfoque de un estudio casos-control es el más apropiado en el abordaje inicial de la investigación de una asociación y puede abrir la puerta a estudios de cohortes que confirmen la hipótesis planteada por nuestro estudio. Adicionalmente, es posible que por la naturaleza del diseño del estudio (casos-control) los efectos de asociación estén magnificados en los pacientes que ingresan en el hospital (sesgo de Berkson). Sin embargo, creemos que el impacto de este sesgo en la fractura de cadera será mínimo ya que en estos pacientes no hay gradación en la intensidad de la enfermedad (fractura de cadera) y es poco probable que una fractura de cadera tenga la levedad sintomática para evitar su ingreso. Independientemente de haber realizado un diseño con criterios de inclusión y exclusión restrictivos, hemos encontrado que la discrepancia de edad puede suponer una limitación a la hora de interpretar nuestros resultados. No obstante, y dadas las grandes diferencias interindividuales en la MI de las personas mayores, es difícil definir cuál es la MI típica de las personas mayores o establecer en qué intervalos de edad se producen los cambios sustanciales en la abundancia bacteriana29. Por último, no hemos tenido en cuenta otros factores que pueden interferir en la MI como la dieta, la toma de otros fármacos diferentes a antibióticos y el estilo de vida, ni hemos analizado niveles taxonómicos por debajo del orden de bacterias. No obstante, creemos que, a raíz de los resultados obtenidos, este trabajo puede servir como punto de partida para desarrollar futuros estudios que profundicen y aporten más evidencia en este tema.
ConclusiónNuestros resultados ofrecen una descripción de los cambios en la composición y diversidad de la MI que se asocian a pacientes que han sufrido una fractura de cadera por fragilidad ósea. De esta manera, se han identificado grupos bacterianos de distintos niveles taxonómicos que pueden ayudar a comprender los posibles mecanismos por los que la MI influye en la salud ósea y; además, sentar las bases en la búsqueda de nuevos biomarcadores microbianos. Es posible que la microbiota alterada se revele como un marcador pronóstico en la aparición de fracturas de cadera y pueda definirse la modificación de la microbiota mediante probióticos como una estrategia en la reducción del riesgo de fracturas por fragilidad. Es necesario seguir realizando más estudios en esta línea de trabajo/investigación, con el fin de encontrar nuevas evidencias que puedan ser trasladadas a nuestra práctica clínica habitual.
Nivel de evidenciaNivel de evidencia III.
FinanciaciónEste estudio ha sido financiado por la Ayuda a Proyectos de Investigación en Cirugía Ortopédica y Traumatología, 2019, dotada con 12.500€. El ID de la beca es el autor: J. Doménech Fernández.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.