Describir el desarrollo y caracterización de un material vitrocerámico y la respuesta inicial de células madre mesenquimales adultas (MSC-A) aisladas de la medula ósea.
Material y metodologíaEl material se obtuvo por calentamiento de un vidrio 55SiO2-41CaO-4P2O5 (mol/%) por el método sol-gel. Las células se aislaron por aspirados directos de cresta ilíaca de pacientes adultos jóvenes. Se estudió el grado de adherencia, proliferación y diferenciación a osteoblastos de las MSC-A sembradas sobre el material. La diferenciación celular se evaluó mediante la producción de osteocalcina y la pérdida del marcador mesenquimal CD90. La proliferación celular sobre el sustrato se realizó mediante el ensayo de reducción de sales de tetrazolio. El material sembrado se implantó en un defecto crítico realizado en fémur de conejo para valorar su capacidad osteorregeneradora, y se observó mediante TAC.
ResultadosLas MSC-A se adhirieron, expandieron, proliferaron y produjeron matriz extracelular mineralizada sobre el material durante el tiempo en cultivo, al mismo tiempo que mostraron fenotipo osteoblástico, e incrementaron la producción de osteocalcina y la pérdida de expresión de CD90. El material se reabsorbió parcialmente al final del estudio.
ConclusiónEl material es citocompatible, osteoconductor, bioactivo, con capacidad de promover la diferenciación de MSC-A a osteoblastos y la neoformación ósea después de su implantación en asociación con MSC-A; es una matriz adecuada para la regeneración del tejido óseo.
To describe the development and characterization of a vitroceramic material as well as the initial response of adult mesenchymal stem (MSCs-A) isolated from bone marrow.
Material and methodologyThe material was obtained by heating glass with composition in mol% 55SiO2-41CaO-4P2O5 by a sol gel method. Cells were isolated from direct iliac crest aspirates from young adult patients. An analysis was performed of the degree of adhesion, proliferation and osteoblastic differentiation of MSCs-A seeded onto the material. Cell differentiation was evaluated through the production of osteocalcin and the loss of the CD90 mesenchymal marker. Cell proliferation on the substrate was performed using the tetrazolium salt reduction method. The seeded material was implanted in a critical defect caused in a rabbit femur in order to determine its osteogenerating capacity; CT observations were carried out.
ResultsMSCs-A se bound to the material, expanded, proliferated and produced mineralized extracellular matrix on the material during the culture period. At the same time, they showed an osteoblastic phenotype, increasing osteocalcin production and losing CD90 expression. The material was partially resorbed at the end of the study.
ConclusionThe material is cytocompatible, osteoconductive, bioactive and has a capacity to promote osteoblastic differentiation of MSCs-A as well as new bone formation following its implantation in association with MSCs-A; an appropriate matrix for bone tissue regeneration.
Los sustitutivos óseos se están diseñando y desarrollando a partir de materias naturales y sintéticas, entre los que se incluyen las cerámicas de fosfato cálcico, los biovidrios (Bv) y las vitrocerámicas bioactivas (Vc)1–3. Estos materiales son biocompatibles, bioactivos y reabsorbibles en diverso grado, con la capacidad de integrarse con el tejido óseo receptor, sin interposición del tejido fibroso. Se utilizan en clínica, en sustitución del tejido óseo, para rellenar pequeños defectos óseos o para incrementar el volumen de los injertos óseos. La posibilidad de aislar células progenitoras osteogénicas adultas (células madre mesenquimales adultas [MSC-A]) ha planteado nuevas estrategias para la regeneración de éstos, y tanto las cerámicas de fosfato cálcico (hidroxiapatita [HA], FTC y compuestos bifásicos) como las Vc y los Bv son capaces de soportar la adherencia, proliferación y formación de matriz extracelular por parte de células diferenciadas de estirpe osteoblástica4–6 debido a las modificaciones que presenta la superficie del material. No es de extrañar el interés por mejorar las propiedades osteogénicas de estos materiales construyendo materiales híbridos más activos biológicamente y sembrando diferentes tipos de células4–8 para imitar la estructura y biología del hueso.
Un compuesto o material híbrido en el que se combine MSC-A alogénicas y una nueva matriz bioactiva en el sistema SiO2-CaO-P2O5 puede alcanzar requerimientos precisos para considerarse como un material osteoconductor, osteoinductor y osteogénico. Para demostrarlo hemos diseñado, desarrollado y caracterizado una matriz compuesta de 55-SiO2; 41-CaO; 4-P2O5 mol/% para comprobar in vitro si las MSC-A son capaces de adherirse, proliferar y expresar diferenciación fenotípica osteoblástica sobre la matriz.
Material y métodosEl vidrio precursor 55% SiO2; 41% CaO; 4% P2O5 (mol %) se obtuvo mediante el método sol-gel9. El gel secado obtenido se molió y se tamizó hasta obtener una fracción de partículas con tamaños de entre 32 y 68mm. Las piezas se obtuvieron compactando 0,1g del gel seco por compresión uniaxial (55MPa) seguida de presión isostática (150MPa) en moldes de acero. Después, se calentó el material a 1.100°C, durante 3h. Finalmente, se obtuvieron discos de 4,8mm de diámetro y 1,3mm de longitud para los estudios in vitro y cilindros de 4,8mm×6mm para los estudios in vivo. Las fases cristalinas presentes fueron seudowollastonita (54%), wollastonita (38%) y cristobalita (4%). Todas las piezas se limpiaron aplicando aire a presión, lavadas varias veces en PBS y se envasaron individualmente, antes de esterilizarse con gas-plasma.
Las piezas se caracterizaron por difracción de rayos X (Microanalysis-Link-ISIS software JEOL 6400, New Brunswick, Canadá), microscopia electrónica de barrido (MEB) (JEOL 6400, Microscope-Oxford Pentafet, New Brunswick, Canadá) y porosimetría de mercurio (Autopore III 9420, Micromeritics Instrument, Norcross, GA, EE. UU.).
La bioactividad in vitro se evaluó sumergiendo el material en un fluido corporal simulado (SBF), durante 3 a 7 días. La morfología del material, antes y después de la inmersión en SBF, se analizó con MEB, espectroscopia de energía dispersiva (EDS) y espectroscopia transformante de infrarrojos de Fourier (espectrómetro Nicolet NEXUS, Oxford, R.U.).
Preparación y cultivo de las células madre mesenquimales adultasLas MSC-A se aislaron a partir de médula ósea por aspirado directo de cresta ilíaca de donantes voluntarios que habían firmado previamente el consentimiento informado. Para el aislamiento celular, el material aspirado se depositó en un tubo que contenía heparina sódica (20U/1ml de aspirado) para su transporte al laboratorio. Se añadió Ficoll (1:1ml) y se centrifugó a 1.800g, durante 30min. Seguidamente, se aspiró el buffy coat y se depositó en un tubo al que se añadió tampón fosfato (PBS, pH 7.4) y se centrifugó a 2.400g, durante 10min (se repitió el procedimiento 3 veces). A continuación, se resuspendió en medio de cultivo alpha-minimal essential medium (alfa-MEM) (Gibco, Invitrogen Corporation, Carlsbad, CA, EE. UU.) suplementado con suero bovino fetal (FCS) (Gibco) al 15% y antibióticos de rutina (penicilina, 100U/ml, y estreptomicina, 100μg/ml) (Gibco). Finalmente, tras estimar la viabilidad con azul tripán, se sembraron las células a una densidad de 1,0×106, en frascos de cultivo de 75cm2, con 10ml de alfa-MEM suplementado, y se incubaron a 37°C, en una atmósfera de CO2 del 5% y el 95% de humedad relativa.
A los 7 días se renovó el medio de cultivo; se eliminaron de esta forma las células hematopoyéticas no adherentes y se seleccionaron las MSC-A sobre la base de su capacidad para fijarse al plástico de los frascos de cultivo. Una semana después, cuando las células fueron confluentes, se subcultivaron en una relación 1:3, y se trató el frasco de cultivo con tripsina al 0,25% y EDTA (0,02%), en PBS durante 5min. Una parte de las células se congeló en medio de cultivo con FCS al 15% y DMSO al 10% para su posterior utilización en diferentes ensayos, y otra parte se utilizó para caracterizar las células y estudiar su comportamiento frente al material así como la posible diferenciación a osteoblastos (OB).
Aislamiento y cultivo de osteoblastosLos OB utilizados como controles en este estudio se obtuvieron mediante el método de digestión enzimática. Pequeñas muestras de tejido óseo esponjoso de 1–2mm se lavaron varias veces en PBS con antibióticos de rutina. A continuación, se incubaron durante 15min a 37°C con colagenasa tipo xi (1,25mg/ml en solución de Hank). El producto de la digestión se filtró a través de una malla de 100μm y se centrifugó, durante 10min, a 200g. Las células obtenidas se resuspendieron en medio de cultivo (DMEM y Ham's F12 1:1,10% de FCS y antibióticos de rutina), y se tiñeron con azul tripán para establecer su número y viabilidad. El medio se renovó cada 3 o 4 días. La incubación se realizó a 37°C en atmósfera del 7,5% de CO2 y humedad relativa del 95%. El primer subcultivo (Po) se realizó a los 7 días en frascos de 25 cm2 previa tripsinización, y se utilizaron los 2 primeros subcultivos para la identificación de las células.
Los OB aislados se identificaron y caracterizaron por su morfología y características de crecimiento con microscopia de contraste de fase y MEB, además de por su capacidad de mineralización (tinción de Von Kossa).
Para la caracterización y diferenciación de las MSC-A aisladas se utilizó un medio de crecimiento (MC) compuesto por alfa-MEM suplementado con el 10% de FCS inactivado por calor y antibióticos de rutina y se incubaron en condiciones estándares. Posteriormente, se separaron de los frascos mediante tripsinización y se sembraron para su caracterización mediante microscopia óptica y MEB, expresión de CD90, CD45 y osteocalcina (OC).
Para el estudio con microscopio electrónico de barrido de la MSC-A, se sembraron 1×105 células en tubos Leighton y se cultivaron en MC durante 15 días. Se realizó el cambio de medio cada 3 o 4 días. Posteriormente, las células cultivadas se lavaron con PBS, se fijaron con glutaraldehído al 3% en tampón cacodilato de 0,1M durante 30min a 4°C. Se lavaron y posfijaron en tetraóxido de osmio durante 1h y se deshidrataron a través de concentraciones crecientes de etanol 30, 50, 70, 90 (v/v) con deshidratación final en alcohol absoluto, y se secaron mediante el método de punto crítico. Seguidamente, unas muestras se recubrieron con oro y otras con carbono (para EDS) y se observaron con el microscopio electrónico de barrido. La superficie del material también se analizó para evaluar la adherencia y proliferación celular, y se utilizó el mismo procedimiento descrito.
Determinación de la expresión de CD90 y CD45 por las células madre mesenquimales adultasSe utilizaron los anticuerpos CD90 y CD45 unidos a isocianato de fluoresceína (BD Pharmingen, BD-Biosciences Europa, Bruselas, Bélgica). Las células se separaron del frasco de cultivo con tripsina/EDTA (0,25/0,25%) y se ajustaron a una concentración de 5×106 células/ml. De la suspensión se tomaron 100μl, se añadieron los anticuerpos y se incubaron durante 15min; seguidamente, las muestras se analizaron en un citómetro de flujo Becton-Dickinson (modelo FACSort, Oxford, R.U.) con láser de argón de 488nm y 15mw. Como controles negativos se utilizaron la línea celular primaria de OB humanos obtenida en nuestro laboratorio y la línea celular Kato III (ECACC, Salisbury, R.U.) de carcinoma humano gástrico.
Producción de osteocalcinaLa producción de OC se realizó en los sobrenadantes de células MSC-A y OB cultivados, y se eliminó el FCS del medio de cultivo 5 días antes de realizar las determinaciones. La presencia de OC se determinó mediante el Gla-type osteocalcin EIA kit (Takara cat# MK111) (Reactiva SA, Barcelona, España); se aplicó el ensayo a todas las muestras y a los estándares del kit por triplicado, y se utilizó la línea de OB como control positivo.
Estudio de la proliferación de las células madre mesenquimales adultas sobre el materialSe sembraron en placas de 96 pocillos; su fondo se cubrió con agarosa al 0,6%, y sobre ella se colocaron los discos sobre los que se sembraron las células. De esta forma, se aseguró que el incremento del número de células detectado durante el estudio correspondería únicamente a las células que crecían adheridas al material. Se sembraron 5×103 células sobre cada disco, y a los 1, 7, 14, 21 y 28 días se estudió la adherencia y el crecimiento de las células, y se determinaron el grado de recubrimiento mediante MEB y el incremento del número de células mediante el ensayo de reducción de sales de tetrazolio (XTT). Brevemente, a cada pocillo se añadió XTT (concentración final, 0,2mg/ml) con menadiona (concentración final, 0,02mM) y se incubó durante 4h. La absorbancia (OD) del medio de cultivo de las células que crecen sobre el material y los controles (crecimiento sobre el plástico) se midió a 450nm en un lector de placas Lab System (mod. Multiskan MCC 340, Fisher Scientific, Pittsburgh, PA, EE. UU.).
Al cabo de un mes, se midió la producción de OC y la expresión de CD90 y CD45 de las células cultivadas para valorar una posible diferenciación de las MSC-A a OB. Tanto las medidas de la proliferación celular sobre el material como las determinaciones enzimáticas se realizaron por triplicado.
Diseño del estudio in vivoSe utilizaron un total de 12 animales (conejo albino de Nueva Zelanda) adultos y de ambos sexos, de un peso aproximado de 3,5–4 kg, en los que se realizaron resecciones segmentarias críticas en fémures derechos. El defecto se rellenó con el material híbrido y se estabilizó mediante un fijador externo. En el fémur contralateral se realizó el mismo defecto sin rellenar como grupo control.
Los animales se distribuyeron aleatorizadamente en 3 períodos de estudio establecidos (1, 3 y 6 meses), y se asignaron 4 animales a cada grupo. Permanecieron en jaulas individuales, comieron y bebieron ad libitum, y se controlaron las condiciones ambientales según el protocolo establecido por la Comisión de Ética y Uso y Cuidado de Animales de Laboratorio de la Universidad de Murcia.
El implante se preparó mediante la asociación de MSC-A y el material objeto de estudio. Las células en cultivo correspondientes al segundo pase (P2) se despegaron del frasco utilizando tripsina-EDTA al 25% durante 5min en incubación, seguidamente centrifugadas a 1.000g/10min y resuspendidas en MC; al mismo tiempo, el material se sumergió en FCS y se incubó durante 30min. Las células se sembraron sobre la superficie del material por pipeteo directo (1×104 células/cm2) y se cultivaron en condiciones estáticas durante una hora antes de añadir el medio de cultivo. El implante híbrido se mantuvo en incubación una semana antes de su implantación en el defecto óseo.
La técnica anestésica se llevó a cabo siguiendo el protocolo establecido (ketamina de 50mg/kg, i.m.; clorpromacina de 10mg/kg, i.m.) con profilaxis antibiótica (amoxicilina de 20mg/kg, i.m.) en dosis única. El dolor postoperatorio se controló mediante la administración de ácido tolfenámico (0,1mg/kg, s.c.), cada 12h durante 2 días. Se expuso el fémur derecho a través de un abordaje lateral directo sobre el tabique intermuscular cuádriceps y bíceps femorales isquiotibiales; el primero se rechazó anteriormente y los segundos se rechazaron posteriormente. Se desperiostizó la diáfisis desde 1cm distal del trocánter mayor y 1cm proximal del epicóndilo lateral. Realizamos hemostasia cuidadosa con electrobisturí. Se implantó un clavo proximal en la base del trocánter mayor, y otro distal, en las inmediaciones del epicóndilo. Seguidamente, con la plantilla, se implantaron los 2 clavos restantes. A continuación, se resecó un segmento óseo critico, 1,5cm en el tercio medio diafisario, incluyendo el periostio, mediante minisierra circular e irrigación continua. El espacio resultante fue lavado repetidas veces con suero fisiológico. A continuación se adaptó el fijador y se implantó el material híbrido en el defecto; se fijaron los componentes del fijador, con lo que se aseguró la alineación y la estabilidad. Finalmente, se cerró por planos con material de sutura reabsorbible (Vicryl® 3/0 y Vicryl-Rapid® 3/0). Los animales se sacrificaron previa sedación (ketamina, 10mg/kg, i.m.) con una sobredosis de thiopental por vía intracardíaca.
Estudio radiográficoSe obtuvieron radiografías simples y TAC de los especímenes, desprovistas de partes blandas adheridas, en los diferentes períodos de estudio.
Estudio anatomopatológicoLas muestras obtenidas se fijaron inicialmente en formol neutro al 10%; seguidamente, se descalcificaron (TBD-1) y deshidrataron en alcohol a concentraciones crecientes, y, finalmente, se incluyeron en parafina y se tiñeron con hematoxilina-eosina y tricrómico de Masson.
Análisis estadísticoSe aplicó un análisis de variancia (ANOVA) de medias repetidas para valorar la significación estadística de los resultados. Valores de p<0,05 se consideraron significativos para los estudios in vitro. Los datos, después de aplicar una transformación logarítmica natural, cumplían las condiciones de homocedasticidad y esfericidad requeridas para el análisis.
ResultadosCaracterización del materialEl material mostró que la fase cristalina fue seudowollastonita, wollastonita, fosfato tricálcico y cristobalita. La formación de una capa apatita sobre la superficie del material después de la inmersión en SBF fue un indicador de bioactividad in vitro. A los 3 días de inmersión, la superficie del material se recubrió con una neocapa de pequeños agregados de aspecto cristalino, tamaño que se incrementó a los 7 días de inmersión. El análisis mediante EDS mostró un incremento del contenido de calcio y fósforo y una disminución del contenido de silicio, mientras que en el espectro de infrarrojos se observaron nuevas bandas correspondientes a grupos fosfato (fase apatita) y una disminución de las bandas de seudowollastonita debida a la solubilización de esta fase.
Caracterización e identificación de las células madre mesenquimales adultasLas células adherentes aisladas a partir de aspirados de médula ósea e inicialmente consideradas como MSC-A mostraron, al principio (24–48h), una morfología variable fusiforme, bipolar o tripolar cuando crecían a baja densidad, que maduraron con el tiempo hasta crecer en monocapa. Después del primer subcultivo y en los sucesivos, las células volvieron a crecer de forma uniforme en el fondo de la placa sin formar colonias.
Los OB aislados de tejido óseo esponjoso, utilizados como control de diferenciación, presentaron un tamaño mayor, con una morfología generalmente tripolar, con largas prolongaciones citoplasmáticas y un crecimiento característico en multicapas, que formaron nódulos que crecían de forma radial y en cuyo centro se observaban acúmulos de material refringente. Este material se identificó posteriormente como depósitos de calcio (tinción de Von Kossa). Con el microscopio electrónico de barrido, las MSC-A mostraban un aspecto aplanado, alargado y en ocasiones poligonal con variables y extensas prolongaciones citoplasmáticas, y en su superficie exhibía espículas y pequeños nódulos. Más tarde, cuando el cultivo fue confluente, crecieron en multicapa y las células adoptaban una morfología fusiforme con tendencia a orientarse en la misma dirección con abundantes filopodias e interconexiones celulares.
Las MSC-A, en MC durante 15 días, apenas mostraron niveles de OC. Sin embargo, los OB utilizados como control produjeron niveles apreciables de OC en el mismo medio.
Las células adherentes obtenidas de aspirado de médula ósea, inicialmente consideradas como MSC-A, fueron positivas para el CD90 (CD90+) y fueron negativas para el anticuerpo hematopoyético CD45 (CD45−), lo que indicaba que estas células presentaban antígenos de membrana característicos de células madre mesenquimales (MSC). Tanto las células Kato III como los OB fueron CD90−.
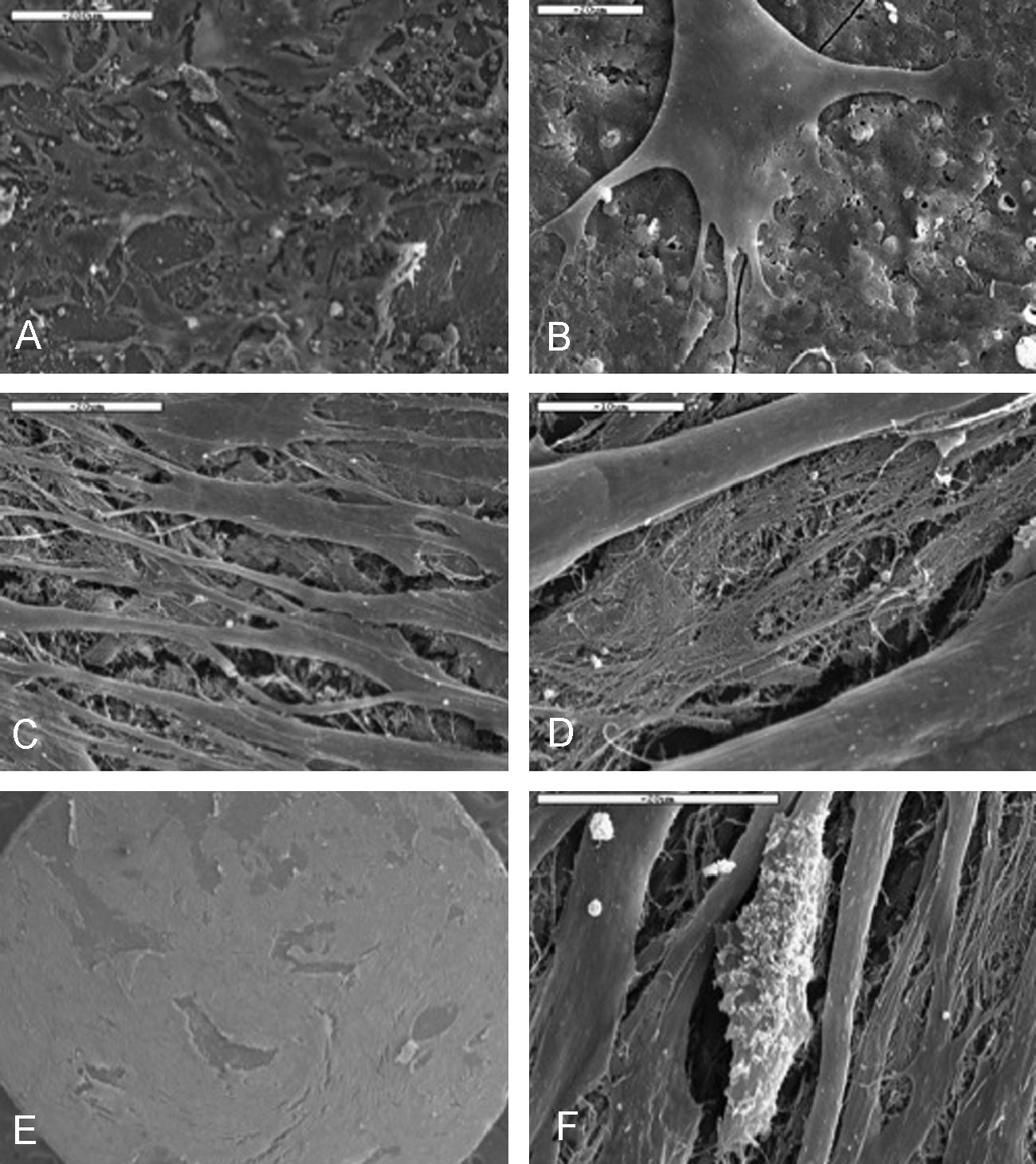
Crecimiento de las células madre mesenquimales sobre el materialEn el ensayo con XTT, los valores de absorbancia detectados a las 24h fueron muy bajos, e indicaron que el número de células que inicialmente se adhirieron al material era escaso. Sin embargo, el crecimiento de aquellas células que fueron capaces de fijarse fue progresando de forma exponencial. Mediante MEB (fig. 1) vimos que en las primeras 24h de cultivo varias células se habían adherido de forma aislada o constituyendo pequeños grupos dispersos a la superficie de aspecto rugoso del material. Esta adherencia fue firme por medio de múltiples digitaciones citoplasmáticas (filopodios) que se desplegaban sobre la superficie del material, lo que aumentó el área de contacto con el material. A los 7 días, las células se expandieron y propagaron, y llegaron a formar acúmulos dispersos por la superficie; se observó alguna interconexión citoplasmática entre ellas. Después de 2 semanas en cultivo, las células siguieron proliferando e incrementando su número, y en determinadas áreas eran patentes pequeños depósitos de matriz fibrilar extracelular. A los 21 días, las células se hicieron confluentes: adoptaron una morfología fusiforme y en ocasiones formaban multicapas y mostraban un mayor número de interconexiones así como abundante matriz extracelular; llegaron a cubrir la totalidad de la superficie de los discos. Además, la superficie celular mostraba un aspecto granulado debido a la presencia de abundantes nódulos de aspecto blanquecino que emergían de la superficie.
Microfotografía con microscopía electrónica de barrido (MEB) de las células creciendo sobre la superficie del material que muestran: A) a las 24h en cultivo; B) adherencia firme de las células por medio de extensiones citoplasmáticas; C) a los 7 días; D y E) a los 21 días, ocupando los espacios intercelulares; F) aspecto granular a los 21 días (barra: 200, 20, 20, 10, 300 y 20μm, respectivamente).
Al finalizar el ensayo del crecimiento de las MSC-A sobre el material, se realizaron determinaciones de OC y CD90 y CD45 para determinar si se había producido algún efecto funcional o diferenciador en las células.
Las células que crecieron sobre el material presentaron mayores niveles de OC que las células que crecieron sobre el plástico y utilizaron el mismo medio de cultivo, por lo que intuimos que el material indujo la producción de OC en las MSC-A.
Los resultados obtenidos mediante CMF mostraron que la expresión de CD90 se redujo considerablemente (18,9%) en las células que crecieron sobre el material respecto a las células que crecieron sobre plástico en las mismas condiciones.
A los 16 días, las MSC-A cultivadas en tubos Leighton produjeron MEx en forma de una red fibrilar que ocupa los espacios intercelulares; además, se identificaron depósitos de material granular de aspecto blanquecino incluidos en la trama fibrilar.
Estos hallazgos, junto con la expresión de OC, la presencia de matriz mineralizada y la pérdida progresiva del marcador CD90, podrían ser datos suficientes para afirmar que las MSC-A han realizado un proceso de diferenciación, y muestran un fenotipo osteoblástico.
Modelo experimental in vivoTodas las heridas curaron sin complicaciones, y no se observaron signos de infección incluso en aquellos especímenes que murieron sin causa aparente o que se sacrificaron debido a otro tipo de complicaciones.
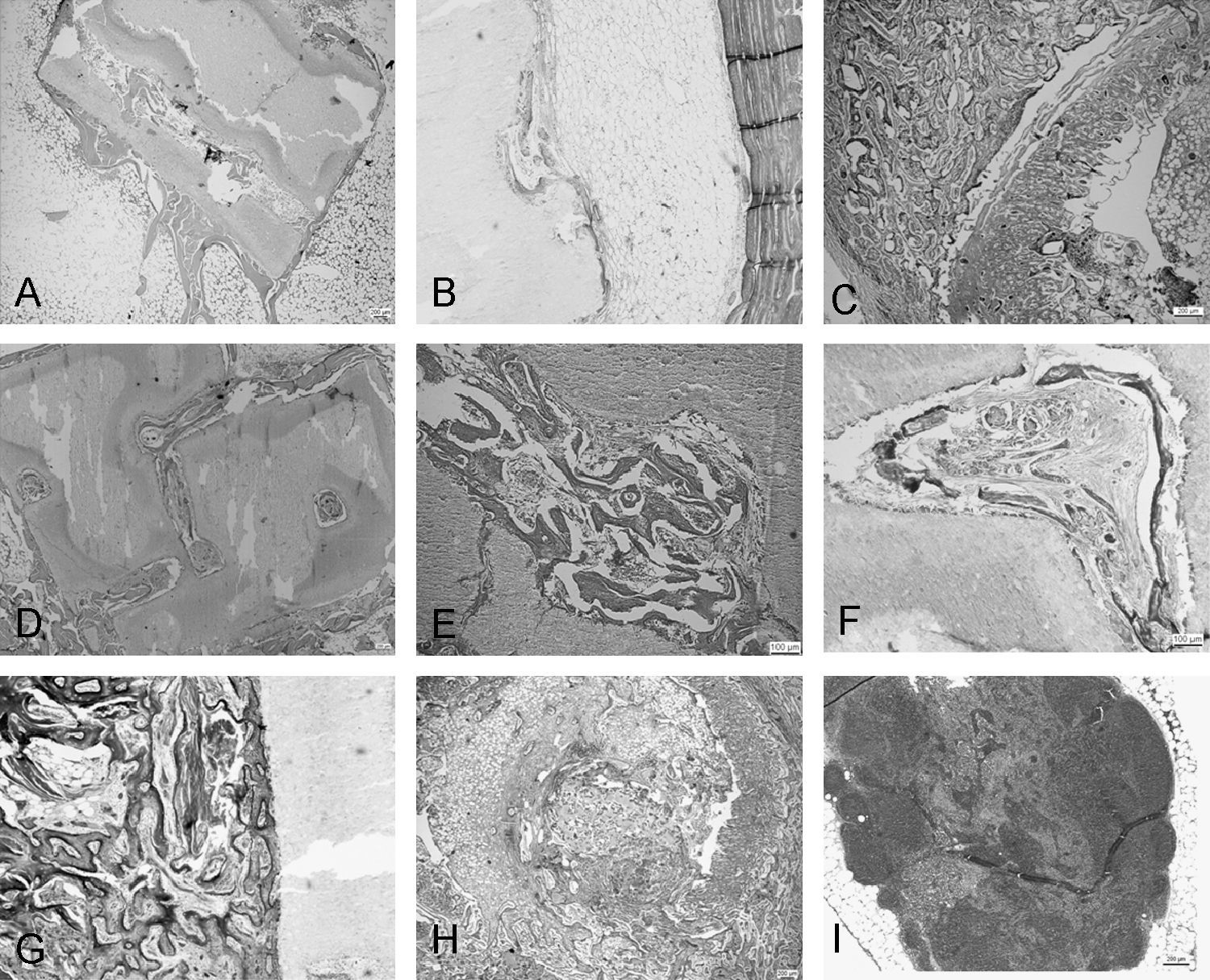
Histológicamente (fig. 2), al mes de evolución observamos la conservación del material implantado que mostró fenómenos de colonización de la médula ósea hematopoyética hacia el interior del material implantado, que en algunas zonas llega a contactar originando un patrón reticulado. Alrededor del implante, la médula ósea adyacente mostraba múltiples focos de neoformación ósea con depósitos de osteoide y trabéculas óseas neoformadas que ocupaban casi todo el perímetro del material. En la zona del defecto óseo, se observaron fenómenos de regeneración ósea caracterizados por acúmulos de tejido de granulación con depósitos irregulares de material osteoide y osificación endocondral que delimitan el perímetro del material implantado, así como fenómenos de remodelación parcial.
Microfotografía con microscopio óptico: A) al mes, (Hematoxilina eosina [HE], 200×); B) cortical ósea, médula ósea y porción periférica del implante (tricrómico de Masson, 312,5×); C) callo periférico en formación (tricrómico de Masson, 250×); D) a los 3 meses (HE, 400×); E) tejido óseo en el interior del implante (HE, 500×); F) trabéculas neoformadas dentro del poro (T. Masson, 400×); G) a los 6 meses (tricrómico de Masson, 200×); H) reabsorción del material implantado y sustitución parcial por tejido óseo en uno de sus extremos (HE, 500×); I) ganglio linfático regional con adenitis crónica reactiva (HE, 125×).
A los 3 meses, los fenómenos de colonización eran más extensos, así como las áreas de neoformación ósea con presencia de abundantes depósitos de osteoide y trabéculas óseas neoformadas tapizadas por numerosos osteoblastos. Fenómenos que se observaban con mayor detalle con la técnica de tricrómico de Masson.
Finalmente, a los 6 meses, el defecto está prácticamente relleno de tejido óseo neoformado, aunque no totalmente remodelado. En cuanto al material, destacan las áreas de reabsorción y sustitución por tejido óseo neoformado que alcanza su máxima intensidad en sus extremos.
No anotamos respuesta adversa de tipo inflamatorio así como formación de cápsula fibrosa que delimite al material implantado del tejido óseo adyacente, ni otros tipos de alteraciones patológicas asociadas. Observamos adenopatías regionales que microscópicamente correspondían a adenitis crónica reactiva caracterizada por hiperplasia folicular cortical con intensa histiocitosis sinusal.
En la TC a las 4 semanas, el material implantado apareció como un elemento cuboideo de elevada densidad en el interior del defecto óseo rodeado por una línea radiolucida. A los 3 meses, el material implantado se podía observar con una densidad similar a la del tejido óseo. Se observó una neoformación ósea voluminosa periférica que sobrepasaba los límites del defecto.
A los 6 meses, vimos un callo óseo hipertrófico que rellenaba todo el defecto sin evidenciar la formación de hueso ectópico. Por el contrario, en el defecto óseo control sólo se observó una limitada neoformación ósea en sus extremos y una ausencia de reparación ósea en su interior. En los cortes tomográficos transversales aparecieron líneas trabeculares de densidad calcio que desde el tejido óseo adyacente se dirigían hacia el interior del implante. El implante en el interior del defecto óseo presentaba cambios en su forma y una disminución de su tamaño desapareció su disposición reticular.
DiscusiónLa sustitución del tejido óseo mediante técnicas de ingeniería tisular implica el uso de matrices biocompatibles, osteoconductoras y bioactivas que favorezcan la adherencia y el crecimiento celular in vitro, para posteriormente trasplantarse en el defecto que se va a reparar. Parte de los materiales han demostrado su capacidad de influir en la adherencia, proliferación y diferenciación de un modo muy variable, debido a las características dinámicas o reactivas de su superficie, lo que permite la liberación de iones Ca, P, Si, Na, Mg cuando entran en contacto con los fluidos biológicos y puede influir en la respuesta celular10,11.
El material desarrollado para este estudio presenta una composición de 55SiO; 41CaO; 4P2O5 (mol/%) y mostró una rápida bioactividad in vitro relacionada con la formación de una capa de apatita en su superficie, a los 3 días de inmersión en SBF9,12,13. Esta capa es esencial para la unión química primaria del material en el tejido óseo receptor después de implantarse. De igual modo, la capa apatítica formada junto con la liberación iónica de Si, Ca, P, Na al medio puede afectar a la respuesta celular11,14–16 al igual que la alcalización del medio, causada por la liberación de Na.
La producción de OC es un marcador bioquímico de uso frecuente en la determinación de la funcionalidad de los OB, al igual que la producción de fosfatasa alcalina y colágeno tipo i. Sin embargo, la producción de OC es una característica exclusiva de los OB, y se considera el procedimiento más sensible y específico a diferencia de la producción de fosfatasa alcalina y colágeno i, que también son producidos por fibroblastos y otros tipos celulares. Por este motivo, la producción de OC fue el criterio utilizado en nuestro estudio para controlar el proceso de diferenciación de MSC-A aisladas de médula ósea a OB, y se utilizaron como control positivo una línea celular primaria de OB aislada a partir de tejido óseo esponjoso17 y la línea Kato III. Para valorar su producción, tanto las MSC-A como los OB aislados se cultivaron en MC. En esta situación, los OB produjeron espontáneamente cantidades apreciables de OC; por el contrario, las MSC-A no fueron capaces de hacerlo ni en los primeros subcultivos ni después de 2 meses en cultivo. Pero cuando las MSC-A se cultivaron sobre el material, se observó un incremento en la producción de OC, lo que indicó que expresaban fenotipo osteoblástico. Este hecho se acompañó de la pérdida paulatina de la expresión del marcador CD90 característico de las MSC-A. Sobre la base de estos hallazgos, podemos asumir que el material ejerce por sí mismo un cierto efecto inductor de la diferenciación osteoblástica de las MSC-A. Este efecto podría estar favorecido por la liberación de iones de Si, Ca y P al medio y también por el incremento del pH12, que influirían en la actividad enzimática intracelular, de modo similar al control genético que algunos Bv ejercen sobre el ciclo celular de los OB, lo que favorece la expresión de genes que regulan la osteogénesis y la producción de factores de crecimiento18,19. El mecanismo por el que el material objeto de estudio induce la diferenciación de las MSC-A a OB se investigará en futuros trabajos.
La capacidad de las células de producir matriz mineralizada y nódulos de mineralización es un aspecto importante para destacar, en cuanto al diseño y desarrollo de materiales para la regeneración ósea.
En nuestro estudio, al igual que en el de Vrouwenvelder et al20, las células que crecieron en presencia del material fueron capaces de producir, aunque no de forma uniforme, pequeños depósitos de mineral con contenido Ca-P, identificados mediante tinción histoquímica de Von Kossa y microanálisis-EDS, tanto en el interior de la matriz como en las proximidades de las células. La matriz mineralizada producida por las MSC-A cultivadas sobre el material, asociada a la producción de OC y a la pérdida del marcador CD90, apoya la interpretación de que las MSC-A fueron diferenciándose hasta presentar un fenotipo osteoblástico inducido por el material. La formación de nódulos de mineralización básicamente está considerada como el resultado final del proceso de diferenciación a OB20,21.
Las células que crecieron sobre el material, inicialmente, mostraron una forma aplanada, digitaciones citoplasmáticas y una membrana celular homogénea. Con el tiempo en cultivo, algunas de éstas mostraban en la membrana celular algunas irregularidades a modo de pequeños gránulos. Además, las células presentaban abundantes filopodias y conexiones intercitoplasmáticas, características similares a las observadas por Vrouwenvelder et al20, que las describieron como características de los OB. Las células exhibieron una buena adherencia sobre la superficie del material, favorecida por la forma expandida que exhibían y por sus abundantes filopodias. Estas observaciones son similares a las descritas para los OB sembrados sobre cerámicas de HA, titanio y Vc por parte de diversos autores17,20–22.
Para valorar la capacidad de proliferación, las MSC-A se sembraron sobre el material, y para obtener datos precisos al respecto se añadió agarosa al fondo de los pocillos para evitar la adherencia y el crecimiento de las células en los espacios entre el disco y las paredes del pocillo. Los hallazgos en los diferentes períodos del estudio mostraron una buena adherencia de las células sobre la superficie del material, dada la forma desplegada que exhibían. Este hecho, en coincidencia con Vitale-Brovarone et al22, tiene lugar en un primer momento y es previo a la proliferación y diferenciación. Las células crecieron de forma exponencial, si bien en los primeros momentos su crecimiento fue algo más lento debido al período de adaptación al medio.
En cuanto a la citocompatibilidad del material, tanto la adherencia como la producción de OC son datos para considerar a la hora de valorar esta propiedad. En nuestro estudio, el hecho relevante de observar tanto una excelente adherencia y proliferación celular así como un incremento de la producción de OC constituye un indicador de biocompatibilidad.
Entre un considerable número de grupos de investigación en el campo de los biomateriales han diseñado y aplicado para su evaluación preclínica diversos modelos de defectos óseos segmentarios en diferentes especies animales. Para poder comparar los diferentes estudios y tomarlos como base para desarrollos posteriores, y especialmente con vistas a su traslación a la clínica, es esencial que tanto el modelo animal como el dispositivo de fijación, la técnica quirúrgica, el método de cuantificación, etc. sean aspectos estandarizados. En esta nueva disciplina emergente, la ingeniería de tejidos, los principios generales se centran en la asociación de células con un andamiaje o matriz (natural o de síntesis) para conseguir un material híbrido más biológico, implantable en el defecto que se va a reparar. Sin embargo, si revisamos la literatura médica podemos darnos cuenta de que la mayoría de los modelos preclínicos utilizados para el estudio de defectos óseos críticos no están suficientemente descritos y estandarizados debido a que cuando se selecciona un modelo animal (rata, conejo, oveja, perro, minicerdo, etc.) no se tienen en consideración diversos factores relacionados con analogías fisiológicas y fisiopatológicas del humano (edad, sexo, microestructura ósea, tasa de metabolismo, etc.). Aunque todos ellos aportan un número de ventajas e inconvenientes, creemos que la elección del modelo debe ajustarse para dar respuesta a una cuestión concreta, sin infravalorar otros factores, como coste, mantenimiento, manejabilidad, tamaño esquelético, viabilidad, aceptación social, tolerancia a la cautividad, estabulación, etc. En nuestro estudio hemos elegido al conejo albino Nueva Zelanda por ser el más utilizado, después de la rata, en estudios de reparación-regeneración ósea en publicaciones más destacadas de nuestra especialidad23. Recientemente, diferentes preparados (FTC, hormonas, MSC, polímeros, etc.), desarrollados por ingeniería tisular, se han utilizado para la regeneración de defectos óseos diversos (tibia, fémur, cúbito, radio) en diferentes especies, razones por las que es difícil contrastar nuestros resultados24–26. No obstante, hoy todos coincidimos en que para la formación del tejido óseo se requiere: a) una fuente de MSC multipotenciales capaces de diferenciarse a OB; b) factores de crecimiento (proteínas osteoinductoras) que conduzcan a estas células a emigrar sobre el defecto, proliferar y diferenciarse a OB; c) una matriz reabsorbible que soporte la adherencia y migración de estas células dentro del defecto, y d) la formación de una red vascular en el tejido neoformado (angiogénesis).
En cuanto al tipo celular utilizado en este estudio, Arinzed et al26 y De Nicola et al27 demostraron que las MSC-A alogénicas no provocan respuesta inmunitaria adversa cuando se han implantado en defectos óseos, y no precisan tratamiento inmunosupresivo; indican en sus estudios que las MSC son capaces de suprimir la proliferación de las células T, además de no expresar moléculas de la clase ii. Estas características las convierte en reguladoras de la respuesta inmunitaria; en ocasiones, se han utilizado de modo experimental, para mejorar la supervivencia de los aloinjertos28. Esos hechos confieren cierta confianza a la hora de diseñar este tipo de materiales híbridos. Histológicamente, hemos observado una cantidad sustancial de hueso neoformado tanto en las porciones periféricas del implante como en el interior de sus poros, superiores a las encontradas en los defectos sin tratar. Al igual que observaron Bruder et al24, a los 3 meses del estudio el defecto implantado prácticamente se había rellenado con tejido óseo que creció de un modo hipertrófico, y sobrepasó los límites del defecto. No hubo evidencias de formación de hueso ectópico. No se observó reacción inflamatoria adversa durante todo el tiempo del estudio.
El hecho de que los implantes estén inmersos en amplias zonas de la medula ósea y que la supervivencia de las MSC-A en el lugar de su implantación sea superior a las 4semanas, como han demostrado Gazit et al29, nos evidencia que el material promovió el proceso de diferenciación de la MSC-A a OB productores de tejido óseo, y no se descarta la posibilidad de que ejerza un efecto directo sobre otras células osteoprogenitoras periféricas incluidas entre las poblaciones celulares de la medula ósea. Nuestro diseño experimental no nos ha permitido cuantificar el número de células que finalmente crecieron sobre el material antes de su implantación en el defecto, aunque su crecimiento tuvo un carácter exponencial con el transcurso del tiempo.
Aparentemente, el tejido óseo neoformado se inició tanto en la periferia del defecto como en el interior de éste, concretamente en las proximidades del material, lo que corrobora el efecto osteoinductor sobre las MSC-A y, probablemente, sobre otros progenitores celulares de la medula ósea hematopoyética. El proceso de reabsorción del material se inició en la superficie de éste, aunque no llegó a ser completo al final del estudio; éste fue uno de los inconvenientes de este material.
La elección de la matriz adecuada para soportar la adherencia y proliferación de las MSC sigue siendo un tema sujeto a discusión. No obstante, los materiales basados en sistemas Ca-P y con una relación próxima a la fracción mineral del tejido óseo (1:67) corresponden a la matriz más utilizada. Sin embargo, muestran una dudosa actividad osteinductora capaz de iniciar la diferenciación hacia células de estirpe osteoblástica. Por otra parte, la baja tasa de reabsorción, sobre todo de la HA, podría limitar a largo plazo el éxito tanto de estos materiales como de los bifásicos, principalmente si guardan una relación 65:35 a favor de la HA. En este sentido, se precisaría ampliar los estudios centrados en otras proporciones más a favor del FTC.
En nuestro trabajo hemos desarrollado una estrategia diferente para la reparación de defectos óseos, que incluye la implantación directa de MSC-A alogénicas sembradas sobre una matriz porosa bioactiva y osteoinductora, y esta última propiedad es lo que la hace novedosa con respecto a otras.
El material testado en este estudio ha mostrado excelentes propiedades en cuanto a grado de bioactividad e histocompatibilidad. Además, ha sido capaz de proporcionar un ambiente adecuado para soportar la adherencia, la expansión y la proliferación de MSC-A. Durante el tiempo en cultivo con el material, las MSC-A expresaron un fenotipo osteoblástico caracterizado por la producción de OC, producción de matriz extracelular mineralizada al mismo tiempo que se detectó la pérdida de expresión del marcador CD90. La diferenciación de MSC-A alogénicas a OB tuvo lugar por el efecto osteoinductor del material sobre las células.
En el estudio in vivo, el material híbrido desarrollado fue capaz, después de su implantación, de regenerar la pérdida de sustancia ósea de un defecto crítico segmentario realizado en fémur de conejo.
FinanciaciónEste trabajo ha sido financiado a través del programa de Becas de Investigación 2007, convocadas por la Fundación SECOT.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.






![Microfotografía con microscopio óptico: A) al mes, (Hematoxilina eosina [HE], 200×); B) cortical ósea, médula ósea y porción periférica del implante (tricrómico de Masson, 312,5×); C) callo periférico en formación (tricrómico de Masson, 250×); D) a los 3 meses (HE, 400×); E) tejido óseo en el interior del implante (HE, 500×); F) trabéculas neoformadas dentro del poro (T. Masson, 400×); G) a los 6 meses (tricrómico de Masson, 200×); H) reabsorción del material implantado y sustitución parcial por tejido óseo en uno de sus extremos (HE, 500×); I) ganglio linfático regional con adenitis crónica reactiva (HE, 125×). Microfotografía con microscopio óptico: A) al mes, (Hematoxilina eosina [HE], 200×); B) cortical ósea, médula ósea y porción periférica del implante (tricrómico de Masson, 312,5×); C) callo periférico en formación (tricrómico de Masson, 250×); D) a los 3 meses (HE, 400×); E) tejido óseo en el interior del implante (HE, 500×); F) trabéculas neoformadas dentro del poro (T. Masson, 400×); G) a los 6 meses (tricrómico de Masson, 200×); H) reabsorción del material implantado y sustitución parcial por tejido óseo en uno de sus extremos (HE, 500×); I) ganglio linfático regional con adenitis crónica reactiva (HE, 125×).](https://static.elsevier.es/multimedia/18884415/0000005400000001/v1_201305031810/S1888441509002902/v1_201305031810/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
