En losúltimos años, el avance de la quimioterapia, lasnuevas tecnologías de criopreservación de tejidos yel desarrollo de nuevos instrumentos y técnicasquirúrgicas en el tratamiento de los tumores, han cambiadolos planteamientos de la cirugía oncológicaósea, lo que hace que la amputación sea cada vezmenos frecuente19,20,23-25,27-29 y prosperentécnicas más conservadoras. En la cirugíatumoral se requieren resecciones extensas con una cirugíaagresiva que puede causar problemas en sureconstrucción,5,6,8,32 para los que se puedenproponer diferentes alternativas, como las endoprótesis y eltrasplante óseo, autólogo oalogénico.3,4,7,8,12,19
Los injertosóseos tienen como función promover laosteoconducción y ofrecer un soporte mecánico. Encualquier caso, todo injerto óseo cortical debe restablecerla continuidad ósea como un material de sustitucióncapaz de resistir y de transmitir las solicitacionesmecánicas del esqueleto.
En el presenteestudio se analizó la incorporación (desde el puntode vista radiológico, gammagráfico ehistológico) de los aloinjertos masivos en pacientestumorales y la posible influencia de la histocompatibilidadreceptor/donante en dicha incorporación.
Material ymétodo
Desde elaño 1986 hasta 1998 se han empleado: 72 aloinjertos paraenfundar prótesis, 71 aloinjertos intercalares, 34osteoarticulares y 21 aloinjertos de otro tipo (artrodesis conaloinjerto cortical, injertos pélvicos, esternales, etc.)con una longitud media de 19 cm (mínimo: 4 y máximo:42 cm), en pacientes con una edad media de 19,6 años(mínimo 3 y máximo 69 años).27 En22 pacientes se emplearon dos aloinjertos y en seis casos tres (porfallo del primero, metástasis ósea o presentar variaslocalizaciones de su tumor primario). Todos los pacientes fueronsometidos a tratamiento quimio y/o radioterápico siguiendoel protocolo establecido para cada tipo de tumor.
En el presenteestudio se analizó la consolidaciónradiológica de los 158 aloinjertos con más de dosaños de evolución, colocados en 139 pacientes, querepresentan 135 uniones diafisarias injerto-hueso receptor y 58uniones metafisarias. La osteotomía fue horizontal en todoslos casos metafisarios, si bien el tipo de osteosíntesis fuemuy diversa. Por el contrario, las osteotomías diafisarias,fueron en 81 casos horizontales y en 54 oblicuas. Para sufijación se utilizaron en 58 casos, placas y en 77, clavosintramedulares.
El tiempo mediode seguimiento fue de 54 meses (mínimo: 24 y máximo133 meses). En el seguimiento de estos pacientes se han efectuadoradiografías mensuales de control durante el primeraño, posteriormente se hicieron controles cada tres meses y,después del segundo año, cada seis meses.
Para evaluar laconsolidación se siguieron los criterios de la ISOLS(International Symposium On Limb Salvage), que clasifica launión aloinjerto-hueso como: excelente (línea deosteotomía no visible), buena (unión > 75% con unalínea de osteotomía todavía visible),aceptable (unión entre 25-75%) y pobre (no evidencia decallo o unión < 25%).
Seestudió la influencia sobre la consolidación medianteun análisis estadístico multivariante de lossiguientes parámetros: a) edad del paciente y del donante,b) longitud del aloinjerto, c) localización, d)osteotomía, e) tipo de osteosíntesis, f) empleo dequimio y/o radioterapia en sus diversas modalidades.
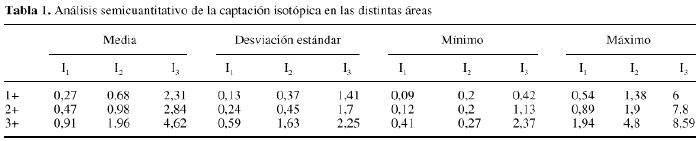
Además,en 36 de estos pacientes se efectuó un estudio prospectivode captación isotópico con Tc99-MDP para evaluar larevascularización del aloinjerto, efectuándose lalectura, tres horas después de la inyección, por dosobservadores, para efectuar una interpretación cualitativa.La captación en el aloinjerto fue valorada como: similar alos tejidos blandos (0); captación en el aloinjerto menorque en el hueso contralateral (1); actividad en el aloinjertosimilar al hueso normal (2) y captación mayor que el huesocontralateral (3). También se efectuó unamedición semicuantitativa de la captaciónisotópica obteniendo los índices: I1 = A1/A2; I2 =A1/A3; y I3 = A2/A4. Para ello, se considera A1: sobre elaloinjerto; A2 justo por encima del aloinjerto; A3 y A4 en lasmismas zonas que A1 y A2 pero en la extremidad contralateral. Seempleó el test de ANOVA para comparar cada índiceentre los distintos grupos que habían sido clasificadosvisualmente. Cuando se encontraron diferencias significativas, seempleó el análisis de Schefe posthoc.
En los 24aloinjertos retirados por infección o fractura se hizo unestudio histológico con tinciones de hematoxilina-eosina ytricrómico de Masson. También se utilizó latinción de Von Wilebrand para evaluar la viabilidad de losvasos encontrados en el interior de los aloinjertos y, paraconstatar la validez de esta técnica, se realizó lamisma tinción en aloinjertos desechados porcontaminación para su uso clínico. En aquellospacientes a los que se iba a retirar el aloinjerto seinyectó oxitetraciclina 500 mg, seis, cuatro y dosdías antes de la intervención, para estudiar laincorporación del aloinjerto con fluorescencia.
Porúltimo, en los 43 pacientes que recibieron aloinjertos dedonantes multiorgánicos se estudió la compatiblidadHLA entre donante y receptor para comprobar su posible influenciaen la aparición de complicaciones (pseudoartrosis,infección o fractura), mediante el test estadísticode la «U» de Mann Whitney.
Resultados
Estudioradiológico
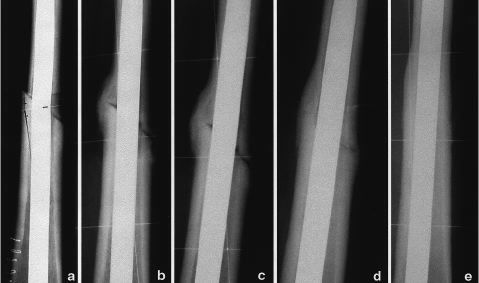
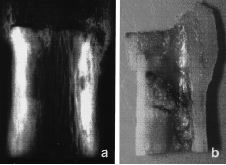
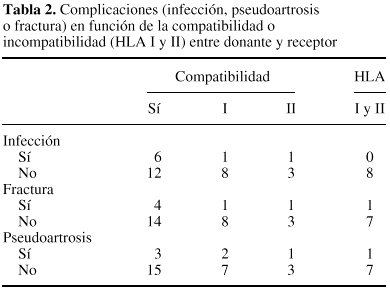
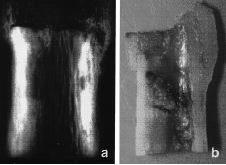
Laconsolidación de las osteotomías metafisarias seobtuvo en un tiempo medio de 6,5 meses con medios defijación mínimos y no se ha encontradorelación con los factores estudiados. Por el contrario, eltiempo medio de consolidación en las osteotomíasdiafisarias fue de 16 meses, encontrando una correlaciónnegativa con la utilización de quimioterapiasistémica (p < 0,05) radioterapia externa (p < 0,01) ycon la edad del paciente (p < 0,01). No se observórelación con los otros parámetros estudiados (Fig.1). En 35 casos (22%) se produjo una pseudoartrosis en launión aloinjerto-hueso, que se resolvió con el aportede autoinjerto en 30 casos (18%).
Figura 1. Evolución radiológica de laconsolidación de la unión diafisaria de un aloinjertocon el hueso receptor.
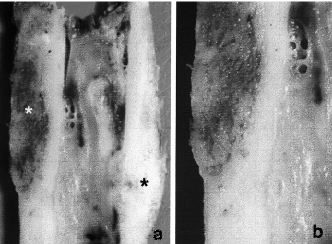
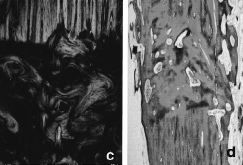
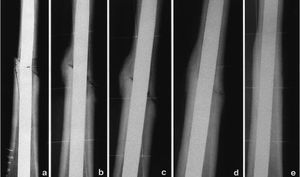
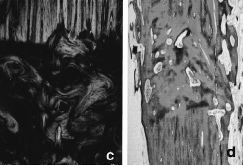
Se observaron 17fracturas (11%), que se resolvieron: en ocho casos, conosteosíntesis y aporte de injerto autólogo (Fig. 2)y, en nueve casos, mediante el recambio del aloinjerto(conminución o infección).
Figura 2. Consolidación de la fractura de unaloinjerto tras la osteosíntesis y el aporte de injertoautólogo. A: neoformación ósea en ambascorticales (*). B: detalle.
Estudioisotópico
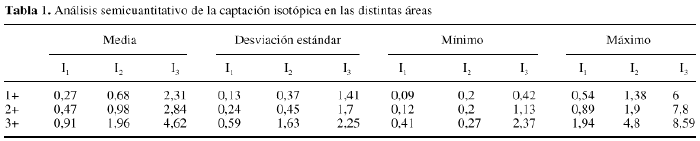
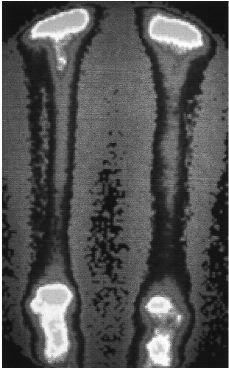
La tabla 1muestra los resultados del análisis semicuantitativo. Nohubo ningún aloinjerto en el que la captación fueravalorada como similar a las partes blandas. Los valores obtenidosen el análisis semicuantitativo fueron diferentes en ladistintas áreas del aloinjerto. La captaciónepifisaria y metafisaria fue, como en el hueso normal, mayor que ladiafisaria. Las zonas de unión entre el aloinjerto y elhueso receptor presentaron mayor captación que el interiordel aloinjerto. Se observó una mayor captación en elinterior de los aloinjertos con mayor tiempo de evolución(Fig. 3). La captación en la cortical de los aloinjertos fuesemejante a la de la extremidad contralateral, excepto en los casosde corta evolución. Tras el estudio estadístico, seencontraron diferencias altamente significativas entre losíndices I1 e I2 en los tres grupos, con diferencias entre elgrupo con captación 1- y los grupos con captación 2-y 3-, significativas también después delanálisis Schefe post hoc. Así mismo, para elíndice I3 las diferencias entre los tres grupos fueronaltamente significativas, aunque tras el estudio Schefe posthoc sólo se encontraron diferencias significativas entrelos grupos 3- y 1-.
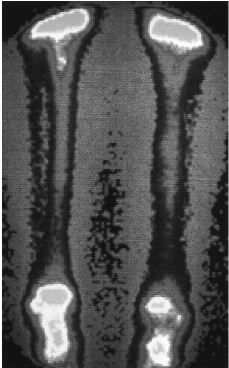
Figura 3. Aloinjerto intercalar distal de tibia tras laresección de un osteo sarcoma. Cinco añosdespués de su implantación la captaciónisotópica del aloinjerto es similar a la del hueso sano,indistinguible de la tibia contralateral.
Estudiohistológico
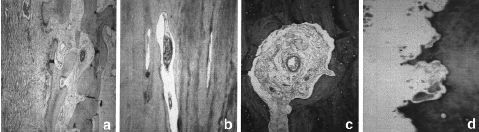
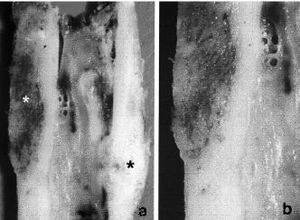
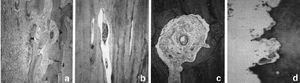
En launión del hueso receptor y el aloinjerto se observóuna neoformación ósea perióstica y, en menorgrado, también endóstica (Fig. 4). El aloinjertopresentó numerosas zonas de hueso necrótico rodeadaspor zonas de hueso en formación, con un proceso desustitución ósea aprovechando los canalesóseos del aloinjerto. La superficie externa del aloinjertopresentó la llegada de numerosos vasos desde las partesblandas. Los vasos encontrados en el interior de los aloinjertosmostraron positividad en la tinción de Von Wilebrand, adiferencia de los aloinjertos no implantados, que se utilizaroncomo grupo control (Fig. 5). Los marcajes de fluorescenciaconfirmaron la aposición de hueso nuevo en el interior delaloinjerto. La unión metafisaria se produjo por unaformación de trabéculas óseas desde el huesoreceptor hacia el aloinjerto.
Figura 4. Unión perióstica diafisariaaloinjerto-hueso receptor. A: imagen radiológica. B: imagenmacroscópica. C: imagen con luz polarizada de launión injerto-hueso receptor (x100), d) uniónaloinjerto-hueso receptor (Tricrómico de Masson *40).
Figura 5. Penetración vascular en el aloinjertocortical. A: unión injerto-hueso receptor, con vasos en suinterior (Tricrómico de Masson *40). B y C: detalle de un vaso en el interior del aloinjerto(Tricrómico de Masson *100).D: osteoclastos efectuando la reabsorción en la superficieperióstica del aloinjerto (Tricrómico deMasson *200).
Compatibilidad HLA
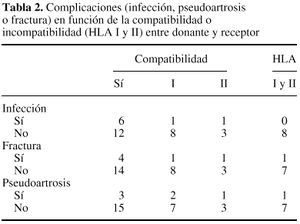
La tabla 2muestra los casos que sufrieron alguna complicación enrelación con la compatibilidad o no compatibilidad de losantígenos HLA tipo I y II entre el donante y el receptor.Aunque el número de complicaciones es mayor en el grupo delos no compatibles, no se encontró relaciónestadísticamente significativa entre la compatibilidad oincompatibilidad HLA y la aparición de complicaciones(pseudoartrosis, fractura o infección delaloinjerto).
Discusión
El estudioradiológico muestra la influencia de factores como laquimioterapia, la radioterapia y la edad del paciente en laconsolidación de los aloinjertos empleados enpatología tumoral. Algunos autores aconsejan el empleosistemático de injerto autólogo para disminuir lastasas de pseudoartrosis de los aloinjertos1,34. Nosotrossomos partidarios de hacerlo únicamente en los casos depseudoartrosis, evitando la morbilidad en el foco donante y elaumento del tiempo quirúrgico. Además, laquimioterapia retrasa la consolidación de estos injertos ypuede hacer ineficaz el gesto quirúrgico del aporte deinjerto autólogo. La radioterapia, por su parte, es otrofactor que retrasa la consolidación del aloinjerto, por eldaño que provoca sobre lavascularización.33-35 La edad del receptor delaloinjerto es otro factor que influye en las posibilidades deconsolidación pues cuanto más joven es un paciente,mayor capacidad osteogénica presenta. Sin embargo, ni lalocalización, ni la edad del donante, ni la longitud delaloinjerto, ni el tipo de osteotomía o deosteosíntesis parecen influir en el tiempo deconsolidación.
El estudioisotópico mostró una captación en losaloinjertos de mayor tiempo de seguimiento similar a la del mismohueso de la extremidad contralateral. Únicamente observamosuna captación disminuida en aquellos aloinjertos con untiempo de evolución corto, lo que puede estar relacionadocon una inhibición de la revascularización atribuiblea la quimioterapia y a la reorganización de los tejidosperiféricos. La captación en la periferia delaloinjerto es una demostración de la penetración delmismo por los vasos desde las partes blandas adyacentes. Lamayoría de los aloinjertos mostraron hipercaptaciónen la zona de unión aloinjerto-hueso, incluso una vezconseguida la consolidación, por lo que, a nuestro entender,este fenómeno no guarda relación con el proceso deconsolidación sino con una mayor penetración de vasospor los extremos que por la periferia del aloinjerto. Elpatrón gammagráfico característico de losaloinjertos pone de manifiesto el proceso derevascularización.2 El análisissemicuantitativo manifiesta de forma objetiva que estacaptación es real, con diferencias significativas entre losdistintos grupos y áreas de interés, y por tanto nopuede atribuirse a la subjetividad del observador.
Básicamente en la incorporación de los injertosóseos confluyen tres mecanismos: a) laosteoinducción,30 b) la osteoconducción yc) el propio injerto, como fuente de formación decélulas óseas.
Laincorporación se produce por un mecanismo denominado por losanglosajones creeping substitution, una reabsorcióngradual del injerto y un reemplazo simultáneo de hueso nuevoque penetra «reptando» en la estructuramuerta.15 Es un proceso lento en el que el huesoneoformado aprovecha los canales de Havers y de Volkman del huesocortical y el espacio intertrabecular del huesoesponjoso.13-14,26,29-31 En las zonas de unióndiafiso-diafisaria se produce un puente perióstico desde elhueso receptor que tiende a englobar y estabilizar el extremo delaloinjerto.
La rotura ycoagulación de los vasos sanguíneos de los sistemasde Havers próximos a la osteotomía induce necrosisósea, dejando un área desprovista deirrigación que desempeña un papel pasivo en laconsolidación. En la unión metafisaria, en cambio, seproduce un crecimiento de trabéculas desde el hueso receptorque penetran en el aloinjerto de una manera másrápida que la formación del puente periósticoen la unión diafisaria. Junto con los puentesperióstico y endóstico, desde las partes blandas querodean el aloinjerto llegan los vasos en el hueso transplantado,como demuestra el estudio isotópico.
En losaloinjertos intercalares se produce una doble invasiónvascular desde las uniones injerto-huésped y, en menorgrado, desde los tejidos blandos, lo que reafirma la importancia deque todo injerto óseo quede bien cubierto por partesblandas.
Coincidimos conotros trabajos9-10,18 en afirmar que laintegración de un aloinjerto intercalar de hueso cortical sepuede producir por dos mecanismos complementarios: unaerosión progresiva de la superficie del aloinjerto y unreemplazo del hueso cortical muerto por penetración a lolargo de los sistemas haversianos preexistentes.
El lento procesode incorporación del aloinjerto explica las dificultades detratamiento de las complicaciones más frecuentes(infección, pseudoartrosis y fractura).27-29 Unainfección de un aloinjerto exige en muchas ocasiones laretirada del mismo para obtener la curación, ya que la lentapenetración de los vasos en el aloinjerto hacedifícil obtener una concentración deantibióticos adecuada. Así mismo, se pueden producirfracturas en un hueso que durante un período largo de tiempopermanece parcialmente muerto, con el consiguiente riesgo de que serompa con pequeños traumatismos. Sin embargo, las fracturasde los aloinjertos pueden ser tratadas medianteosteosíntesis, como si de un hueso normal se tratara, ya queuna buena estabilización permitirá el puenteoperióstico y endóstico, ayudando a la curacióndel foco de fractura.28
Como ya hanpublicado otros autores21 no existe relaciónentre la compatibilidad HLA y la aparición decomplicaciones, que pudiera sugerir una diferencia deintegración entre los aloinjertos que son compatibles con elhueso receptor y los que no lo son.
Agradecimientos
A la Dra. AnaVillas, del Departamento de Medicina Nuclear de la ClínicaUniversitaria de Navarra, por el estudio gammagráfico y aD.a Purificación Ripalda, del Laboratorio deOrtopedia Experimental, por la realización del estudiohistológico.