Con el objetivo de proponer recomendaciones para el manejo perioperatorio de los fármacos modificadores de la enfermedad (FAME) en pacientes con enfermedades reumáticas que van a ser sometidos a cirugía, se ha realizado una revisión sistemática de la literatura. Se realizó una búsqueda de todos los estudios publicados y de los resúmenes de congresos, recopilando 5.285 documentos, de los que finalmente se incluyeron 27 estudios que proporcionan información de 5.268 pacientes y 7.933 cirugías. La mayoría eran mujeres (edad media: 55 años), estaban diagnosticados de artritis reumatoide y el fármaco más estudiado fue el metotrexate (MTX). Las recomendaciones finales son las siguientes: mantener el tratamiento con MTX o leflunomida en el período perioperatorio en ausencia de otros factores de riesgo de complicaciones posquirúrgicas (Nivel de evidencia 1c; Grado de recomendación D) y con respecto a los FAME biológicos, suspenderlos momentáneamente o programar la cirugía lo más alejada posible a la última dosis, espaciando al menos 2 dosis si existieran otros factores de riesgo (Nivel de evidencia 2c; Grado de recomendación D).
The objective of this paper is make recommendations for the perioperative management of antirheumatic treatment based on the best available evidence. A systematic review was performed including studies in which patients with rheumatic diseases treated with biological and non-biological disease-modifying antirheumatic drugs (DMARDs) had undergone surgery. A total of 5,285 studies were recorded, of which 27 were finally included. These contained information on 5,268 patients and 7,933 surgeries. The majority were women (mean age 55 years) were diagnosed with rheumatoid arthritis, and the most studied drug was methotrexate (MTX). The final recommendations include: maintaining treatment with MTX or leflunomide in the perioperative period in the absence of other risk factors for postoperative complications (Level of Evidence 1c, Grade D recommendation). Biological DMARDs should be temporarily suspended, or the surgery scheduled as far as possible from the last dose, and, if there were other risk factors a space at least two doses (Level of Evidence 2c; Grade D recommendation).
Un número elevado de pacientes con enfermedades reumáticas inflamatorias se somete a operaciones quirúrgicas a lo largo de su enfermedad y, muy especialmente, a cirugías ortopédicas. Solo en la artritis reumatoide (AR), se estima que el 26% de los pacientes serán sometidos a algún procedimiento ortopédico en España1. Las complicaciones de una cirugía pueden ser varias, siendo la tasa de complicaciones mayores de la cirugía ortopédica en AR de 3,4 por 100 pacientes/año2. En especial, se teme el desarrollo de infecciones postoperatorias cuya incidencia está en torno al 2% de las intervenciones3,4, o mayor2, según las series.
La suspensión de todos los fármacos modificadores de la enfermedad (FAME), biológicos y sintéticos, antes de llevar a cabo una operación quirúrgica en pacientes con enfermedad inflamatoria reumática es una práctica habitual. El motivo de este procedimiento subyace en el carácter inmunodepresor de estos fármacos, lo que teóricamente aumentaría la probabilidad de infección postoperatoria y, en la creencia no contrastada de que pueden afectar a la curación de la herida quirúrgica. Por otro lado, la suspensión de la medicación de fondo en una enfermedad inflamatoria puede llevar a la reactivación de la misma, situación asociada en sí a complicaciones de todo tipo, incluido un aumento del riesgo de infecciones, por lo que otros reumatólogos son reacios a dicha suspensión. Los datos que apoyan una y otra práctica son muy escasos y dejan aún muchos interrogantes clínicos abiertos, como si es necesaria realmente la suspensión, cuánto tiempo antes y cuánto tiempo después se debería reiniciar el tratamiento con FAME, etc.
El objetivo de este documento fue desarrollar unas recomendaciones para el manejo perioperatorio de los FAME, tanto biológicos como sintéticos utilizados en el tratamiento de las enfermedades reumáticas, que estuvieran basadas en la mejor evidencia disponible.
Material y métodosSe realizó una revisión sistemática de la literatura, siguiendo la metodología Cochrane5 de todos los estudios en los que pacientes diagnosticados de cualquier enfermedad reumática en tratamiento con FAME, biológicos y sintéticos, fueran a ser sometidos a una intervención quirúrgica.
Estrategia de la búsquedaLa búsqueda bibliográfica se realizó por 2 revisores (BH y LC) en las siguientes bases de datos electrónicas: Medline (desde 1950 hasta el 14 de junio de 2010), la Cochrane Library (desde 1972 hasta el 14 de junio de 2010) y EMBASE (desde enero de 1961 hasta el 14 de junio de 2010). La búsqueda inicial se amplió con una búsqueda manual de los resúmenes de los 5 últimos Congresos de la Liga Europea contra las Enfermedades Reumáticas (EULAR) (2007-2011) y del Colegio Americano de Reumatología (ACR) (2006-2010). Adicionalmente se realizó una búsqueda activa de todas las citas bibliográficas de los estudios incluidos. Los resultados de la búsqueda fueron procesados con un gestor de referencias bibliográficas para eliminar los duplicados y seleccionar aquellos que cumplieran los criterios de selección, tanto por título como por resumen. Los artículos con título relacionado con el tema y sin resumen se incluyeron para lectura detallada. De todos los artículos seleccionados se obtuvo la referencia completa y se recabó la información detallada.
Criterios de selección, recogida y análisis de los datosSe seleccionaron estudios que incluyeran pacientes con enfermedades reumáticas inflamatorias en tratamiento con FAME clásicos o biológicos y cuyos objetivos fueran: 1) La comparación de estrategias perioperatorias de tratamiento con FAME (suspender frente a continuar); 2) La medida del riesgo del uso de FAME en relación con las complicaciones quirúrgicas, y/o 3) La frecuencia de las complicaciones. Se excluyeron los estudios sobre los casos clínicos aislados. Dos revisores independientes (AB y LO) llevaron a cabo la selección de artículos, por título y resumen y, un tercero (LC) comparó los artículos seleccionados. Cuatro revisores (AB, LO, MG y BH) realizaron un análisis detallado de los artículos seleccionados recogiendo los datos (tabla 1) de forma independiente en formato en papel y un quinto (DT) los incluyó en un archivo de datos Excel®. La calidad de los estudios se evaluó mediante la escala de riesgo de sesgos de Newcastle-Ottawa6 para estudios observacionales y la de Jadad7 para los ensayos clínicos. Se planeó realizar metaanálisis (LC) en caso de que existiera homogeneidad en al menos 3 estudios (en tipo de estudio, población y medida de desenlace) y, en estudios observacionales, dado que los pocos ensayos clínicos existentes eran de baja calidad. El nivel de evidencia final para apoyar las recomendaciones se estableció en base a los niveles de evidencia del Centro Oxford de Medicina Basada en la Evidencia8.
Datos recogidos de los artículos
| Apartado | Datos | Detalle |
| Datos de la publicación | Autor | |
| Revista y año de publicación | ||
| Características del estudio | Tipo estudio | |
| Intervención | Controlado/abierto/aleatorizado | |
| Observacional | Cohorte (longitudinal observacional prospectivo), retrospectivo, caso control, serie de casos, otros | |
| Características de los pacientes | N total, edad media, distribución por sexos | |
| Enfermedad de base | ||
| Diagnóstico (indicar n total de) | Artritis reumatoide, espondiloartritis, artritis psoriásica, conectivopatía, etc, | |
| Actividad | ¿Existe una medida de la actividad basal antes de la cirugía? (sí/no), medida de la actividad (DAS28, DAS, BASDAI, etc.), media de actividad basal | |
| Factores de confusión | ||
| Comorbilidad (indicar n) | Diabetes mellitus, neoplasias concomitantes, infecciones previas, insuficiencia renal, vasculopatía periférica, cardiopatía | |
| Uso de corticoides | Indicar n de pacientes con corticoides, tiempo medio de utilización de corticoides, dosis media acumulada, dosis media en cirugía | |
| FAME perioperatorio | Indicar la n de pacientes en tratamiento | Metotrexato, leflunomida, sulfasalazina, antipalúdicos, terapia combinada con FAME, anti-TNF y especificar, rituximab, abatacept, tocilizumab, FAME + biológico |
| Indicar en cuántos se suspende el FAME o biológico | ||
| Tiempo medio de suspensión antes de la cirugía | ||
| Tiempo medio de reinicio tras la cirugía | ||
| Cirugía | Tipo | Ortopédica (artroscopia de cualquier articulación, rodilla, cadera, otras COT), cirugía dental, cirugía digestiva, otras cirugías |
| Carácter | Cirugía programada o urgente | |
| Desenlace | Infección posquirúrgica | |
| Infección local | ||
| Infección sistémica | ||
| Alteración de la cicatrización | ||
| Otras complicaciones | ||
| Éxitus | ||
| Reactivación de la enfermedad | ||
Se recuperaron un total de 5.285 documentos, de los cuales, tras eliminar duplicados y realizar el primer cribado por título y resumen, se seleccionaron 82, que fueron evaluados en detalle. De estos, se excluyeron 56 por las causas referidas en el anexo 1. Finalmente, se incluyeron 27 estudios (anexo 2), publicados entre 1991 y 2011, 5 comunicaciones a congresos y disponibles solo en formato abstract11,23,79,82,84. Cinco ensayos clínicos67,70,75,84,87, pero de calidad dudosa (todos con una puntuación de Jadad7 de 2 o inferior). El resto se trató de estudios longitudinales de carácter retrospectivo, series de casos y 2 casos controles (aunque dos estudios se autodenominan casos-control, en realidad son estudios retrospectivos comparativos entre diversos tipos de pacientes no divididos por el desenlace sino por el fármaco39,77. Los autores tenían como país de origen Estados Unidos (n=10), Japón (n=7), Reino Unido (n=4) y Francia (n=3).
En total, estos documentos proporcionan información de 5.226 pacientes en los que se efectuaron 6.327 cirugías, 4.128 (79%) a mujeres, con una edad media de 56,8 (mínimo: 17; máximo; 94) años. Todos los pacientes estaban diagnosticados de AR de acuerdo con los criterios ACR89, excepto en 3 estudios: 20% de espondiloartritis en el de Ruyssen-Witrand57 y, pequeños porcentajes de artritis psoriásica (4%) o artritis idiopática juvenil (AIJ) (2%) en otros73,85. La duración del seguimiento postoperatorio se obtuvo en 19 trabajos y fue de 6 meses (0,5-24). El tipo de cirugía fue difícil de precisar, ya que esta información estaba incompleta, con los datos analizados destacaron 957 (15%) artroplastias de rodilla, 774 (12%) artroplastias de cadera, 412 (6%) cirugías de tobillo y pie, 135 (2%) cirugías de mano y muñeca, 124 (2%) cirugías de codo, 114 (2%) cirugías de hombro, 64 (1%) artroscopias y 1.935 (30%) cirugías ortopédicas de otro tipo, en 1.587 (25%) casos no se especificó el tipo de cirugía de trauma. Además, se incluyeron 614 (9%) procedimientos quirúrgicos que no fueron de traumatología, predominantemente cirugía de digestivo y la cirugía fue de urgencia en solo 10 casos.
Los datos sobre comorbilidad y posibles factores de riesgo de infección posquirúrgica son escasos. Se reportaron comorbilidades en el 7% de los casos: cardiopatía isquémica en 210 (4%) pacientes, DM en 120 (2%) pacientes, y menos de 1% para el conjunto de hipertensión arterial (n=21), insuficiencia renal (n=12), bronquiectasias (n=9) y neoplasias (n=4), No se encontró informe de infección previa en ningún caso. En general, la descripción de los pacientes y, la comparabilidad de los grupos de estudio es muy poco satisfactoria, salvo señaladas excepciones (tabla 2). Dixon23 no informa datos de la comorbilidad y factores predisponentes para el desarrollo de infecciones, pero ajusta por ellos en los modelos de remisión multivariante. En el estudio de Giles74 analizan comorbilidades, pero no aparecen datos numéricos, solo refieren en resultados que no influyen significativamente y, en el Fuerst73 refieren recogerla, pero ni proporcionan datos, ni ajustan por ella en los modelos de remisión de los distintos fármacos. El estudio de Alarcón67 no especifica las características de la población estudiada, a pesar de que es un ensayo clínico, simplemente refieren que los grupos de comparación son homogéneos.
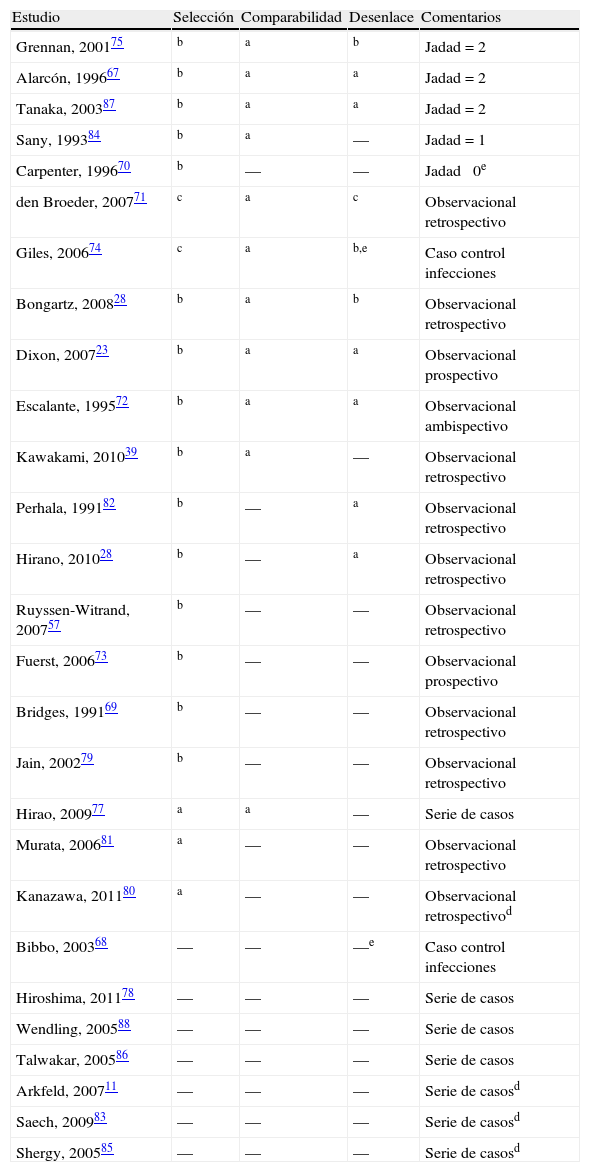
Calidad (ausencia de sesgos) de los estudios incluidos, por orden decreciente
| Estudio | Selección | Comparabilidad | Desenlace | Comentarios |
| Grennan, 200175 | b | a | b | Jadad=2 |
| Alarcón, 199667 | b | a | a | Jadad=2 |
| Tanaka, 200387 | b | a | a | Jadad=2 |
| Sany, 199384 | b | a | — | Jadad=1 |
| Carpenter, 199670 | b | — | — | Jadad 0e |
| den Broeder, 200771 | c | a | c | Observacional retrospectivo |
| Giles, 200674 | c | a | b,e | Caso control infecciones |
| Bongartz, 200828 | b | a | b | Observacional retrospectivo |
| Dixon, 200723 | b | a | a | Observacional prospectivo |
| Escalante, 199572 | b | a | a | Observacional ambispectivo |
| Kawakami, 201039 | b | a | — | Observacional retrospectivo |
| Perhala, 199182 | b | — | a | Observacional retrospectivo |
| Hirano, 201028 | b | — | a | Observacional retrospectivo |
| Ruyssen-Witrand, 200757 | b | — | — | Observacional retrospectivo |
| Fuerst, 200673 | b | — | — | Observacional prospectivo |
| Bridges, 199169 | b | — | — | Observacional retrospectivo |
| Jain, 200279 | b | — | — | Observacional retrospectivo |
| Hirao, 200977 | a | a | — | Serie de casos |
| Murata, 200681 | a | — | — | Observacional retrospectivo |
| Kanazawa, 201180 | a | — | — | Observacional retrospectivod |
| Bibbo, 200368 | — | — | —e | Caso control infecciones |
| Hiroshima, 201178 | — | — | — | Serie de casos |
| Wendling, 200588 | — | — | — | Serie de casos |
| Talwakar, 200586 | — | — | — | Serie de casos |
| Arkfeld, 200711 | — | — | — | Serie de casosd |
| Saech, 200983 | — | — | — | Serie de casosd |
| Shergy, 200585 | — | — | — | Serie de casosd |
a,b,c Según la escala de sesgos de New Castle-Ottawa para cohortes (adaptada en EC) o casos-control.
b Solo disponible en formato abstract.
c Es un caso-control, esta evaluación se refiere a la exposición, no al desenlace, que sería el criterio de selección de los casos.
Actividad y tratamiento previo de la enfermedad reumática: estos datos no se informan de modo sistemático. Se encontró informe sobre alguna medida de actividad en 21 de los artículos, sin embargo, en solo un caso esta medida fue un Índice de actividad (DAS28), en el resto se emplearon reactantes de fase aguda o medidas semicualitativas no validadas, como la opinión del médico, o un 20% de empeoramiento en el recuento de articulaciones inflamadas. En relación con los tratamientos concomitantes, 1.287 de 2.230 pacientes, es decir un 58% informaron de consumo de corticoides a dosis media de 7,5mg (5-10), y en algunos estudios los corticoides fueron el único tratamiento de la AR previo a la cirugía. Los FAME sintéticos que empleaban los pacientes antes de la cirugía fueron metotrexate (MTX) (11%) y leflunomida (LFN) (2%). El fármaco más estudiado es el MTX con 9 estudios, incluso ensayos clínicos. La leflunomida se analiza en 2 estudios, uno de ellos un ensayo clínico87. En 1.399 (22%) casos se anotó el consumo de FAME sinéticos sin precisar el tipo y no fue posible obtener información clara de las combinaciones. Los FAME biológicos se utilizaron en 2,033 (32%) de los pacientes, de ellos, los anti-TNF fueron los más usados y solo se informan casos aislados de tratamiento con tocilizumab y rituximab, se incluyeron 8 estudios observacionales y ningún ensayo clínico con FAME biológicos. Los fármacos para los que hemos encontrado evidencia se recogen en el anexo 2). En varios trabajos no se estudia un FAME específico, sino que se estudian todos como factores de riesgo.
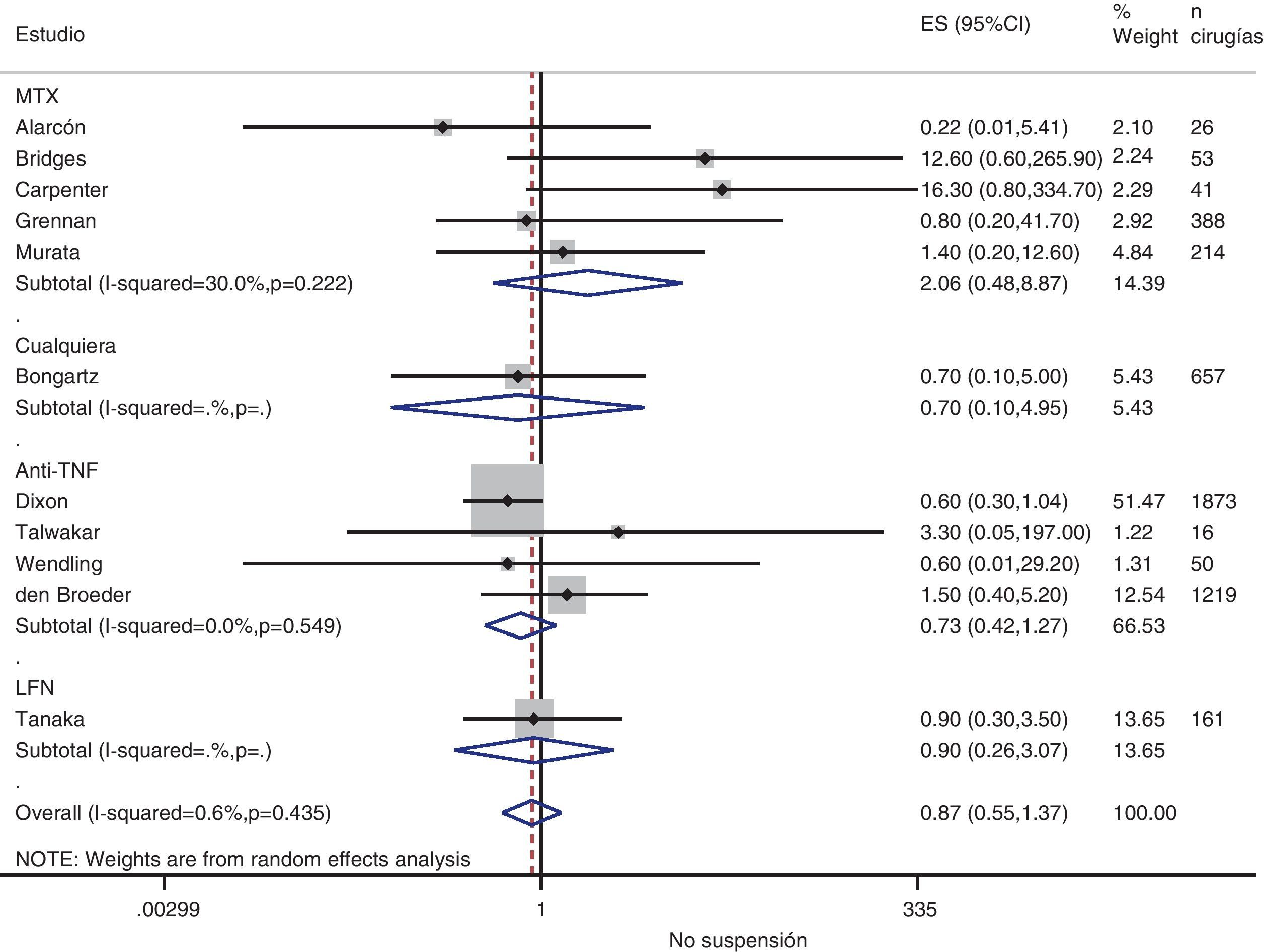
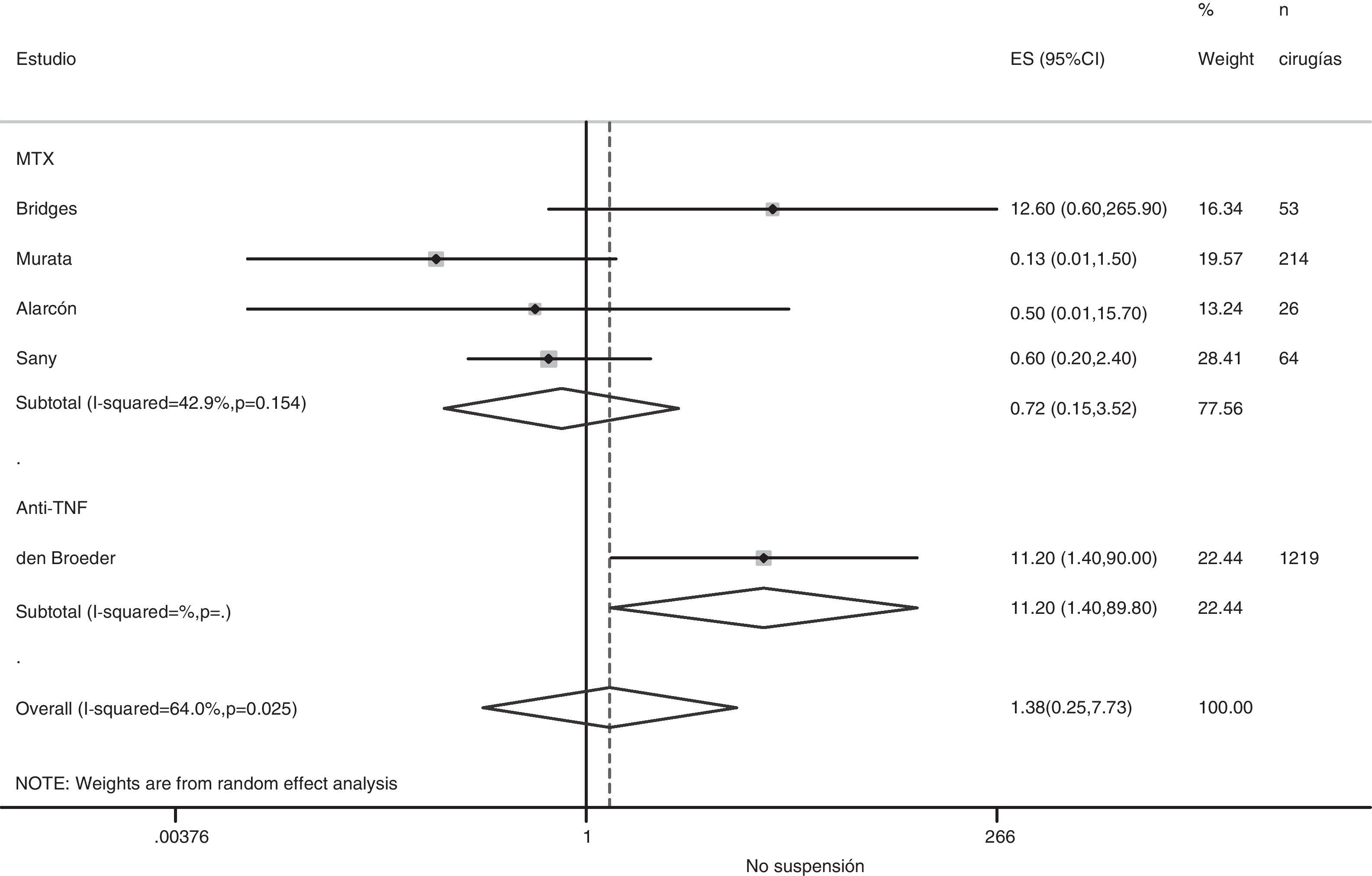
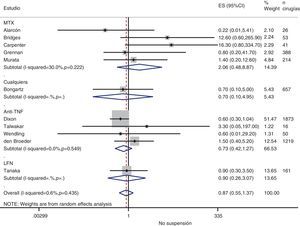
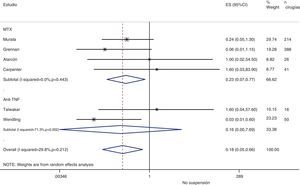
Riesgo de complicaciones entre estrategias: suspensión frente a continuaciónLa tabla 3 muestra los datos sobre el riesgo de complicaciones en los estudios que comparan directamente estrategias. Realizamos un metaanálisis de las infecciones quirúrgicas y las alteraciones de la cicatrización: el OR agrupado de presentar complicaciones infeccionas con cualquier FAME si no se suspende en el período perioperatorio es de 0,8 (IC del 95%: 0,6-1,4), no existiendo variaciones aparentes entre el tipo de FAME (fig. 1). El metaanálisis de las alteraciones de la cicatrización no muestra un estimador agrupado definido hacia ninguna estrategia, OR: 1,4; IC del 95%: 0,2-7,7 (fig. 2).
Riesgo comparado de complicaciones entre suspender o no el tratamiento en el periodo perioperatorio
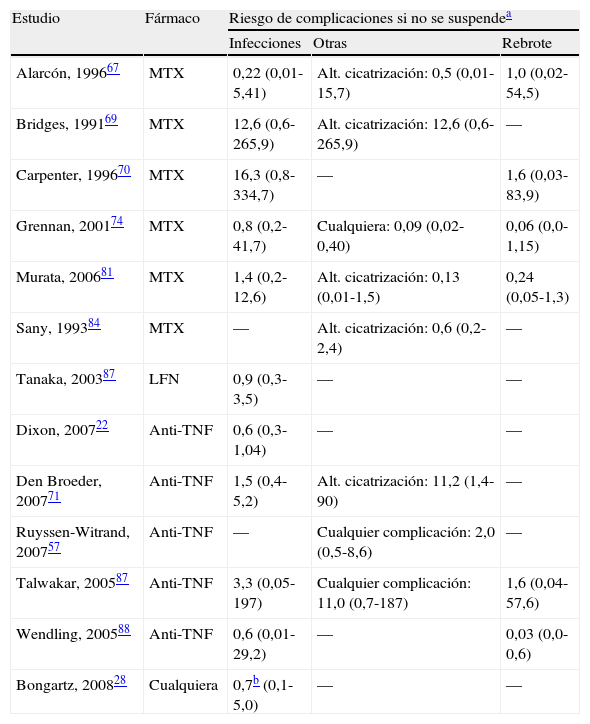
| Estudio | Fármaco | Riesgo de complicaciones si no se suspendea | ||
| Infecciones | Otras | Rebrote | ||
| Alarcón, 199667 | MTX | 0,22 (0,01-5,41) | Alt. cicatrización: 0,5 (0,01-15,7) | 1,0 (0,02-54,5) |
| Bridges, 199169 | MTX | 12,6 (0,6-265,9) | Alt. cicatrización: 12,6 (0,6-265,9) | — |
| Carpenter, 199670 | MTX | 16,3 (0,8-334,7) | — | 1,6 (0,03-83,9) |
| Grennan, 200174 | MTX | 0,8 (0,2-41,7) | Cualquiera: 0,09 (0,02-0,40) | 0,06 (0,0-1,15) |
| Murata, 200681 | MTX | 1,4 (0,2-12,6) | Alt. cicatrización: 0,13 (0,01-1,5) | 0,24 (0,05-1,3) |
| Sany, 199384 | MTX | — | Alt. cicatrización: 0,6 (0,2-2,4) | — |
| Tanaka, 200387 | LFN | 0,9 (0,3-3,5) | — | — |
| Dixon, 200722 | Anti-TNF | 0,6 (0,3-1,04) | — | — |
| Den Broeder, 200771 | Anti-TNF | 1,5 (0,4-5,2) | Alt. cicatrización: 11,2 (1,4-90) | — |
| Ruyssen-Witrand, 200757 | Anti-TNF | — | Cualquier complicación: 2,0 (0,5-8,6) | — |
| Talwakar, 200587 | Anti-TNF | 3,3 (0,05-197) | Cualquier complicación: 11,0 (0,7-187) | 1,6 (0,04-57,6) |
| Wendling, 200588 | Anti-TNF | 0,6 (0,01-29,2) | — | 0,03 (0,0-0,6) |
| Bongartz, 200828 | Cualquiera | 0,7b (0,1-5,0) | — | — |
En el ensayo clínico aleatorizado (ECA) de Grennan75 se evidencia que la incidencia de las complicaciones fue menor en el grupo que continuó con el MTX (2%), que en el grupo que lo suspendió (15%). El OR de complicaciones para la continuación es de 0,09 (IC del 95%: 0,02-0,40). Seis semanas tras la cirugía, ninguno de los pacientes que habían continuado con MTX presentó reactivación de la enfermedad, frente a 6 (8%) de los que lo habían suspendido. No hubo variaciones en actividad a largo plazo.
Alarcón67 no consiguió realizar un ECA de estrategias al no alcanzar el tamaño muestral, dado que los médicos abandonaron el estudio por considerar poco ético continuar o suspender el tratamiento. Los pacientes (26) fueron aleatorizados a recibir MTX o placebo antes y después de la cirugía (13 en cada grupo) con un período de observación de 12 semanas tras la cirugía. Hubo 5 (38%) complicaciones con MTX y 2 (15%) con placebo. En cada grupo se realizaron 9 (70%) cirugías de rodilla, que fueron las únicas que presentaron complicaciones. No hubo rebrotes de la enfermedad en ninguno de los grupos y la función física a las 12 semanas era comparable. No obstante, el tamaño muestral impide llegar a ninguna conclusión fiable, como demuestran los amplios intervalos de confianza calculados en la tabla 3. Un estudio observacional del mismo grupo69 analizó datos de 38 pacientes en tratamiento con MTX sometidos a cirugía programada. Hubo 8 complicaciones en 19 pacientes que continuaron con MTX hasta al menos 2 semanas antes de la cirugía, frente a ninguna complicación en los 34 que suspendieron el MTX 4 semanas antes o más. Eran grupos con otros factores de riesgo parecidos. El porcentaje de prótesis de rodilla era mayor entre los pacientes que continuaron, entre los que también había un mayor porcentaje de diabéticos. La evaluación no se hizo de forma independiente y los intervalos de confianza son excesivamente amplios.
Carpenter70 llevó a cabo un ensayo clínico abierto, en el que el cirujano asignaba, según sus preferencias suspender el MTX 2 semanas antes de la cirugía o no suspenderlo, sin evaluación ciega y por tanto, con múltiples sesgos. También con un pequeño tamaño muestral e intervalos de confianza imprecisos, si bien, como en los previos se detecta una mayor tendencia a infecciones en el grupo que continúa el MTX.
Sany84 realizó un estudio similar, aunque con asignación aleatoria. De los 32 pacientes que no suspendieron el MTX, el 13% presentaron algún tipo de complicación, frente al 19% en los 32 que lo suspendieron al menos una semana antes. Ningún grupo registró infecciones.
Murata81 realizó un estudio retrospectivo de las complicaciones de procedimientos quirúrgicos en AR en los que se había mantenido el MTX frente a procedimientos en los que se había suspendido al menos 2 semanas antes de la cirugía. Los grupos eran bastante comparables, salvo que todos los pacientes de cada grupo provenían de una fuente distinta. Hubo 4 complicaciones en el grupo que continuó el MTX y 3 en el que se suspendió. Hubo reactivaciones de la enfermedad en 3 casos en cada grupo (5% en los que continuaron y 14% en los que suspendieron).
En la revisión de Loza43, metaanalizan los estudios de Sany y Grennan, no encuentran variaciones al suspender o no el MTX en la morbilidad relacionada con la cicatriz quirúrgica, con un RR: 0,69; IC del 95%: 0,23-2,02.
Suspensión de leflunomidaEl ECA de Tanaka87 analiza el efecto de la suspensión de leflunomida durante 4 semanas (2 antes y 2 después) en la tasa de infecciones posquirúrgicas. Los pacientes podían estar además tratados con otros FAME, pero todos se suspendían antes de la intervención en los 2 grupos. Los grupos son bastante comparables, ambos con más de un 80% de pacientes con corticoides, aunque a dosis bajas. La tasa de infecciones es prácticamente la misma en ambos grupos. No aporta datos sobre rebrote de la actividad de la AR.
Suspensión de anti-TNFEn el registro británico de biológicos, Dixon23 examinó el riesgo de infección posquirúrgica grave (30 días) asociado con retirar o no previamente el anti-TNF (28 días de seguridad). Ajustando por edad, sexo, actividad, diabetes y esteroides, el OR de infección posquirúrgica grave si se retiran los anti-TNF es de 0,56 (IC del 95%: 0,30-1,04), que corresponde a unas tasas de infección del 7,3% sin retirada y 4,8% retirados (n=1.694). Van den Broeder71, en un estudio retrospectivo, examinó el riesgo combinado de infección precoz (inferior a 30 días) y tardía en pacientes en tratamiento con anti-TNF que suspendieron o no el tratamiento, dependiendo de si el tiempo hasta la fecha de la cirugía había sido al menos de 4 vidas medias. Las tasas de infección quirúrgica fueron: 4% en no expuestos, 5,8% en expuestos que suspendieron y 8,7% en expuestos que no suspendieron. El uso perioperatorio de anti-TNF no se asoció significativamente a un aumento de las infecciones (OR: 1,5; IC del 95%: 0,4-5,2), pero sí con alteración de la cicatrización (OR: 11,2; IC del 95%: 1,4-90).
En el estudio de Ruyssen-Wytrand57, la tasa de complicaciones entre los pacientes que suspendieron el anti-TNF un tiempo superior a 5 vidas medias antes de la cirugía (36 cirugías) fue de 19,4% frente al 18,4% entre los que se suspendió menos de ese tiempo o no se suspendió (p=0,48). Si se había suspendido un tiempo superior al de dos vidas medias, la tasa de complicaciones era de 17,6% frente al 30% si este tiempo era inferior o no se había suspendido (p=0,24).
En la serie de 16 cirugías expuestas a anti-TNF de Talwakar86 no encontraron ninguna infección ni en el grupo que suspendió ni en el que mantuvo el anti-TNF. Un paciente rebrotó en el grupo de suspensión (etanercept). En la serie de Wendling88 no ocurrieron complicaciones graves, ni infecciones en ninguno de los grupos. Hubo 6 casos (12%) de reactivación moderada con cada anti-TNF y cirugía ortopédica asociado de forma significativa a la interrupción.
Suspensión de cualquier fármaco modificador de la enfermedadEn el estudio de Bongartz15 la suspensión de cualquier FAME en el momento de la cirugía se asocia a un menor riesgo, aunque no estadísticamente significativo de infección protésica (OR: 0,65; IC del 95%: 0,09-4,95)28.
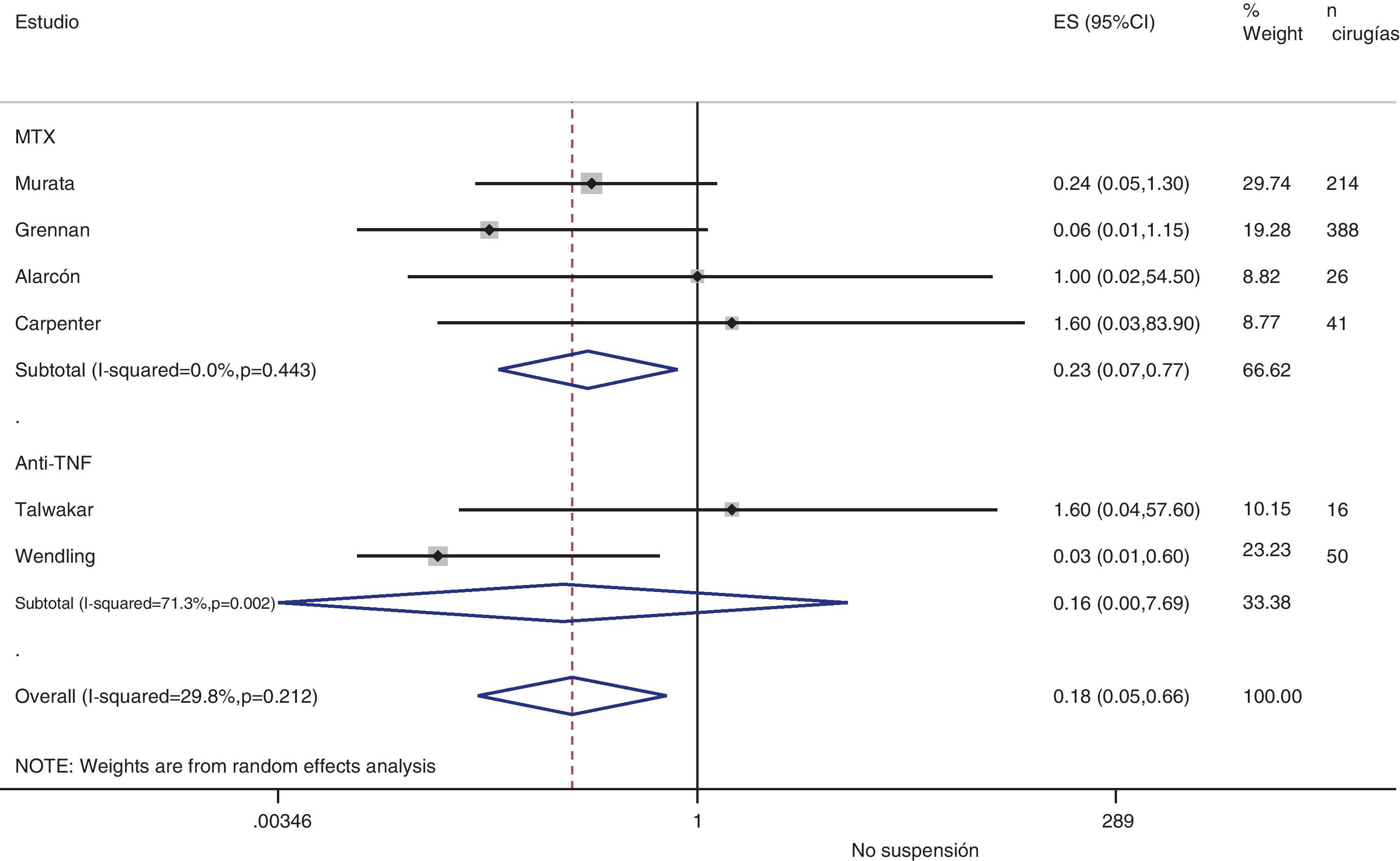
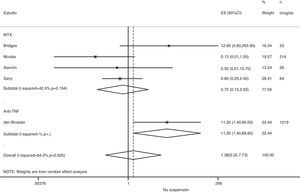
Rebrote de actividadSolo en 8 estudios existe alguna referencia a la actividad basal de la enfermedad antes de la cirugía, aunque solo 2 facilitan datos numéricos75,77. En el postoperatorio se suele producir un aumento de los reactantes de fase, y por tanto bastantes de las medidas habituales de actividad de la enfermedad quedan artefactadas. Si asumimos una definición homogénea de reactivación de la enfermedad y realizamos un metaanálisis del riesgo de reactivación si se suspende el tratamiento en el perioperatorio, el OR agrupado es de 0,2 (IC del 95%: 0,05-0,7), a favor de no suspender. No obstante, este metaanálisis tiene una heterogeneidad muy alta (I2=29,8%), sobre todo en los resultados de los estudios de anti-TNF (fig. 3). En el estudio de Kawakami39, en el que comparan biológicos frente a no biológicos, utilizan la presencia de artralgias como criterio de rebrote de la enfermedad. Encuentran 11 casos de rebrote que atribuyen a la suspensión del anti-TNF. No dan porcentajes de suspensión en ningún grupo, con lo que no sabemos qué asociación existe con la suspensión misma.
En los estudios de Alarcón67 y Carpenter70 no identifican rebrote de actividad en ningún grupo (ni en los que suspendieron MTX ni en los que continuaron), pero no explican cómo definieron rebrote, ni cuál era la actividad basal de la enfermedad. En el de Sany84 todos los pacientes que interrumpieron el MTX más de 4 semanas rebrotaron, pero no dice cuántos lo interrumpieron ese tiempo ni cómo definen rebrote.
Kanazawa80 muestra en 68 cirugías, que aparecieron rebrotes de actividad (sin definición) en 3 pacientes que suspenden etanercept más de 12 días y, en todos en los que lo suspendieron más de 21 días. El estudio concluye, que el uso preoperatorio de biológicos no constituye un factor independiente de riesgo de infecciones.
Otras medidas de desenlaceDos estudios japoneses se centran en la aparición de fiebre o aumento de proteína C-reactiva (PCR) en pacientes con AR sometidos a cirugía. En el de Hirao77 analizan la temperatura corporal y la PCR en 22 cirugías expuestas a tocilizumab y 22 cirugías expuestas a FAME no biológicos. En principio, no observan complicaciones en ningún grupo, pero sí que los pacientes con tocilizumab no elevan PCR ni hacen fiebre. Hiroshima78 analiza 8 cirugías en 5 pacientes con tocilizumab frente a 16 con anti-TNF y 16 con FAME clásicos. A todos los pacientes con tocilizumab se les suspendía este 4 semanas antes y se reiniciaba 4 semanas después. La temperatura y los niveles de PCR aumentaron tanto en el grupo de anti-TNF como de FAME, pero no en el de tocilizumab. No comentan si tuvieran complicaciones.
Kawakami39 encuentra mayor diferencia (significativa) entre la PCR pre y posquirúrgica de los expuestos a biológicos que en los no expuestos. Además, encuentran una asociación entre el uso de biológicos y trombosis venosa profunda (TVP) (OR: 3,0; IC del 95%: 1,1-7,8), mientras que el MTX no se asoció con TVP (OR: 1,2; IC del 95%: 0,4-3,4).
Hirano76 examina el tiempo hasta la recuperación total de la herida quirúrgica y no encuentra variaciones entre los expuestos a anti-TNF y los no expuestos. Tampoco había diferencias en el período febril posquirúrgico y la anemia entre ambos grupos.
Comparación entre fármacosVarios estudios no aportan datos comparados entre estrategias, pero sí del riesgo de complicaciones asociado a fármacos.
Con respecto al MTX, en el ensayo de Grennan75 se incluyó un brazo de pacientes que no estaban con MTX. Al comparar este brazo frente a los que habían estado expuestos a MTX, se hubiera o no suspendido este en el período operatorio, el número de complicaciones en general no difiere entre grupos (OR: 0,75; IC del 95%: 0,37-1,53) ni tampoco se reactivan más (OR: 0,95; IC del 95%: 0,33-2,72). Igualmente, en el estudio de Murata81 se incluyó un brazo sin MTX. Al comparar las tasas de infecciones no se ven variaciones (OR: 1,05; IC del 95%: 0,26-4,33), ni tampoco en las reactivaciones (OR: 0,89; IC del 95%: 0,29-2,76). Perhala82 compara retrospectivamente la proporción de complicaciones entre pacientes con AR expuestos y no expuestos a MTX, siendo esta del 9 y del 6% respectivamente (OR para infecciones: 1,5; IC del 95%: 0,4-5,9). Jain79 compara varios desenlaces posquirúrgicos entre 4 grupos, dependiendo de los fármacos que estuvieran tomando en el momento de la cirugía, en ninguno se modificaba la pauta perioperatoria: 48 con MTX solo, 30 con prednisolona solo, 30 con ambos y 21 sin ninguno. Hubo un 5% de infecciones de la herida quirúrgica entre los que tomaban MTX y 4% entre los que no (p>0,05, pero sin ajuste por otros factores de riesgo).
En el caso de la leflunomida, Fuerst73 utiliza regresión logística para ver el efecto del tratamiento continuado durante el período perioperatorio de MTX, leflunomida, etanercept, infliximab o corticoides y, las infecciones posquirúrgicas. No encuentran asociación salvo con leflunomida (OR: 3,5; IC del 95%: 1,3-9,2), ni siquiera con corticoides. No está claro si ajustan por otros factores de riesgo de infección.
Con respecto a los FAME biológicos, Arkfeld10,11 compara el número de infecciones tras cirugía de codo en 11 pacientes expuestos a anti-TNF y 11 no expuestos. Cuatro (36%) de los codos expuestos se infectaron frente a uno (9%) de los no expuestos (OR calculado para anti-TNF: 5,7 (IC del 95%: 0,5-62,7).
Giles74 realiza un estudio caso-control para ver el efecto de haber estado tratado con anti-TNF y las infecciones posquirúrgicas. La terapia anti-TNF se asocia de forma significativa con el desarrollo de infecciones posquirúrgicas en el bivariado (OR: 4,4; IC del 95%: 1,1-18,4) y tras ajuste por edad, sexo, uso de corticoides, diabetes y factor reumatoide (OR: 5,3; IC del 95%: 1,1-24,9).
Dixon23 examina el riesgo de infección postquirúrgica grave (30 días) asociado con la exposición durante el período quirúrgico a anti-TNF (se suspendan o no) frente a FAME no biológicos. Ajustando por edad, sexo, actividad, diabetes y esteroides, el OR de infección postquirúrgica grave con FAME frente a anti-TNF es de 0,75 (IC del 95%: 0,44-1,28). En el grupo con FAME la tasa de infección fue del 5,9% frente al 7,1% en el de anti-TNF.
Den Broeder71 compara frente a no expuestos con anti-TNF. El OR de infecciones quirúrgicas en expuestos frente a no expuestos es de 0,8 (IC del 95%: 0,3-2,0). Además, se identifica la sulfasalazina como un factor protector de infecciones, con un OR de 0,21.
Kawakami39 compara la tasa de infecciones entre pacientes expuestos o no expuestos a anti-TNF pareados por edad, sexo y tipo de cirugía, siendo esta claramente mayor en los expuestos (OR ajustado: 21,8; IC del 95%: 1,2-386,1). En el estudio de Hirano76, el total de complicaciones en el grupo con anti-TNF (5%) no fue distinto del de los no expuestos (7%), con OR: 0,7; IC del 95%: 0,1-4,0.
Ruyssen-Witrand57 proporcionan la tasa de complicaciones posquirúrgicas con anti-TNF, aproximadamente un 19% (24/127), incluidas infecciones (9%), trombosis (<1%) y complicaciones de la cicatrización (5%). En el estudio de Shergy85, la tasa de infecciones con infliximab es del 3% y de complicaciones en general del 9%.
En el estudio de Saech83, 13 pacientes con rituximab sometidos a cirugía ortopédica experimentan una infección de tejidos blandos y otra de vías urinarias, ninguna grave, y 3 alteraciones en la cicatrización.
Para otros FAME, Bibbo68 no encuentra asociación entre infección posquirúrgica en pacientes con AR sometidos a cirugía de pie o tobillo y el estar expuesto a algún FAME no biológico. Escalante72 estudia los factores de riesgo de complicaciones y no encuentran ninguna asociación con los FAME, únicamente con azatioprina (RR=2,13; IC del 95%: 1,04-4,4). El riesgo de complicaciones era el mismo entre procedimientos quirúrgicos en pacientes expuestos y no expuestos a FAME; tampoco a prednisona (RR=1,3; IC del 95%: 0,9-1,8).
Otros factores asociados con el riesgo postoperatorio de complicacionesAdemás de los FAME, se estudiaron otros factores, tanto del paciente como de la cirugía, importantes a la hora de seleccionar pacientes con mayor riesgo. Entre los factores del paciente destacan el uso de esteroides4,23, diabetes79 e hipertensión80. Bongartz28 demuestra que la AR es un factor de riesgo de complicaciones quirúrgicas, sin embargo no identificó la edad como un factor de riesgo importante. Con respecto a la enfermedad, ningún estudio encontró asociación con la duración, la clase funcional ni los niveles de PCR antes de la operación28,81.
En cuanto a los factores de la propia cirugía, Ruyssen-Witrand57 encuentra una tasa de complicaciones de los procedimientos ortopédicos del 12% con el 6% de infecciones, mientras que el 50% de los procedimientos abdominales tuvieron complicaciones, todas infecciosas. Además, las complicaciones de los procedimientos ortopédicos de urgencia fueron del 20%. Den Broeder71 encuentra mayor riesgo de complicaciones en cirugías de codo, pie o mano, y Kanazawa80 en rodilla. Bongartz28 identifica la presencia de infecciones en operaciones previas como un claro factor de riesgo.
DiscusiónAl iniciar esta revisión tomamos la decisión de incluir estudios de cualquier calidad, dado que una búsqueda previa nos puso sobre aviso de la ausencia de ensayos clínicos. Las conclusiones y recomendaciones deben ser prudentes y basarse, en la medida de lo posible, en los estudios de mejor calidad.
La realización de ensayos clínicos en el contexto perioperatorio es complicada, como puso de manifiesto Alarcón67 a raíz de un ensayo clínico de estrategias perioperatorias que no llegó a lograr el tamaño muestral planeado. Los frenos principales al estudio de Alarcón fueron, entre otras como la corta financiación y la poca colaboración de los cirujanos para el reclutamiento, las ideas preconcebidas sobre cómo se debe manejar la inmunosupresión en este período, tanto de reumatólogos como de traumatólogos. Curiosamente, la proporción de médicos que consideraban poco ético suspender era similar a la de aquellos que consideraban poco ético no suspender, y en ambos casos se apartaron del estudio. Esta polarización en la opinión también la hizo patente Steuer60 en una encuesta a reumatólogos en la que el 35% de los reumatólogos y el 46% de los traumatólogos consideraban que el MTX se asociaba claramente a complicaciones postoperatorias. Incluso en un mismo centro es difícil predecir en qué pacientes se va a suspender el tratamiento y en cuáles no, porque esta decisión no suele estar basada en la edad del paciente ni en la gravedad de la enfermedad de base ni en las comorbilidades28, ni siquiera es homogénea dentro del mismo centro27.
En relación con los matices que hay que considerar a la hora de dar por válidas las conclusiones de los estudios, hemos podido comprobar que la definición de suspensión de tratamiento varía de un estudio a otro, haciéndose muy sofisticada en algunos, con tablas de tiempo, etc. y, especialmente nos preocupa que la definición de vida media sea tan variable entre los estudios. Decir si un paciente ha suspendido la medicación antes de la operación es especialmente complicado en los estudios observacionales, dado que se basa en las fechas recogidas de la última dosis frente a la de la cirugía. La consecuencia de esto es muy poco apoyo de la evidencia, no ya en cuanto a si se debe o no suspender la medicación, sino en cuanto al tiempo en que se debe suspender.
Por otro lado, si era bastante constante la definición de complicaciones, sobre todo en cuanto a las infecciones posquirúrgicas y alteraciones de la cicatrización, lo que nos permitió realizar un metaanálisis; aunque la definición de reactivación de la enfermedad no era homogénea, o no era clara, realizamos un metaanálisis, que resultó a favor de no suspender la medicación.
A la hora de decidir una estrategia perioperatoria, es vital tener en cuenta otros factores, sobre todo aquellos que aumenten el riesgo de infecciones, como son la edad, la diabetes, la insuficiencia renal o el uso de corticoides a dosis medias-altas3,22,23. No parece que exista una relación firme entre los factores clínicos relacionados con la expresión de la enfermedad y las complicaciones. Hämäläinen3 en un estudio caso-control sobre factores de riesgo de desarrollo de infecciones, no incluido por no aportar datos de fármacos, no encuentran asociación ni con la duración previa de la enfermedad, ni el grado de Steinbrocker, VSG, o el factor reumatoide. Factores relacionados con la cirugía o el ingreso, sin embargo si parecen estar relacionados: el tiempo de hospitalización3, el día de hospitalización (mayor riesgo en lunes)3, el tiempo de isquemia3 y el tipo de operación (mayor en prótesis de rodilla y sinovectomías de la mano 2,4. Hämäläinen3 destacan además otra variable solo recogida en el estudio de Bongartz28 y que sin embargo, y de forma claramente plausible, se relaciona con un mayor riesgo, que es la presencia de infecciones en operaciones previas. En general, y siendo los corticoides un factor de riesgo constante entre estudios23,25, parece razonable no suspender el tratamiento inmunosupresor si con ello nos vamos a ver obligados a aumentar la dosis de corticoides.
Es importante señalar, que en esta revisión hemos encontrado estudios sobre todo en AR y, sobre todo en cirugía ortopédica programada, que aunque es lo más frecuente, quizás no es del todo generalizable. Podemos concluir, por tanto, que existen datos a favor de no suspender para evitar la reactivación y, que no existen datos que apoyen la suspensión para evitar complicaciones, no obstante, quizás es más importante tener en cuenta otros factores que los fármacos a la hora de decidir suspender o no una medicación en el perioperatorio.
Inevitablemente, de esta revisión se concluye, además la necesidad de que se realicen estudios de calidad, que comparen estrategias de retirada frente a no retirada de inmunosupresión. Estudios en los que exista control de factores de confusión y, medidas objetivas de los resultados, tanto de actividad de la enfermedad de base, como de las complicaciones.
En conclusión, se recomienda que cuando un paciente con una enfermedad reumática inflamatoria se someta a cirugía, se considere el riesgo de infección, de acuerdo con los factores de riesgo preoperatorio y el tipo de FAME. Se consideran factores de riesgo: la edad, la diabetes, la insuficiencia renal o el uso de corticoides a dosis medias-altas, el tiempo de hospitalización, el tiempo de isquemia y el tipo de operación (mayor en prótesis de rodilla y sinovectomías de la mano) y la presencia de infecciones en operaciones previas.
En el paciente que recibe FAME sintéticos y que no presenta otros factores de riesgo de complicaciones posquirúrgicas, como edad avanzada, diabetes, tratamiento con corticoides, insuficiencia renal o determinadas cirugías, se recomienda mantener el tratamiento con MTX o leflunomida en el período perioperatorio (Nivel de evidencia 1c; Grado de recomendación D). Dado que el análisis de la evidencia no apoya una estrategia concreta de retirada o mantenimiento de estos inmunosupresores, pero sí hay datos que identifican la diabetes, los corticoides y algunos tipos de cirugía como de mayor riesgo de complicaciones, pensamos que es más sencillo no realizar modificaciones en el tratamiento con motivo de la cirugía y que las estrategias sencillas son más fáciles de cumplir y están expuestas a menos problemas de seguridad por lo que el mantenimiento del tratamiento es la opción deseable en la mayoría de los casos.
En el paciente que recibe FAME biológicos sin otros factores de riesgo de complicaciones posquirúrgicas asociados, se recomienda suspenderlos momentáneamente o programar la cirugía lo más alejada posible a la última dosis. En presencia de otros factores de riesgo de complicaciones posquirúrgicas como diabetes o tratamiento con corticoides, se deberán espaciar al menos 2 dosis (Nivel de evidencia 2c; Grado de recomendación D).
Nivel de evidenciaNivel de evidencia III.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
| Referencia | Causa de exclusión |
| Appau, 20089 | No incluye pacientes con enfermedades reumáticas |
| Arkfeld, 200710 | Duplicado de Arkfeld, 200710 |
| Berbari, 200612 | Estudio retrospectivo de 200 prótesis de rodilla o cadera en pacientes con AR para ver los factores de riesgo de infección, sobre todo quirúrgicos y evolución. No se menciona medicación alguna |
| Bibbo, 200713 | Revisión del tema |
| Blum, 197414 | Se centra en la técnica quirúrgica y los cuidados postoperatorios, no en la actitud preoperatoria |
| Bongartz, 200715 | Revisión del tema |
| Bridges, 199716 | Revisión del tema |
| Brooks, 199217 | Revisión del tema |
| Colville, 197818 | Estudio quirúrgico del desenlace de prótesis de cadera en la AR, pero no menciona los tratamientos |
| Corrao, 200819 | Duplicado de Corrao, 200719 |
| Corrao, 200720 | Serie de 5 casos con etanercept |
| Dias, 200121 | Carta al director. Opinión |
| Dixon, 200622 | Duplicado. Más especificado en Dixon, 200723, aunque este último sea un abstract de congreso |
| Garner, 197324 | Compara infección y retraso en la cicatrización en 100 pacientes con AR, frente a otras enfermedades no reumáticas. Solo estudia el efecto de los esteroides que se relacionan con más riesgo de complicaciones infecciosas y retraso en la cicatrización |
| Gilson, 200825 | El objetivo es realmente identificar los factores de riesgo de infección en los pacientes en tratamiento con anti-TNF. No permite obtener datos de incidencia |
| Hall, 196926 | Revisión del tema |
| Halligan, 200427 | Abstract de congreso preliminar y posteriormente publicado como artículo27 |
| Hämäläinen, 19843 | Agrupa todos los tratamientos, incluidos los corticoides, como factor de riesgo de las infecciones. Aún así refieren no encontrar relación entre las infecciones y el tratamiento médico de las enfermedades inflamatorias en general, pero no dan datos numéricos |
| Harigane, 201029 | Abstract de congreso que solo proporciona una p sobre una asociación negativa entre infección posquirúrgica y metotrexato, pero no explica si se suspendió o no perioperatoriamente |
| Harigane, 20114 | Es un abstract de congreso en formato solo título |
| Harle, 201030 | Revisión del tema |
| Hayata, 201131 | Serie de 50 casos, todos con anti-TNF, en los que hay en total de 2 infecciones. No explican si se retira o no el tratamiento. Simplemente proporcionan un valor de p=0,486, obtenido por remisión logística entre infección posquirúrgica y tiempo desde la última dosis de anti-TNF, pero ni dan la medida del efecto, ni explican siquiera si ajustan por algo |
| Haynie, 199332 | Revisión del tema |
| Jandric, 200733 | Es un abstract de congreso y solo incluye pacientes con artrosis |
| Jayakar, 201034 | Solo Takayasu y solo glucocorticoides. No encuentran asociación con el uso de corticoides y el desarrollo de las infecciones |
| Jones, 201035 | Editorial sobre recomendaciones quirúrgicas en casos de artroplastias complicadas, no específico de afección reumática |
| Kanbe, 200736 | Está solo en formato abstract y la información es inconsistente |
| Kasdan, 199337 | Se trata de la casuística de un cirujano. Refiere estudiar 2 grupos, uno con MTX y otro sin MTX en el momento de la cirugía, pero únicamente comunica que de los 15 pacientes con MTX «ninguno tuvo ningún problema de ningún tipo», sin proporcionar datos |
| Kawakami, 200938 | Duplicado de Kawakami, 201038 incluido |
| Kelley, 200240 | Revisión del tema |
| Keystone, 199641 | Revisión del tema |
| Lee, 201042 | Revisión del tema |
| Loza, 200943 | Revisión sistemática (todos los artículos incluidos) |
| Malik, 200744 | Revisión retrospectiva del tabaquismo y consumo de AINE de todas las artroplastias de cadera de un hospital |
| Makarov, 201045 | No proporcionan datos sobre tratamiento con FAME antes/durante la cirugía, ni resultados al respecto |
| Michaud, 200946 | Abstract a congreso: compara la mortalidad postoperatoria entre AR y artrosis. Identifica como factores de mayor riesgo, en AR, el uso de corticoides. No encuentra asociación con FAME |
| Michaud, 200947 | Abstract a congreso: compara mortalidad postoperatoria de causa específica entre AR y artrosis. No da datos de resultado en relación con FAME |
| Nishida, 201048 | Estudio de los niveles plasmáticos de etanercept tras la cirugía. No desenlaces de interés |
| Osnes-Ringen (1), 200849 | Abstract a congreso: no mencionan el empleo de FAME previo y las medidas de desenlace evaluadas son dolor, calidad de vida y función física, pero no complicaciones de la cirugía |
| Osnes-Ringen (2), 200850 | Abstract a congreso: medición de utilidades poscirugía con Euroqol y sf6d. No complicaciones quirúrgicas |
| Pappas, 200851 | Revisión del tema |
| Park, 200652 | Abstract a congreso; no mencionan el tratamiento al momento de la cirugía ni si se hizo algún cambio |
| Pieringer, 200753 | Revisión del tema |
| Pieringer, 200854 | Revisión sistemática (todos los artículos incluidos) |
| Rosandich, 200455 | Revisión del tema |
| Rosas, 20062 | No menciona fármacos. Artículo sobre el desenlace de prótesis de rodilla y cadera. |
| Ruyssen-Witrand, 200556 | Duplicado de Ruyssen-Witrand, 200756 |
| Shaw, 199958 | Revisión del tema |
| Singh, 2009 59 | Es un abstract de congreso en formato solo título |
| Steuer, 199760 | Encuesta sobre manejo perioperatorio. |
| Takeuchi, 200761 | Todos los pacientes están con biológicos. Lo que en realidad se compara es la frecuencia de infecciones entre los que se operan y los que no se operan. Imposible sacar datos útiles para la revisión (formato abstract) |
| Wendling, 200762 | Carta al editor revisando los estudios de Corrao y otros |
| Wilkinson, 200463 | Indicaciones y tipos de cirugías en pacientes con AR |
| Wluka, 200264 | Carta al editor referente al artículo de Greenan |
| Wolfe, 199865 | Estudio longitudinal sobre la prevalencia y la evolución de cirugía ortopédica en pacientes con AR. No hace referencia a complicaciones posquirúrgicas ni retirada de DMARDS. |
| Yazdanyar, 201066 | Abstract a congreso: estudio transversal en donde determinan la frecuencia de las complicaciones cardiovasculares de la cirugía de bajo, mediano y alto riesgo, en enfermos con AR o DM. Estiman odds ratio mediante la remisión logística, sin dar cifras absolutas del número de complicaciones CV ni su relación con los fármacos |
| Estudio | Pacientes | Tratamientos evaluados | Cx | Medidas |
| Estudios que comparan estrategias | ||||
| Alarcón, 199667EE. UU.ECA controlado multicéntrico a 12 semanas | N=26 AR (26 Cx)Sin referencia de actividad basalSin datos de comorbilidad | 13 (50%) suspenden MTX 2 semanas antes hasta 2 semanas después13 (50%) no suspenden MTX | 18 artroplastias de rodilla8 artroplastias cadera | % infecciones posquirúrgicas% infecciones locales% infecciones sistémicas% alteración de la cicatrización% rebrote de la enfermedad |
| Grennan, 200175Reino UnidoECA controlado en un centro a un año | N=388 AR (388 Cx); Edad media: 61 (rango: 17-95); 82% mujeresMedida de actividad basal=recuento articularDM 4%, cardiopatía 5%, HTA 5%, bronquiectasias 2%, diverticulitis 0,8%, asma 7%, osteoporosis 12 (3,1)Utilizan corticoides 155 (40%) | 88 MTX desde hace más de 6 semanas y no lo suspenden72 suspenden MTX 2 semanas antes hasta 2 semanas después de la Cx228 no habían recibido MTX | 77 Cx de rodilla programadas44 Cx de cadera programadas275 Otras ortopédicas programadas | % infecciones posquirúrgicas% infecciones sistémicas% alteración de la cicatrización% reactivación de la enfermedad% otras complicaciones |
| Carpenter, 199670EE. UU.EC controlado, no aleatorizado abierto, a un año | N=32 AR (41 Cx); Edad media: 60 (rango: 35-78); 78% mujeresSin referencia de actividad basalSin datos de comorbilidad69% con corticoides a una dosis media de 6 mg | 19 (59%) (25 Cx) se les suspendió el MTX 2 semanas antes de la Cx13 (41%) (16 Cx) continuaron con la misma dosis | 10 Cx de rodilla programadas12 Cx de cadera programadas6 Cx de muñeca programadas | % infecciones posquirúrgicas% rebrote de la enfermedad |
| Sany, 199384FranciaEC controlado y aleatorizado, abierto a 8 meses | N=64 AR (64 Cx); Edad media: 50 (rango: 26-70); 91% mujeresSin referencia de actividad basalSin datos de comorbilidad28% con corticoides, a una dosis media de 10 mg | 32 continuaban MTX la semana de la Cx32 suspendían el MTX al menos un semana antes y hasta un mes después de la Cx | 89 Cx ortopédicas programadas | % infecciones posquirúrgicas% alteración de la cicatrización% reactivación de la enfermedad |
| Tanaka, 200387Japón, EC controlado y aleatorizado, abierto a un año | N=82 AR (161 Cx); Edad media: 57 (rango: 28-77); 82% mujeresSin referencia de actividad basalSin datos de comorbilidad80% con corticoides, a una dosis media de 5 mg | 41 (82 Cx)a mantienen LFN41 (79 Cx)a suspenden LFN 2 semanas antes hasta 2 semanas después de Cx | 99 Cx de rodilla programadas33 Cx de cadera programadas29 Otras Cx ortopédicas programadas | % infecciones posquirúrgicas |
| Murata, 200681JapónLongitudinal observacional retrospectivo | N=122 AR (214 Cx); Edad media: 60 (rango: 45-80); 82% mujeresSin referencia de actividad basal11% DM, 10% insuficiencia renal, 13% hipotiroidismo | 48 (77 Cx) MTX durante >6 semanas antes de la Cx y no se suspende12 (21 Cx) MTX se suspende al menos 2 semanas antes de la Cx56 (103 Cx) sin MTX | 28 Cx de rodilla programadas82 Cx de cadera programadas99 Otras Cx ortopédicas programadas | % infecciones posquirúrgicas% alteración de la cicatrización% reactivación de la enfermedad |
| Ruyssen-Witrand, 200757FranciaLongitudinal observacional retrospectivo a un año | N=92 (127 Cx); Edad media: 5477,2% AR, 20% SpA; sin referencia de actividad basalSin datos de comorbilidad | 92 pacientes con anti TNF (127 Cx) suspendidos:10< 2 medias vidas antes de Cx55 entre 2 y 5 medias vidas antes de Cx36>5 medias vidas antes de Cx(6 artritis sépticas y 20 con fecha de última dosis desconocida excluidas) | 13 (10%) Cx de rodilla16 (13%) Cx de cadera28 (24%) Artrodesis28 (32%) Otras Cx ortopédicas6 (5%) Cx digestivas2 (2%) Cx ginecológicas12 (9%) Otras Cx10 (8%) Cx urgente | % infecciones posquirúrgicas% alteración de la cicatrización |
| Wendling, 200588FranciaSerie de casos tras un año | N=30 AR (50 Cx); edad media: 54; 83% mujeresScore articular como medida de actividad basal. Se define brote posquirúrgico como aumento de score articular y V Global pac >20%Sin datos de comorbilidad82% con corticoides, a una dosis media de 8,2 mg | 32 anti-TNF sin suspender18 anti-TNF suspendido | 2 Cx de rodilla programadas4 Cx de cadera programadas29 Otras Cx ortopédicas programadas6 Cx digestivas programadas5 Otras Cx programadas | % infecciones posquirúrgicas% alteración de la cicatrización% reactivación de la enfermedad |
| Talwalkar, 200586Reino UnidoSerie de casos | N=11 (16 Cx); Edad media: 57; 55% mujeres91% AR; sin referencia de actividad basalSin datos de comorbilidad | 12 anti-TNF sin suspender4 anti-TNF suspendido | 16 Cx ortopédicas mayores (artroplastias y artrodesis) y menores (ambulantes) | % complicaciones |
| Bridges, 199169EE. UU.Serie de casos | N=38 AR (53 Cx); Edad media: 59;70% mujeresSin referencia de actividad basal10% DM63% con corticoides, a una dosis media de 8 mg | 19 (50%) habían recibido MTX en las 4 semanas previas a la Cx25 (66%; 6 también en el otro grupo) habían suspendido el MTX antes de 4 semanas estaban sin DMARD | 24 Cx de rodilla programadas20 Cx de cadera programadas9 Otras Cx ortopédicas programadas | % infecciones posquirúrgicas% infecciones locales% alteración de la cicatrización |
| Estudios que comparan fármacos | ||||
| Dixon, 200723bReino UnidoCohorte a 30 días | N=1.503 AR (1.873 Cx)Sin referencia de actividad basal ni de comorbilidad (es un abstract) | 1.348 (1.694 Cx) expuestos a anti-TNF1.421 Cx mantenido273 Cx suspendido≥4 semanas antes155 (179 Cx) no expuestos a anti-TNF | 1.873 Cx totales1.399 (75%) Cx ortopédicas programadas | % infecciones posquirúrgicas |
| den Broeder, 200771HolandaLongitudinal observacional retrospectivo tras un año | N=768 AR (1.219 Cx); Edad media: 60; 77,3% mujeresSin referencia de actividad basalDM 76 (6%); Cardiopatía 178 (15%)Utilizan corticoides 388 (32%) | Cohorte 1: 1.023 Cx anti-TNF-naïveCohorte 2: anti-TNF104 Cx suspenden anti-TNF antes de Cx (4 veces el tiempo de una vida media)92 Cx continúan el anti-TNF | 195 (16%) Cx de rodilla172 (15%) Cx de cadera280 (23%) Cx de tobillo y pie114 (9%) Cx de hombro102 (8%) Cx de codo29 (3%) Otras Cx | % infecciones posquirúrgicas% alteración de la cicatrización% otras complicaciones |
| Perhala, 199182EE. UU.Longitudinal observacional retrospectivo a 6 meses | N=121 AR (202 Cx); Edad media: 54 (rango: 26-87); 82% mujeresSin referencia de actividad basalSin datos de comorbilidadCorticoides a una dosis media de 4,78 mg | 66 (92 Cx) con MTX61 (110 Cx) sin MTX | 92 Artroplastias totales de cadera y rodilla | % infecciones posquirúrgicas% infecciones locales% infecciones sistémicas% alteración de la cicatrización |
| Jain, 200279Reino UnidoLongitudinal observacional retrospectivo tras un año | N=80 AR (129 Cx); Edad media: 53 (rango: 28-81); 77,5% mujeresSin referencia de actividad basalDM 6 (5%); Cáncer 4 (3%); Cardiopatía 11 (8,5%)45% con corticoides, a una dosis media de 7,6 mg | 28 (48 Cx) MTX solo18 (30 Cx) solo esteroides18 (30 Cx) MTX + prednisolona16 (21 Cx) ninguno | 129 Cx ortopédicas de mano programadas | % infecciones posquirúrgicas% infecciones locales% infecciones sistémicas% alteración de la cicatrización% rebrote de la enfermedad |
| Fuerst, 200673AlemaniaLongitudinal observacional prospectivo a 2 meses | N=201 (201 Cx); Edad media: 62 (rango: 28-82); 85% mujeres94% AR; 4% APs; 2% AIJ; no referencia actividad basalSin datos de comorbilidad49% con corticoides a una dosis media de 5,9 mg | 124 MTX (65 + corticoides)32 LFN (28 + corticoides)25 MTX + LFN (20 + corticoides)5 ETN (4 + corticoides)11 MTX + ETN (9 + corticoides)3 MTX + IFX (2 + corticoides)1 LFN + IFX + corticoides | 6 artroscopias cualquier localización programadas44 Cx de rodilla programadas38 Cx de cadera programadas119 Otras Cx ortopédicas programadas | % infecciones posquirúrgicas |
| Kawakami, 201039JapónLongitudinal observacional retrospectivod | N=112 AR (128 Cx); Edad media: 57 (rango: 47-61); 75% mujeresArtralgias como medida de actividad basalDM 5 (5%) | 49 (64 Cx) expuestas a biológicos (IFX 21, ETN 19, TCZ 2)63 (64 Cx) no expuestas a biológicos | 33 Cx de rodilla8 Cx de cadera23 Otras Cx ortopédicas | % infecciones posquirúrgicas% infecciones locales% alteración de la cicatrización% trombosis venosa profunda% reactivación de la enfermedad |
| Bongartz, 200828EE. UU.Longitudinal observacional retrospectivo, un año | N=462 AR (657 Cx); Edad media: 64; 67% mujeresSin referencia de actividad basalSin datos de comorbilidad52% con corticoides, a una dosis media de 10 mg | 429 Cx con FAME (biológico o no)222 (34% Cx) suspendidob,e228 Cx sin FAME | 238 Cx de rodilla164 Cx de cadera | % infecciones posquirúrgicas |
| Escalante, 199572EE. UU.Longitudinal observacional retrospectivo a 2 meses | N=204 AR (367 Cx); edad media: 52, 90% mujeresSteinbrocker IV 18%10% diabetes, 40% con corticoides | 228 Cx tomando algún FAMEc139 Cx sin exposición a FAME | 119 Cx de rodilla106 Cx de cadera128 Otras Cx ortopédicas | % infecciones posquirúrgicas% infecciones locales% infecciones sistémicas% infección prótesis con retirada% alteración de la cicatrización |
| Giles, 200674EE. UU.Caso control tras 30 días | N=91 AR (91 Cx); Edad media: 59; 85% mujeresSin referencia de actividad basalSin datos de comorbilidad43% con corticoides | 35 (35 Cx) anti-TNF56 (56 Cx) sin anti-TNF | 35 artroscopias cualquier localización programadas66 Otras Cx ortopédicas programadas | % infecciones posquirúrgicas% infecciones locales |
| Bibbo, 200368EE. UU.Caso-control a tiempo no especificado | N=104 AR (725 Cx); Edad media: 56 (rango: 23-83); 84% mujeresSin referencia de actividad basalDM y vasculopatía y neuropatía periférica excluidasUtilizan corticoides 48 (46%) | 40 MTX16 hidroxicloroquina9 oro68 terapia combinada | 100% Cx de tobillo y pie múltiples programadas | % complicaciones posquirúrgicas% alteración de la cicatrización |
| Arkfeld, 200710,11EE. UU.Serie de casos a 8 meses | N=15 AR (22 Cx)Sin referencia de actividad basalSin datos de comorbilidad | 11 codos expuestos a anti-TNF11 codos no expuestos | 22 Plastias de codo | % infecciones posquirúrgicas% infecciones locales |
| Hirano, 201076JapónLongitudinal observacional retrospectivo a un mes | N=113 AR (113 Cx); Edad media: 61 (rango: 30-77); 86% mujeresVSG, PCR y grado funcional de Steinbrocker como medida de actividad basal Sin datos de comorbilidad Corticoides a una dosis media de 3,5 mg | 39 (39 Cx) con anti-TNF (siempre suspenden)64 (64 Cx) con otro FAME (no datos de suspensión) | 65 (58%) Cx de rodilla programadas30 (27%) Cx de cadera programadas18 (16%) Otras Cx ortopédicas programadas | % infecciones locales% alteración de la cicatrizaciónDías a la retirada de puntosHemoglobina mediaPeríodo febril posoperatorio |
| Hirao, 200977JapónSerie de casos a 2 semanas | N=44 AR (44 Cx);DAS28-PCR como medida de actividad basalSin datos de comorbilidadCorticoides a una dosis media de 7 mg | 22 Cx con tocilizumab sin suspender22 Cx con FAME no biológico (6 MTX, 10 sulfasalazina, 3 bucilamina, 1 D-penicilamina, 17 prednisolona(pareados por edad y Cx) | 15 (68%) artroscopias cualquier localización programadas9 (41%) Cx de rodilla programadas1 (5%) Cx de cadera programadas7 (32%) Otras Cx ortopédicas programadas | Fiebre y alteración de reactantes de fase aguda |
| Hiroshima, 201178JapónSerie de casos a 2 semanas | N=5 AR (8 Cx); Edad media: 57 (rango: 47-69); 98% mujeresSin referencia de actividad basalSin datos de comorbilidad | 5 (8 Cx) con tocilizumab (retirado 4 semanas antes) y pareados por edad y tipo de Cx:16 Cx con anti-TNF16 Cx con FAME no biológico | 1 (13%) Cx de rodilla programadas3 (38%) Cx de cadera programadas4 (50%) Otras Cx ortopédicas programadas | Fiebre y alteración de reactantes de fase aguda |
| Kanazawa, 201180JapónLongitudinal observacional retrospectivo sin especificar tiempo | N=442 AR (887 Cx); Edad media: 61; 90% mujeresSin referencia de actividad basalSin datos de comorbilidad ni de corticoides | 347 pacientes sin biológicos33 con ETN62 con otros biológicos | 887 Cx ortopédicas programadas | % infecciones |
| Saech, 200983AlemaniaSerie de casos | N=13 AR (18 Cx); Edad media: 61; 53% mujeresSin referencia de actividad basal ni datos comorbilidad salvo depleción de linfocitos B CD19.Todos con corticoides, a una dosis media de 7,5 mg | 13 con rituximab | 14 Cx ortopédicas4 otras Cx | % infecciones posquirúrgicas% alteración de la cicatrización |
| Shergy, 200585EE. UU.Serie de casos | N=73 AR (76 Cx)Sin referencia de actividad basalSin datos de comorbilidad | 73 con infliximab | 76 Cx sin especificar | % infecciones posquirúrgicas |
Cx: cirugía; DM: diabetes mellitus; ECA: ensayo controlado aleatorizado; ETN: etanercept; IFX: infliximab; LFN: leflunomida; MTX: metotrexato.
aPodían estar además tratados con D-penicilamina, oro, sulfasalazina o MTX, pero todos se suspendían antes de la Cx; bEn este estudio también se comparan estrategias en el grupo de expuestos a anti-TNF, pero lo incluimos en este apartado únicamente para no duplicarlo en la tabla; cCompara pacientes con complicaciones frente a pacientes sin complicaciones, pero especifica que en la institución no se suspende el tratamiento con FAME, por lo que es de suponer que la mayoría de los pacientes lo continúan; dDescrito por los autores como caso control, porque seleccionan a pacientes sin anti-TNF pareados por edad, sexo y tipo de cirugía; eDe acuerdo con una tabla de días por fármaco: MTX 8, leflunomida 85 o 14 con colestiramina, oro oral 8, oro intramuscular 29, sulfasalazina 8, hidroxicloroquina 85, azatioprina 8, ciclosporina 8, ciclofosfamida 8, D-penicilamina 15, etanercept 8, adalimumab 15, infliximab 57 y anakinra 8.