Investigar los mecanismos moleculares de respuesta tisular tras el tratamiento con la técnica Electrólisis Percutánea Intratisular (EPI®) en la tendinosis inducida por colagenasa tipo i en ratas Sprague Dawley.
MétodosEn una muestra de 24 ratas Sprague Dawley de 7 meses de edad y 300g se indujo tendinosis mediante la inyección en el tendón rotuliano de 50μg de colagenasa tipo i. Se procedió a dividir la muestra en 4 grupos: un grupo control, un grupo colagenasa y 2 grupos de tratamiento con técnica EPI® a 3 y 6mA, respectivamente. Se aplicó una sesión de tratamiento EPI® y tras 3 días se procedió al análisis de los tendones mediante técnicas de inmunodetección y electroforesis. Se analizaron las proteínas citocromo C, Smac/Diablo, factor de crecimiento endotelial vascular y su receptor 2. También se analizó el factor de transcripción nuclear peroxisoma proliferador activado del receptor gamma.
ResultadosSe observó un aumento estadísticamente significativo en la expresión del citocromo C, Smac/Diablo, factor de crecimiento endotelial vascular, su receptor 2 y peroxisoma proliferador activado del receptor gamma en los grupos a los que se les aplicó la técnica EPI® respecto al grupo control.
ConclusionesLa técnica EPI® produce, en la lesión tendinosa inducida con colagenasa tipo i en ratas, un aumento de los mecanismos moleculares antiinflamatorios y angiogénicos.
To investigate the molecular mechanisms of tissue response after treatment with the Intratissue Percutaneous Electrolysis (EPI®) technique in collagenase-induced tendinopathy in Sprague-Dawley rats.
MethodsTendinopathy was induced by injecting 50μg of type i collagenase into the patellar tendon of 24 Sprague Dawley rats of 7 months of age and weighting 300g. The sample was divided into 4 groups: the control group, collagenase group, and two EPI® technique treatment groups of 3 and 6mA, respectively. An EPI® treatment session was applied, and after 3 days, the tendons were analysed using immunoblotting and electrophoresis techniques. An analysis was also made of cytochrome C protein, Smac/Diablo, vascular endothelial growth factor and its receptor 2, as well as the nuclear transcription factor peroxisome proliferator-activated receptor gamma.
ResultsA statistically significant increase, compared to the control group, was observed in the expression of cytochrome C, Smac/Diablo, vascular endothelial growth factor, its receptor 2 and peroxisome proliferator-activated receptor gamma in the groups in which the EPI® technique was applied.
ConclusionsEPI® technique produces an increase in anti-inflammatory and angiogenic molecular mechanisms in collagenase-induced tendon injury in rats.
La tendinosis rotuliana afecta a un número importante de atletas cuyo denominador común es realizar saltos o movimientos balísticos1. Actualmente se considera la tendinosis un proceso degenerativo más que un proceso inflamatorio, y a pesar de que se han descrito múltiples opciones terapéuticas, ninguna se ha establecido como método estándar2,3.
El uso de modelos experimentales basados en la inducción de tendinosis mediante colagenasa (metaloproteinasa capaz de romper los enlaces peptídicos del colágeno) ha sido aplicado previamente4. Para el estudio experimental de las tendinosis se ha utilizado previamente la valoración de proteínas como el citocromo C, Smac/Diablo, factor de crecimiento endotelial vascular (VEGF), su receptor 2 (VEGFR-2) y el factor de transcripción nuclear peroxisoma proliferador activado del receptor gamma (PPAR-γ). El citocromo C es una proteína monomérica capaz de activar las caspasas desencadenantes de las últimas fases de la apoptosis en las tendinopatías5. La Smac/Diablo es una proteína mitocondrial, cuya liberación al citosol celular induce la apoptosis, presumiblemente siguiendo las mismas rutas de salida que el citocromo C6. El VEGF es una proteína señalizadora implicada en la angiogénesis y vasculogénesis que ha demostrado, in vitro, estimular la división y la migración de células endoteliales7. El VEGFR-2 es un receptor tirosina-quinasa que actúa como el mediador más importante de la respuesta angiogénica del VEGF8. Por último PPAR-γ, de la familia de los factores de transcripción nucleares (superfamilia de receptores esteroideos), ha demostrado producir una disminución de la respuesta inflamatoria9.
La técnica Electrólisis Percutánea Intratisular (EPI®) produce una ablación electrolítica no termal que induce una respuesta inflamatoria controlada, permitiendo activar los mecanismos celulares implicados en la fagocitosis y en la regeneración del tejido blando dañado10.
Dado que trabajos recientes han demostrado buenos resultados clínicos con la técnica a estudio11, el objetivo del presente análisis fue investigar mediante técnicas de inmunodetección y electroforesis los mecanismos moleculares de respuesta tisular implicados en el tratamiento con técnica EPI®, tras la inducción de tendinosis con colagenasa en ratas Sprague Dawley.
Material y métodoPara llevar a cabo el estudio se utilizaron 24 hembras de rata Sprague Dawley de 7 meses de edad y aproximadamente 300g de peso. El estudio cumplió con los requisitos éticos y fue aprobado por el Comité de Bioética de la Universidad de Medicina (A-1301314899794). Se siguieron las normas del Real Decreto 1201/2005, de 10 de octubre, relativo a la protección de los animales utilizados para experimentación (BOE n.o 252. p. 34367-34391).
Los animales se distribuyeron en 4 grupos: 6 ratas de control que no recibieron ninguna intervención (grupo control), 6 ratas inyectadas con colagenasa que no recibieron tratamiento con técnica EPI® (grupo colagenasa), 6 ratas inyectadas con colagenasa y tratadas con técnica EPI® a 3mA de intensidad (grupo EPI®-3mA), y 6 ratas inyectadas con colagenasa y tratadas con técnica EPI® a 6mA de intensidad (grupo EPI®-6mA).
La técnica EPI® consistió en la aplicación ecoguiada a través de una aguja de 0,32mm de una corriente continua mediante un dispositivo especialmente diseñado y certificado para tal fin (Directiva CE 93/42/EEC. EPI Advanced Medicine®, Barcelona, España).
Modelo experimentalSe inyectó en la zona proximal del tendón rotuliano de las ratas 50μg de colagenasa de tipo i (Laboratorios Sigma-Aldrich, St. Louis, MO, EE. UU.), produciendo una tendinosis comprobada por ecografía siguiendo el protocolo definido por la European Society of Musculoskeletal Radiology para el estudio de tendinopatías12.
Para la realización de la técnica EPI® se realizaron 3 punciones ecoguiadas de 4s de duración cada una, en la zona proximal del tendón rotuliano de las ratas, con una intensidad de 3 o 6mA, dependiendo del grupo a estudio. Tras 7 días las ratas fueron sacrificadas y se extrajo quirúrgicamente una muestra del tendón siguiendo el procedimiento estándar.
Se utilizó el método Lowry13 para determinar la concentración de proteína en la muestra de tejido en rangos de 0,01-1mg/ml, y se analizaron las muestras por inmunodetección y espectrofotometría (λ= 660nm). Se analizaron las proteínas citocromo C, Smac/Diablo, VEGF y VEGFR-2. A su vez, se estudió el factor de transcripción nuclear PPAR-γ. Se validaron los resultados por estudio western blot contra tubulina, expresando los resultados en unidades de densitometría relativas.
Análisis estadísticoLos resultados se expresan como media±desviación estándar. El análisis estadístico se realizó mediante la prueba t-test. Se realizó análisis ANOVA para valorar las relaciones entre las variables, así como pruebas post-hoc y de Dunnett para comparar los diferentes grupos con el grupo control y la prueba de Scheffé para comparar todos los grupos entre sí. El nivel de significación se fijó en el 5% (p<0,05). El análisis estadístico se realizó con el programa SPSS® versión 17 (SPSS Inc., Chicago, Illinois, EE. UU.).
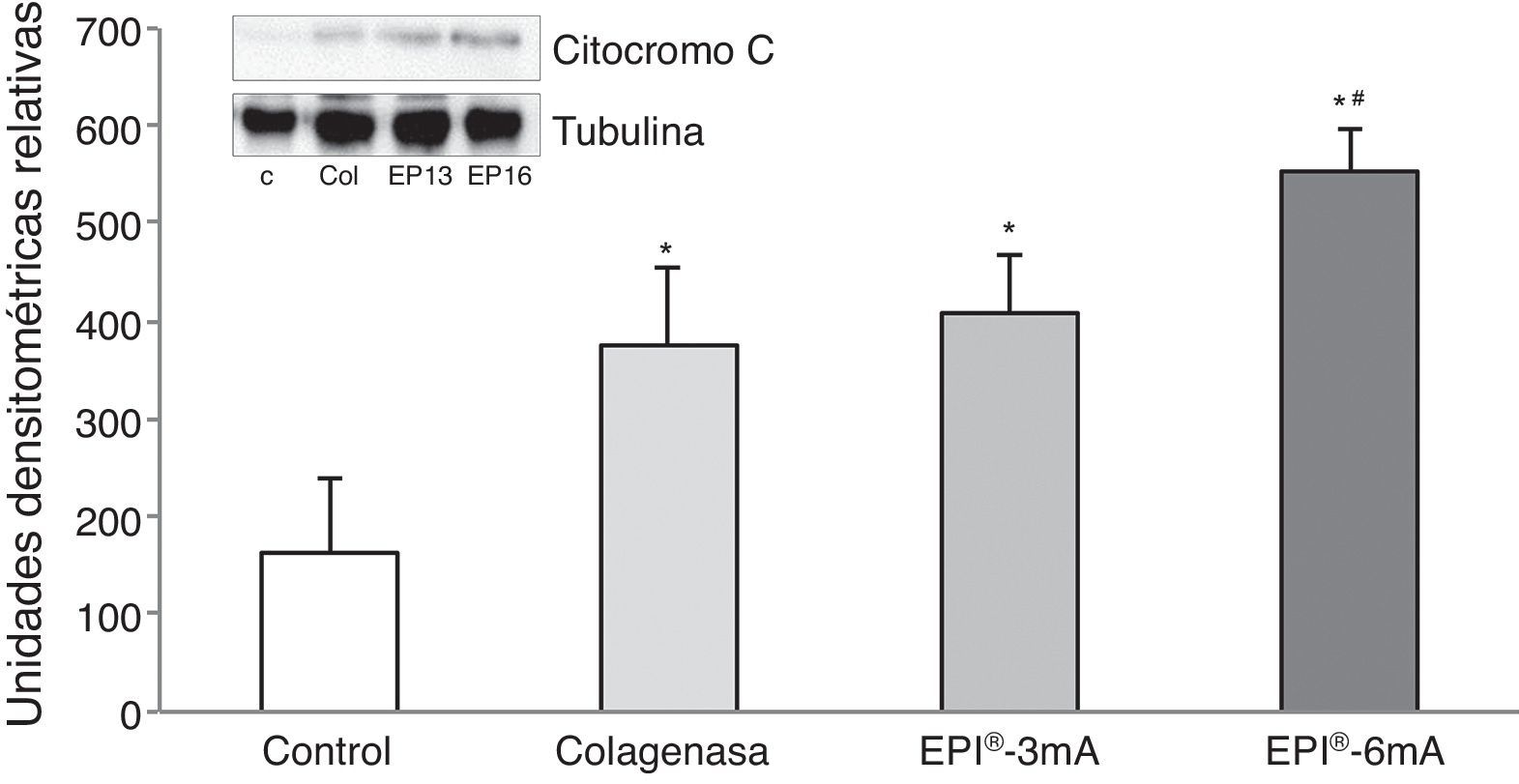
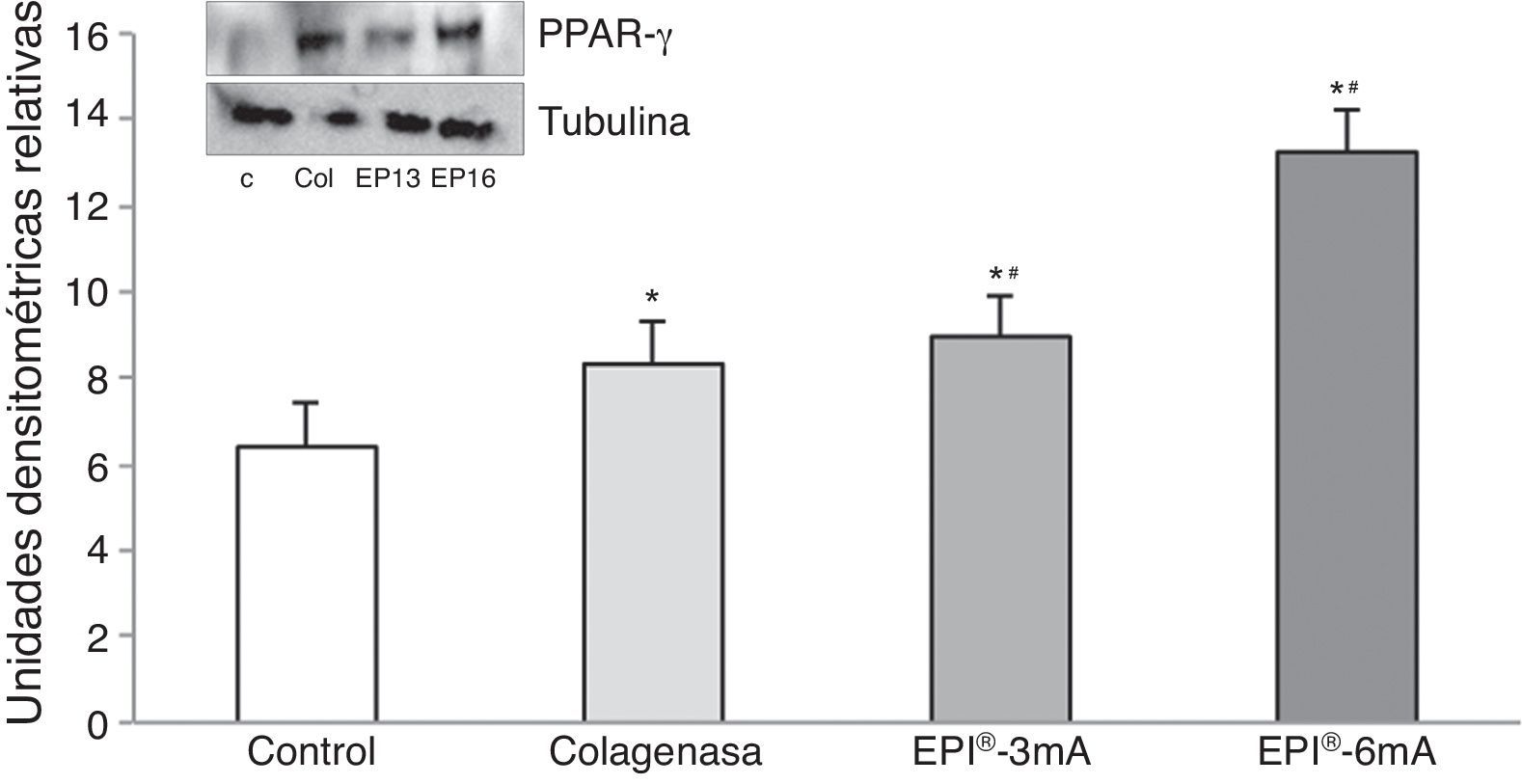
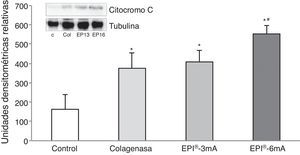
ResultadosEl estudio del citocromo C (fig. 1) mostró niveles elevados de esta proteína en todos los grupos en comparación con el grupo control (p<0,001). Se encontraron diferencias estadísticamente significativas al comparar el grupo EPI®-3mA y el grupo EPI®-6mA (p<0,013), al igual que al compara el grupo EPI®-6mA y el grupo colagenasa (p=0,002).
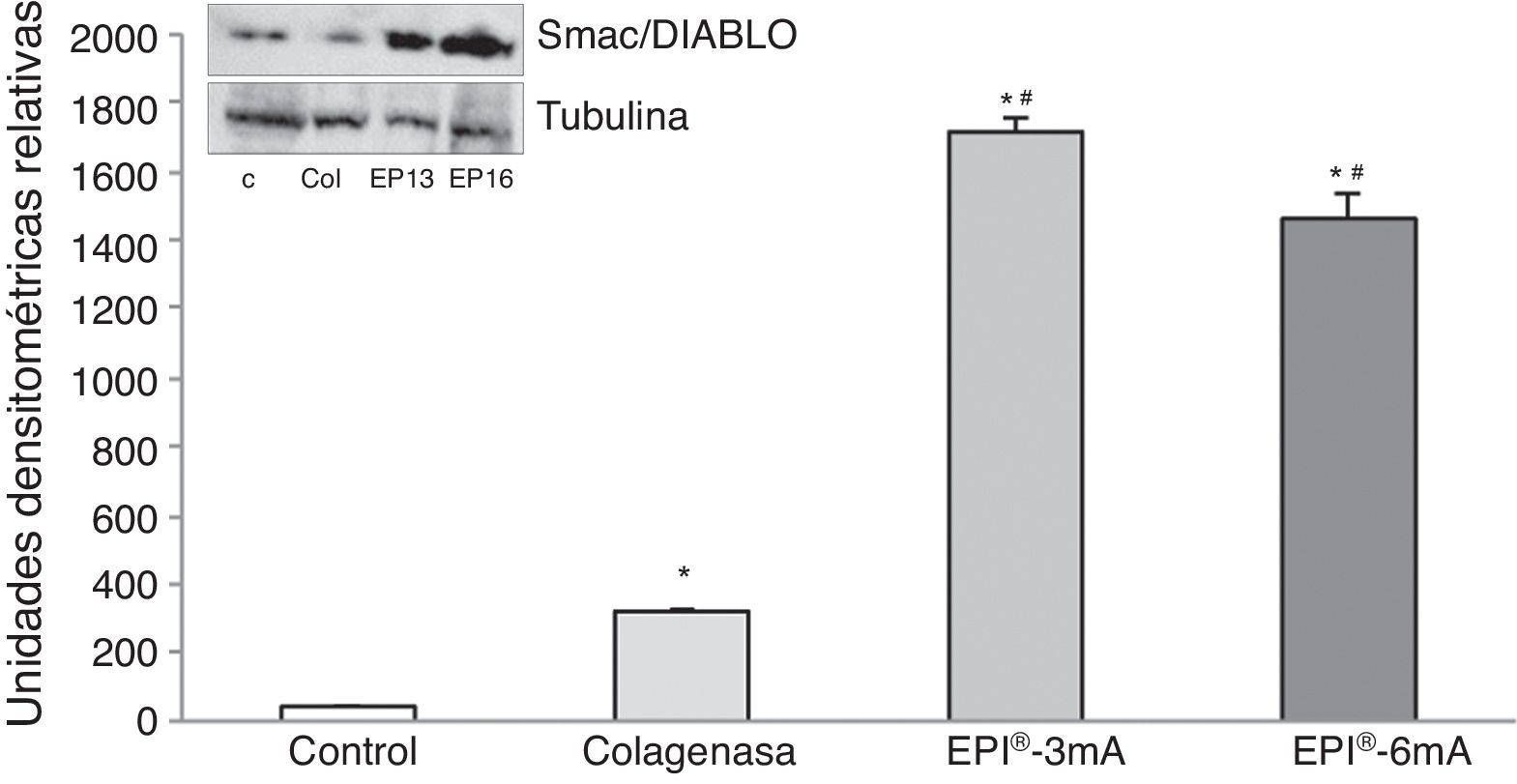
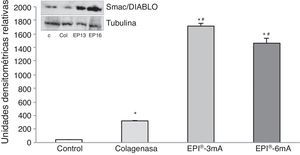
La proteína Smac/Diablo (fig. 2) mostró una sobreexpresión de la misma (p<0,001), detectando diferencias estadísticamente significativas al comparar los 2 grupos de tratamiento (EPI®-3mA y EPI®-6mA) con el grupo colagenasa (p<0,001).
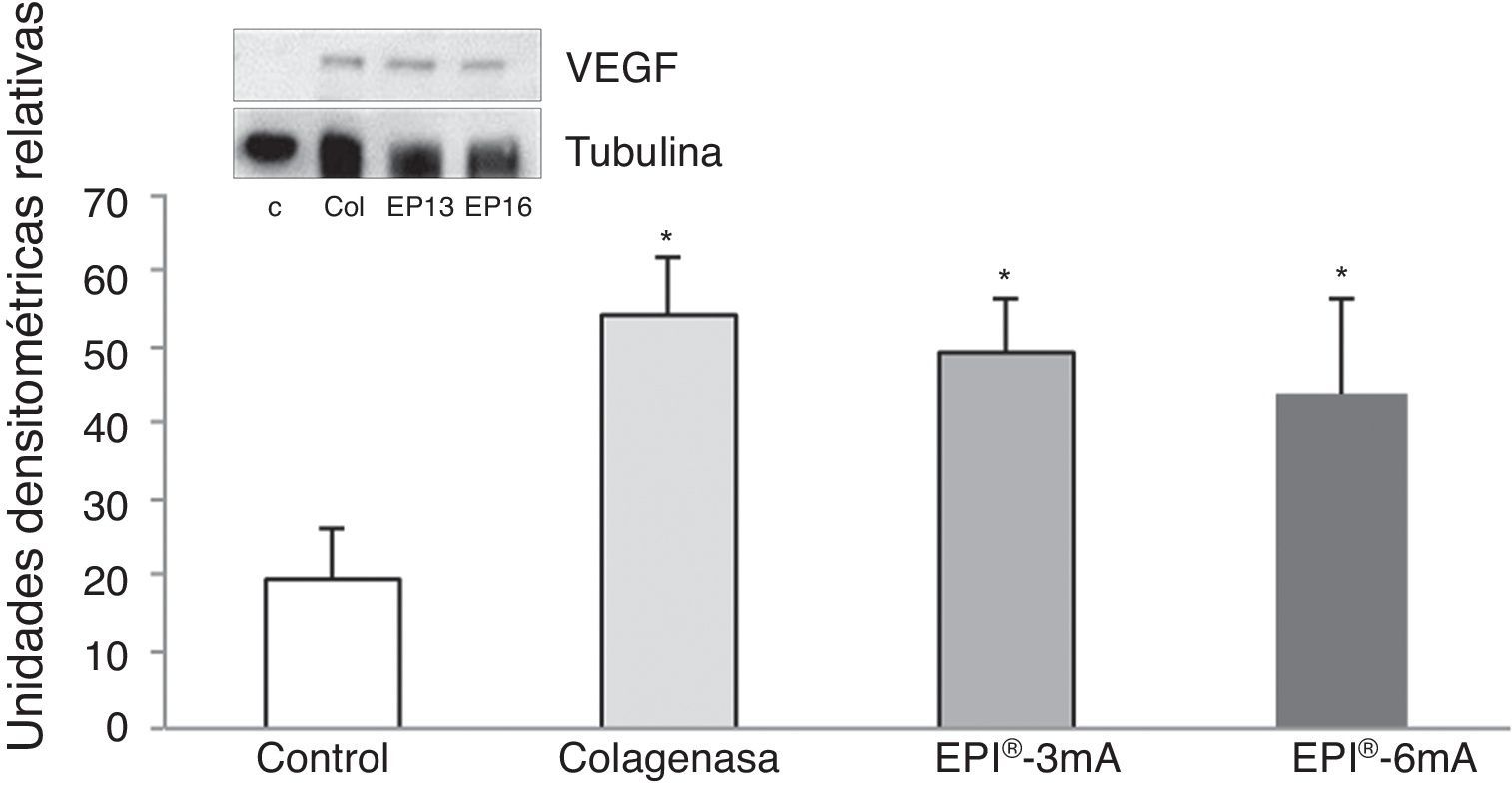
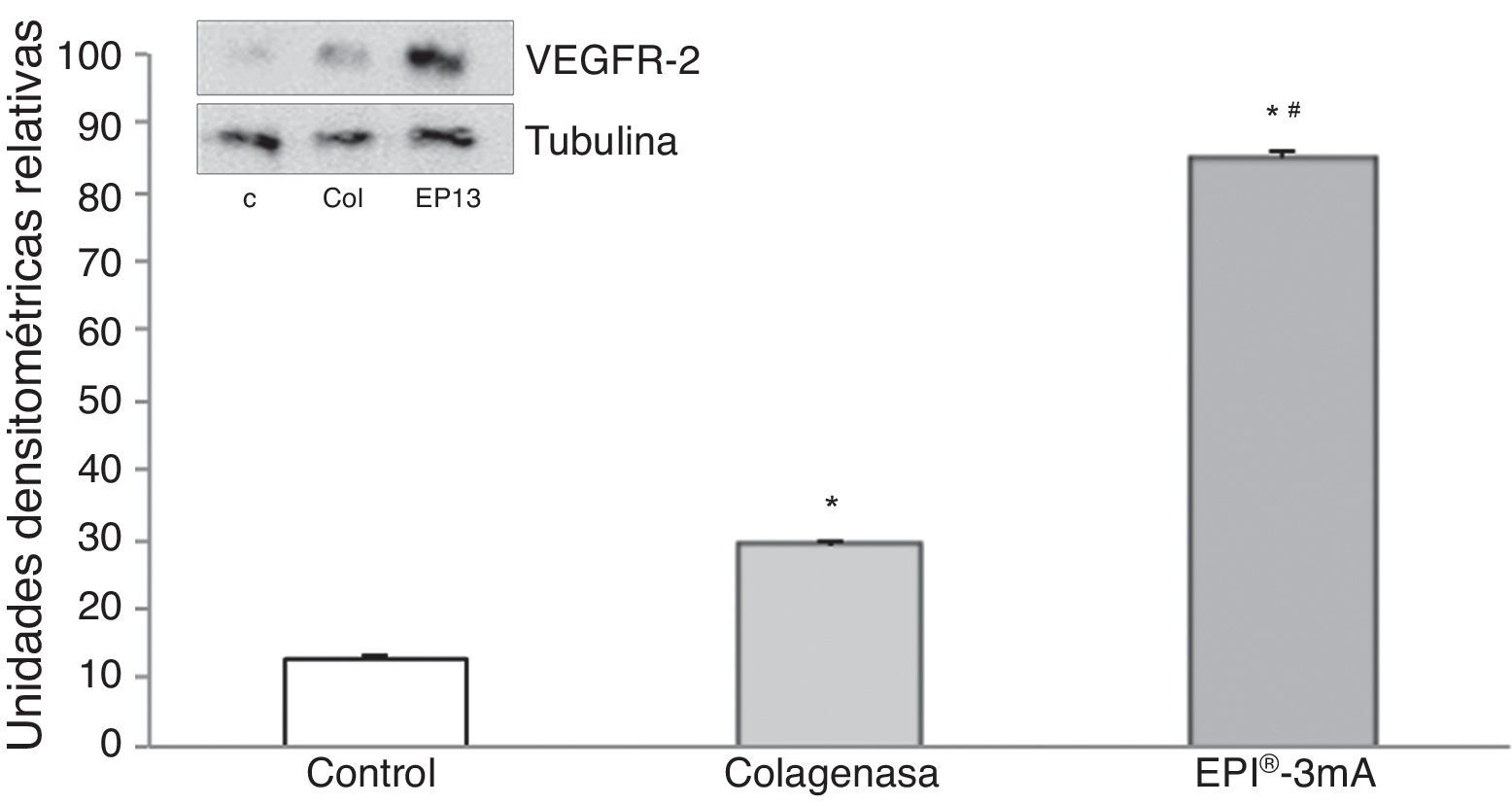
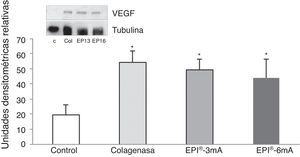
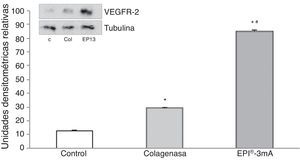
El análisis del VEGF (fig. 3) mostró un aumento significativo (p<0,001) en todos los grupos a estudio. A su vez se detectó un aumento significativo (p<0,001) del VEGFR-2 (fig. 4).
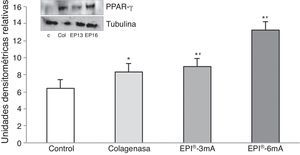
Por último, la PPAR-γ (fig. 5) presentó un aumento significativo en comparación con el grupo control (p<0,001), presentando diferencias estadísticamente significativas al comparar los grupo EPI®-3mA (p=0,009) y EPI®-6mA (p<0,001) con el grupo colagenasa.
DiscusiónEl principal hallazgo de este trabajo fue que la técnica EPI® produjo una sobreexpresión de las proteínas citocromo C, Smac/Diablo, VEGF, VEGFR-2 y del factor de transcripción nuclear PPAR-γ.
A pesar de que actualmente no exista un tratamiento para la tendinosis considerado como estándar, se han descrito múltiples técnica destinadas a tal fin. Entre ellas se encuentra el ejercicio excéntrico, la cirugía (abierta o artroscópica), las ondas de choque, la esclerosis de las neovascularizaciones, los antiinflamatorios no esteroideos o la aplicación de plasma rico en plaquetas o aprotina, entre otras2,3.
La técnica EPI® es una corriente eléctrica no termal que induce una respuesta regenerativa del tejido dañado10. Por inestabilidad iónica se crea la formación de moléculas de hidróxido de sodio, produciendo debajo del electrodo activo o aguja catódica una modificación del pH y un aumento de la presión de oxígeno, permitiendo la fagocitosis y la activación biológica de la reparación del tendón, que se encontraba alterada por la cronicidad del proceso degenerativo10,11.
Trabajos anteriores con terapia electrolítica, como el de Gravante et al.14, demostraron los efectos de estas técnicas en la respuesta inflamatoria. Un metaanálisis de Gardner et al.15 demostró que la estimulación eléctrica en heridas crónicas y úlceras de decúbito producía una curación más rápida, mientras que Zhao et al.16 observaron cómo un campo eléctrico aplicado a cultivos de células endoteliales estimulaba la producción de VEGF, así como la elongación y migración celular, resultados que concuerdan con los mostrados en el presente trabajo. Posteriormente, Yang et al.17 observaron que la aplicación de corriente directa en tejido blando lesionado es fundamental en la gestión y migración de células epiteliales en la respuesta de cicatrización.
La teoría de la lesión tendinosa secundaria al sobreuso parece ser la más aceptada1. Al igual que autores como Alfredson et al.18 o Tan y Chan19, consideramos la tendinosis como un proceso degenerativo más que como un proceso inflamatorio. De acuerdo con Fu et al.20, el aumento de las proteínas VEGF, Smac/Diablo, citocromo C, VEGFR-2 y la proteína antiinflamatoria PPAR-γ está relacionado con la respuesta inflamatoria y la reparación tisular. Dado que la tendinosis es un proceso degenerativo, el tratamiento con la técnica EPI® podría estar justificado10,11,21–23.
El presente estudio mostró una mayor capacidad de sobreexpresión del citocromo C, marcador de apoptosis relacionado con las tendinosis5, tras la aplicación de la técnica EPI®. La proteína Smac/Diablo es exportada al citosol desde la mitocondria, produciendo apoptosis a través de la activación de caspasas6 y daño en el ADN como resultado de la unión al receptor CD9524. Los datos presentados muestran cómo los grupos que recibieron tratamiento con la técnica EPI® presentaron un aumento de la expresión de esta proteína. Tal y como describieron Huang et al.25, el aumento de la apoptosis vía las proteínas Smac/Diablo y la inducción de VEGF a través de VEGFR-2 es probablemente debido al aumento de la inhibición de las células B en el desarrollo de la médula ósea y de la diferenciación de las células T del timo.
Tras el tratamiento con la técnica EPI® se ha observado un aumento de las proteínas antiinflamatorias como la PPAR-γ9, que tienen un papel primordial en la inhibición de la expresión de moléculas proinflamatorias secretadas por los macrófagos como el TNF-α, IL-6 e IL-1β26, produciendo una respuesta molecular en el tejido tratado altamente beneficiosa en el transcurso de una tendinosis. A su vez, esto resulta en un aumento de la expresión del VEGF y VEGFR-2, mediadores responsables de la angiogénesis y respuesta antiinflamatoria7,27. La literatura identifica los receptores VEGFR-1 y VEGFR-2 como los mayor expresados en el tendón de Aquiles humano8. Nuestros resultados muestran un aumento del VEGFR-2 tras el tratamiento con la técnica EPI®, lo que evidencia una modificación en la vía de apoptosis celular y un aumento de la angiogénesis.
Una limitación de este estudio fue el uso de modelos experimentales en animales, por lo que los resultados obtenidos podrían no ser completamente extrapolables a humanos28. Sin embargo, los resultados de este estudio son alentadores y ponen de relieve la necesidad de realizar estudios adicionales que incluyan microdiálisis molecular y estudio histológico del tejido tratado18,29. Se debe destacar el moderado número de animales de experimentación, si bien los resultados han demostrado una adecuada potencia estadística. Otra limitación podría ser el estudio de 6 alteraciones moleculares en una dolencia tan compleja y desconocida como la que se presenta.
ConclusionesLa técnica EPI® produce, en la lesión tendinosa inducida con colagenasa tipo i en ratas, un aumento de los mecanismos moleculares antiinflamatorios y angiogénicos.
Nivel de evidenciaNivel de evidencia i.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor J.M. Sanchez-Ibáñez posee la patente de los dispositivos EPI®. Ha participado en la realización del tratamiento, así como en la redacción del manuscrito, pero no ha participado en la obtención de las muestras, el análisis molecular ni el estudio estadístico de los datos obtenidos.