Una de las más graves complicaciones que pueden aparecer tras la cirugía discal es la fibrosis peridural (FP) o perirradicular. La FP consiste en la formación de tejido fibrótico extradural, que produce una adherencia de la duramadre y de las raíces nerviosas a los músculos paravertebrales de la columna, por atrás, y al disco y al cuerpo vertebral por delante. Esta formación cicatricial restringe la movilidad de la raíz nerviosa haciéndola más vulnerable a la recidiva de la protrusión discal y a la estenosis del canal raquídeo. Algunos autores1 consideran que el principal causante del dolor postquirúrgico tras la discectomía y laminectomía lumbar es la fibrosis peridural, la cual produce un atrapamiento de las raíces nerviosas y un dolor de tipo neuropático (dolor por desaferenciación). Actualmente la teoría etiopatogénica más en boga es la propuesta, en 1974, por LaRocca y MacNab2, en la que afirman que la FP procede de la superficie sangrante de la capa profunda de los músculos paravertebrales posteriores. Estos autores bautizaron esta capa como «la membrana de la laminectomía» que cubriría el defecto creado por la laminectomía en un intento de reemplazo del espacio vacío mediante la formación de tejido fibroso que procura reconstituir la lámina resecada y se extiende dentro del canal neural.
Ante una FP establecida y diagnosticada convenientemente, las medidas terapéuticas son escasas. No se conoce un tratamiento farmacológico que cure la FP3, habiéndose recurrido de forma paliativa a la prescripción de analgésicos, tratamiento fisioterápico o antiinflamatorios no esteroideos (AINE) en períodos dolorosos. Al plantearse la indicación quirúrgica no hay uniformidad en la bibliografía que hemos revisado. Algunos autores la descartan sistemáticamente4 y otros la admiten como medida de salvación en enfermos con dolor incapacitante5.
Se acepta que la mejor manera de evitar la aparición de la FP es prevenir su formación. Se han descrito como medidas preventivas intraoperatorias la realización de una cirugía meticulosa6, la hemostasia cuidadosa y la colocación de barre-
ras entre la musculatura paravertebral y la duramadre, tanto físicas7-9 como químicas10-12. Los AINE son un ejemplo de barrera química. Presentan una ventaja en comparación con las barreras físicas, no suponer cuerpos extraños que por sí mismos aumentarían la respuesta inflamatoria secundaria al trauma quirúrgico. Por el contrario, son inhibidores de la enzima ciclooxigenasa responsable de la síntesis de las prostaglandinas (PG), mediadores biológicos de gran potencia capaces de desencadenar reacciones de vasodilatación y quimiotaxis. Además, hemos de mencionar el efecto ya conocido de los AINE en la prevención de las calcificaciones, osificaciones heterotópicas y adherencias abdominales13.
Nuestro objetivo es comprobar si un AINE de uso común, el aceclofenaco, suministrado desde el mismo momento de la intervención, es capaz de inhibir la proliferación fibroblástica tras practicar una laminectomía en el conejo.
MATERIAL Y MÉTODO
Este estudio, aprobado por la Comisión de Investigación y Ética de nuestro hospital, cumple, en todos sus extremos, el Real Decreto 223/1988, de 14 de marzo, la Orden de 13 de octubre de 1989 y la Directiva del Consejo de Europa de 24 de noviembre de 1986 (86/609/CEE).
Realizamos un estudio experimental en 24 conejos machos New Zealand White (NZW), practicando una laminectomía en el espacio L4-L5, distribuidos en 2 grupos, que se sacrificaron a las 2 y 4 semanas, respectivamente. Todos fueron anestesiados con una inyección intramuscular de ketamina (35 mg/kg), xilacina (5 mg/kg) y acepromacina (1 mg/kg). La profilaxis antibiótica se realizó con cefazolina (50 mg/kg por vía intramuscular), en una dosis preoperatoria. Se practicó una incisión de 4 cm con el bisturí en la línea media posterior entre la L3 y L5, considerando que los conejos cuentan con siete vértebras lumbares y la altura del cuerpo vertebral de L5 es de 24 mm14. La fascia fue incidida para exponer el extremo de las apófisis espinosas, que son cortas y orientadas en sentido craneal. Los músculos paraespinosos fueron disecados subperiósticamente de las espinosas y de las láminas, y retraídos con un separador autoestático. La laminectomía consistió en la resección de la apófisis espinosa de la vértebra caudal, resección del ligamento amarillo y resección de las apófisis articulares inferiores de la vértebra craneal y del tercio distal de la lámina de esta vértebra (L4), hasta conseguir una exposición de la duramadre, de 4 x 8 mm, aproximadamente, con una técnica meticulosa para no lesionar la médula espinal. Los conejos fueron divididos en 2 grupos experimentales según fueran sacrificados en la segunda o cuarta semana (G1 y G3, respectivamente) y sus correspondientes grupos control (G2 y G4); así se constituyeron 4 grupos de 6 conejos cada uno. Los conejos de los grupos control fueron inyectados con 1 cc de suero fisiológico, por vía intramuscular, desde el día de la intervención hasta el séptimo día después de la operación. Los conejos de los grupos experimentales fueron inyectados con 5 mg/kg al día de aceclofenaco, por vía intramuscular, desde el día de la intervención hasta el séptimo día después de la operación.
Los animales fueron sacrificados a las 2 o 4 semanas, según el grupo, mediante una sobredosis de pentobarbital (60 mg/kg) por una vía intravenosa. Se extrajo la columna en bloque, entre la L3 y la L5, para el estudio anatomopatológico. Se fijó con formol al 10% durante 24 horas y se decalcificó en ácido fórmico durante 3 semanas. Se practicaron secciones axiales de 2 mm (fig. 1) para su inclusión en parafina. Se tiñeron las preparaciones con hematoxilina-eosina (H-E), que permitió la cuantificación de las células inflamatorias: linfocitos, macrófagos y polimorfonucleares (PMN); con tricrómico de Masson, que posibilitó la cuantificación de la superficie de la membrana fibrosa, y con métodos inmuno-histoquímicos (IHQ), que permitieron la cuantificación de los fibroblastos con un sistema de análisis.
Figura 1. Cortes medulares axiales de 2 mm.
Para las técnicas de inmunohistoquímica se empleó la siguiente metodología.
Se desenmascaraban los antígenos por calor, se realizó una inmunotinción para la detección de antígenos mediante el sistema estreptavidina-biotina-peroxidasa, se procedió al marcaje enzimático mediante peroxidasa de rábano y se utilizó como cromógeno la diamino-bencidina y como anticuerpos primarios el anticuerpo antivimentina monoclonal producido en conejo (clona V9, Biogenex®). La vimentina es una proteína constituida por un único péptido de 57 kilo-daltons que forma parte fundamentalmente del citoesqueleto de los fibroblastos y presenta expresión antigénica.
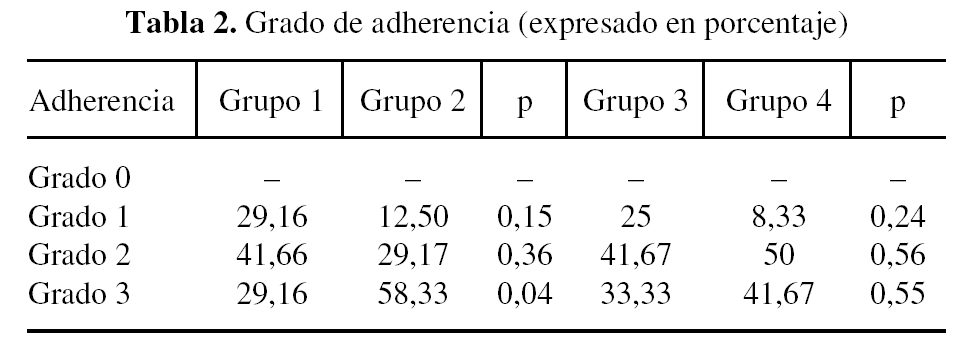
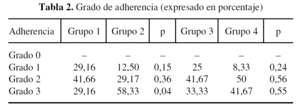
Se realizaron las siguientes mediciones en cada una de las cuatro secciones histológicas obtenidas de cada animal: superficie de la membrana fibrosa en mm2, grado de adherencia a la duramadre, número total de fibroblastos por mm2, densidad de fibroblastos por mm2 y densidad de células inflamatorias por mm2. Las adherencias se graduaron en: grado 0 (no existe adherencia entre duramadre y fibrosis), grado 1 (adherencia menor de un tercio de la superficie de la duramadre), grado 2 (entre uno y dos tercios), grado 3 (mayor de dos tercios).
Se procedió a la detección del área de fibrosis en función de las intensidades del color verde de la tinción de Masson, reflejándose en un falso color para una mejor visualización. Posteriormente, se realizó una primera selección mediante el lápiz óptico, donde se señalaron las áreas de fibrosis que interesaban, separándolas de otras áreas que presentan una tonalidad similar de color verde (por ejemplo, osteoide) y se procedió a la cuantificación del área de fibrosis en mm2.
Por otro lado, para realizar la cuantificación del número de fibroblastos, las preparaciones inmunohistoquímicas fueron digitalizadas mediante una cámara Leica DC 100 (Leica, Solms, Alemania) anexionada a un microscopio con un ocular vario dotado de magnificación 1,6x, y un objetivo con un aumento 10x/0,25, y analizadas mediante un procesador de imágenes Leica QWIN (Leica, Solms, Alemania). Se procedió a la captura mediante digitalización en color real del área de interés, quedando así establecido el rango de color. En ese momento se realizó una detección automática, en función del color, de todos los citoesqueletos celulares (la reacción IHQ de la vimentina tiñe los fibroblastos de color marrón). Así, se realiza la cuantificación del área de medición, número de células positivas y número de células positivas/mm2.
Por último, se realizó la cuantificación de las células inflamatorias (linfocitos, PMN y macrófagos) tras teñir las preparaciones histológicas con H-E y tricrómico de Masson.
El análisis de los datos consistió en una estadística descriptiva y estadística inferencial. Como el tamaño muestral es reducido se aplicó el test no paramétrico de la U de Mann-Whitney cuando se trataba de variables cuantitativas continuas y el de ji cuadrado en las variables cualitativas.
RESULTADOS
No se registró ninguna infección superficial ni profunda. El drenaje fue similar en ambos grupos, con una media de 1 ml. Los puntos quirúrgicos se retiraron a los 7 días. En ningún caso se observaron dehiscencias ni alteraciones macroscópicas en la herida quirúrgica.
Los hallazgos histológicos del grupo control, a las 2 semanas, se limitaron a un amplio hematoma que rellenaba la laminectomía y se hallaba en contacto con la duramadre. En el grupo de casos, a las 2 semanas, se observó una menor adherencia del hematoma a la duramadre, con similares estirpes celulares. En el grupo control, a las 4 semanas, se apreció cómo el hematoma había sido progresivamente sustituido por tejido fibroso, y que en las zonas cercanas a la lámina resecada se había sufrido una metaplasia a tejido condroide y hueso. En los casos, a las 4 semanas, el hematoma había sido progresivamente sustituido por tejido fibroso.
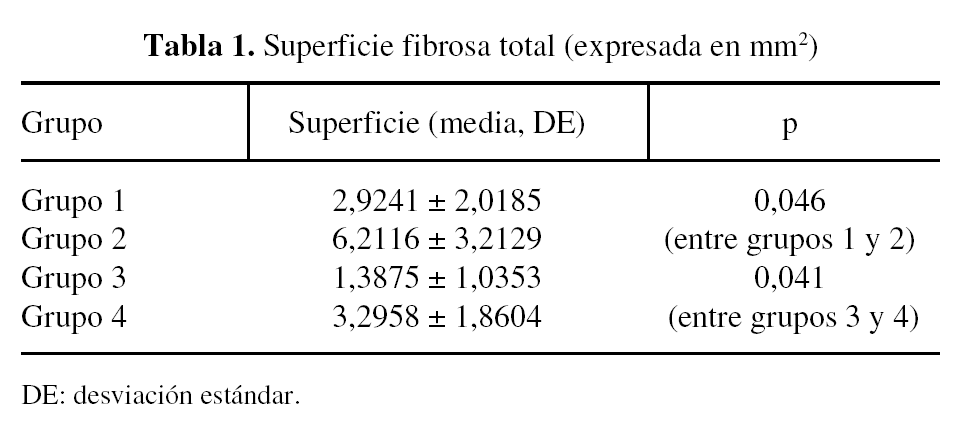
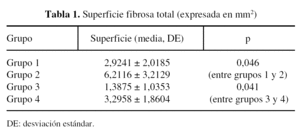
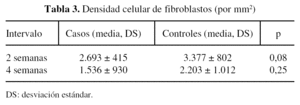
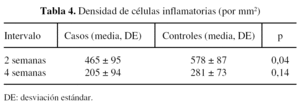
La superficie fibrosa total, a las 2 y a las 4 semanas, viene reflejada en la tabla 1. El grado de adherencia, a las 2 y a las 4 semanas, se expresa en la tabla 2. El número de fibroblastos y de células inflamatorios se reseñan en las tablas 3 y 4.
Se puede observar que la media de la superficie fibrosa es siempre menor en los conejos de los grupos de intervención frente a los controles, tanto a las 2 como a las 4 semanas. La diferencia es estadísticamente significativa (p < 0,05) sólo cuando se estudian todas las secciones en conjunto. En cuanto al grado de adherencia de la FP a la duramadre, hemos observado que esta adherencia siempre está presente, ya que no se han observado grados 0.
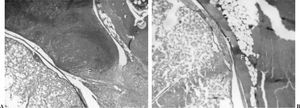
En más del 70% del total de las muestras esta adherencia era, como mínimo, de moderado tamaño y al menos un tercio tenía proporciones considerables. También fue menor en los conejos del grupo inyectado con aceclofenaco (fig. 2). Únicamente se observó diferencia estadísticamente significativa en los grados 3 y en el grupo sacrificado a las 2 semanas.
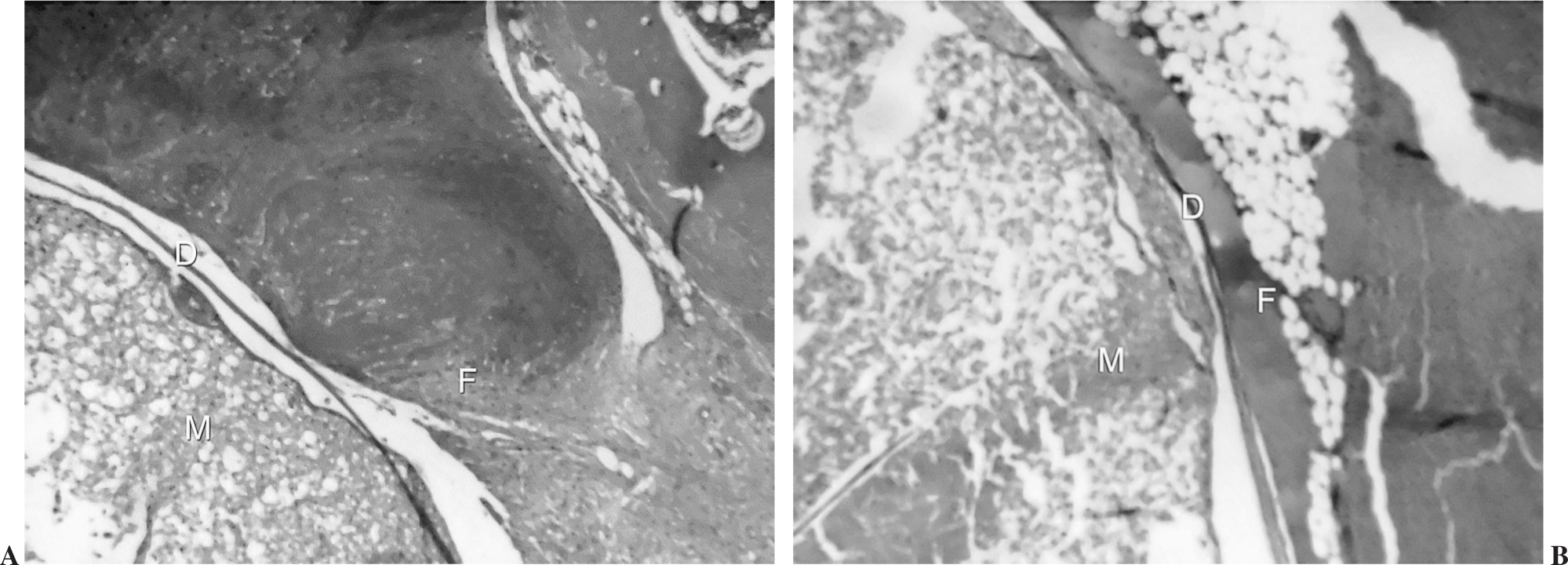
Figura 2. Adherencia fibrosa a la duramadre a las 4 semanas. A. Grupo experimental. B. Grupo control. H-E3 40. D: duramadre; F: fibrosis peridural; M: médula espinal.
En relación a la densidad celular de la cicatriz fibrosa se apreció un menor número de fibroblastos en los grupos de intervención y un progresivo descenso con el paso de los días, pero sin alcanzar significación estadística. Asimismo, se observó un menor número de todas las células inflamatorias, pero únicamente es reseñable una diferencia estadísticamente significativa en el grupo de las 2 semanas. Los tipos de células inflamatorias fueron similares en ambos grupos.
DISCUSIÓN
Desde los primeros estudios realizados sobre FP por LaRocca y MacNab2 se han venido utilizando diversas barreras físicas. Estas barreras impedirían la migración de los fibroblastos desde la musculatura expuesta hasta las estructuras neurales. Se han utilizado muchas sustancias con este fin, tanto biológicas como inertes, reabsorbibles e irreabsorbibles, sólidas o fluidas, quedando comprobado que ninguna es muy eficaz. Recientemente se ha utilizado una membrana de politetrafluroetileno expansible (ePTFE)15 y el ADCON-L (gel biorreabsorbible de gelatina y poliglicanos)16.
Bagó et al17 defienden el papel de la grasa frente a la fibrina que es hemostático pero estimula la síntesis de fibroblastos. Beajeux et al18 defienden el papel mecánico de la grasa epidural, que protege y facilita el movimiento del saco dural en relación al canal óseo. La resección de esta grasa también favorecería la formación de FP. Por otro lado, el injerto de grasa libre no se encuentra exento de complicaciones. Cabezudo et al19 observan una compresión del injerto de grasa sobre una raíz al tercer día después de la operación, lo que obliga a la reintervención. Consideran que no es conveniente que se talle muy grueso porque la musculatura lo puede empujar dentro del canal.
Kuivila et al20 reflejan en su revisión otros problemas más frecuentes del injerto de grasa como son la necrosis, la atrofia e incluso la presión sobre la cola de caballo.
MacKay et al21 estudian otros problemas de las barreras físicas. En un estudio clínico prospectivo concluyeron que colocar barreras de grasa sobre las raíces y la dura después de una discectomía no tenía efecto sobre el resultado de los síntomas, situación funcional o hallazgos por resonancia magnética (RM) pues la membrana de interposición no suponía efectos beneficiosos.
Bellen22 describe una grave complicación por el uso de una esponja hemostática como fue una parálisis motora monorradicular por hematoma intracanal el tercer día después de la operación.
Debido a los malos resultados de las barreras físicas o mecánicas, también se han intentado barreras químicas como son los corticoides, los activadores del plasminógeno tisular, la urocinasa y la elastasa. Todas cuentan con defensores y detractores, pero en la actualidad están siendo abandonadas10,12,20,22.
Los corticoides son potentes antiinflamatorios, pero acarrean graves efectos secundarios como hemorragias extensas, formación de abscesos o retraso en la cicatrización de las heridas22.
Como ya sabemos, los AINE inhiben la síntesis de PG, por lo que disminuyen la permeabilidad de los capilares, inhiben la infiltración inflamatoria y controlan la hiperplasia de los fibroblastos y la formación del tejido de granulación.
El motivo de elegir el aceclofenaco para este estudio se fundamenta en que es un AINE ampliamente utilizado por sus propiedades analgésicas y antiinflamatorias, y es un fármaco bien tolerado cuando se utiliza durante cortos períodos de tiempo. El aceclofenaco es un derivado del ácido fenilacético, de estructura similar al resto de los AINE. Su mecanismo de acción fundamental es la inhibición de la ciclooxigenasa y por tanto de la síntesis de PG11,23.
Kéller et al24, realizando una infusión local de PGE2 en las osteotomías de conejo, comprobaron que estimulaba preferentemente la proliferación del tejido conectivo más que la replicación de las células óseas. Los AINE, al inhibir la producción de PGE2, disminuyen esta proliferación conjuntiva.
Los AINE no actúan sólo inhibiendo la síntesis de PG, sino que también modifican la síntesis de leucotrienos, la generación de superóxidos, la liberación de enzimas por lisosomas, la agregación y adhesión de neutrófilos, las funciones de membrana celular (actividades enzimáticas, transporte de aniones a través de la membrana, procesos de fosforilación oxidativa, recaptación de ácido araquidónico), la función de los linfocitos, la producción del factor reumatoide y la acción sobre el metabolismo del cartílago23.
En cuanto a la dosis empleada, se consideraron los estudios de Brogden y Wiseman23 en roedores. Existe consenso acerca de que la dosis apropiada es de 5 mg/kg y que la vía de administración no tiene relevancia clínica25. Se administró únicamente durante una semana para valorar el efecto inhibitorio precoz de la fibrosis, así como para evitar posibles reacciones adversas.
La mayoría de los estudios referidos anteriormente, salvo excepciones9,26, sólo ofrecen análisis cualitativos, por lo que es difícil comparar la efectividad de los diferentes fármacos o materiales.
En nuestro estudio destacamos que la media de la superficie fibrosa fue siempre menor en los conejos de los grupos de intervención que en los controles, tanto a las 2 como a las 4 semanas. Esta diferencia es estadísticamente significativa (p < 0,05) sólo cuando se estudian todas las secciones en conjunto.
En relación a la densidad celular de la cicatriz fibrosa se aprecia un menor número de fibroblastos en los grupos de intervención, pero sin alcanzar significación y un progresivo descenso con el paso de los días. También se observa un menor número de las células inflamatorias, pero únicamente es reseñable una diferencia estadísticamente significativa en estadios tempranos. Los tipos de células inflamatorias fueron similares en ambos grupos, como también afirmaron He et al26 en su trabajo con ketoprofeno en ratas.
El presente estudio nos ha permitido demostrar que la fibrosis peridural se puede desarrollar experimentalmente en el conejo y que el aceclofenaco es capaz de reducir esta superficie fibrosa. Además, es capaz de inhibir la presencia de células inflamatorias en la cicatriz fibrosa en estadios precoces. Sin embargo, no se aprecia una determinante diferencia estadísticamente significativa en cuanto a la presencia de fibroblastos en los animales tratados con aceclofenaco frente a los controles, por lo que podemos concluir que no hay evidencias de que el aceclofenaco consiga evitar la formación experimental de la fibrosis peridural.
Declaración de conflicto de intereses
Los autores han declarado no tener ningún conflicto de intereses.
Fuentes de financiación: Ayuda a Nuevos Proyectos (NP-97-11) del Vicerrectorado de Investigación de la Universidad de Oviedo (1997).
Beca del Fondo de Investigación Sanitaria (00/0663) del Ministerio de Sanidad y Consumo (2000).
Correspondencia:
M.A. Sandoval.
Hospital San Agustín. Avilés.
C/ Cabruñana, 48, 1.o A
33402 Avilés.
Correo electrónico: sandovalmag@yahoo.es
Recibido: abril 2006.
Aceptado: septiembre 2006.