Recuperación de sangre intra y postoperatoria en cirugía ortopédica
Intraoperative and postoperative blood recovery in orthopaedic surgery
SEBASTIÁN BUENO, C.*; FERRER LARIÑO, C.*; SÁNCHEZ ARRIETA, Y.**; GARCÍA VALLEJO, J. J.**; MÉRIDA DE LA TORRE, F. J.***; MORELL OCAÑA, M.**, y MUÑOZ GÓMEZ, M.**
* GIEMSA. Cirugía Ortopédica y Traumatología. Clínica Parque de San Antonio. Málaga. ** Departamento de Bioquímica y Biología Molecular. Facultad de Medicina, Universidad de Málaga. *** Laboratorio de Bioquímica Clínica y Hematología. Hospital Universitario Nuestra Señora de la Victoria. Universidad de Málaga.
Correspondencia:
Dr. M. MUÑOZ.
Departamento de Bioquímica y Biología Molecular.
Facultad de Medicina.
Universidad de Málaga.
Campus de Teatinos.
29071 Málaga.
Recibido: Junio de 1998.
Aceptado: Noviembre de 1998.
Resumen: Se ha realizado una evaluación del estado funcional y metabólico de los eritrocitos obtenidos de la sangre recuperada del campo quirúrgico y los drenajes postoperatorios, así como de los parámetros hematológicos y bioquímicos de la misma en 20 pacientes sometidos a artrodesis vertebral lumbar (AVL) o artroplastia de rodilla (PTR). Tanto las muestras obtenidas del campo quirúrgico como las del drenaje postoperatorio presentaron parámetros hematológicos más bajos y niveles de hemoglobina plasmática libre (HBPL) más altos que sus correspondientes controles, aunque los eritrocitos no mostraron anomalías morfológicas ni en la resistencia globular osmótica. No se encontraron alteraciones significativas en los parámetros bioquímicos estudiados, a excepción del aumento en las concentraciones séricas de potasio y fosfato que se correlacionaron con el aumento de HBPL, indicando un cierto grado de hemolisis. Tampoco se encontraron diferencias en el transporte eritrocitario de glucosa y aminoácidos ni en los niveles eritrocitarios de adenosín-trifosfato (ATP) y 2,3-bisfosfo-glicerato (DPG), salvo en el ATP de la muestra del campo quirúrgico. En conclusión, la sangre recuperada parece ser una buena fuente de eritrocitos autólogos, ya que no muestra alteraciones bioquímicas importantes y sus eritrocitos mantienen un estado funcional y metabólico normal.
PALABRAS CLAVE: Cirugía ortopédica. Recuperación. Hematíe.
ABSTRACT: An evaluation was made of the functional and metabolic condition of red blood cells of blood recovered from the surgical field and postoperative drainage, as well as hematological and biochemical parameters in the same samples of 20 patients who underwent lumbar vertebral arthrodesis (LVA) or knee arthroplasty (KA). The samples from the surgical field and postoperative drainage showed lower hematological values and free plasma hemoglobin levels (PHPL) than controls, but red blood cells showed no abnormalities in morphology or globular osmotic resistance. No significant disturbances in biochemical parameters were found, except for increased serum potassium and phosphate concentrations, which correlated with increased PHBL, indicating a degree of hemolysis. No differences were found in red blood cell transport of glucose and amino acids, or in adenosine-triphosphate (ATP) and 2,3-diphospho-glycerate (DPG) levels, except for ATP in blood from the surgical field. In conclusion, recovered blood is a good source of autologous blood cells because it shows no major biochemical changes and red blood cells conserve their normal functional and metabolic conditions.
KEY WORDS: Orthopaedic surgery. Red blood cell recovery.
La demanda de sangre homóloga en Cirugía Ortopédica y Traumatología a menudo supera la oferta de los bancos de sangre. Además, la transfusión de sangre homóloga puede tener efectos adversos, tales como reacciones de incompatibilidad, alteraciones inmunológicas y metabólicas o transmisión de enfermedades infecciosas.9,17,23 Todo ello ha propiciado el desarrollo de técnicas de ahorro de sangre. Entre estas técnicas, el uso de la autotransfusión intra y posoperatoria, junto a los programas de autotransfusión (preoperatorios), se han extendido en los últimos años debido a su capacidad para reducir las necesidades transfusionales y eliminar así los riesgos inherentes a la práctica de la transfusión de sangre homóloga.18 Sin embargo, en nuestro país, aunque se han publicado recientemente algunos estudios sobre autotransfusión preoperatoria,4,11,14,20,30 la experiencia en la modalidades intra y postoperatoria de la misma parece ser escasa.25,29
En la autotransfusión intraoperatoria la sangre del campo quirúrgico puede ser aspirada y anticoagulada mediante un dispositivo que permite el filtrado y posterior reinfusión al paciente con o sin lavado. La eficacia de esta técnica para reducir la necesidad de sangre homóloga en cirugía ortopédica ha sido demostrada cuando la pérdida de sangre es mayor de 900 ml.2,6,24,26 En lo que se refiere a la autotransfusión postoperatoria, aunque la seguridad de la reinfusión de eritrocitos no lavados procedentes del drenaje postoperatorio en cirugía ortopédica está bien documentada,1-3,10,13,15,16 existe aún cierta controversia sobre su utilización; controversia que se centra fundamentalmente en tres aspectos: los efectos nefrotóxicos de la hemoglobina libre, el aumento del sangrado y las alteraciones de la funcionalidad y viabilidad de los eritrocitos retransfundidos.3,5,18
Dentro de este contexto los objetivos de este estudio han sido: 1) examinar las características hematológicas y bioquímicas de la sangre al campo quirúrgico y del drenaje postoperatorio en pacientes sometidos a cirugía ortopédica programada, y 2) establecer el estado metabólico y funcional de los eritrocitos obtenidos de dicha sangre.
Material y Método
El estudio se realizó prospectivamente sobre 20 pacientes consecutivos sometidos a artrodesis vertebral lumbar (AVL) o artroplastia de rodilla (PTR) (Tabla 1). Las intervenciones de columna con o sin microcirugía se realizaron bajo anestesia general, en tanto que las de rodilla se realizaron bajo anestesia general o epidural y sin manguito de isquemia. Todos los pacientes recibieron 1,5 g de cefuroxima intraoperatoriamente, así como heparinización (Dalteparina 5.000 UI/24 h 2-3 días) y antibioterapia (Cefuroxima 750 mg/6 h 3-4 días) en el postoperatorio para evitar complicaciones tromboflebíticas e infecciosas.
| Tabla 1. Características de los pacientes estudiados y tipo de intervenciones realizadas. | ||
| Parámetros | PTR | AVL |
| Número de pacientes | 7 | 13 |
| Edad (años) | 69 ± 9 | 51 ± 11** |
| Sexo (V/M) | 2/5 | 6/7 |
| Duración (h) | 2,52 ± 0,2 | 4,75 ± 0,9* |
| Sangrado total (ml) | 1.020 ± 220 | 1.190 ± 214 |
| -- Intraoperatorio (ml) | 475 ± 196 | 705 ± 215* |
| -- Posoperatorio (ml) | 549 ± 260 | 491 ± 235 |
| Transfusiones (U) | 10 | 23 |
| Hb ingreso (g/dl) | 13,7 ± 0,9 | 14,2 ± 1,8 |
| Hb alta (g/dl) | 10,5 ± 0,8 | 11 ± 1,2 |
| Hcto ingreso (%) | 41,5 ± 1,8 | 42,8 ± 4,1 |
| Hcto alta (%) | 31,3 ± 2,1 | 33,5 ± 3,2 |
| PTR: Artroplastia total de rodilla. AVL: Artrodesis vertebral. V: Varones. M: Mujeres. Hb: Hemoglobina. Hcto: Hematocrito. * p < 0,01. ** p < 0,05. | ||
En la Tabla 1 se expresan las características de los dos grupos de pacientes. No hubo diferencias significativas en el sangrado total perioperatorio, si bien la pérdida intraoperatoria de sangre fue significativamente mayor en el grupo AVL (PTR: 475 ± 196 ml vs. AVL: 705 ± 215 ml, p < 0,05), lo que podría relacionarse con una mayor duración de la intervención (PTR: 2,52 ± 0,2 h vs. AVL: 4,75 ± 0,9 h; p < 0,01).
Las muestras de sangre se obtuvieron en cinco etapas de la cirugía: inmediatamente antes de la inducción a la anestesia (muestra 1), del campo quirúrgico, utilizando jeringas heparinizadas (muestra 2), al final de la intervención (muestra 3) y del drenaje posoperatorio, una en la primera hora (muestra 4) y otra en la sexta hora (muestra 5). La muestra 1 sirvió como control para la muestra 2, mientras que la muestra 3 sirvió como control para las muestras 4 y 5.
Parámetros hematológicos
El recuento de eritrocitos, hematocrito, hemoglobina, leucocitos y plaquetas se realizaron en muestras recogidas en tubos con ácido etilendiamino-tetracético (EDTA) utilizando un contador hematológico Technicon II. La hemoglobina plasmática libre (HBPL) se determinó en plasma centrifugado a 12.000 g mediante la reacción de la bencidina. La morfología eritrocitaria fue analizada a microscopia óptica (*600, Nikon Microphot FXA, Japón) en muestras teñidas según la técnica de May-Grümwald-Giemsa. Las extensiones de sangre se realizaron por duplicado y se evaluaron al menos 100 células en cada una de ellas.
Resistencia globular osmótica
Se determinó tanto en muestras de sangre fresca como tras la incubación de las mismas a 37° C durante 24 horas. Se utilizaron 13 diluciones de cloruro sódico tamponado a pH 7,4 (10 ml) en concentraciones decrecientes desde 0,9% hasta agua destilada y se añadieron 50 ml de sangre recogida en EDTA a cada una de ellas. Tras 30 minutos de incubación a 25° C, se centrifugaron a 2.000 g durante 5 minutos, se midió la densidad óptica a 540 nm de todos los tubos, usando el de concentración 0,9% como blanco, y se calculó el porcentaje de hemolisis en cada uno de ellos, para lo cual se tomó el de ClNa al 0% como 100% de hemolisis. La fragilidad corpuscular media, o concentración de cloruro sódico necesaria para conseguir una hemolisis del 50% (FCM), se obtuvo mediante la representación computerizada de los porcentajes de hemolisis en cada tubo. Los valores normales de esta prueba son los siguientes: fragilidad corpuscular media en fresco (FCMf) = 0,40-0,45% NaCl; fragilidad corpuscular media en muestras incubadas 24 horas (MCFi) = 0,465-0,590% NaCl.
Parámetros bioquímicos
Los niveles séricos de glucosa, triglicéridos, proteínas totales y de iones (cloro, sodio, potasio, fosfato) se midieron utilizando un multianalizador Hitachi 747. La electroforesis de proteínas séricas se realizó en un Olympus Hite 320. La concentración de haptoglobina se determinó por nefelometría en un NB-II Behring.
Para las pruebas de captación de aminoácidos y glucosa los eritrocitos se obtuvieron de muestras de sangre heparinizada y se lavaron dos veces con una solución de lavado (NaCl, 75 mM; KCl, 75 mM; EDTA, 0,1 mM, y Tris-ClH, 10 mM; pH 7,4) y una vez más con solución de incubación (NaCl, 150 mM; KCl, 5 mM; CaCl2, 0,5 mM; MgC2, 0,2 mM, y Hepes-Tris, 10 mM; pH 7,4) para eliminar leucocitos, plaquetas y plasma. Los eritrocitos lavados se suspendieron a un hematocrito del 10% en medio de incubación, se preincubaron a 37° C durante 40 minutos para minimizar los efectos de estimulación de flujos y se realizaron los ensayos de captación utilizando el método de parada en frío y centrifugación (12.000 g, 30 s).27,28 Los resultados se expresaron en nmol/min · 100 mg Hb.
Para las determinaciones de trifosfato de adenosina (ATP) y ácido 2,3-bisfosfoglicérico (DPG), ambos metabolitos se midieron en sobrenadantes desproteinizados utilizando reactivos estandarizados. Para la obtención de dichos sobrenadantes se procedió a la mezcla de 1 ml de sangre heparinizada con 1 ml de TCA al 12% (para el ATP) o 3 ml de TCA al 8% (para el DPG), seguido de agitación, incubación a 4° C durante 5 minutos y centrifugación (5.000 rpm, 10 min). Para la determinación de ATP se siguió el método de la fosfoglicérico/gliceraldehído deshidrogenasa, mientras que para la de DPG se utilizó el método de la fosfogliceratomutasa. Los resultados se expresaron en µmol/g Hb. Los reactivos fueron: L-[2,6 3H]fenilalanina (55 Ci/mmol), L-[3 3H]serina (30 Ci/mmol) y D-[6 3H] glucosa (37 Ci/mmol) de Amersham International PLC, UK. Los reactivos para la determinación de ATP y DPG fueron suministrados por Sigma Chemical Co., EE. UU. El resto de reactivos fueron de grado analítico y procedentes de Merck, Alemania.
Análisis estadístico
Todos los resultados se expresaron como la media ± desviación estándar. La comparación de medias se realizó mediante la «t» de Student. Las correlaciones lineales se estimaron mediante la «r» de Pearson. Los estudios estadísticos se realizaron con el paquete informático SPSS-PC+.
Resultados
Hematología
Como se observa en la Tabla 2 las muestras procedentes del campo quirúrgico y del drenaje en la primera hora del período postoperatorio contenían menor número de eritrocitos, hemoglobina, hematocrito y plaquetas que sus respectivos controles (muestras 1 y 3, respectivamente). La sangre del drenaje a la sexta hora del período postoperatorio presentó valores similares a los de su control. No se encontraron anormalidades morfológicas reseñables en los eritrocitos de ninguna de las muestras examinadas, ni hubo diferencias en los valores de la FCM obtenidos a partir de las curvas de resistencia globular osmótica. Tampoco hubo diferencias significativas en los recuentos de leucocitos en ninguna de las muestras estudiadas. Los niveles de HBPL se elevaron significativamente en las muestras 2, 4 y 5, y aunque no se pudo demostrar una correlación estadísticamente significativa entre ellos, los niveles de haptoglobina variaron de forma inversa a los de HBPL.
Tabla 2. Parámetros hemtológicos y bioquímicos determinados en las muestras obtenidas en las diferentes etapas de la intervención. | |||||
| Antes de la anestesia 1 | Campo quirúrgico 2 | Final de la intervención 3 | Drenaje (1.a hora) 4 | Drenaje (6.a hora) 5 | |
| Eritrocitos (106/µl) | 4,63 ± 0,38 | 2,99 ± 0,67* | 3,68 ± 0,59 | 3,25 ± 0,40* | 3,82 ± 0,45 |
| Hemoglobina (g/dl) | 13,5 ± 1,4 | 9,4 ± 2,9* | 10,7 ± 1,9 | 9,7 ± 1,7*** | 10,4 ± 1 |
| Hematocrito (%) | 40,4 ± 3,2 | 26 ± 6,7* | 32,1 ± 5,1 | 28 ± 3,8** | 32,3 ± 2,9 |
| MCFf (NaCl%) | 0,406 ± 0,01 | 0,403 ± 0,01 | 0,408 ± 0,01 | 0,408 ± 0,01 | 0,422 ± 0,01 |
| MCFi (NaCl%) | 0,498 ± 0,01 | 0,502 ± 0,01 | 0,490 ± 0,01 | 0,503 ± 0,01 | 0,486 ± 0,01 |
| Leucocitos (103/µl) | 6,82 ± 1,56 | 5,68 ± 3,17 | 6,26 ± 1,70 | 4,82 ± 3 | 5,19 ± 2,38 |
| Plaquetas (103/µl) | 186 ± 71 | 111 ± 55*** | 123 ± 25 | 78 ± 59*** | 99 ± 21 |
| HBPL (mg/l) | 17 ± 11 | 179 ± 69** | 13 ± 10 | 144 ± 70** | 59 ± 18** |
| Haptoglobina (mg/dl) | 215 ± 89 | 177 ± 65 | 180 ± 66 | 96 ± 25 | 121 ± 59 |
| Glucosa (mg/dl) | 100 ± 15 | 147 ± 33*** | 154 ± 40 | 142 ± 43 | 81 ± 19* |
| Triglicéridos (mg/dl) | 185 ± 100 | 192 ± 70 | 138 ± 80 | 176 ± 83** | 132 ± 53 |
| Proteínas (g/dl) | 6,5 ± 1 | 6,6 ± 1,5 | 5,5 ± 0,9 | 5,8 ± 0,9 | 6,1 ± 0,4 |
| La muestra 1 es el control para la muestra 2. La muestra 3 es el control para las muestras 4 y 5. Los resultados se presentan como media ± desviación estándar de 20 determinaciones. * p < 0,001. ** p < 0,01. *** p < 0,05. | |||||
Bioquímica
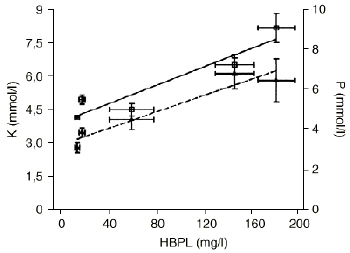
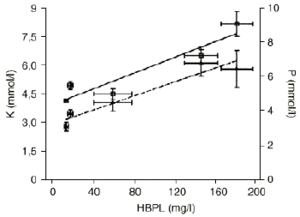
Las concentraciones séricas de triglicéridos y proteínas totales en las muestras de campo y drenaje, aunque sufrieron modificaciones con respecto a sus controles, se mantuvieron siempre dentro de los límites de normalidad (Tabla 2). Sin embargo, la concentración de glucosa aumentó desde la muestra 2 a la 4 para descender posteriormente en la muestra 5 (Tabla 2). La electroforesis de proteínas plasmáticas sólo reveló un aumento de ß-globulina en las muestras 2, 4 y 5, lo que concuerda con una concentración elevada de HBPL en estas muestras. Aunque no se encontraron diferencias significativas en cuanto a las concentraciones de Cl o Na+, las concentraciones de K+ y PO4 estaban elevadas de forma significativa en las muestras 2, 4 y 5, correlacionándose con los niveles de HBPL (r: 0,94, p < 0,02 para K+ y r: 0,96, p < 0,01 para PO4)(Fig. 1).
Figura 1. Correlaciones entre los niveles de hemoglobina plasmática libre (HBPL) y las concentraciones séricas de K+ (M, K, r = 0,938, p < 0,02) y PO4 (, P, r = 0,959, p < 0,01).
Transporte de nutrientes y metabolismo eritrocitario
Al compararlas con las de sus respectivos controles no hubo diferencias estadísticamente significativas en las captaciones de D-glucosa, L-serina y L-fenilalanina por los eritrocitos de obtenidos en el campo quirúrgico o en el drenaje a la primera o sexta hora del período postoperatorio (Tabla 3). Las concentraciones de los marcadores metabólicos ATP y DPG tampoco cambiaron de forma estadísticamente significativa en ninguna de las muestras analizadas, excepto el contenido de ATP de los eritrocitos procedentes del campo quirúrgico (Tabla 3).
Tabla 3. Captación de aminoácidos, glucosa y concentraciones de marcadores metabólicos determinados en las muestras de sangre obtenidas en las diferentes etapas de la intervención. | |||||
| Antes de la anestesia 1 | Campo quirúrgico 2 | Final de la intervención 3 | Drenaje (1.a hora) 4 | Drenaje (6.a hora) 5 | |
| Captación de glucosa (nmol/min · 100 mg HB) | 101,3 ± 30 | 99,67 ± 30,2 | 123,9 ± 30,7 | 131 ± 29,2 | 118,9 ± 25,1 |
| Captación de L-Phe (nmol/min · 100 mg HB) | 3,4 ± 0,63 | 3,46 ± 0,92 | 4,06 ± 1,01 | 4,02 ± 0,78 | 4,60 ± 0,92 |
| Captación de L-Ser (nmol/min · 100 mg HB) | 1,61 ± 0,6 | 1,60 ± 0,51 | 1,79 ± 0,62 | 1,82 ± 0,38 | 2,08 ± 0,75 |
| Contenido de ATP (µmol/g HB) | 3,47 ± 0,81 | 2,71 ± 0,78** | 3,93 ± 0,97 | 3,98 ± 0,95 | 4,26 ± 0,65 |
| Contenido de DPG (µmol/g HB) | 16,12 ± 2,64 | 15,58 ± 4,47 | 15 ± 2,65 | 14,36 ± 3,47 | 11,52 ± 2,63 |
| La muestra 1 es el control para la muestra 2. La muestra 3 es el control para las muestras 4 y 5. Los resultados se presentan como media ± desviación estándar de 20 determinaciones. ** p < 0,01. | |||||
Discusión
La utilización perioperatoria de sangre autóloga es beneficiosa para el paciente puesto que disminuye la necesidad de sangre homóloga y por tanto disminuye o evita los riesgos asociados a las transfusiones. En nuestro país si bien la autotransfusión preoperatoria se está convirtiendo en una práctica cada vez más empleada en los procedimientos ortopédicos programados,4,11,14,20,30 son pocos los equipos quirúrgicos que utilizan la autotransfusión intra o posoperatoria. Con respecto a éstas, aunque la seguridad de la reinfusión de sangre recuperada y procesada intraoperatoriamente o de sangre filtrada del drenaje postoperatorio está bien documentada,1-3,10,15,16 su eficacia ha sido cuestionada en base a posibles alteraciones de la viabilidad y funcionalidad de estos eritrocitos, los efectos nefrotóxicos de la HBPL y las alteraciones de la hemostasia que conducirían a un aumento del sangrado. Dado que los dos últimos puntos de controversia han sido abordado por diversos autores y revisados recientemente,18 el presente estudio se ha realizado con la finalidad de comprobar tanto el grado de normalidad hematológica y bioquímica de la sangre recuperada intra y posoperatoriamente en pacientes sometidos a AVL o PTR como la normalidad metabólica y funcional de sus eritrocitos. Respecto a los pacientes, no existieron diferencias según el tipo de intervención en los datos hematológicos, bioquímicos o metabólicos obtenidos para ambos grupos, por lo que se han presentado y se discutirán conjuntamente.
Desde el punto de vista hematológico tanto las muestras intraoperatorias como las procedentes del drenaje postoperatorio contenían un menor número de plaquetas y de eritrocitos, aunque éstos presentaban una morfología y una fragilidad corpuscular media normales y presentaban valores de hematocrito y hemoglobina más bajos que sus respectivos controles. La reducción de los parámetros hematológicos debida a hemolisis, hemodilución y/o sangrado es similar a la descrita por otros autores3,10,16 y no afecta al recuento de leucocitos por elevarse éstos en respuesta a la agresión quirúrgica. La determinación de HBPL se utiliza como un índice de hemolisis y sus niveles en las muestras 2, 4 y 5 estaban por encima de los límites normales y se correlacionaban positivamente con los de K+ y PO4 (Fig. 1), lo que denota hemolisis. No obstante, si se reinfundiese sangre filtrada del drenaje postoperatorio hasta un 15% de la volemia3 o hasta un máximo de 1.000 ml1 habría suficiente haptoglobina circulante para neutralizar la HBPL, evitando el posible daño renal. Por otra parte, la sangre obtenida del campo quirúrgico puede contener, además, detritus químicos y tisulares, lo que hace obligatorio su lavado antes de reinfundirla al paciente.
Debido a la administración intravenosa de fluidos durante la intervención para contrarrestar los efectos del sangrado intraoperatorio (475 ± 196 ml en PTR y 705 ± 215 ml en AVL) se produjo un cierto grado de hemodilución en los pacientes (20% al final de la intervención calculado en base a los valores del hematocrito en las muestras 1 y 3). Esta hemodilución no afectó solamente a los parámetros hematológicos, sino también a los bioquímicos, induciendo un relativo descenso en los niveles de proteínas totales y triglicéridos, aunque las concentraciones de estos últimos en las muestras 2 y 4 no disminuyeron probablemente debido a contaminación de la sangre extravasada con triglicéridos tisulares liberados durante la cirugía. En cuanto a las concentraciones de glucosa se observaron dos patrones distintos. Por una parte, se objetivó la presencia de hiperglucemia en las muestras 2, 3 y 4 debido a la administración de glucosa en los sueros y al efecto glucogenolítico del glucagón y las catecolaminas liberados por el estrés quirúrgico. Por otra parte, los niveles de glucosa disminuyeron significativamente en la muestra 5, sugiriendo un aumento de su utilización por parte de los eritrocitos drenados. Los datos obtenidos demostraron que no hubo modificaciones significativas ni en el transporte de D-glucosa ni en el ATP eritrocitarios, lo que sugiere que, junto a una mayor producción, se produce un consumo acelerado del ATP por la Na+/K+-ATPasa y la Ca2+-ATPasa, entre otras, para mantener la homeostasis interna del eritrocito.19 Además, los datos correspondientes al transporte de glucosa y aminoácidos, junto con los de resistencia globular osmótica, confirmaban la integridad funcional de la membrana eritrocitaria.8 Por su parte, las concentraciones de ATP en las muestras de campo, si bien descendieron respecto a su control, se encontraban prácticamente dentro de los límites normales. Por su parte, el DPG es un metabolito de la glucosa que, además de su papel en la afinidad de la hemoglobina por el O2, modula las propiedades mecánicas de la membrana eritrocitaria. 21, 22 Por tanto, que el contenido de DPG de los eritrocitos del campo quirúrgico y del drenaje postoperatorio no sea significativamente diferente al de la muestra control es otro argumento importante en favor de la normalidad estructural y funcional de estas células.
Tomados en conjunto, nuestros resultados parecen señalar que estos eritrocitos no están dañados, mantienen su integridad morfológica, funcional y metabólica y por tanto podría presumirse una viabilidad normal de los mismos. A este respecto estudios recientes han demostrado que los eritrocitos obtenidos del drenaje postoperatorio de pacientes sometidos a artrodesis vertebral posterior7 o artroplastia de rodilla13 poseen una viabilidad comparable a la de aquéllos procedentes de sangre de banco o de sangre recuperada intraoperatoriamente.24 Dado que la recuperación perioperatoria de sangre y su posterior reinfusión ha demostrado ser segura y reducir los requerimientos transfusionales en cirugía ortopédica1-3,5,6,10,15,16,24,26,31 y que los resultados de este estudio indican que la sangre recuperada parece ser una excelente fuente de eritrocitos normofuncionantes, contiene unas concentraciones no despreciables de plaquetas y no presenta alteraciones bioquímicas significativas; en la actualidad se está realizando un estudio prospectivo usando un dispositivo de recuperación/reinfusión (Constavac II®, Stryker) para evaluar el impacto de la autotransfusión postoperatoria, no sólo sobre las necesidades de sangre de banco, sino también sobre el estado inflamatorio e inmunológico de los pacientes intervenidos.
Agradecimientos
Los autores agradecen la financiación de la Junta de Andalucía a GIEMSA (Grupo Internacional de Estudios Multidiciplinarios sobre Autotransfusión, CTS 0189).
Bibliografía
1.Ayers, TC; Murray, DG, y Duerr, DM: Blood salvage after total hip arthroplasty. J Bone Joint Surg, 77A: 1347-1351, 1995.
2.Behrman, MJ, y Keim, HA: Perioperative red blood cell salvage in spine surgery. Clin Orthop, 278: 51-57, 1992.
3.Blevins, FT; Shaw, B; Valeri, CR; Kasser, J, y Hall, J: Reinfusion of shed blood after orthopaedic orthopaedic procedures in children and adolescents. J Bone Joint Surg, 75A: 363-371, 1993.
4.Busquets, R; Bago, J; Aguirre, M; Rodríguez, S; Villanueva, C, y Durán-Suárez, JR: La autotransfusión preoperatoria en la cirugía de las deformidades del raquis. Rev Ortop Traumatol, 37: 201-205, 1993.
5.Clements, DH; Sculco, TP; Burke, SW; Mayer, K, y Levine, DB: Salvage and reinfusion of postoperative sanguineous wound drainage. A preliminary report. J Bone Joint Surg, 74A: 646-651, 1992.
6.Cotton, RL: Blood conservation using autotransfusion in total joint arthroplasty. Iowa Orthop J, 11: 43-48, 1991.
7. Davis, RJ; Agnew, DK; Shealy, CR, y Friedman, SE: Erythrocyte viability in postoperative autotransfusion. J Pediatr Orthop, 13: 781-783, 1993.
8. Ellory, JC: Amino acid transport systems in mammalian red cells. En: Yudilevich, DL, y Boyd, CAR (Eds): Amino Acid Transport in Animal Cells. Oxford. Oxford University Press, 1987, 106-119.
9.Fariñas, F; Muñoz, M; García-Vallejo; JJ; Ruiz, MD, y Morell, M: Inmunodepresión inducida por transfusión de sangre homóloga. Sangre, 43: 213-217, 1998.
10.Faris, PM; Ritter, MA; Keating, EM, y Valeri, CR: Unwashed filtered shed blood collected after knee and hip arthroplasties. J Bone Joint Surg, 73A: 1169-1178, 1991.
11.Furundarena, JR; Salsamendi, MR; Flor, V; Yánez, MJ; Apalategi, M; Atristaín, J; Martínez, A; Lertxundi, MM, y Urzelai, X: Tranfusión autóloga predepósito en cirugía de cadera y rodilla. Rev Ortop Traumatol, 39: 417-420, 1995.
12.Goodnough, LT; Vizmeg, K, y Marcus, RE: Blood lost and transfused in patients undergoing elective othopaedic operation. Surg Gynecol Obstet, 176: 235-238, 1993.
13.Gronborg, H; Otte, KS; Jensen, TT; Marving, J; Solgaard, S, y Rechnagel, K: Survival of autotransfused red cells. 51Cr studies in 10 knee arthroplasty patients. Acto Orthop Scand, 67: 439-442, 1996.
14.Guinea, JM; Lafuente, P; Mendizábal, A; Pereda, A; Sainz-Arroniz, MR, y Pérez-Clausell, C: Resultados de la autotransfusión preoperatoria con profilaxis con ascorbato ferroso en enfermos de cirugía ortopédica. Sangre, 41: 25-28, 1996.
15.Healy, WL; Pfeifer, BA; Kurtz SR; Johnson, C; Johnson, W; Johnston, R; Sanders, D; Karpman, R; Halleck, GN, y Valeri, CR: Evaluation of autologous shed blood for autotranfusion after orthopaedic surgery. Clin Orthop, 299: 53-59, 1994.
16.Heddle, NM; Brox, WT; Klama, LN; Dickson, LL, y Levine, MN: A randomized trial on the efficacy of an autologous blood drainage and transfusion device in patients undergoing elective knee arthroplasty. Transfusion, 32: 742-746, 1992.
17.Klein, HG: Allogenic transfusion risks in the surgical patient. Am J Surg, 170 (suppl): 21S-26S, 1995.
18.Lemos, MJ, y Healy, WL: Blood transfusion in orthopaedic operations. J Bone Joint Surg, 78A: 1260-1270, 1996.
19.Luque, J; Pinilla, M; Escrivá, F, y Giménez, A: Bioquímica de las células sanguíneas: Serie eritrocitaria. En: Herrera, E (Ed): Bioquímica. Biología molecular y bioquímica fisiológica. Madrid. Interamericana-McGraw-Hill, 1991, 1255-1284.
20.Maestro, A; Prado, L; Acebal, G; Reyes, I; Ricarte, I; Rodríguez, L, y Murcia, A: Autotransfusión en cirugía ortopédica. Rev Ortop Traumatol, 39: 232-238, 1995.
21.Mohandas, N; Winardi, R; Knowles, D; Leung, A; Parra, M; George, E; Conboy, J, y Chasis, J: Molecular basis for membrane rigidity of hereditary ovalocytosis: A novel mechanism involving the cytoplasmic domain of band 3. J Clin Invest, 89: 686-692, 1992.
22.Moriyama, R; Lombardo, CR; Workman, RF, y Low, PS: Regulation of linkages between the erythrocyte membrane and its skeleton by 2,3-diphosphoglycerate. J Biol Chem, 268: 10990-10996, 1993.
23.Nielsen, HJ: Detrimental effects of perioperative blood transfusion. Br J Surg, 82: 582-587, 1995.
24.Ray, JM; Flyn, JC, y Bierman, AH: Erythrocyte survival following intraoperative autotransfusion in spinal surgery: An in vivo comparative study and 5-year update. Spine, 11: 879-882, 1986.
25.Rosell, J; Guerrero, JA, y Vara-Thorbeck, R: Autotransfusión en traumatismos torácicos y toracoabdominales. Rev Esp CTV, 9: 509-512, 1991.
26.Tawes, RL, y Duvall, TB: Is the «Salvaged-cell syndrome» myth or reality? Am J Surg, 172: 172-174, 1996.
27.Vadgama, JV, y Christensen, HN: Discrimination of Na+-dependent transport systems L, T, and ASC in erythrocytes. Na+-independence of the latter a consequence of cell maturation? J Biol Chem, 260: 2912-2921, 1985.
28.Valdeolmillos, M; García-Sancho, J, y Herreros, B: Differential effects of transmembrane potential on two Na+-dependent transport systems for neutral amino acids. Biochim Biophys Acta, 858: 181-187, 1986.
29.Vara-Thorbeck, R; Guerrero, JA, y Muñoz, N: Autotransfusión en el politraumatizado. SILAC, 4:12-18, 1996.
30.Villar, J; Fraga, M; León, R; Nieto, E; Fernández, H; Mosquera, S, y Pérez, C: Programa de autotransfusión autóloga en Cirugía Ortopédica. Rev Ortop Traumatol, 36: 637-640, 1992.
31.Woolson, ST, y Watt, JM: Use of autologous blood in total hip replacement. J Bone Joint Surg, 73A: 76-80, 1991.