La concepción mecanicista del cuerpo humano ha considerado el hueso como estructuras inertes de gran resistencia, como soportes arquitectónicos, esta idea ha impedido ver todas las posibilidades biológicas del tejido óseo. Es cierto que el 70% del contenido óseo corresponde a minerales (calcio, fósforo, magnesio...), oxígeno e hidrógeno, en proporciones que se corresponden con la hidroxiapatita, pero el 30% restante está formado por colágeno. La unión del colágeno con la hidroxiapatita confiere al hueso sus excepcionales propiedades mecánicas: un compuesto viscoelástico y anisotrópico, con espacios y membranas ocupadas por células, vasos y nervios entre la matriz ósea, a la que pueden modificar.
Establecer la relación entre la biología y la mecánica y la influencia de las solicitaciones mecánicas sobre el hueso, es uno de los aspectos que más interés han despertado, pues el tejido óseo no apto mecánicamente es incapaz de cumplir la función que tiene encomendada.
Las leyes mecánicas que rigen el comportamiento óseo
En el siglo XIX se comenzó a plantear la relación entre la arquitectura ósea y las solicitaciones mecánicas aunque ya Galileo, en 1638, había señalado la importancia de la fuerza de la gravedad de la tierra sobre los seres vivos y cómo para una resistencia semejante, los animales grandes necesitan huesos mayores que los animales más pequeños.
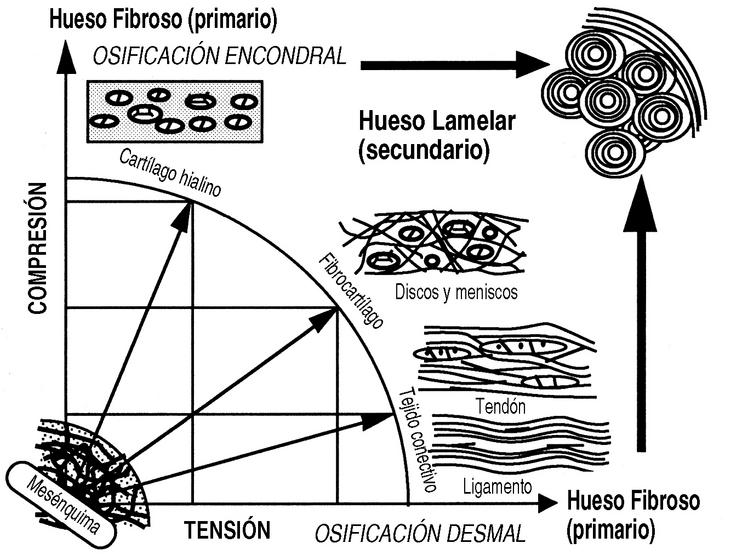
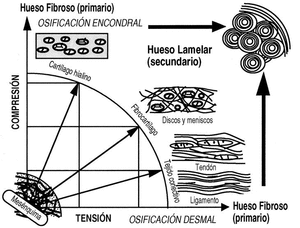
El estudio mecánico del hueso comenzó con Wertheim, en 1847, aunque Roux (1850-1924) fue el descubridor de la mecánica del desarrollo causal y el impulsor de una nueva anatomía, desarrollada posteriormente por autores como Benninghoff (1890-1953) y Pauwels (1885-1980). Roux, hablaba, en 1885, de la «Entwicklungsmechanik» o mecánica del desarrollo, durante y después del crecimiento, las influencias mecánicas hacen que el esqueleto se diseñe a sí mismo con la actividad física y los estímulos mecánicos, por medio de la «adaptación funcional», explicado por la teoría de la histogénesis causal de Pauwels (Fig. 1).
Figura 1. Histogénesis causal de Pauwels. Las células mesenquimales, según las condiciones mecánicas a las que están sometidas producen los diferentes tipos de tejidos conectivos.
Julius Wolff (1836-1902), intentó demostrar, experimental y matemáticamente, que el hueso se modifica internamente y puede cambiar su forma externa en algunas enfermedades. Sus observaciones iniciales se convirtieron en análisis matemáticos hasta establecer una ley («Das Gesetz der Transformation der Knochen»), que defiende que la forma y la estructura interna de un hueso se adapta a la función y a las necesidades mecánicas: «todo cambio en la forma y función de los huesos, o únicamente de su función, es seguido por ciertos cambios bien definidos en su arquitectura interna y, también, por alteraciones secundarias definidas en su conformación externa, siguiendo leyes matemáticas»68. La idea de que la remodelación del hueso es un proceso de control continuo procede de Roux, quien sugirió que el proceso adaptativo en el hueso está regulado por las células influidas por las tensiones locales48,68 mientras que la ley de Wolff hace referencia a una situación de la forma y de la función estática y a un modelo matemático, entre la arquitectura trabecular y la trayectoria de las tensiones. Wolff nunca habló del comportamiento adaptativo del hueso pues considera que la forma viene heredada y, por lo tanto, es constante.
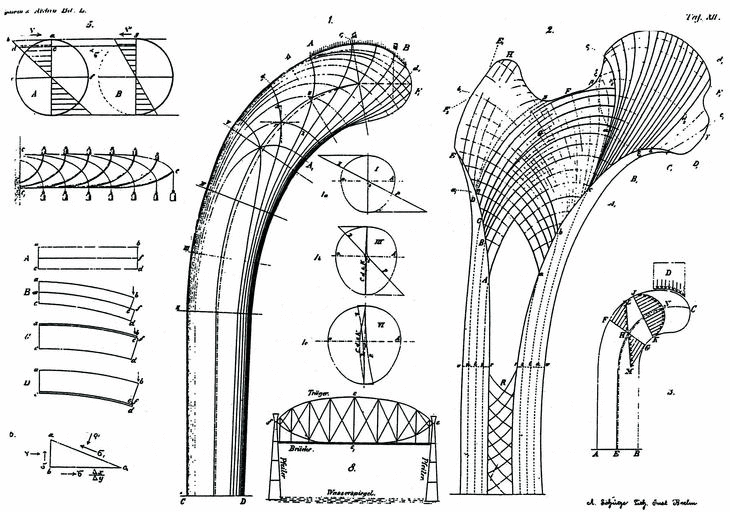
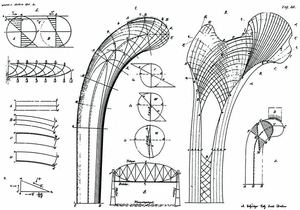
Según Wolff, los cambios en la función producen una reabsorción o formación de hueso nuevo que modifica su estructura interna y, a veces, su geometría externa basado en los trabajos de von Meyer (1815-1892) en 1867, quien estudió las líneas trabeculares de la cabeza del fémur, y del ingeniero suizo Karl Culman (1821-1881), relacionando las líneas observadas en la cabeza del fémur con el análisis mecánico de una grúa, de donde dedujo su teoría trayectorial: cuando las cargas externas sobre un hueso cambian, como consecuencia de un traumatismo, patología osteoarticular o por modificaciones de los patrones de vida, las líneas trabeculares se reorientan, adaptándose a las nuevas solicitaciones y los patrones trabeculares coinciden con la trayectoria de las tensiones. Aunque criticó que von Meyer no tuviese en cuenta las observaciones de Culmann, pues la orientación de las trabéculas debe ser perpendicular a las principales solicitaciones de la carga, evitando las solicitaciones a cizallamiento (Fig. 2).
Figura 2. La grúa de Culmann con las líneas de las principales trayectorias de tensión y el modelo de von Meyers de la estructura trabecular de la extremidad proximal del fémur, explicado por Wolff, 1872.
En 1885, Roux, analizó la estructura de tejido esponjoso en una rodilla anquilosada, como demostración evidente de la ley descrita por Wolff. Pauwels, reexaminó la misma rodilla, conservada en la Universidad de Wurzburgo, con fotoelasticidad concluyendo que no se comportaba según la ley descrita por Wolff; pues como ha señalado Kummer, 1972, la relación entre las solicitaciones mecánicas y la estructura trabecular es más compleja que el simple análisis matemático de las diferentes secciones óseas.
A pesar de que Wolff conoció la teoría de la presión sobre el cartílago de crecimiento de Richard Volkmann (1830-1889) y Carl Hueter (1838-1882), conocida como relación de cambio recíproco (a mayor carga menor crecimiento y viceversa) sostuvo que los patrones de osificación en el cartílago del esqueleto es independiente de las solicitaciones mecánicas, pues la arquitectura ósea está latente en la «Anlage» y los estímulos mecánicos durante el desarrollo tienen poca importancia, definiéndose las alteraciones en la forma del hueso por los cambios en la estructura ósea, mientras que la arquitectura macroscópica es muy semejante durante toda la vida. Por el contrario, Roux distinguió dos periodos en la vida de los seres vivos, el embrionario cuando «el órgano se expande, se diferencia y crece» y el del adulto, cuando crece y se reemplaza, según la función que realice. Por su lado Carter y cols., 1991, piensan que la osificación encondral está regulada por estímulos mecánicos intrauterinos y las solicitaciones influyen sobre los patrones de desarrollo de los tejidos14,51,61 y según Bailey y McCulloch, 1990, la contracción muscular y la gravedad son las dos fuerzas mecánicas primarias que soporta un hueso. Si una de ellas cambia variará la densidad ósea, pues cada segmento esquelético tiene su propio umbral de respuesta a los estímulos mecánicos.4
También para Wolff, 1892, el patrón de osificación básico, la distribución inicial del tejido óseo y el desarrollo de la cavidad medular son independientes de las solicitaciones mecánicas.68 Por el contrario, Carter y cols., 1991 y 1992, sostienen que la estructura interna, la forma de la cavidad medular y la morfología de las trabéculas de los huesos largos está gobernado por las cargas.13,14
El hueso responde ante estímulos mecánicos, pero es difícil valorar las modificaciones que tienen lugar con el aumento de solicitaciones. Se comprende el beneficio de la carga en la curación de una fractura o de la falta de actividad de un hueso en crecimiento, pero resulta difícil observar cambios en la forma de un hueso maduro ante el aumento de solicitaciones. Los huesos tienen la forma adecuada para enfrentarse a las necesidades mecánicas y cada sección transversal presenta la cantidad de hueso necesaria para someterse sobradamente a las tensiones locales. El esqueleto evita los momentos flectores mediante la geometría de su forma longitudinal, la variación del área en cada sección y la actuación de los músculos y de los ligamentos y el material óseo se distribuyen proporcional al valor de las tensiones.
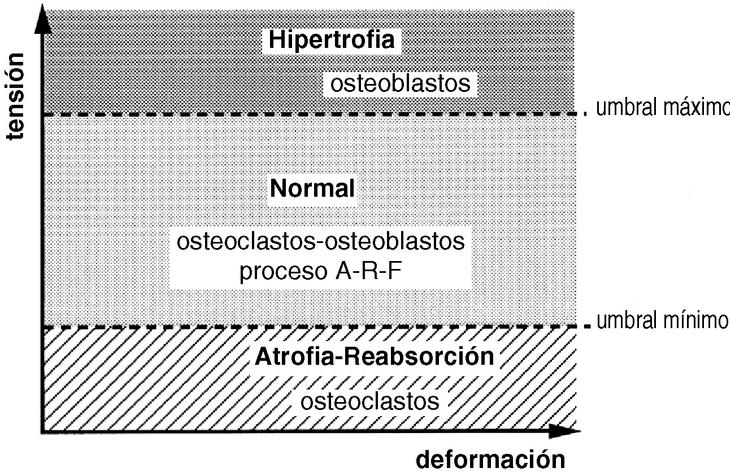
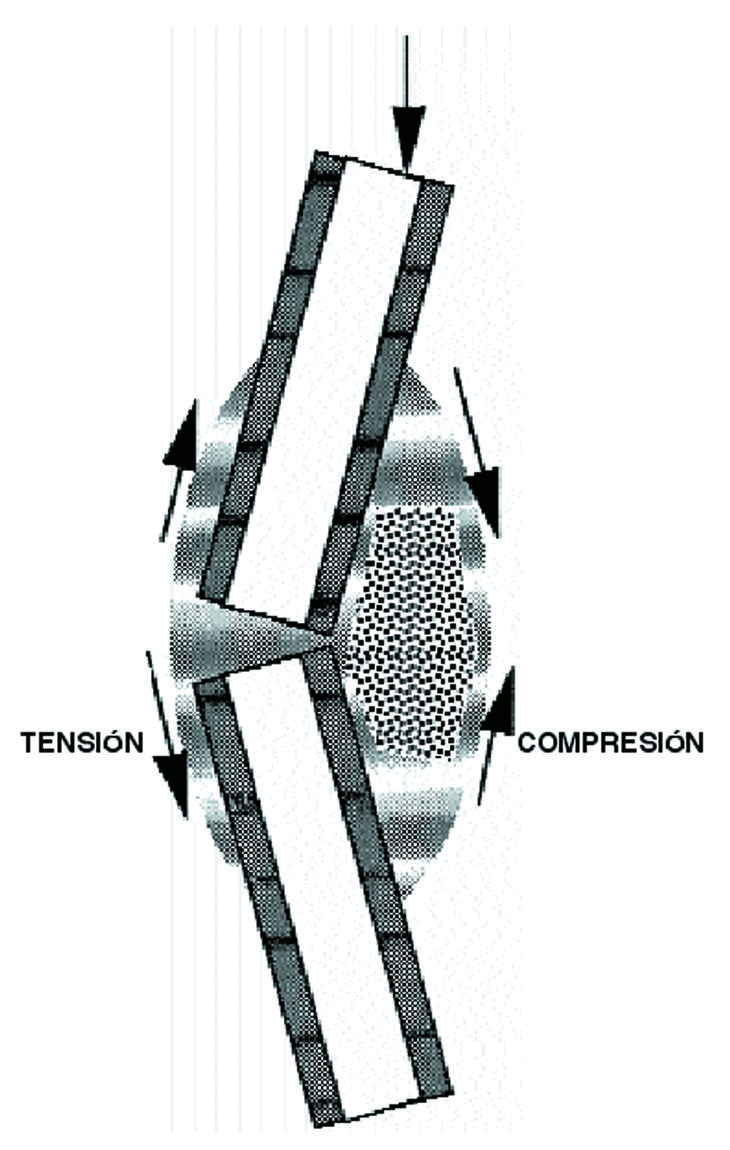
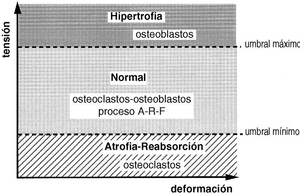
La forma de un hueso puede ser vista como la adaptación fisiológica para reducir las solicitaciones. Su rigidez y su resistencia vienen determinadas por la cantidad y densidad ósea en las secciones transversales perpendiculares al plano de flexión51, lo que indica que la forma y la estructura de un hueso no se modifican con los estímulos mecánicos sino que la forma ósea sirve para enfrentarse a unas condiciones mecánicas y que las diferencias morfológicas de los huesos largos de las extremidades de los vertebrados evidencian las muchas posibilidades por las que un hueso se adapta a funciones mecánicas específicas.10 Sólo cuando se sobrepasa el límite máximo de tensión se produce una fractura (Fig. 3). En la forma externa de un hueso también juegan un papel importante las inserciones musculares, así en las personas con una mayor actividad física, laboral o deportiva, existen inserciones más llamativas con la apariencia de un hueso más desarrollado.
Figura 3. El hueso vive normalmente entre dos umbrales de tensión, manteniéndose en condiciones adecuadas con el proceso denominado por Frost como A-R-F (Activación-Reabsorción-Formación). Cuando se sobrepasa el umbral máximo, el hueso se hipertrofia y cuando está sometido a tensiones por debajo del umbral mínimo, se atrofia.
El hueso cortical sometido a grandes deformaciones se adapta desarrollando hueso plexiforme en la superficie perióstica9,40 y las osteonas y el sistema lamelar concéntrico se orientan siguiendo la dirección de las mayores solicitaciones y deformaciones de mayor intensidad.39,52 Además, el hueso debe ofrecer unas garantías mecánicas con una función anatómica adecuada, como es el caso del radio, ya que sin su curvatura no podría efectuar el movimiento de prono-supinación. Lo mismo ocurre con el diseño de la extremidad proximal del fémur. Muchos huesos presentan una curvatura, en un plano, más o menos prominente para producir compresión axial y contrarrestar la flexión de las cargas excéntricas23,51 o para contrarrestar la acción muscular mientras mantienen la inserción tendinosa alineada con el eje del miembro, además de estimular la actividad celular del tejido óseo.39
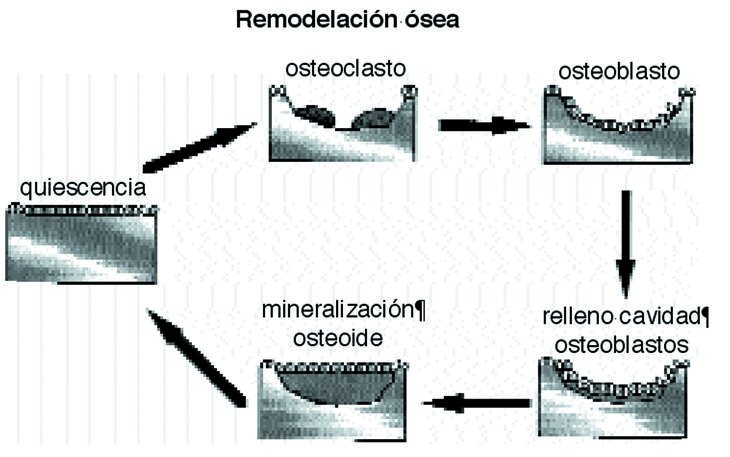
Ante un cambio de las solicitaciones en intensidad y frecuencia, el hueso modifica su densidad y en menor medida altera su área de sección, endóstica y perióstica.12,18 La densidad ósea no es homogénea en todo el hueso,2 confirmando la teoría inicial de Pauwels de que el tejido óseo se distribuye en las diferentes secciones transversales, en relación con las tensiones que debe soportar. El hueso, sin variar su forma externa, juega con los valores de tensión, aumentando o disminuyendo su densidad. El valor óptimo de tensión es el que mantiene un equilibrio entre la reabsorción y formación de nuevo hueso, entre límites de tolerancia; cuando la tensión es superior a la óptima, sin sobrepasar el límite superior de tolerancia, se produce formación ósea, mientras que si es inferior a la óptima, se producirá reabsorción ósea23,38,51 (Fig. 4).
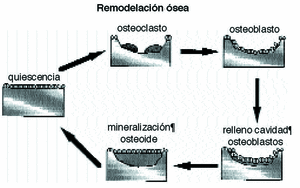
Figura 4. Esquema del proceso de remodelación ósea.
El hueso se adapta a las modificaciones mecánicas con la remodelación osteonal que es un mecanismo reparativo que elimina y sustituye el hueso cortical fatigado6-8,31,56 por acumulación de fracturas trabeculares y reorienta su dirección en función de las solicitaciones mecánicas,45 respondiendo a los potenciales eléctricos, a las presiones hidroestáticas del fluido extracelular y a las alteraciones en la difusión de la membrana celular.25 En el proceso de remodelación se asumen dos formas diferentes, la remodelación interna, cuando la geometría es constante y cambian las propiedades del material y la externa o superficial, cuando las propiedades del material son constantes variando únicamente la morfología externa.
La remodelación es un proceso de dos fases, pues a la reabsorción de una zona de hueso por los osteoclastos sigue el relleno de la cavidad por los osteoblastos, un sistema funcional celular que Frost, 1997, denomina «unidad básica multicelular»; es decir, en condiciones normales, se forma hueso de donde desaparece. Esta secuencia requiere entre tres y cuatro meses hasta completar todo el proceso y evita cambios en la arquitectura y en la masa ósea, eliminando los daños por fatiga45 y renovando el tejido óseo.50 En casos de huesos sometidos a procesos de remodelación intensos se pueden encontrar grandes superficies reabsorbidas que aumentan la porosidad y disminuyen la densidad y la resistencia del mismo.28
¿Quién dirige el comportamiento óseo?
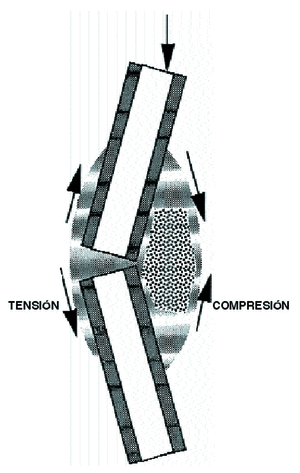
Las solicitaciones mecánicas sobre un hueso producen deformaciones y hace que el líquido intersticial fluya con más o menos intensidad, como si fuera una esponja,15,16,23 produce cambios de flujo y empuja al fluido hasta atravesar la membrana celular,19,66 lo que Biot, 1941, denominó como «teoría poroelástica», donde el periostio actúa como la barrera que evita que el fluido óseo salga del hueso15,16,43 y por esto la formación ósea es mucho mayor cuando se aplican solicitaciones a compresión pues aumentan el flujo tisular62 (Fig. 5).
Figura 5. Ver texto.
Para Weinbaum y Cowin, 1994, los osteocitos se estimulan con los pequeños cambios del fluido en los poros óseos (canales de Volkmann y Havers; lagunas y canalículos osteocitarios y poros entre los cristales de hidroxiapatita), que producen solicitaciones de cizallamiento sobre su membrana. De esta manera, las cargas mecánicas estimulan la respuesta temprana de los osteocitos,20,58 que se convierten así en el sensor biológico de las deformaciones mecánicas y el flujo de fluido, para transmitir señales a los osteoblastos,1 que junto con los osteoclastos, son los responsables de los procesos de formación y remodelación del hueso y de alguna manera los agentes finales y sensibles a las modificaciones mecánicas de hueso.
Los osteocitos pueden aumentar sus digitaciones en la matriz ósea e incrementar la producción de proteínas (colágenos, integrinas, osteopontina) o degradar la matriz, produciendo enzimas que digieren el colágeno, como la metaloproteinasa-1 (MMP-1).55 El osteocito responde en unos tres días, a los estímulos mecánicos osteogénicos produciendo colágeno en el espacio pericelular que modula las condiciones mecánicas y morfológicas de la relación de las células con su laguna.
La síntesis de colágeno es el primer paso para la formación de hueso y su eliminación, el inicio de la reabsorción. La relación de los osteocitos con el colágeno no se conoce y no parecen ser células determinantes en la osteolisis, dejando esta función a los osteoclastos, si bien, como hemos visto, los osteocitos pueden estimular la producción de metalopropteinasas (MMP) capaces de degradar los colágenos tipo I, II y III en la laguna osteocitaria.55,59
Sólo cuando los estímulos exceden la plasticidad celular participan los osteoblastos y los osteoclastos, o ambos, para adaptar las superficies óseas a las nuevas condiciones,55 esta teoría indica que la ley de Wolff es el resultado de una adaptación celular más que un cambio de la morfología ósea y explica el fallo de muchas señales físicas o mecánicas para estimular la formación ósea y, también, las diferencias existentes entre unas zonas y otras de hueso, pues no son todas iguales, ni por su densidad, ni por el tipo y la sensibilidad de los osteocitos que puede verse afectada con la edad o disminuir con procesos fisiológicos u hormonales, como la menopausia.59
Estudios experimentales
Se han desarrollado trabajos experimentales que intentan correlacionar las magnitudes y deformaciones óseas con su respuesta biológica. De los trabajos de Lanyon y cols.,26,39-42 se puede concluir que la remodelación es la respuesta del hueso frente a una deformación, dependiendo de su distribución y el número de ciclos diarios, viendo que sólo unos pocos ciclos de carga diarios, con la deformación apropiada, mantienen la estructura ósea.
El trabajo de Burr, 1980, observó que la estructura del hueso cortical de los primates es un reflejo de su tipo de locomoción y señalan cómo al aumentar la diferenciación funcional entre la extremidad anterior y posterior, se incrementa el porcentaje de hueso osteonal.11 Por su parte, Bouvier y Hylander, 1981, vieron el efecto de dietas fuertes y blandas sobre la morfología de las mandíbulas en macacus rhesus, demostrando que la remodelación ósea está relacionada con las magnitudes de las tensiones, encontrando mayor remodelación en las mandíbulas de los monos con dietas más duras y con más hueso osteonal en los lugares sujetos a mayor tensión.8
También se ha encontrado una relación entre remodelación y vascularización. Antonov, 1980, señaló el aumento de los canales de Havers y de su diámetro en relación con la intensidad del ejercicio,3 mientras que Forwood y cols., 1986, 1995, vieron que el ejercicio modifica la morfología vascular y el número de canales haversianos y no haversianos aumentan, en la diáfisis femoral de las ratas, después de someterlas a ejercicios de natación, durante ocho semanas, aunque no todos los canales aumentan su diámetro y los cambios tienen lugar, únicamente, en el tercio medio de la cortical.21,22 También aumenta con el ejercicio la perfusión ósea60 y la resistencia vascular.27
La actividad repercute sobre la morfología ósea y se han encontrado diferencias entre personas que realizan una actividad deportiva. Jones y cols., 1977, estudiaron el húmero de tenistas profesionales, viendo un mayor ancho cortical que en la población control.35 Para Wolman y cols., 1991, el contenido de mineral óseo en la porción media del fémur fue mayor en corredoras (1,51 g/cm2) que en regatistas (1,43 g/cm2), bailarinas (1,39 g/cm2) o en controles sedentarios (1,40 g/cm2).71 Sin embargo, el ejercicio muy intenso inhibe el crecimiento óseo, especialmente en animales jóvenes, disminuyendo la longitud y el volumen óseo. Uhthoff y cols.,33,63 produjeron atrofia en perros jóvenes, inmovilizando con esparadrapo una de sus patas delanteras, por una fuerte reabsorción ósea perióstica sin variar la superficie medular. Sin embargo, repitiendo la experiencia con perros de ocho años de edad, no observaron variaciones de la superficie perióstica pero presentaron una gran reabsorción endostal. Por su parte, Woo y cols., 1981, sometieron a cerdos jóvenes a un programa de ejercicio durante un año, demostrando una formación de hueso en las dos superficies, la perióstica y la endóstica.72
Los estudios realizados sobre animales bípedos también son controvertidos. Simon y Papierski, 1982, señalan que las ratas macho bípedas tienen un fémur más corto que el grupo control, mientras que a las hembras les ocurre lo contrario, no encontrando diferencias en la longitud de la tibia entre ambos grupos.57 Kay y Condon, 1987, en ratas machos con una pata posterior amputada, señalaron que de un total de 25 parámetros, sólo el diámetro antero-posterior proximal del fémur difería estadísticamente, sin observar cambios en la longitud, la curvatura del fémur o el peso.36 Jee y cols.,34,44 sobrecargando una pata al inmovilizar la contralateral, en ratas, vieron que el aumento de cargas muestra una tendencia, no significativa, al incremento de la formación de hueso perióstico mientras que Van der Meulen y cols., 1995, suspendiendo ratas en crecimiento de sus patas posteriores observaron una expansión endostal normal con reducción del crecimiento perióstico.46 Gross y Rubin, 1995, mantuvieron inmovilizada una de las alas en cinco pavos adultos machos, encontrando, a las ocho semanas, un aumento de la porosidad ósea y una pérdida de masa ósea por remodelación intracortical.27 Por otra parte, las ratas que han pasado un tiempo en el espacio, sin el efecto de la fuerza gravitatoria terrestre, presentaron un retardo en la formación del hueso perióstico, disminución del crecimiento longitudinal, alteración de la homeostasis del calcio y del fósforo, alteración de la orientación del colágeno y del metabolismo óseo64,73 y exponiendo ratas de varias edades a la hipergravedad, aumenta la densidad en la porción media del hueso 32.
Cambios biológicos del hueso
El hueso también sufre cambios fisiológicos durante la vida de un individuo, se señala un rápido crecimiento de la densidad durante la pubertad, con diferencias significativas entre ambos sexos y edades, apreciando las mayores diferencias durante la adolescencia24,37 aunque el mineral óseo aumenta hasta la tercera década de la vida. A partir de los 35 años, comienza la pérdida de hueso cortical, en ambos sexos, entre el 0,3% y el 0,5% de la densidad ósea total por año. En la quinta década de la vida, empieza a disminuir la densidad ósea de forma considerable, más en las mujeres, y especialmente en el hueso trabecular. En el hombre, la pérdida de densidad ósea con la edad parece consecuencia de la disminución de la formación ósea mientras que en las mujeres, después de la menopausia, resulta de un aumento de la reabsorción ósea,29 aunque también se ha señalado que después de los 40 años de edad, el índice de formación ósea es constante mientras que aumenta la reabsorción en ambos sexos, si bien es siempre mayor en las mujeres.49 También existen diferencias raciales. Hasta la adolescencia la densidad ósea es semejante en las razas blanca y negra. Después aumenta más en la raza negra siendo también menor su disminución. Los norteamericanos descendientes de europeos tienen menor masa ósea y mayor riesgo de fracturas ósea que los descendientes de africanos de la misma edad.53
El hueso desarrollado modifica su densidad con la edad y el sexo pero tampoco cambia su forma, tal vez debido a que con la edad disminuye la actividad física y se requiere un material óseo menos denso, y, además, los músculos, a partir de los 30 años, disminuyen su fuerza de contracción quedando a los 80 años un 50% de la fuerza muscular máxima10 para lo que también se requiere un hueso menos rígido y resistente y, por lo tanto, menos denso.