Los procedimientos de cirugía ortopédica y traumatológica (COT) pueden ocasionar pérdidas significativas de sangre y anemia postoperatoria aguda, que en muchos casos requiere transfusión de sangre alogénica (TSA). Las desventajas clínicas, económicas y logísticas de la TSA han promovido el desarrollo de programas multidisciplinares y multimodales, genéricamente conocidos como programas de Patient Blood Management (PBM), cuyo objetivo es el de reducir o eliminar la necesidad de TSA y mejorar el resultado clínico. Estos programas se apoyan en la aplicación de cuatro grupos de medidas perioperatorias: 1) uso de criterios restrictivos de transfusión; 2) estimulación de la eritropoyesis; 3) reducción del sangrado; y 4) transfusión de sangre autóloga. En este artículo, revisamos la eficacia, seguridad y recomendaciones de las estrategias aplicables en COT, así como los condicionantes para el desarrollo e implementación de los programas de PBM en esta especialidad.
Orthopaedic and trauma surgical procedures (OTS) can lead to significant blood losses and acute postoperative anaemia, which in many cases requires allogeneic blood transfusions (ABT). The clinical, economic and logistical disadvantages of ABT have promoted the development of multidisciplinary and multimodal programs generically known as Patient Blood Management (PBM) programs, which have as their objective to reduce or eliminate the need for ABT and improve clinical outcomes. These programs are supported by the implementation of four groups of perioperative measures: (1) use of restrictive transfusion criteria; (2) stimulation of erythropoiesis; (3) reduction of bleeding; and (4) autologous blood transfusion. In this article, a review is presented of the effectiveness, safety and recommendations of applicable strategies in OTS, as well as the barriers and requirements to the development and implementation of PBM programs in this surgical specialty.
Los procedimientos de cirugía ortopédica y traumatológica (COT), como las artroplastias de rodilla (PTR) y cadera (PTC), las intervenciones instrumentadas de columna o la reparaciones de fracturas de cadera, pueden ocasionar en promedio hasta dos litros de pérdida de sangre y esto suele generar una anemia postoperatoria aguda, que en muchos casos requiere transfusión de sangre alogénica (TSA)1–3. Sin embargo, existen una serie de motivos que indican la conveniencia de transfundir menos, entre los que se encuentran: la condición de recurso limitado de la sangre humana; los elevados costes de la preparación, distribución y administración de los componentes sanguíneos; los efectos adversos de la transfusión, como las reacciones hemolíticas agudas por errores de identificación, la transmisión de enfermedades infecciosas, el daño pulmonar agudo, la sobrecarga circulatoria, la inmunomodulación, entre otros; y diversas disposiciones de la legislación vigente4.
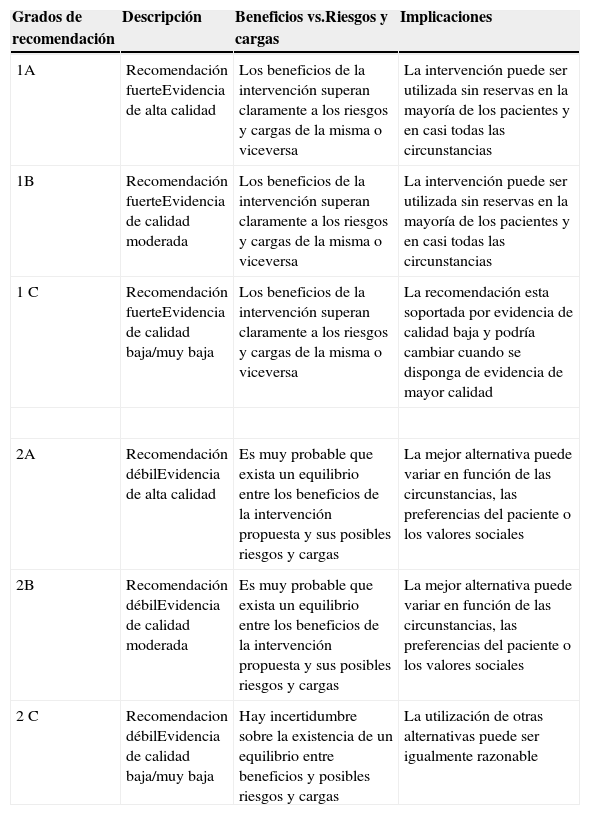
Estas desventajas clínicas, económicas y logísticas de la TSA han promovido recomendaciones para un uso restrictivo de la misma, particularmente para evitar la transfusión innecesaria, y el desarrollo de programas multidisciplinares y multimodales para el manejo integral de estos pacientes, genéricamente conocidos como Programas de Patient Blood Management (PBM), cuyo objetivo último es el de reducir o eliminar la necesidad de TSA y mejorar el resultado clínico. Estos programas se apoyan en la aplicación de cuatro grupos de medidas perioperatorias: 1) optimización de la tolerancia a la anemia normovolémica, para permitir el uso de criterios restrictivos de transfusión; 2) estimulación de la eritropoyesis; 3) corrección de la hemostasia y reducción del sangrado; y 4) uso de sangre autóloga5 (tabla 1). La eficacia, seguridad y recomendaciones de la mayoría de estas medidas han sido recogidas en la actualización del Documento Sevilla de Consenso sobre Alternativas a la Transfusión (DS 2013)6 y en la Guía Europea de Manejo del Sangrado Perioperatorio Grave (Guía ESA)7, elaboradas utilizando la metodología GRADE (Grading of Recommendations Assessment, Development and Evaluation). La metodología GRADE formula recomendaciones graduadas que pueden ser fuertes [1] o débiles [2], positivas o negativas, y apoyadas por evidencia de calidad alta [A], moderada [B] o baja/muy baja [C] (tabla 2)6. Cuando se hace una recomendación fuerte, se utiliza la terminología «Recomendamos …» o «No recomendamos …» y, cuando se hace una recomendación débil, una menos concluyente como «Sugerimos …».
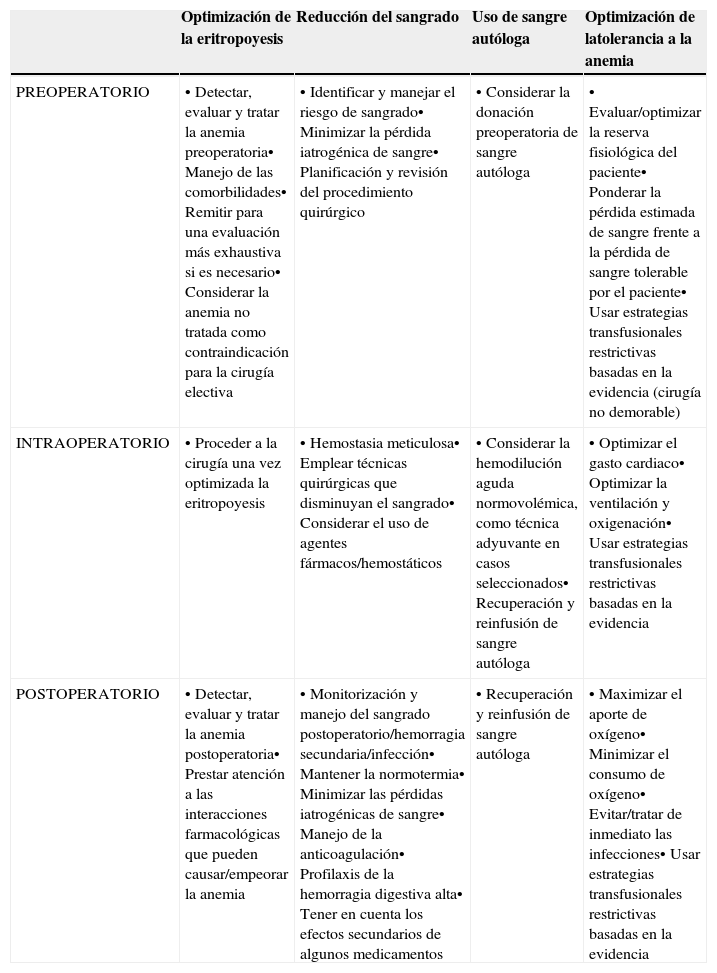
Resumen de las estrategias perioperatorias para abordar la implementación de un programa de Patient Blood Management (Modificado de referencia 5)
| Optimización de la eritropoyesis | Reducción del sangrado | Uso de sangre autóloga | Optimización de latolerancia a la anemia | |
|---|---|---|---|---|
| PREOPERATORIO | • Detectar, evaluar y tratar la anemia preoperatoria• Manejo de las comorbilidades• Remitir para una evaluación más exhaustiva si es necesario• Considerar la anemia no tratada como contraindicación para la cirugía electiva | • Identificar y manejar el riesgo de sangrado• Minimizar la pérdida iatrogénica de sangre• Planificación y revisión del procedimiento quirúrgico | • Considerar la donación preoperatoria de sangre autóloga | • Evaluar/optimizar la reserva fisiológica del paciente• Ponderar la pérdida estimada de sangre frente a la pérdida de sangre tolerable por el paciente• Usar estrategias transfusionales restrictivas basadas en la evidencia (cirugía no demorable) |
| INTRAOPERATORIO | • Proceder a la cirugía una vez optimizada la eritropoyesis | • Hemostasia meticulosa• Emplear técnicas quirúrgicas que disminuyan el sangrado• Considerar el uso de agentes fármacos/hemostáticos | • Considerar la hemodilución aguda normovolémica, como técnica adyuvante en casos seleccionados• Recuperación y reinfusión de sangre autóloga | • Optimizar el gasto cardiaco• Optimizar la ventilación y oxigenación• Usar estrategias transfusionales restrictivas basadas en la evidencia |
| POSTOPERATORIO | • Detectar, evaluar y tratar la anemia postoperatoria• Prestar atención a las interacciones farmacológicas que pueden causar/empeorar la anemia | • Monitorización y manejo del sangrado postoperatorio/hemorragia secundaria/infección• Mantener la normotermia• Minimizar las pérdidas iatrogénicas de sangre• Manejo de la anticoagulación• Profilaxis de la hemorragia digestiva alta• Tener en cuenta los efectos secundarios de algunos medicamentos | • Recuperación y reinfusión de sangre autóloga | • Maximizar el aporte de oxígeno• Minimizar el consumo de oxígeno• Evitar/tratar de inmediato las infecciones• Usar estrategias transfusionales restrictivas basadas en la evidencia |
Grados de recomendación de acuerdo con la metodología GRADE
| Grados de recomendación | Descripción | Beneficios vs.Riesgos y cargas | Implicaciones |
|---|---|---|---|
| 1A | Recomendación fuerteEvidencia de alta calidad | Los beneficios de la intervención superan claramente a los riesgos y cargas de la misma o viceversa | La intervención puede ser utilizada sin reservas en la mayoría de los pacientes y en casi todas las circunstancias |
| 1B | Recomendación fuerteEvidencia de calidad moderada | Los beneficios de la intervención superan claramente a los riesgos y cargas de la misma o viceversa | La intervención puede ser utilizada sin reservas en la mayoría de los pacientes y en casi todas las circunstancias |
| 1C | Recomendación fuerteEvidencia de calidad baja/muy baja | Los beneficios de la intervención superan claramente a los riesgos y cargas de la misma o viceversa | La recomendación esta soportada por evidencia de calidad baja y podría cambiar cuando se disponga de evidencia de mayor calidad |
| 2A | Recomendación débilEvidencia de alta calidad | Es muy probable que exista un equilibrio entre los beneficios de la intervención propuesta y sus posibles riesgos y cargas | La mejor alternativa puede variar en función de las circunstancias, las preferencias del paciente o los valores sociales |
| 2B | Recomendación débilEvidencia de calidad moderada | Es muy probable que exista un equilibrio entre los beneficios de la intervención propuesta y sus posibles riesgos y cargas | La mejor alternativa puede variar en función de las circunstancias, las preferencias del paciente o los valores sociales |
| 2C | Recomendacion débilEvidencia de calidad baja/muy baja | Hay incertidumbre sobre la existencia de un equilibrio entre beneficios y posibles riesgos y cargas | La utilización de otras alternativas puede ser igualmente razonable |
El establecimiento de criterios de transfusión claramente definidos y que puedan ser aplicados de manera uniforme durante toda la estancia hospitalaria es la piedra angular de cualquier programa de PBM (tabla 3). En los últimos años, diversas guías de práctica clínica vienen recomendando el uso de criterios “restrictivos” de transfusión frente al de criterios «liberales». Entre ellas, la de la AABB (antigua American Association of Blood Banks)8 formula las siguientes recomendaciones:
- •
Recomendación 1: La AABB recomienda adherirse a una estrategia de transfusión restrictiva (Hb de 7 a 8g/dL) en los pacientes hospitalizados, estables (GRADE 1A).
- •
Recomendación 2: La AABB sugiere adherirse a una estrategia restrictiva en pacientes hospitalizados con enfermedad cardiovascular preexistente y considerar la transfusión en pacientes con síntomas o una Hb de 8g/dL o menos (GRADE 2B).
- •
Recomendación 3: La AABB no puede hacer una recomendación a favor o en contra del uso de un umbral de transfusión liberal o restrictivo para pacientes hospitalizados, hemodinámicamente estables con síndrome coronario agudo.
- •
Recomendación 4: La AABB sugiere que las decisiones de transfusión estén basadas en los síntomas, así como en la concentración de Hb (GRADE 2C).
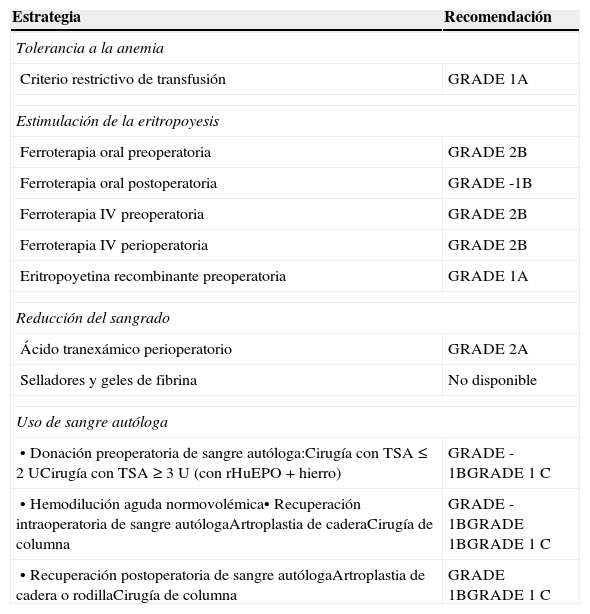
Grados de recomendación (GRADE) de las distintas estrategias incluidas en un programa de Patient Blood Management6,7
| Estrategia | Recomendación |
|---|---|
| Tolerancia a la anemia | |
| Criterio restrictivo de transfusión | GRADE 1A |
| Estimulación de la eritropoyesis | |
| Ferroterapia oral preoperatoria | GRADE 2B |
| Ferroterapia oral postoperatoria | GRADE -1B |
| Ferroterapia IV preoperatoria | GRADE 2B |
| Ferroterapia IV perioperatoria | GRADE 2B |
| Eritropoyetina recombinante preoperatoria | GRADE 1A |
| Reducción del sangrado | |
| Ácido tranexámico perioperatorio | GRADE 2A |
| Selladores y geles de fibrina | No disponible |
| Uso de sangre autóloga | |
| • Donación preoperatoria de sangre autóloga:Cirugía con TSA ≤ 2 UCirugía con TSA ≥ 3 U (con rHuEPO+hierro) | GRADE -1BGRADE 1C |
| • Hemodilución aguda normovolémica• Recuperación intraoperatoria de sangre autólogaArtroplastia de caderaCirugía de columna | GRADE -1BGRADE 1BGRADE 1C |
| • Recuperación postoperatoria de sangre autólogaArtroplastia de cadera o rodillaCirugía de columna | GRADE 1BGRADE 1C |
TSA, transfusión de sangre alogénica; rHuEPO, eritropoyetina humana recombinante.
Estas recomendaciones nos ayudan a decidir «cuando considerar la necesidad de transfundir», mientras que las recomendaciones del DS 20136, que complementan a las de la AABB, nos orientan sobre «cuanto transfundir»:
- •
Recomendación 1: En pacientes críticos, politraumatizados o quirúrgicos, sin afectación cardiológica o del sistema nervioso central, recomendamos la transfusión de concentrado de hematíes para mantener cifras de Hb entre 7 y 9g/dL, con objeto de disminuir la tasa transfusional (GRADE 1A).
- •
Recomendación 2: En pacientes críticos, politraumatizados o quirúrgicos, con afectación cardiológica o del sistema nervioso central, recomendamos la transfusión de concentrado de hematíes para mantener cifras de Hb entre 8 y 10g/dL, con objeto de disminuir la tasa transfusional (GRADE 1A).
Estas recomendaciones son totalmente aplicables a los pacientes de COT (tabla 3), y los ensayos clínicos hasta ahora realizados han demostrado que el uso de criterios restrictivos (generalmente Hb <8g/dL) reduce los requerimientos de TSA y la incidencia de infección postoperatoria (Riesgo relativo 0.70 [IC95%, 0.54-0.91]), sin diferencias significativas en cuanto a morbilidad, mortalidad y estado funcional de los pacientes, en comparación con el uso de criterios liberales (generalmente Hb <10g/dL)9.
Por ello, el uso de criterios restrictivos se ha convertido en práctica común en nuestros servicios de COT. Ya en 2004, una encuesta a la que respondieron 59 hospitales reveló que se transfunde habitualmente con Hb <8g/dL (58%) o <9g/dL (25%), aunque determinadas circunstancias clínicas (e.g., edad, enfermedad cardíaca, respiratoria, renal o hepática, sangrado, o Hb previa) pueden modificar las necesidades transfusionales. Sin embargo, la mayoría de los traumatólogos mantenían la idea de que «la transfusión mínima» debe ser de dos concentrados de hematíes10; concepción errónea que debe ser corregida ya que, siempre que sea posible, los concentrados de hematíes deben ser administrados de uno en uno, con revaloración clínica y/o analítica del paciente entre ellos.
En cualquier caso, se debe recordar que la implementación de criterios transfusionales restrictivos, aunque eficaz para reducir tanto el porcentaje de pacientes transfundidos como el volumen de componentes administrados (y los costes de este tratamiento) (tabla 4), no siempre es suficiente y conviene la implementación de otras medidas. Recientemente, se ha podido comprobar que, a pesar de la aplicación de criterios restrictivos, los pacientes críticos que reciben transfusión presentan un peor desenlace clínico que los no transfundidos11.
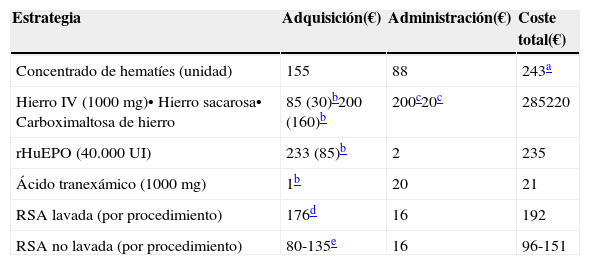
Costes estimados de algunas estrategias incluidas en un programa de Patient Blood Management15,16,42,53
| Estrategia | Adquisición(€) | Administración(€) | Coste total(€) |
|---|---|---|---|
| Concentrado de hematíes (unidad) | 155 | 88 | 243a |
| Hierro IV (1000mg)• Hierro sacarosa• Carboximaltosa de hierro | 85 (30)b200 (160)b | 200c20c | 285220 |
| rHuEPO (40.000 UI) | 233 (85)b | 2 | 235 |
| Ácido tranexámico (1000mg) | 1b | 20 | 21 |
| RSA lavada (por procedimiento) | 176d | 16 | 192 |
| RSA no lavada (por procedimiento) | 80-135e | 16 | 96-151 |
No tiene en cuenta coste de las complicaciones (eg, aumento de la estancia hospitalaria en los pacientes transfundidos: 320 €/día). En relación a las unidades alogénicas, el coste total de las unidades autólogas se vería incrementado en función del número de unidades no utilizadas, ya que éstas no pueden ser transfundirse como alogénicas a otros pacientes.
Utilizando los criterios de la OMS, la anemia preoperatoria está presente en buena parte de los pacientes COT, y hasta un 30% presentan un nivel sub-óptimo de Hb (Hb<13g/dL)1,2. La anemia preoperatoria muestra una asociación independiente con el aumento de la morbilidad y la mortalidad y con una mayor duración de la estancia hospitalaria, así como con el riesgo de TSA, que a su vez también está asociada con un aumento de morbilidad y mortalidad perioperatorias1,12,13. A pesar de ello, aún sigue sin prestársele la debida atención y en muchos casos no se instaura un tratamiento para corregirla o mejorarla, recibiendo los pacientes TSA según sea necesario. La anemia postoperatoria es aún más frecuente y debe ser corregida, lo que no implica que necesariamente haya de hacerse mediante la administración de TSA. Por ello, la estimulación perioperatoria de la eritropoyesis constituye un pilar fundamental del programa de PBM.
Diagnóstico y tratamiento de la anemia preoperatoriaEn los pacientes programados para COT mayor se debería investigar la presencia de anemia preoperatoria al menos 30 días antes de la intervención, para realizar su diagnóstico diferencial e instaurar el tratamiento adecuado, si procede (GRADE 1C)6,14. Ante una anemia inesperada, un procedimiento quirúrgico electivo debería ser pospuesto hasta que haya sido debidamente clasificada y tratada.
Generalmente, se define la presencia de anemia por una Hb <13g/dL en varones o <12g/dL en mujeres, pero quizás necesitemos una definición diferente en pacientes de COT. Las mujeres tienen un volumen circulante menor que los varones, mientras que las pérdidas de sangre en estos procedimientos quirúrgicos son similares para ambos sexos. En el estudio multicéntrico austríaco (18 hospitales, 1401 PTC, 1296 PTR), la pérdida perioperatoria relativa de masa eritocitaria fue del 37% en PTC (mujeres 39%, hombres 34%) y del 35,2% en PTR (mujeres 44%, hombres 34%). Esto se reflejó en los requerimientos de transfusión alogénica y autóloga: 43% en PTC (mujeres 52%, hombres 30%) y 41% en PTR (mujeres 45%, hombres 31%)2. Ya en el estudio OSTHEO se había observado que, para un mismo nivel de Hb preoperatoria (eg, 13g/dL), la tasa de TSA en PTR y PTC era mayor en mujeres (34%) que en hombres (22%)1.
Por lo tanto, para las pacientes de COT la definición de la anemia debería ser al menos la misma que para los pacientes varones; es decir, Hb <13g/dL. Para no entrar en confrontación con las definiciones habituales, deberíamos cambiar el término «anemia preoperatoria» por el de «nivel sub-óptimo de Hb preoperatoria» cuando ésta es <13g/dL. Consecuentemente, el objetivo del tratamiento preoperatorio debe ser el de optimizar la Hb para alcanzar un nivel de al menos 13g/dL y minimizar el riesgo de transfusión.
En el caso de la anemia postoperatoria, el objetivo del tratamiento será el de alcanzar niveles de Hb que eviten la TSA, así como la corrección de la anemia en el periodo más corto posible, para facilitar la recuperación funcional y mejorar la calidad de vida. Además, en este periodo se debe prestar atención a las interacciones farmacológicas que puedan causar o empeorar la anemia5.
Un aspecto importante, y frecuentemente olvidado, es el diagnóstico de las deficiencias de hematínicos sin anemia (déficit de hierro, vitamina B12 o folato), ya que su corrección es de capital importancia para optimizar los niveles preoperatorios de Hb, especialmente en los pacientes en tratamiento con agentes estimuladores de la eritropoyesis, y para acelerar la recuperación de la anemia postoperatoria (GRADE 1C)14.
FerroterapiaIndicaciones. La Guía ESA recomienda de forma genérica tratar la deficiencia de hierro mediante la administración de hierro oral o intravenoso (GRADE 1B)7, pero esta recomendación ha de ser matizada según la gravedad de la anemia, el tipo de cirugía y el tiempo disponible para tratarla. Ante una anemia ferropénica preoperatoria, siempre que sea posible y se disponga del tiempo necesario, se debe considerar el uso de hierro oral (p.e., sulfato ferroso) por su bajo costo y fácil administración (GRADE 2B) (tabla 3)6.
Sin embargo, en algunas ocasiones, bien sea por mala absorción, mala tolerancia o poco tiempo antes de la cirugía, está plenamente justificado el uso de hierro por vía intravenosa (FeIV), con el que la respuesta medular y la repleción de los depósitos serán más rápidas (1-2 semanas) (GRADE 2B) (tabla 3)6. En pacientes anémicos programados para COT, la administración preoperatoria de FeIV elevó significativamente la Hb, corrigió la anemia en la mayoría de pacientes y redujo las necesidades de TSA, aunque los costes del tratamiento fueron menores con carboximaltosa de hierro que con hierro sacarosa (tabla 4)15.
Por el contrario, la evidencia disponible demuestra que la administración de hierro oral en el postoperatorio no mejora los niveles de Hb ni reduce las necesidades de TSA y no se recomienda (GRADE -1B) (tabla 3)6, mientras que el FeIV sí parece ser eficaz en la consecución de estos objetivos (GRADE 2B)16,17.
Posología. Aunque existen numerosas formulaciones de hierro oral en el mercado (sales ferrosas, compuestos amino-quelados, complejos ferro-proteicos, compuesto de hierro en liposomas, etc.), el fármaco de referencia sigue siendo el sulfato ferroso y la dosis diaria habitual suele ser de 100mg de hierro elemental.
Cuando se utiliza FeIV, el objetivo es el de cubrir la deficiencia de hierro del paciente, evitando un aporte excesivo. La dosis de FeIV puede calcularse utilizando la fórmula de Ganzoni [Deficit de hierro (mg)=peso (kg) x (Hbobjetivo–Hb actual) (g/dL) x 2.4+500] o puede utilizarse un esquema posológico simplificado (200mg de FeIV por cada g/dL de Hb que deseemos recuperar+500mg para rellenar los depósitos).
Seguridad. Los efectos adversos de los preparados de FeIV que más suelen preocupar son las reacciones de hipersensibilidad y el posible aumento de infecciones. La Agencia Europea del Medicamento (EMA) sostiene que, correctamente indicados y administrados a las dosis adecuadas, los beneficios de estos preparados superan a los riesgos, la incidencia de reacciones alérgicas graves es baja y no existen diferencias de seguridad entre los distintos preparados de hierro disponibles en Europa (hierro gluconato, hierro sacarosa, hierro dextrano de bajo peso molecular, carboximaltosa de hierro, hierro isomaltósido), aunque la calidad de la evidencia que sustenta esta última consideración es baja18. Por ello, la EMA recomienda que solo se administre FeIV en un entorno donde se disponga de medios y personal entrenado para realizar reanimación cardiopulmonar, suprime la necesidad de administrar una dosis de prueba y recomienda el seguimiento de los pacientes durante al menos 30min tras la infusión18.
En lo que respecta al incremento del riesgo de infección, Litton et al.19 publican un meta análisis de 72 ensayos clínicos con un total de 10.000 pacientes incluidos para evaluar la eficacia y seguridad del FeIV. Concluyen que estos preparados mejoran el nivel de Hb y reducen la tasa de TSA, pero que aumentan el riesgo relativo de infección. Es muy criticable que los autores establezcan una relación causal entre FeIV y aumento del riesgo de infección cuando: 1) en la mayoría de estudios incluidos éste no era una «variable objetivo» predefinida; 2) existe una gran heterogeneidad en los estudios incluidos en cuanto a las dosis y duración del tratamiento, tipos de hierro, población de estudio, etc.; 3) no ha podido demostrarse una relación dosis-efecto entre la administración de FeIV y la mayor incidencia de infecciones o mortalidad; y 4) los estudios que sí incluyen los criterios de definición para esta variable no demuestran un incremento de la tasa de infección en los pacientes tratados con FeIV.
Finalmente, el FeIV no ejerce una influencia directa sobre la eritropoyesis, por lo que su administración no da lugar a niveles supra-fisiológicos de Hb (como puede ocurrir con la eritropoyetina) y, por tanto, no incrementa el riesgo de enfermedad tromboembólica. Es más, podría reducirlo al disminuir la trombocitosis inducida por la deficiencia de hierro20.
Contraindicaciones. El uso de FeIV está contraindicado en casos de hipersensibilidad al principio activo, anemia no atribuida a una deficiencia de hierro, o indicios de sobrecarga de hierro o problemas en la utilización del mismo. Además, en pacientes con alergias o insuficiencia hepática, así como en embarazadas (2.° y 3.er trimestres), los beneficios y los riesgos de la administración de FeIV deberá ser cuidadosamente valorados18.
- -
Eritropoyetina humana recombinante
Indicaciones y posología. El 30% de los pacientes de COT programada presentan una Hb preoperatoria menor de 13g/dL1,12. Para los pacientes con Hb entre 10 y 13g/dL y niveles adecuados de hierro (ferritina ≥100ng/mL), se ha aprobado el uso de eritropoyetina humana recombinante (rHuEPO), con dos protocolos de administración: 4 dosis de 600 UI/Kg/semana s.c. comenzando tres semanas antes de la intervención, o 15 dosis de 300 UI/Kg/día s.c. empezando 10 días, el día de la intervención y los siguientes cuatro días después de la misma. Ambos protocolos consiguen una significativa reducción del riesgo de TSA (GRADE 1A) (tabla 3), pero se desconoce cuál es la dosis mínima eficaz de rHuEPO para alcanzar la Hb objetivo (generalmente 14g/dL) y reducir las TSA en estos pacientes6. No obstante, Rosencher et al.21 observaron que la mayoría de los pacientes de COT alcanzaban dicha Hb objetivo con una o dos dosis de 40.000 UI de rHuEPO, en lugar de las 4 dosis recomendadas por el fabricante, lo que permite reducir significativamente los costes (tabla 4). Aunque la administración de rHuEPO con hierro oral reduce significativamente los requerimientos transfusionales22, en general, se obtienen mejores resultados mediante la administración de FeIV en monoterapia, o en combinación con una o dos dosis de 40.000 UI de rHuEPO cuando no se consigue la respuesta deseada o en paciente con inflamación23,24.
En muchas ocasiones no disponemos de varias semanas para realizar el tratamiento de la anemia, bien por tratarse de cirugía no electiva o urgente, bien porque el paciente es evaluado poco días antes del señalado para la intervención. En estos casos aún se puede recurrir al tratamiento peri- o post-operatorio de la anemia. En COT para reparación de fractura de cadera, así como en artroplastia de rodilla o cadera, la administración perioperatoria de FeIV (400-600mg), con o sin una sola dosis preoperatoria de rHuEPO (40.000 UI), más un criterio restrictivo de transfusión (Hb<8g/dL), redujo la necesidad de TSA y contribuyó a una más rápida corrección de la anemia postoperatoria (GRADE 2B)6,25.
Seguridad. Respecto a la rHuEPO en COT, un meta-análisis reciente confirma su eficacia para reducir la TSA, sin que existan diferencias en el riesgo tromboembólico respecto al placebo, aunque los autores argumentan que la mayoría de pacientes recibían tromboprofilaxis y presentaban bajo riesgo cardiovascular y tromboembólico26. En cualquier caso, es importante resaltar que para una óptima respuesta a rHuEPO (reduciendo las dosis y los potenciales efectos adversos), las deficiencias de hierro, ácido fólico y vitamina B12 deben ser excluidas antes de iniciar la terapia. Así mismo, consideramos prudente no sobrepasar intencionadamente los 14g/dL (Hb objetivo), excepto en casos especiales como los Testigos de Jehová o los pacientes con cirugías más sangrantes (cirugía de revisión).
Contraindicaciones. La administración de rHuEPO está contraindicada en pacientes con hipertensión no controlada, antecedentes de enfermedad tromboembólica venosa o arterial, así como en aquellos que por algún motivo no puedan recibir un tratamiento profiláctico antitrombótico adecuado o padezcan neoplasia curable.
Reducción del sangrado perioperatorioEl segundo pilar del PBM agrupa las actuaciones perioperatorias dirigidas a «Corregir la hemostasia y minimizar la hemorragia y la pérdida sanguínea». La reducción de las pérdidas sanguíneas perioperatorias en COT está plenamente justificada y puede conseguirse mediante6,7:
- 1)
El uso de cuestionarios estandarizados para evaluar antecedentes de sangrado, trombosis y consumo de fármacos que interfieren la hemostasia (GRADE 1C).
- 2)
Un manejo adecuado de antiagregantes y anticoagulantes, aunque no se recomienda suspender el tratamiento con aspirina (GRADE 1B).
- 3)
La limitación de las extracciones sanguíneas con fines diagnósticos.
- 4)
El mantenimiento de la normotermia.
- 5)
El uso de hipotensión controlada, (inducida o permisiva; manteniendo la normovolemia, pero evitando la excesiva administración de fluidos).
- 6)
El adecuado posicionamiento del paciente para evitar la estasis venosa.
- 7)
La monitorización de la hemostasia mediante sistemas «point-of-care» (Tromboelastografía[TEG]/Tromboelastometría[ROTEM]) (GRADE 1C).
- 8)
La realización de una hemostasia quirúrgica cuidadosa y, cuando sea posible, de una cirugía mínimamente invasiva.
Estas medidas pueden complementarse con la administración de fármacos que puedan favorecer la formación del coágulo, aseguren su estabilidad o retrasen su lisis y el uso de drenajes con la mínima presión de aspiración, que analizaremos a continuación.
- –
Antifibrinolíticos
Entre los fármacos para reducir el sangrado, los antifibrinolíticos, especialmente el ácido tranexámico (ATX), son los más utilizados. Sin embargo, su uso en procedimientos de COT es controvertido ya que están considerados de «muy alto riesgo trombótico» y se sugiere que la profilaxis antitrombótica se mantenga durante ≥35 días después de la intervención27.
En el DS 20136 se analizó la eficacia y seguridad del empleo de ácido tranexámico (ATX) y ácido épsilon aminocaproico (ACA), análogos sintéticos de la lisina que inhiben la conversión del plasminógeno a plasmina. El ATX es 10 veces más potente que el ACA, y el máximo beneficio y mayor seguridad de este fármaco se obtiene en aquellas patologías o circunstancias donde predomine o se objetive un incremento de la hemorragia por una hiperfibrinolisis, primaria o secundaria. El papel de la aprotinina en la reducción del sangrado y de los requerimientos transfusionales28,29 no fue analizado en el DS 2013 al haber sido retirada del mercado.
Indicaciones. Según la ficha técnica autorizada30, en su última versión de diciembre de 2012, las indicaciones específicas para el uso de TXA en pacientes quirúrgicos incluyen cirugía de oídos, nariz y garganta, torácica y abdominal y otras intervenciones quirúrgicas importantes como cirugía cardiovascular. La COT no está nominalmente incluida en las indicaciones del ATX.
Uso fuera de indicación en ficha técnica. En España, el uso de TXA en COT se está realizando en una indicación no explícitamente aprobada y debería cumplir, por tanto, lo dispuesto en el CAPÍTULO III del RD 1015/2009 «Acceso a medicamentos en condiciones diferentes a las autorizadas», que en su Artículo 13 «Requisitos para el acceso a medicamentos en condiciones diferentes a las autorizadas en España» expresa que «la utilización de medicamentos autorizados en condiciones diferentes a las establecidas en su ficha técnica, tendrá carácter excepcional y se limitará a las situaciones en las que se carezca de alternativas terapéuticas autorizadas para un determinado paciente, respetando en su caso las restricciones que se hayan establecido ligadas a la prescripción y/o dispensación del medicamento y el protocolo terapéutico asistencial del centro sanitario. El médico responsable del tratamiento deberá justificar convenientemente en la historia clínica la necesidad del uso del medicamento e informar al paciente de los posibles beneficios y los riesgos potenciales, obteniendo su consentimiento conforme a la Ley 41/2002, de 14 de noviembre». La Agencia Española del Medicamento y Productos Sanitarios (AEMPS) dictamina que, si bien la utilización de medicamentos ya autorizados en condiciones diferentes a las establecidas en su ficha técnica no es objeto de autorización caso por caso por parte de la AEMPS, ésta podrá dictar recomendaciones que habrán de ser tenidas en cuenta en la elaboración de los protocolos terapéutico-asistenciales de los centros sanitarios31.
Dosis. En el análisis de los estudios revisados para la elaboración del DS 20136, se objetivó una gran variedad y variabilidad de pautas y dosis de ATX, siendo las dosis más frecuentemente utilizadas las siguientes:
- •
PTR y PTC: una dosis inicial de 10-15mg/kg perioperatoriamente, seguida o no de la infusión de 1mg/kg/h durante 4-6h o de la repetición de la dosis inicial en el postoperatorio. No obstante, algunos autores aconsejan dosis intravenosas fijas de 1 a 2g de ATX, para evitar errores de cálculo y dosis excesivas32.
- •
Columna: una dosis inicial de 20-100mg/kg, seguida de la infusión de 10mg/kg/h durante 4-6h.
Seguridad y efectos secundarios. La eficacia y muy bajo costo del ATX (1000mg=1 €) aparecen como los principales impulsores del uso progresivamente creciente en PTR y PTC, a pesar de que cirugía ortopédica no está nominalmente incluida dentro de las indicaciones específicas de ATX en la ficha técnica revisada del producto30. A ello hay que sumarle la influencia de los resultados del estudio CRASH-2 en más de 20.000 pacientes con traumatismo sangrante, en el que se constató una disminución de la mortalidad por sangrado (4,9 frente a 5,7%; p= 0,0077), sin aumentar los episodios tromboembólicos (0,3 frente a 0,5%; p=0,096), pero sin reducir los requerimientos de TSA33. El gran impacto de esta publicación ha llevado a que muchos profesionales consideren que el uso de ATX en el paciente con coagulopatía precoz con hiperfibrinolisis secundaria asociada a traumatismo sangrante es aplicable al paciente de cirugía ortopédica electiva, cuyo contexto clínico es muy distinto34.
Por tanto, la administración de ATX en pacientes de cirugía ortopédica genera incertidumbre respecto a su seguridad y, antes de su uso, se deben considerar los factores de riesgo de enfermedad tromboembólica. Según la ficha técnica30, en pacientes con antecedentes familiares o personales de enfermedades tromboembólicas, el ATX se debe administrar solamente si hay una clara indicación, después de consultar a un médico con experiencia en hemostasia y bajo estricta supervisión. Igualmente, el ATX se debe administrar con precaución en pacientes que reciben anticonceptivos orales o tratamiento hormonal sustitutorio, sobre todo estrógenos, debido al riesgo aumentado de trombosis, y ajustar la dosis de acuerdo con el nivel de creatinina sérica en la insuficiencia renal leve a moderada (frecuente en los pacientes de COT ancianos). Finalmente, recordar que su uso está contraindicado en casos de insuficiencia renal grave (riesgo de acumulación); y antecedentes de convulsiones.
En cuanto a efectos adversos, se han notificado casos de convulsiones en asociación con el tratamiento con ATX, con una clara relación con la dosis administrada, como se ha documentado en cirugía cardíaca32.
Además, es bien conocido que, tanto la cirugía como la TSA son factores de riesgo de hipercoagulabilidad. Como el ATX reduce significativamente la tasa de TSA, debería esperarse una reducción de eventos trombóticos. Dicha reducción no ha sido demostrada, ni los estudios realizados tienen potencia estadística suficiente para ello. Con estos datos se podría formular la hipótesis de que la administración de ATX en PTR y PTC aumentaría el riesgo de complicaciones trombóticas, como se ha observado en fractura de cadera35, siendo este aumento del riesgo compensado por el beneficio que confiere la reducción de la TSA34.
Recomendaciones basadas en la evidencia. En diversos estudios aleatorizados, se ha encontrado que el ATX reduce el sangrado y el número de TSA en estos pacientes, aunque de forma variable, sin aumento aparente de la incidencia de eventos trombóticos o mortalidad32,35. Sin embargo, dado que el número de pacientes incluidos es insuficiente para valorar efectos adversos de baja incidencia, existen dudas sobre la seguridad de TXA en cirugía de columna y en artroplastia de miembro inferior, pero sobre todo en cirugía de fractura de cadera36. Su administración por vía tópica podría ser más segura aunque se precisan estudios que lo confirmen, ya que no hay estudios fármaco-cinéticos que muestren las concentraciones plasmáticas en sangre cuando se administra por esta vía, y aun así seguiría siendo una indicación no aprobada30.
De acuerdo con la Guía ESA, no se puede recomendar su uso generalizado, debiendo realizarse una indicación individualizada después de descartar la presencia de factores de riesgo (edad avanzada, sexo femenino, antecedentes de trombosis, fractura de cadera, cáncer, etc.) (GRADE 2A)7. De hecho, el 20-30% de los pacientes de COT presentan alguna contraindicación para el uso de ATX37. Por ello, tanto el DS 2013 como la Guía ESA solo «sugieren» su utilización en casos seleccionados de cirugía ortopédica para disminuir el sangrado y/o la tasa transfusional (GRADE 2A) (tabla 3), señalando que se necesitan más estudios de seguridad antes de establecer una recomendación definitiva de estos fármacos, mientras que no lo recomiendan en fractura de cadera6,7.
- –
Selladores y geles de fibrina
Se dispone de un grupo de agentes hemostáticos locales, autólogos o comerciales, que en algunos casos pueden ayudar a reducir el sangrado en el acto operatorio. En lo que se refiere a la eficacia y seguridad en el ámbito de la COT programada, en un reciente meta-análisis de 8 estudios aleatorizados y controlados incluyendo 641 pacientes de PTR, el uso del sellador de fibrina redujo significativamente el volumen de drenaje postoperatorio (–350mL), la tasa de TSA (RR=0,47, IC95%=0,35–0,63) y mejoró el rango de movilidad, pero no redujo significativamente la pérdida total de sangre, y no se encontraron diferencias significativas en la incidencia de fiebre, infección o hematoma entre los grupos de estudio38. Estos resultados parecen indicar que el uso del sellador de fibrina, como terapia hemostática en pacientes de cirugía protésica, es efectivo y seguro, aunque se necesitan más datos para hacer una recomendación firme sobre su uso (tabla 3).
No obstante, en los últimos años hemos asistido a un progresivo aumento del uso de plasma autólogo rico en plaquetas (PARP), no solo como base para la preparación de selladores de fibrina sino también en otras múltiples aplicaciones en COT y otras especialidades. A este respecto, la AEMPS ha elaborado un informe en el que resuelve clasificar al PARP como medicamento de uso humano y recoge el marco de su uso autólogo en España, incluyendo la normativa sobre su prescripción, que ésta reservada sólo a médicos, odontólogos y podólogos, únicos y principales responsables de la correcta obtención (en el caso de la obtención del PARP con técnica abierta), aplicación y seguimiento de este medicamento39.
Drenajes postoperatoriosEl uso de sistemas de drenaje posoperatorio es práctica común en artroplastia del miembro inferior, especialmente en PTR. La ventaja teórica de la utilización de estos drenajes es una reducción de la aparición de hematomas (relacionados con aumento del dolor, alteración de la cicatrización e infecciones postoperatorias) y de compresión de estructuras vitales, ya que ambos pueden prolongar la hospitalización y retrasar la rehabilitación.
Sin embargo, existen dudas acerca de si son eficaces en el logro de estos objetivos40, o sobre si se deben utilizar drenajes de alto o bajo vacío41,42. Por ello, podría postularse que si se van a utilizar drenajes postoperatorios, un sistema de recuperación/re-infusion de bajo vacío puede ser beneficioso para el paciente en caso de drenar un volumen significativo de sangre.
Uso de sangre autólogaBajo este epígrafe se incluye la donación preoperatoria de sangre autóloga (DPSA), la hemodilución aguda normovolémica (HAN) y la recuperación perioperatoria de sangre autóloga (RSA).
- -
Donación preoperatoria de sangre autóloga
La DPSA es una modalidad de autotransfusión que consiste en la extracción, en los días o semanas previos a la intervención, de una o varias unidades de la propia sangre del paciente, para ser utilizadas durante la misma y/o en el postoperatorio inmediato. En pacientes adultos sometidos a cirugía ortopédica mayor (rodilla, cadera o columna), la DPSA ha sido ampliamente utilizada y ha demostrado reducir hasta un 20% el riesgo absoluto de TSA, aunque el 40% de las unidades depositadas no fueron utilizadas. En la actualidad, la DPSA estaría indicada en pacientes sometidos a procedimientos ortopédicos electivos en los que el riesgo de transfusión sea superior al 30-50% y cuya Hb es generalmente <14,5g/dL y/o en pacientes con dificultad para encontrar sangre alogénica compatible o que se niegan a recibir TSA. Por ello, el DS 2013 no recomienda el uso rutinario de DPSA para reducir la tasa transfusional, en procedimientos de COT que requieran generalmente ≤2 unidades de TSA (GRADE -1B) (tabla 3)6. En cambio si la recomienda en aquellos que puedan requerir ≥3 unidades (eg, recambio de prótesis de cadera o instrumentación espinal extensa), preferentemente con tratamiento coadyuvante con hierro y/o rHuEPO (GRADE 1C) (tabla 3)6,7,43. Además, la DPSA sólo debería implementarse en aquellos pacientes en los que la fecha de la intervención esté garantizada, para evitar la caducidad de las unidades6.
- -
Hemodilución aguda normovolémica
La HAN consiste en la extracción y anticoagulación de un volumen determinado de sangre y su sustitución simultánea por cristaloides y/o coloides para mantener normovolemia. Se utiliza en intervenciones de COT con hemorragia moderada-grave y habitualmente se realiza después de la inducción a la anestesia y antes de la fase hemorrágica de la cirugía.
La mayoría de los estudios no muestran una reducción significativa del riesgo de exposición a TSA, aunque el uso de HAN se asoció con una disminución del riesgo de infección postoperatoria y eventos trombóticos en COT44. Por tanto, a pesar de su bajo coste, el DS 2013 no recomienda el uso rutinario de la HAN, como técnica única de ahorro de sangre (GRADE -1B) (tabla 3), salvo en aquellos centros donde no puedan implementarse otras alternativas a la TSA6.
- -
Recuperación perioperatoria de sangre autóloga
La RSA es una técnica de autotransfusión que, al retornar al paciente parte de la sangre que pierde durante y/o después de la intervención, reduce el porcentaje de pacientes que reciben TSA y/o el volumen de la misma en diversos procedimientos quirúrgicos electivos o urgentes en los que se produce un sangrado significativo. En el periodo intraoperatorio, la RSA se realiza utilizando dispositivos que aspiran, anti-coagulan, lavan y concentran la sangre vertida en el campo quirúrgico, retornándola al paciente en forma de concentrado de hematíes en suero salino. En el periodo postoperatorio, la RSA consiste en recolección y reinfusión de la sangre procedente de los drenajes postoperatorios. Cuando no se efectúa recuperación intra-operatoria, la recuperación postoperatoria se realiza habitualmente con dispositivos que recuperan y reinfunden sangre total filtrada y no lavada.
En COT, la RSA intraoperatoria o perioperatoria estaría indicada en procedimientos en los que se prevé una sangrado mayor de 1.500mL: revisión de artroplastia de cadera (GRADE 1B), y corrección de escoliosis, dentro de un programa multidisciplinar (GRADE 1C), mientras que su uso en cirugía tumoral es controvertido (GRADE 2C) (tabla 3)6. Por su parte, la RSA postoperatoria, con reinfusión de sangre filtrada, no lavada, está restringida a pacientes de COT programada en la que se espera un sangrado postoperatorio entre 500 y 1.500mL, como en la artroplastia de rodilla o cadera (GRADE 1B) o en la artrodesis de columna (GRADE 1C) (tabla 3)6,45–47. En estas cirugías, la RSA postoperatoria representa una técnica única para reducir la pérdida sanguínea, mantener niveles altos de Hb y disminuir el uso de TSA. En cambio, no se recomienda en cirugía reparadora de fractura de cadera (por carecer de utilidad)6.
Seguridad de la RSA. En lo que respecta a la seguridad de la RSA postoperatoria, a pesar de estos buenos resultados clínicos, la reinfusión de sangre de drenaje no lavada en COT aún está rodeada de cierta controversia, tanto en cuanto a su calidad y seguridad (calidad hematimétrica, hemoglobina libre, partículas de grasa y cemento, factores de coagulación y fibrinolisis activados, mediadores inflamatorios, etc) como a su eficacia en distintos grupos de pacientes48. Sin embargo, los resultados de numerosos estudios parecen apoyar la idea de que la RSA postoperatoria con sangre no lavada es segura, y existen además datos que apuntan hacia un efecto inmuno-estimulador48. En este sentido, en una evaluación de 2190 reinfusiones tras PTR o PTC electivas en 31 hospitales holandeses solo se registró un 1% de efectos adversos significativos (reacción vagal, hipotensión, fiebre o escalofríos); incidencia inferior a la publicada para la TSA49.
Estos datos concuerdan con los resultados de distintos estudios clínicos aleatorizados y observacionales en distintos tipos de cirugía en los que la RSA intra y/o postoperatoria no aumenta la morbi-mortalidad ni la duración de la estancia hospitalaria, aunque se han descrito algunos casos aislados de efectos adversos, especialmente coagulopatía, cuando se reinfunden grandes volúmenes de sangre recuperada y procesada6.
Otro aspecto a reseñar es la posible interacción de la analgesia mediante infiltración local (LIA) y la recuperación postoperatoria de sangre; dos técnicas importantes en el tratamiento postoperatorio de los pacientes de COT. Aunque la combinación de estas técnicas ha sido cuestionada recientemente, en 6 estudios de pacientes PTR o PTC con LIA (200–490mg de ropivacaína), la reinfusión de la sangre del drenaje no produjo síntomas de toxicidad neurológica por el anestésico local en ningún paciente50. En un trabajo más reciente en pacientes PTR en los que se administró ropivacaina peri-articular (567mg) más infusión continua intra-articular y sub-fascial (192mg/24h), Thomassen et al.51 determinaron las concentraciones de ropivacaína, tanto libre como unida a α1-glicoproteína, en la sangre recuperada del drenaje y realizaron una estimación del posible efecto de su reinfusión sobre los niveles plasmáticos del paciente. El volumen recuperado fue de 600mL (303–869), con una concentración de ropivacaina de 33mg/L18–42, siendo la fracción libre del 70%. De acuerdo con estos datos, las concentraciones de ropivacaína libre tras la reinfusión serían de 0,18mg/L (0,08–0,40mg/L); concentraciones que estarían por debajo del umbral de toxicidad sistémica de este fármaco (0,56mg/L [0,34–0,85])52. Por tanto, los datos disponibles muestran que la RSA postoperatoria con sangre filtrada puede combinarse de forma segura con el uso de LIA, realizando una reinfusión lenta durante 30–60 minutos o más.
Contraindicaciones. En general, las contraindicaciones de la utilización de sangre recuperada perioperatoriamente vienen determinadas, de una parte, por las características de esta sangre y, de otra, por las condiciones particulares del paciente. Entre ellas destacaríamos: insuficiencia renal, función hepática alterada, trastornos de la coagulación, pacientes con alteraciones de la serie roja, uso de agentes hemostáticos locales, irrigación del campo con soluciones inadecuadas, pacientes seropositivos HIV, Hepatitis B y C, negativa del paciente a aceptar la técnica, falta de experiencia del equipo quirúrgico, el anestesiólogo o el personal de enfermería en la utilización de la técnica, patología séptica o neoplásica48. Por otra parte, dadas las características hematológicas y bioquímicas de la sangre recuperada no lavada no se recomienda reinfundir un volumen superior a 1.000-1.500mL48.
Práctica clínica diaria. Desde este punto de vista, podríamos decir que la RSA postoperatoria con sangre filtrada ofrece los siguientes beneficios:
- 1.
No interfiere con el procedimiento quirúrgico estándar.
- 2.
No requiere de aparataje, software, o fuentes de alimentación o vacío; el pack suele contener todo lo necesario para la recolección y reinfusión de la sangre drenada.
- 3.
Es fácil de usar por el cirujano y el personal de enfermería, con unas necesidades mínimas de formación para su manejo.
- 4.
Es aceptada por los pacientes (incluyendo a los Testigos de Jehová, añadiendo una línea de continuidad entre el drenaje y el paciente).
- 5.
Proporciona sangre compatible de forma inmediata y casi en la misma cantidad que se recoge por los drenajes (aprox. 1 unidad/paciente), sin los inconvenientes de la sangre alogénica.
- 6.
Posee una concentración de Hb similar a la del paciente; aunque, a diferencia de la sangre almacenada, posee una capacidad de oxigenación óptima.
- 7.
Es clínicamente segura y ahorra unidades de hematíes alogénicos.
- 8.
Finalmente y no menos importante, su uso es compatible con casi cualquier otra estrategia de ahorro de sangre.
Coste efectividad de la RSA. A este respecto, aunque los estudios de coste-efectividad son escasos y realizados con metodologías muy distintas, en general, se acepta que el procedimiento sería coste-efectivo si se puede recuperar al menos el equivalente a 1,5-2 unidades de concentrado de hematíes en RSA lavada, o el equivalente a 1 concentrado de hematíes en RSA filtrada (tabla 4)6,53.
ConclusionesLa revisión de la eficacia de los métodos de optimización del empleo de hemoderivados (hierro perioperatorio, agentes estimuladores de la eritropoyesis, predonación, recuperación perioperatoria de sangre autóloga, antifibrinolíticos, etc.) muestra que su uso se traduce en una tendencia generalizada hacia la mejora de los resultados clínicos (menor incidencia de TSA, complicaciones postoperatorias y mortalidad, menor duración de la estancia hospitalaria o mejora de la calidad de vida)54. No obstante, la evidencia científica disponible procede de estudios muy heterogéneos respecto de su diseño y calidad, lo que influye significativamente en la fortaleza de las recomendaciones sobre el uso de estas estrategias recogidas en diferentes documentos de consenso y guías de práctica clínica (tabla 3)6,7. Además, dicha evidencia procede mayoritariamente de estudios en los que se evalúa la eficacia y/o seguridad de una estrategia concreta (junto a la aplicación de criterios restrictivos de transfusión en los más recientes). Finalmente, debe tenerse en cuenta que, aunque una técnica determinada pueda ser eficaz, el objetivo de realizar procedimientos quirúrgicos mayores, sin el uso de TSA y sin exponer al paciente al riesgo de complicaciones, puede ser más fácilmente alcanzado mediante la integración de varias de estas estrategias dentro un algoritmo definido.
Por ello, la introducción del concepto de PBM supone un cambio de paradigma. El enfoque del PBM es multidisciplinar y multimodal y se centra en la identificación y provisión de los cuidados necesarios para la continuidad asistencial de los pacientes, donde la comunicación y coordinación entre las diferentes disciplinas pueden no solo reducir la probabilidad de que un paciente requiera TSA, sino también mejorar su resultado clínico y reducir los costes de tratamiento55.
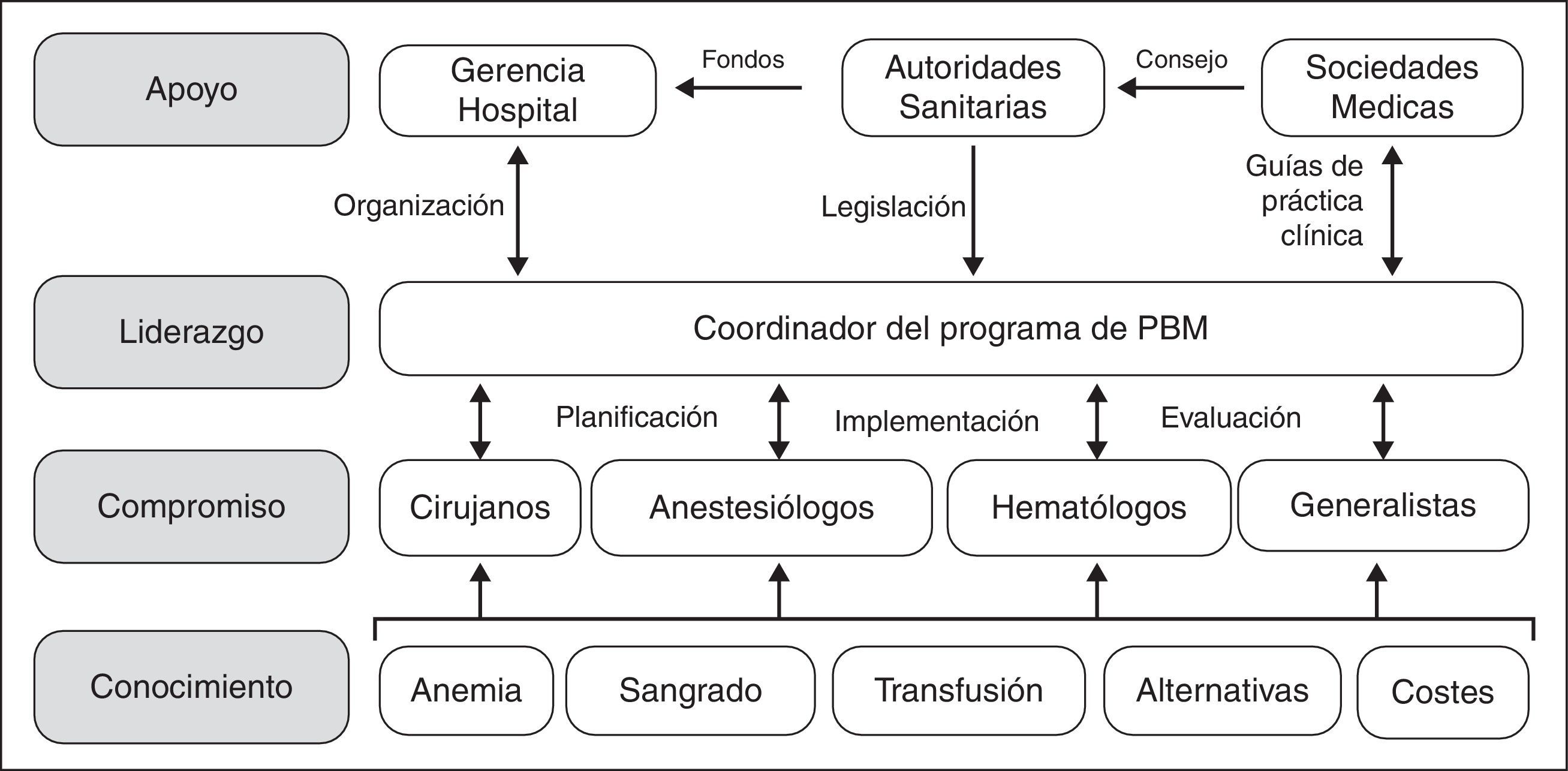
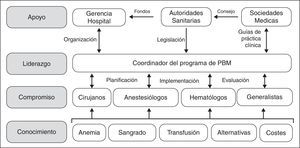
Sin embargo, aunque los beneficios de los programa de PBM, tanto para el paciente como para el sistema de salud, parecen indiscutibles, su implementación no es sencilla, ya que hay que superar varios obstáculos. El desarrollo e implementación de programas de PBM conlleva planificación y previsión; no van a ocurrir espontáneamente solo por desearlo o por simple evolución porque, sencillamente, es demasiado fácil pedir una unidad de concentrado de hematíes al banco de sangre. Como se muestra en la figura 1, hay que transmitir conocimientos específicos a los profesionales involucrados, con el fin de obtener su compromiso con el programa. Para ejecutar el programa PBM, es necesario el liderazgo de un Coordinador, que tiene además que interactuar con médicos y enfermeros para su planificación, implementación y auditoría. Además, el Coordinador va a necesitar el apoyo de la dirección/gerencia de hospital (facilitando los aspectos organizativos), de las autoridades sanitarias (proporcionando la financiación necesaria para su puesta en marcha, aunque al cabo del tiempo el PBM produzca un ahorro significativo, y un marco regulador de estas actividades) y de las sociedades científicas del área de cuidados de la salud (ofreciendo asesoramiento a las autoridades de salud y desarrollando guías de práctica clínica).
Nivel de evidenciaNivel de evidencia V.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo no tiene fuentes de financiación.
Conflictos de interesesLos autores declaran que no tienen conflictos de intereses.