La infección por Clostridium difficile es la causa más frecuente de diarrea nosocomial y presenta un incremento en su incidencia con la edad. Las manifestaciones clínicas, la tasa de resistencia, el riesgo de recurrencia y la respuesta a los diferentes tratamientos es diferente en la población adulta joven comparado con la población mayor.
El objetivo de esta revisión es actualizar la epidemiología, patogenia, diagnóstico, tratamiento y prevención de la infección por C. difficile en este grupo de edad, con la evidencia que hay hasta el momento actual.
Clostridium difficile infection is the most common cause of health care-associated diarrhoea, and its incidence increases with age. Clinical challenges, risk of resistance to treatment, risk of recurrence, and treatment responses are different in elderly.
The aim of this review is to discuss the updated epidemiology, pathophysiology, diagnosis, and therapeutic management of C. difficile infection in elderly with the available data.
La infección por Clostridium difficile (ICD) es la principal causa de diarrea infecciosa asociada a cuidados sanitarios en países desarrollados, habiéndose convertido también en una causa de diarrea adquirida en la comunidad y fundamentalmente en el medio residencial1. Está asociada a una alta morbimortalidad y elevados costes sanitarios2. La clínica puede variar desde una diarrea leve hasta una colitis fulminante que puede comprometer la vida del paciente. El manejo adecuado de esta infección debe basarse en un reconocimiento precoz con un alto grado de sospecha clínica, una solicitud temprana de pruebas diagnósticas excluyendo otras causas de diarrea, un tratamiento de acuerdo a la gravedad clínica y riesgo de recurrencia, así como en la aplicación de las medidas preventivas que eviten la diseminación de la infección.
EpidemiologíaEl Clostridium difficile (CD) es un bacilo grampositivo, anaerobio estricto, formador de esporas, presente en la microbiota intestinal y capaz de, en determinadas circunstancias, proliferar y producir toxinas.
Recientemente, se ha discutido la posible reclasificación del CD desde el punto de vista filogenético redenominándolo Clostridioides difficile (tal como figura en algunos artículos). Pero en principio es la revista Journal of Systematic and Evolutionary Microbiology la que tiene que publicar la confirmación del cambio taxonómico y a fecha de hoy no se ha hecho3,4.
En España se producen unos 7.600casos/año, con una incidencia de 17,1 episodios/año/10.000 altas hospitalarias. El coste anual para el Sistema Nacional de Salud está en 32.157.093euros. El coste estimado de la primoinfección es de 3.901euros, el de la primera recurrencia de 4.875euros y el de la segunda recurrencia de unos 5.916euros. El 95,6% del gasto sanitario es secundario a la estancia hospitalaria prolongada, el 0,5% es por el tratamiento antibiótico, el 2,8% por la cirugía y el 1,1% por medidas preventivas de control de la infección5,6.
En mayores de 65 años se ha encontrado una prevalencia de portadores asintomáticos de CD entre el 2% y el 10% en la comunidad, y entre un 3% y un 21% en pacientes ingresados en un hospital de agudos, porcentaje que aumenta con la prolongación de la estancia hospitalaria7. En el ámbito residencial se han objetivado cifras similares a las de los enfermos hospitalizados (20%)7 e incluso en algún estudio hasta el 50% de los residentes eran portadores asintomáticos8–10. La toma previa de antibióticos también aumenta el riesgo de colonización por CD. Este alto porcentaje de individuos portadores de CD implica que probablemente en ocasiones se traten como ICD pacientes que están solo colonizados por CD pero que tienen diarrea por otra causa (diarrea por fármacos, por virus, empleo de laxantes…)11.
Por otro lado, se ha descrito que los casos de ICD en un hospital terciario se han debido hasta en un 29% a transmisión a partir de portadores asintomáticos de formas toxigénicas de CD12.
La característica que favorece la transmisión y la persistencia en el ambiente del CD es su capacidad de formar esporas. El ácido gástrico puede eliminar las formas vegetativas pero no sus esporas, de ahí que sea posteriormente en el intestino delgado donde van a germinar por la acción de las sales biliares9. Finalmente, en el colon, en un ambiente anaerobio, pueden proliferar y producir sus toxinas, especialmente en el caso de presentar una microbiota alterada, por ejemplo por la toma previa de antibióticos.
Entre los diferentes ribotipos del CD, los más frecuentes en España son: 078/126 (16%), 014/020 (13%), 001/072 (12%), mientras que solo un 3% son cepas pertenecientes al ribotipo 027. Este último es, en cambio, el más frecuente en el norte de Europa y en Estados Unidos, destacando por su gran virulencia (40% de los casos da cuadros clínicos graves y asocia una mortalidad del 6%). El ribotipo 027 presenta un riesgo de recurrencia del 40%, tiene más capacidad de transmitirse por tener una toxina binaria, un mayor porcentaje de esporas y liberación de toxina. Es el tipo que asocia más costes13.
Las cepas toxigénicas de CD tienen un locus de patogenicidad formado por 5 genes (tcdA, tcdB, tcdC, tcdE, tcdR). Los genes tcdA y tcdB codifican las toxinas A y B, respectivamente. El gen tcdR actúa como liberador de la expresión de tcdA y tcdB, y el gen tcdC como inhibidor. El ribotipo 027 presenta una mutación en el gen tcdC y es por esto que presenta mayor liberación de toxinas. El quinto gen, tcdE, codifica una proteína (holina) que se encarga de romper la membrana citoplasmática para que se produzca la liberación de las toxinas, de tal forma que la ausencia de este gen da lugar a cepas toxigénicas pero que, al no poder liberarse al exterior estas toxinas, no producen ICD13.
Factores de riesgo de infección por Clostridium difficileFactores de riesgoEl envejecimiento está relacionado con un mayor riesgo de padecer ICD, debido a la inmunosenescencia, alteraciones en la microbiota intestinal, reducción de la acidez gástrica con la edad14, mayor prescripción de inhibidores de la bomba de protones (IBP); pero fundamentalmente por ser un grupo con mayor toma de antibióticos y riesgo de contactar con esporas por hospitalización o institucionalización1,15. En individuos mayores se observa, en situación basal, una distinta población bacteriana en el intestino con respecto a los individuos jóvenes, con una menor capacidad inhibitoria del crecimiento de CD16.
El factor de riesgo más frecuentemente implicado en el desarrollo de la ICD es la administración de antibióticos. La toma previa de antibióticos aumenta entre 7 y 10 veces el riesgo de ICD el primer mes, y 3 veces al segundo mes de la toma; pero el riesgo se mantiene aumentado hasta el tercer mes e incluso más allá17. Los principales antibióticos relacionados con la ICD son la clindamicina18–20; las fluorquinolonas, aunque en este caso la cepa relacionada (NAP1/BI/027) tiene una baja prevalencia en España21,22; las cefalosporinas de tercera o cuarta generación; las penicilinas de amplio espectro y los carbapenémicos23–27. Por otra parte, la ICD también se ha relacionado con el tiempo de tratamiento antibiótico y la estancia hospitalaria.
La relación de la toma de IBP y los bloqueantes de los receptores H2 con la ICD es algo controvertido en distintos estudios28,29, aunque se suele recomendar la suspensión de estos, salvo que esté especialmente indicado su mantenimiento.
Otros factores de riesgo asociados a la ICD son la sepsis previa, el ingreso hospitalario no programado, la estancia en centros sociosanitarios, la diverticulitis, la neumonía previa, la quimioterapia, o la infección por el virus de la inmunodeficiencia humana15,30,31.
Finalmente, es reseñable la existencia de 2 trabajos publicados que incluyeron pacientes con una edad media de 62 y 75 años, en donde los niveles bajos de vitamina D se asociaron a un mayor riesgo de diarrea por CD en la comunidad32 y un mayor riesgo de recurrencia33.
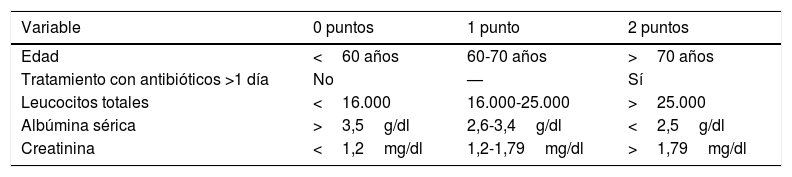
Factores predictores de respuesta al tratamientoSe han analizado qué factores pueden predecir una buena respuesta al tratamiento o qué parámetros se asocian a mayor riesgo de recurrencia34,35. En el trabajo de Bauer et al.34 se observó que, al diagnóstico, la leucocitosis y la insuficiencia renal se unían a un mayor riesgo de fracaso terapéutico. En la publicación de Miller et al.35 se diseñó un sistema de puntuación (ATLAS) que, en el momento del diagnóstico, era capaz de predecir la respuesta al tratamiento (tabla 1).
Sistema de puntuación ATLAS predictor de respuesta al tratamiento
| Variable | 0 puntos | 1 punto | 2 puntos |
|---|---|---|---|
| Edad | <60 años | 60-70 años | >70 años |
| Tratamiento con antibióticos >1 día | No | — | Sí |
| Leucocitos totales | <16.000 | 16.000-25.000 | >25.000 |
| Albúmina sérica | >3,5g/dl | 2,6-3,4g/dl | <2,5g/dl |
| Creatinina | <1,2mg/dl | 1,2-1,79mg/dl | >1,79mg/dl |
Fuente: Miller et al.35.
El índice de masa corporal menor de 17 en la ICD asocia mayor riesgo de mortalidad en la población general36.
Factores de riesgo de recurrenciaLos factores de riesgo de recurrencia de ICD son la edad avanzada, la toma de antibióticos durante el tratamiento de la ICD, la toma de IBP, la fragilidad37, la insuficiencia renal y la infección por el ribotipo 027, 078 o 24431,34,38–42.
Se ha observado que la elevación de anticuerpos antitoxina es mayor en gente sana, pero en cambio disminuye con la edad. Los pacientes con ICD que elevan el título de anticuerpos antitoxina con la resolución de la diarrea tienen menor riesgo de recurrencia43.
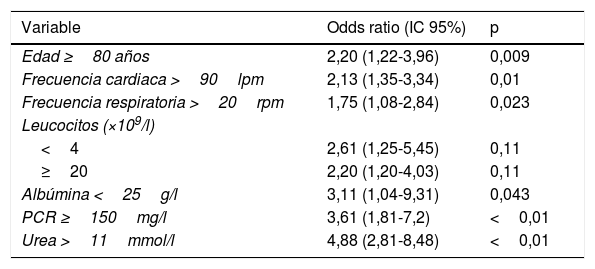
Factores predictores de gravedadLos factores predictores de mayor gravedad de la ICD son la edad mayor de 65 años, la leucocitosis (>15×109/mm), la insuficiencia renal (elevación mayor del 50% de la creatinina respecto de la basal), albúmina<30g/l y una comorbilidad relevante (enfermedad crónica grave o inmunodeficiencia) al diagnóstico de la ICD (tabla 2), así como el ribotipo 027 o 07844–46.
Factores de riesgo de ICD grave
| Variable | Odds ratio (IC 95%) | p |
|---|---|---|
| Edad ≥80 años | 2,20 (1,22-3,96) | 0,009 |
| Frecuencia cardiaca >90lpm | 2,13 (1,35-3,34) | 0,01 |
| Frecuencia respiratoria >20rpm | 1,75 (1,08-2,84) | 0,023 |
| Leucocitos (×109/l) | ||
| <4 | 2,61 (1,25-5,45) | 0,11 |
| ≥20 | 2,20 (1,20-4,03) | 0,11 |
| Albúmina <25g/l | 3,11 (1,04-9,31) | 0,043 |
| PCR ≥150mg/l | 3,61 (1,81-7,2) | <0,01 |
| Urea >11mmol/l | 4,88 (2,81-8,48) | <0,01 |
IC: intervalo de confianza; ICD: infección por Clostridium difficile; PCR: reacción en cadena de la polimerasa.
Fuente: Abou Chakra et al.46.
Faltan estudios sobre la influencia de la fragilidad en pacientes con ICD en el riesgo de su desarrollo, en su respuesta al tratamiento, en el riesgo de recurrencia y en el pronóstico.
ClínicaLa presentación típica es en forma de diarrea que puede ser desde una forma leve hasta una grave con hipotensión y shock. En general, se considerará su diagnóstico si se presentan 3 o más deposiciones blandas diarias, excepto en un pequeño porcentaje de casos en que se puede presentar en forma de íleo. En los casos que se manifiesta como un íleo el pronóstico es peor, puesto que tiene más riesgo de complicaciones como son la hipotensión, el megacolon tóxico o la perforación. También pueden aparecer náuseas, vómitos y presentar asociada fiebre, o más frecuentemente febrícula, y dolor abdominal tipo cólico. La incontinencia, el deterioro funcional y el delirium son otros síntomas presentes con frecuencia en enfermos mayores1.
La presencia de sangre oculta en heces en la ICD es frecuente; en cambio, la aparición de hematoquecia, rectorragia o melena franca obliga a descartar otra causa de la diarrea1,47. La diarrea tras laxantes sin tratamiento antibiótico previo tendría que hacernos sospechar que estamos ante un portador asintomático de CD si las pruebas diagnósticas son positivas30,47.
La leucocitosis es un hallazgo de laboratorio frecuente que en ocasiones precede a la diarrea. De hecho, una leucocitosis mayor de 20.000 sin otra clínica asociada debe hacer pensar en una ICD1.
En los pacientes mayores el riesgo de recurrencia se estima en un 20-30% de las ICD. Las recurrencias asocian mayor estancia hospitalaria, mayor riesgo de complicaciones, de nueva recurrencia y de costes sanitarios1. Los pacientes mantienen el riesgo de recurrencia principalmente los 2 primeros meses48, y esta recurrencia parece relacionarse con la persistencia de esporas de CD en el colon49.
La ICD puede asociarse, aunque de manera infrecuente, a manifestaciones extracolónicas como artritis reactivas (fundamentalmente de rodilla y tobillo), abscesos, infecciones de heridas, osteomielitis, infecciones de prótesis, pleuritis y empiema e infecciones del tracto urogenital50.
DiagnósticoLa ICD debe plantearse en pacientes con clínica compatible, como sería la existencia de diarrea (3 o más deposiciones no formadas con niveles entre 5 y 7 de la escala de Bristol) sin otra causa aparente. Se debe realizar el diagnóstico diferencial con diarrea por fármacos; por ejemplo, antibióticos como el ácido clavulánico y la eritromicina pueden producir diarrea por un aumento del tránsito intestinal de forma directa. Otros antibióticos pueden producir diarrea por disminución de los anaerobios fecales, que condiciona una disminución de la absorción de hidratos de carbono y un descenso del pH fecal51. También se debería sospechar una ICD ante la presencia de íleo paralítico o megacolon (en donde la diarrea no se produce). En presencia de una clínica compatible se confirma el diagnóstico por la detección de toxinas de CD (toxinas A y/o B), la identificación de CD toxigénico o de pseudomembranas en un estudio endoscópico (muy sugestivo aunque no específico). No está indicada la búsqueda de CD en el caso de presentar heces formadas puesto que podríamos encontrarnos ante un portador asintomático30,31.
Entre las técnicas rápidas para la detección de CD están las que determinan la presencia de glutamato deshidrogenasa (GDH), que es una enzima presente en altas concentraciones en estas bacterias. Estas técnicas tienen una alta sensibilidad (88-100%) pero con menor especificidad (76-97%) ya que también detectan cepas no toxigénicas u otras bacterias. Esto obliga al empleo conjunto con otras pruebas más específicas, como la detección de toxinas13,30,31,47.
Para la detección de toxinas A y/o B se pueden emplear técnicas basadas en enzimoinmunoanálisis (sensibilidades entre el 50% y el 80%, con una especificidad por encima del 95%) o técnicas moleculares (reacción en cadena de la polimerasa [PCR]) que detectan el gen formador de la toxina A o B (sensibilidad variable entre el 77% y el 100%, y especificidad por encima del 91%)30,52.
Otros métodos como el ensayo de citotoxicidad, que identifica la toxina B preformada en las heces, o el cultivo toxigénico, en donde se detecta en cultivos de muestras de heces la presencia de CD y su toxina, han sido desplazados por las técnicas previamente descritas, por ser estas últimas más laboriosas y por su demora en tener el resultado, que puede ser de hasta 3 días en el caso del cultivo13,30,53,54.
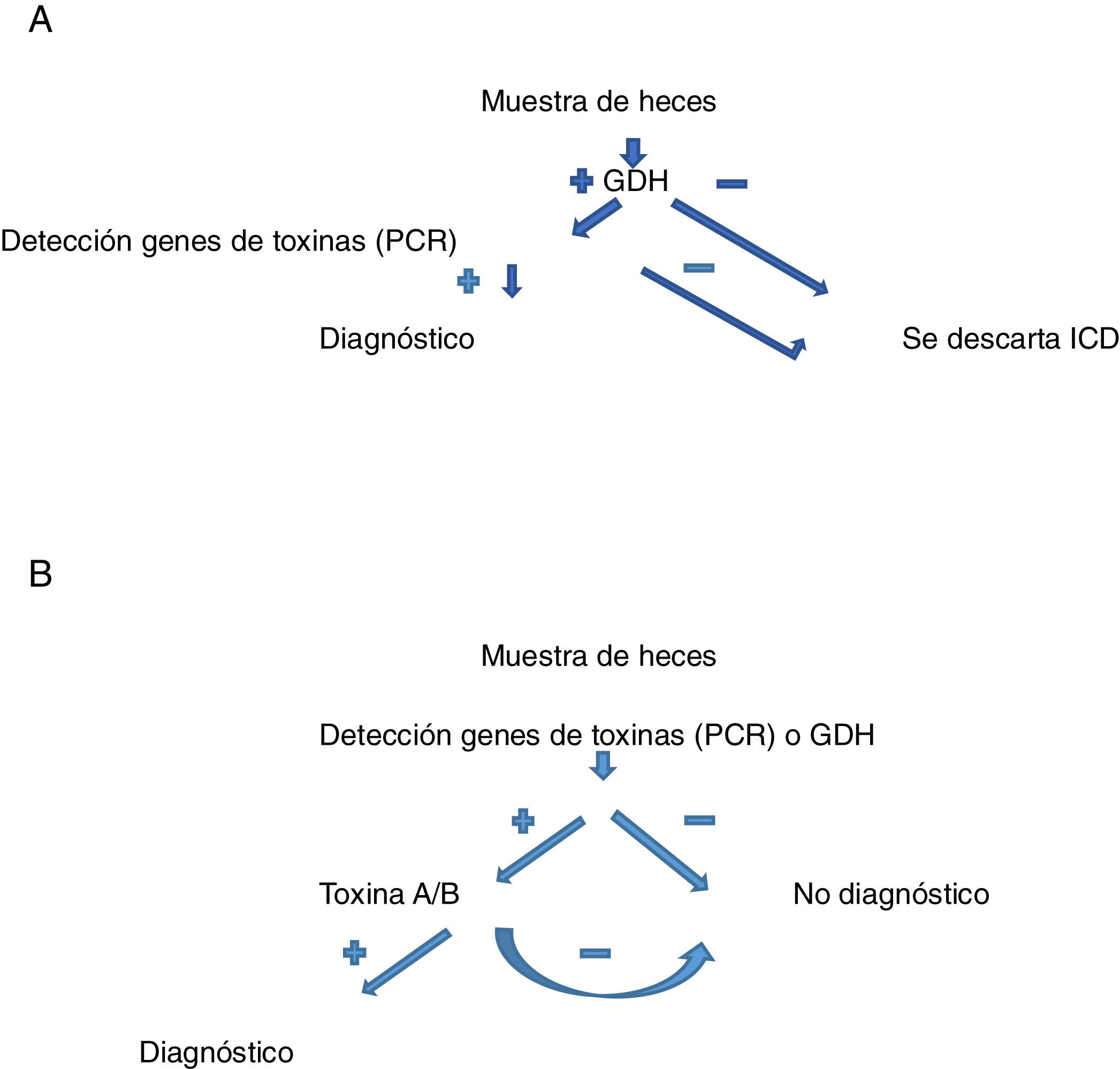
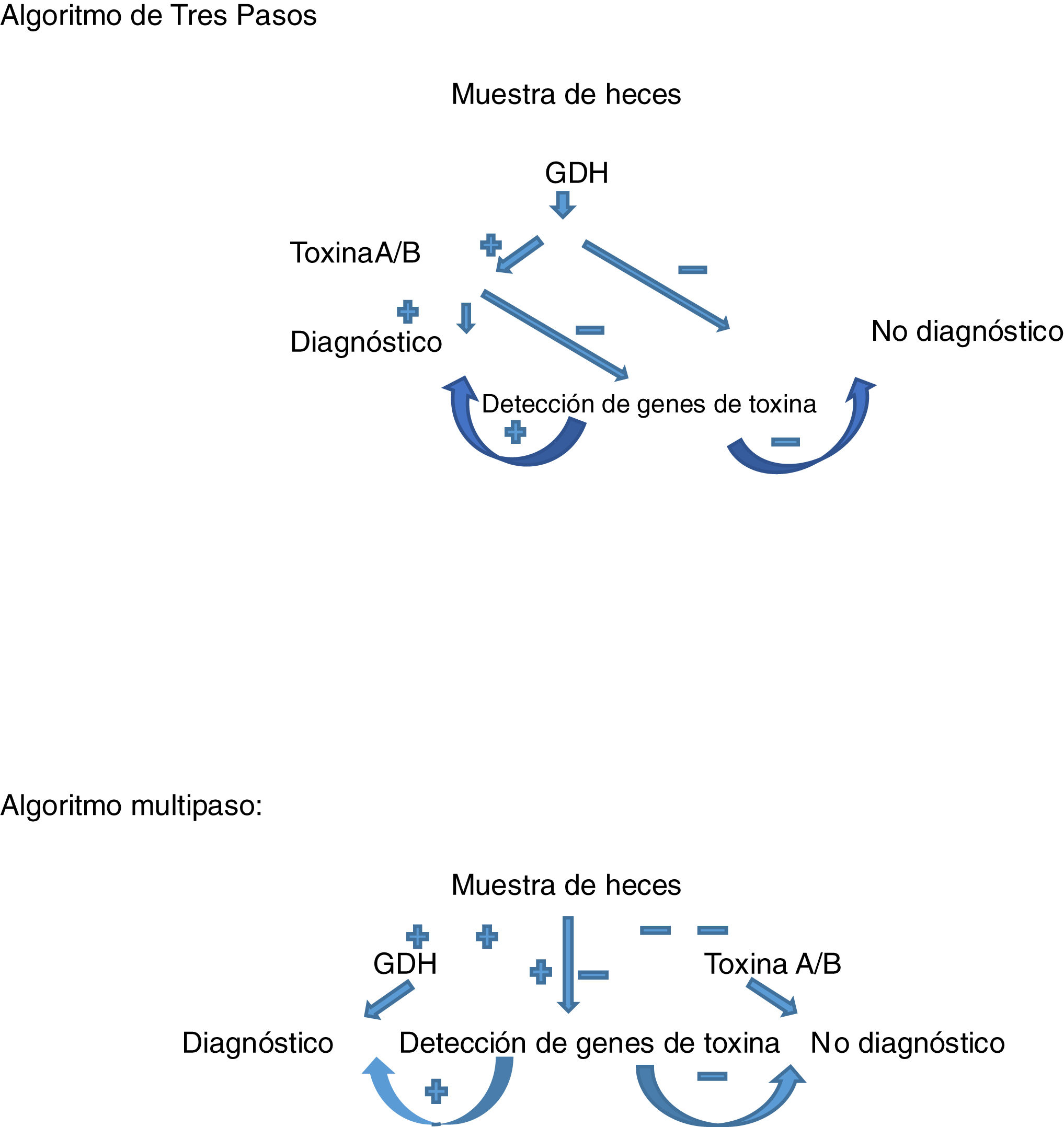
En los últimos años se han desarrollado unos algoritmos diagnósticos basados en la combinación de una prueba rápida, sensible y barata como método de cribado (detección de GDH), seguida de pruebas más específicas que la GDH en caso de ser positiva (detección de toxina A o B, o los genes de estas). Estos algoritmos pueden ser de 2 pasos (GDH-PCR de la toxina), o de 3 pasos, o multipaso, si entre ambas técnicas (GDH y PCR) se intercala la detección de la toxina; dejando el método molecular (PCR de la toxina) para su confirmación en caso de resultados discrepantes con las técnicas previas (figs. 1 y 2). En conjunto poseen valores de sensibilidad y especificidad en torno al 95% o superior13,31,52–55. Aunque hay algoritmos en que se emplea el método molecular (PCR) en una primera aproximación y está recomendado por algunos autores, hay otros autores que lo desaconsejan por su menor especificidad respecto a la determinación de toxinas (aunque mayor que la determinación de GDH) y mayor coste30,53–55.
Algoritmo de 2 pasos: A) en presencia de clínica compatible, tras determinar la positividad o no de GDH. En caso de ser negativa, se excluye el diagnóstico de infección por CD. Si es positiva, se estudian los genes de la toxina de CD (PCR). Si la PCR es negativa, se excluye el diagnóstico. Si es positiva, se confirma el diagnóstico. B) en presencia de clínica compatible, se determina la presencia de GDH y los genes de la toxina de CD (PCR). Si ambos son negativos, se excluye el diagnóstico. Si alguna de estas pruebas es positiva, se determina la presencia de toxinas de CD. Si es positiva, se confirma el diagnóstico. Si es negativa, se excluye.
CD: Clostridium difficile; GDH: glutamato deshidrogenasa; PCR: reacción en cadena de la polimerasa.
Fuente: Alcalá Hernández et al.13.
Algoritmo de 3 pasos: en presencia de clínica compatible, tras determinar la positividad o no de GDH. En caso de ser negativa, se excluye el diagnóstico de infección por CD. Si es positiva, se determina la presencia de toxinas de CD. Si es positiva, se confirma el diagnóstico. Si es negativa, se estudian los genes de la toxina de CD (PCR). Si la PCR es negativa, se excluye el diagnóstico. Si es positiva, se confirma el diagnóstico. Algoritmo multipaso: en presencia de clínica compatible, se determina la presencia de GDH y las toxinas simultáneamente. Si ambas son positivas, se confirma el diagnóstico. Si ambas son negativas, se excluye. Si hay discrepancia entre ambas, se estudian los genes de la toxina (PCR). Si la PCR es positiva, se confirma el diagnóstico. Si es negativa, se excluye.
CD: Clostridium difficile; GDH: glutamato deshidrogenasa; PCR: reacción en cadena de la polimerasa.
Fuente: Alcalá Hernández et al.13.
Un estudio de heces negativo no debería ser repetido en el mismo episodio de diarrea, ya que el riesgo de falsos positivos aumenta y la rentabilidad diagnóstica no supera el 2%. Sin embargo, en caso de recurrencia de síntomas tras completar un tratamiento, sí estaría indicado para evitar tratar a individuos con diarrea por otra causa, hecho que podría producirse hasta en el 35% de los casos. No sería adecuado repetir el estudio para confirmar la curación tras un tratamiento exitoso31.
TratamientoComo medidas generales se encuentran:
- a)
Retirar los antibióticos desencadenantes del cuadro tan pronto como sea posible, ya que su mantenimiento se ha unido a un mayor riesgo de recurrencia y menor respuesta al tratamiento56.
- b)
La reposición hidroelectrolítica.
- c)
Suspender los IBP, si es posible.
- d)
Evitar el empleo de agentes antidiarreicos como la loperamida57,58.
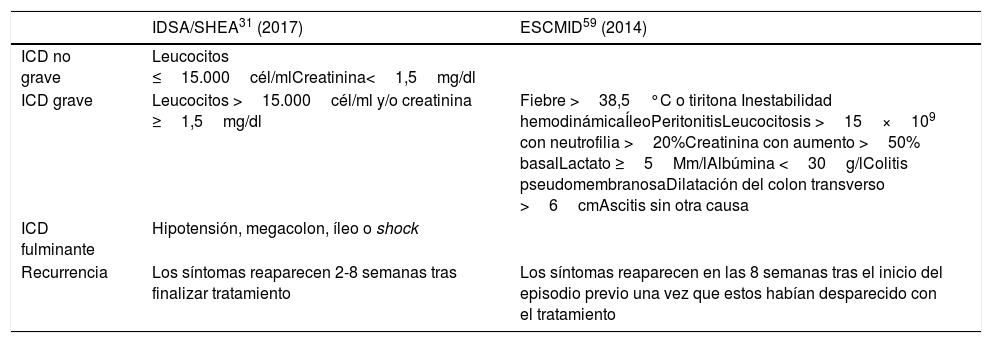
A la hora de seleccionar el antibiótico y la pauta que se va a aplicar, se debe tener en cuenta si estamos ante una infección no grave, grave, o fulminante; y si estamos ante un primer episodio infeccioso o ante una recurrencia. Los criterios más empleados para definir estas distintas situaciones clínicas según las guías americanas31 y europeas59 se indican en la tabla 3.
Situaciones clínicas de la ICD
| IDSA/SHEA31 (2017) | ESCMID59 (2014) | |
|---|---|---|
| ICD no grave | Leucocitos ≤15.000cél/mlCreatinina<1,5mg/dl | |
| ICD grave | Leucocitos >15.000cél/ml y/o creatinina ≥1,5mg/dl | Fiebre >38,5°C o tiritona Inestabilidad hemodinámicaÍleoPeritonitisLeucocitosis >15×109 con neutrofilia >20%Creatinina con aumento >50% basalLactato ≥5Mm/lAlbúmina <30g/lColitis pseudomembranosaDilatación del colon transverso >6cmAscitis sin otra causa |
| ICD fulminante | Hipotensión, megacolon, íleo o shock | |
| Recurrencia | Los síntomas reaparecen 2-8 semanas tras finalizar tratamiento | Los síntomas reaparecen en las 8 semanas tras el inicio del episodio previo una vez que estos habían desparecido con el tratamiento |
ACG: American College of Gastroenterology; ESCMID: European Society of Clinical Microbiology and Infection; ICD: infección por Clostridium difficile; IDSA: Infectious Diseases Society of America; SHEA: Society for Healthcare Epidemiology of America.
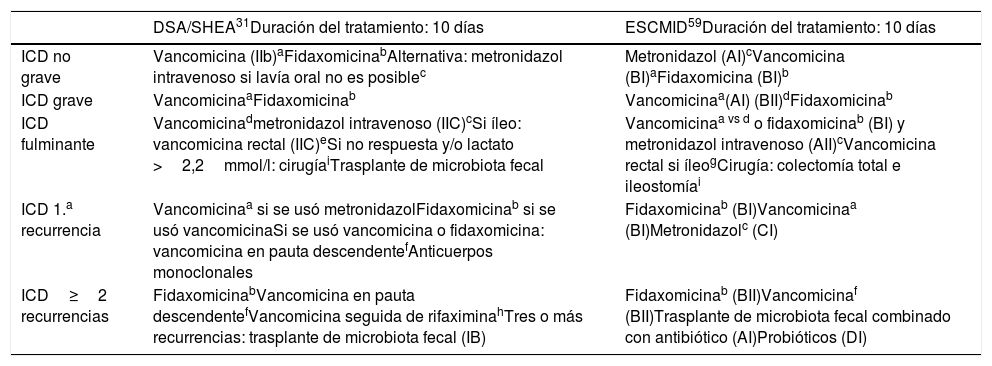
Las pautas terapéuticas ajustadas a la situación clínica del enfermo de las guías clínicas más conocidas en población general se muestran en la tabla 4, pero no son específicas del paciente mayor.
Tratamiento recomendado para la ICD por las Sociedades Americana y Europea de Enfermedades Infecciosas
| DSA/SHEA31Duración del tratamiento: 10 días | ESCMID59Duración del tratamiento: 10 días | |
|---|---|---|
| ICD no grave | Vancomicina (IIb)aFidaxomicinabAlternativa: metronidazol intravenoso si lavía oral no es posiblec | Metronidazol (AI)cVancomicina (BI)aFidaxomicina (BI)b |
| ICD grave | VancomicinaaFidaxomicinab | Vancomicinaa(AI) (BII)dFidaxomicinab |
| ICD fulminante | Vancomicinadmetronidazol intravenoso (IIC)cSi íleo: vancomicina rectal (IIC)eSi no respuesta y/o lactato >2,2mmol/l: cirugíaiTrasplante de microbiota fecal | Vancomicinaa vs d o fidaxomicinab (BI) y metronidazol intravenoso (AII)cVancomicina rectal si íleogCirugía: colectomía total e ileostomíai |
| ICD 1.a recurrencia | Vancomicinaa si se usó metronidazolFidaxomicinab si se usó vancomicinaSi se usó vancomicina o fidaxomicina: vancomicina en pauta descendentefAnticuerpos monoclonales | Fidaxomicinab (BI)Vancomicinaa (BI)Metronidazolc (CI) |
| ICD≥2 recurrencias | FidaxomicinabVancomicina en pauta descendentefVancomicina seguida de rifaximinahTres o más recurrencias: trasplante de microbiota fecal (IB) | Fidaxomicinab (BII)Vancomicinaf (BII)Trasplante de microbiota fecal combinado con antibiótico (AI)Probióticos (DI) |
ACG: American College of Gastroenterology; ESCMID: European Society of Clinical Microbiology and Infection; ICD: infección por Clostridium difficile; IDSA: Infectious Diseases Society of America; SHEA: Society for Healthcare Epidemiology of America.
Metronidazol oral o intravenoso 500mg cada 8h, empleando mejor la vía oral cuando sea posible por ser más efectivo158.
Vancomicina rectal 500mg en 100ml salino en enema retenido 4 veces al día-2g diluidos en 100ml vía rectal. Cuidado por riesgo de perforación.
Vancomicina oral en pauta prolongada descendente93-97: 125mg oral 4 veces al día 10-14 días; 125mg oral 2 veces al día 7 días; 125mg orales una vez al día durante 7 días; 125mg orales cada 2-3 días durante 2-8 semanas (pauta intermitente o en pulsos).
La duración del primer tratamiento, en general, es de 10 días, pero se puede prolongar a 14 días en caso de mejoría al cabo de los 10 días, aunque sin resolución completa de los síntomas31.
Se recomienda que en aquellos pacientes en los que la ICD sea secundaria a un antibiótico que no se ha podido suspender, la duración del tratamiento se prolongue hasta una semana tras suspender el antibiótico responsable60.
En general, los síntomas suelen mejorar en 48-72h tras el inicio del tratamiento, pero la resolución de la diarrea a veces tarda en desaparecer completamente 4 o 5 días. La consistencia y número de deposiciones puede tardar meses en ser completamente normal61-63.
Infección por Clostridium difficile no graveVancomicina-metronidazolDe forma general, el tratamiento con vancomicina es más eficaz que el tratamiento con metronidazol64-67, pero estas diferencias se hacen más llamativas en población anciana, en la cual hay más resistencias frente al metronidazol y más recurrencias que con vancomicina68,69. Esta menor eficacia del metronidazol parece que se debe a que se reabsorbe a nivel intestinal y por tanto presenta menor disponibilidad en el colon70-72. En un estudio de 999 pacientes con ICD73 en el cual se valoró la respuesta clínica al tratamiento en función del envejecimiento se observó que por cada década a partir de 40 años, aumentaba el riesgo de fracaso terapéutico un 17%, el de recurrencia un 17% y había un 13% de menor respuesta clínica sostenida. A partir de los 80 años aumentan al 25% los que presentan fallo terapéutico y se correlaciona con los que tienen leucocitosis al diagnóstico, por lo que este grupo de enfermos no deberían ser tratados con metronidazol73. Tampoco deberían ser tratados con metronidazol los pacientes anticoagulados (por la interacción significativa fármaco-fármaco), los que tienen enfermedad inflamatoria intestinal, hepatopatía, ni los que tienen una ICD grave sin otro fármaco asociado1,74.
Con estas premisas, no se recomienda el uso de metronidazol como primera elección en pacientes mayores47, siendo de elección la vancomicina. En todo caso, si se usara, debería ser de forma intravenosa asociado a otro antibiótico, cuando exista alteración del tránsito intestinal o disfagia, y no se pueda garantizar la disponibilidad de los otros fármacos en el intestino grueso. No se recomienda más de un ciclo por el riesgo de neurotoxicidad con el uso prolongado31.
Se ha visto que en los casos de falta de respuesta a las 72h a vancomicina, a dosis de 125mg cada 6h, aumentando la dosis a 500mg cada 6h, pudiendo añadir metronidazol, se consigue rescatar un 97% de los casos75.
FidaxomicinaSe trata de un macrocíclico bactericida de espectro estrecho (a diferencia de la vancomicina que es bacteriostático), cuyo uso está limitado por su precio elevado (aproximadamente 1.500euros)76.
La fidaxomicina en comparación con vancomicina se asocia a un 50% menos de riesgo de recurrencias73,77,78. Esta reducción en la recurrencia parece que es más evidente en las ICD por cepas que no son NAP1/BI/027, por lo que en España, donde el ribotipo 027 es poco frecuente, tiene aún más trascendencia65,79,80.
Infección por Clostridium difficile grave e infección por Clostridium difficile fulminanteLa vancomicina oral (125mg cada 6h) ha sido el tratamiento de elección en los casos graves. La alternativa es la fidaxomicina 200mg cada 12h31,59.
En los casos de ICD fulminante la dosis de vancomicina se debe aumentar a 500mg cada 6h.
En caso de íleo, la vancomicina puede administrarse también por vía rectal (500mg en 100ml de suero salino cada 6h en forma de enema). La evidencia para el uso de vancomicina en enema no es alta, existiendo artículos que apoyan su empleo81 y otros que no encuentran beneficio82. En ambos estudios81,82 la edad media de los enfermos incluidos estaba en torno a los 61-62 años (32-81 años).
Las dosis altas que se recomiendan vía oral en las formas fulminantes pueden no estar exentas de efectos secundarios, especialmente en presencia de insuficiencia renal, enfermedad inflamatoria intestinal, tratamiento prolongado (más de 10 días) o administración vía enema. En estos casos la vancomicina puede absorberse y pasar al torrente sanguíneo, por lo que se sugiere medir sus niveles en sangre83.
Al tratamiento con vancomicina, en caso de colitis fulminante o íleo, se aconseja asociar metronidazol (500mg cada 8h intravenosos) aunque, igualmente, la evidencia no es muy sólida y está basada en enfermos con una edad media de 60-61 años84.
En los pacientes mayores con ICD fulminante, se debe considerar la intervención quirúrgica de forma individualizada.
TeicoplaninaEn los casos graves se podría plantear el uso de teicoplanina oral (100mg/12h y en caso de complicaciones graves como íleo, megacolon, hipotensión, o insuficiencia respiratoria o renal dosis de 200mg/12h) porque aunque no hay diferencias en mortalidad, sí que parece tener mayor tasa de curación comparada con la vancomicina en casos de ICD grave en pacientes con una edad media de 73,5±10,6 años (90,7% vs. 79,4%, p=0,013)85. En presencia de íleo, se puede administrar en forma de enema (200mg en 150ml de suero salino cada 12h).
Además, la teicoplanina podría tener bajo riesgo de recurrencias en comparación con vancomicina (9,3% vs. 34,3%)85, menor riesgo de fracaso terapéutico86, y cada vez hay más casos publicados en pacientes de edad avanzada87.
En los estudios que hay de teicoplanina en población más joven esta es igual de efectiva que la vancomicina pero con menos efectos adversos61,79, o incluso superior a vancomicina; pero son trabajos de muestras pequeñas y no doble ciego. Al no estar comercializada la teicoplanina en Estados Unidos hay menos evidencia con este fármaco y no se incluye en sus guías88,89.
CirugíaLos criterios de cirugía son el megacolon, la perforación intestinal, el abdomen agudo y el shock séptico. La intervención habitual es la colectomía subtotal, o bien la iliostomía con derivación intestinal y lavados colónicos con vancomicina90. En caso de cumplir criterios de cirugía, los parámetros que pueden identificar a los pacientes que más se pueden beneficiar son: la edad mayor de 65 años, ser inmunocompetente, la leucocitosis mayor o igual a 20.000/mm, o el lactato elevado59,91.
Los mayores frágiles intervenidos mediante colectomía por ICD asocian mayor estancia hospitalaria y morbimortalidad92.
Primera recurrencia de infección por Clostridium difficileEn una primera recurrencia se recomienda el uso de vancomicina en forma de pauta prolongada con dosis descendentes93-97. En el estudio de McFarland et al.93 los pacientes tratados con vancomicina en pulsos tienen menos recurrencia (14%) que los tratados con pauta de vancomicina descendente (31%). La pauta de reducción gradual y en forma de pulsos de vancomicina se muestra en el pie de la tabla 4.
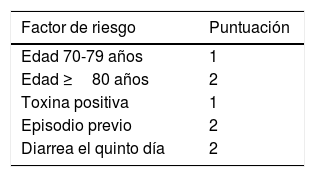
Se debe valorar el uso de fidaxomicina en una primera recurrencia tras un primer tratamiento con vancomicina en pacientes mayores de 65 años98. Se recomienda calcular el riesgo de recurrencias para decidir el tratamiento más adecuado (tabla 5)99. Probablemente la fidaxomicina sería el tratamiento de elección en personas mayores si no fuera por su coste elevado100,101.
GEIH-CDI score de factores de riesgo de recurrencia
| Factor de riesgo | Puntuación |
|---|---|
| Edad 70-79 años | 1 |
| Edad ≥80 años | 2 |
| Toxina positiva | 1 |
| Episodio previo | 2 |
| Diarrea el quinto día | 2 |
GEIH-CDI: Grupo español Infecciones Hospitalarias-Infección por Clostridium difficile.
Resultados: 0-1, bajo riesgo; 2-3, riesgo intermedio; 4-7, alto riesgo.
Fuente: Cobo et al.99.
El bezlotoxumab es un anticuerpo monoclonal que se une a la toxina B de CD. Aprobado en Estados Unidos en 2016, se asocia a menos recurrencias cuando se emplea en pacientes de alto riesgo de recurrencia (incluido enfermos mayores de 65 años). Se administra de forma intravenosa (10mg/kg) y debe asociarse a un tratamiento antibiótico frente al CD. Se ha relacionado con mayor riesgo de insuficiencia cardiaca (12,7% vs. 4,8%), por lo que en algunas personas mayores esto limitaría su uso102-104. Está autorizado en España para prevenir las recurrencias en adultos con ICD, como estrategia adyuvante al tratamiento habitual de la ICD. El bezlotoxumab reduce un 10% los valores absolutos de recurrencias (desde un 27% en los tratados con placebo a un 17% en los tratados con bezlotoxumab) en pacientes adultos con ICD y alto riesgo de recurrencia. Este fármaco constituye una nueva estrategia para la prevención de recurrencias de ICD.
Los episodios producidos por cepas de CD pertenecientes al ribotipo 027 no deberían ser tratados con fidaxomicina por falta de beneficio demostrado, pudiéndose considerar el trasplante de microbiota fecal (TMF) o el bezlotoxumab para reducir su recurrencia105.
La vancomicina 10 días seguida de rifaximina no parece ser una opción adecuada en mayores, pues en el estudio publicado los casos resistentes a esta pauta fueron precisamente la población más anciana106,107.
Segunda recurrencia y sucesivasA partir de una segunda recurrencia habría que plantearse el TMF, y en los centros que no lo tienen disponible, cualquiera de las opciones no empleadas en el tratamiento inicial o primera recurrencia.
En pacientes mayores con más de 4 recurrencias, incluso tras TMF, se ha realizado tratamiento con vancomicina oral seguido, al menos durante 2 meses, de vancomicina 125mg al día, siendo una opción efectiva y segura en personas mayores108,109.
Trasplante de microbiota fecal (TMF)La recurrencia de la ICD parece ser debida a una alteración significativa de la microbiota intestinal. Esto llevó a investigar la posibilidad de restaurar esta microbiota dañada mediante la administración de muestras de heces de donantes sanos110. Desde estos primeros casos hasta la actualidad, son numerosos los estudios publicados de ICD recurrente tratada con TMF con éxitos terapéuticos que varían entre el 77% y el 100%11,111-119. El TMF se ha mostrado eficaz incluso en infecciones por el ribotipo 027120,121.
En un estudio de 64 pacientes con una edad media de 68 años (21 a 92 años) con ICD recurrente, el tratamiento con vancomicina seguido de TMF se mostró superior al tratamiento con fidaxomicina (92% vs. 42%) o vancomicina (19%)113 y la edad (>65 años) no pareció tener influencia a la hora del éxito terapéutico respecto de la subpoblación más joven.
El TMF estaría indicado en aquellos enfermos con múltiples recurrencias de la enfermedad, aunque existe un ensayo como tratamiento de primera línea122. En general, suele plantearse su indicación a partir de la segunda recurrencia (es decir, a partir del tercer ciclo antibiótico). Su indicación en las formas graves tiene menos evidencia, aunque parece también segura y eficaz123,124. En los casos de enfermedad inflamatoria intestinal se ha descrito una menor eficacia y la aparición de brotes de la enfermedad subyacente125,126.
Para la selección del donante se debe tener en cuenta que tenga entre 18 y 65 años, así como descartar cualquier patógeno transmisible, entre los que se incluye colonización por gérmenes multirresistentes, los que hayan recibido antibiótico los 3 meses previos, si existen enfermedades tales como la enfermedad inflamatoria intestinal, infección crónica, neoplasia, enfermedad autoinmune activa, o los que reciban tratamiento inmunosupresor o protectores gástricos127.
La mayor parte de los expertos recomiendan que el receptor tome un ciclo de vancomicina previamente al TMF9,111,118,128,129.
Existen ya guías de uso del TMF en la población pediátrica130, pero no hay guías adaptadas específicamente para ancianos.
Todas las formas de presentación de la microbiota intestinal a trasplantar (fresca o congelada), y todas las formas de administración (oral en cápsulas, sonda nasogástrica, nasoyeyunal, colonoscopia, enema) son efectivas. La vía oral en forma de cápsulas parece la más segura y la colonoscopia la más coste-efectiva131. En población mayor se ha publicado una eficacia del 70% con la toma de una cápsula de microbiota intestinal y del 90% en los que han sido retratados (en estos últimos la edad no era un factor de riesgo de recurrencia)132. Por tanto, se puede plantear un segundo tratamiento con TMF en caso de fracaso terapéutico133.
El TMF parece una técnica segura y con efectos secundarios leves a moderados, la mayor parte autolimitados y habitualmente asociados a los procedimientos empleados en su administración (caso de sondas o colonoscopia), hecho que apoya el empleo de cápsulas para su administración oral132-135. Se han publicado casos aislados de sepsis por transmisión de enteropatógenos multirresistentes136.
El TMF se ha relacionado con una disminución de infecciones de orina recurrentes en relación con una mejora en la microbiota137.
ProbióticosLos estudios sobre el empleo de los probióticos (p. ej., Saccharomyces boulardii) en el tratamiento de las recurrencias parece apoyar su uso pero carece de ensayos controlados. En el estudio de Surawicz et al.138 se incluyeron enfermos con al menos una recurrencia de ICD con una edad media de 63 años, en donde la combinación de S. boulardii (1g/día durante 28 días) junto con vancomicina se asoció a un menor riesgo de recurrencias. Hay que resaltar que la dosis empleada que se mostró eficaz fue de 2g/día de vancomicina. En el estudio de McFarland et al.139 que incluía una muestra de enfermos con un primer episodio de diarrea por CD o recurrencia se empleó igualmente 1g/día de S. boulardii, en este caso durante 4 semanas, junto al tratamiento con metronidazol, vancomicina o una combinación de ambos. En este estudio, el empleo de S. boulardii mostró sus beneficios en los enfermos con ICD recurrente (34,6% vs. 64,7%), siendo indiferente su empleo en los primeros episodios de ICD. En ambos trabajos no se observaron efectos secundarios con el tratamiento.
Hacen falta estudios aleatorizados doble ciego para el uso de probióticos en el tratamiento de ICD porque hasta el momento hay resultados controvertidos, como sucede en la profilaxis, o estudios de muy pocos pacientes mayores de 75 años140.
Otros fármacos empleadosEl ridinilazol es un antibacteriano bactericida frente Clostridium que se encuentra en fase III, y en fase II presentó mayor tasa de curación y menor recurrencia en comparación con vancomicina. Otros fármacos como la bacitracina, el cadazolid, la surotomicina, la tigeciclina, el ácido fusídico, la rifampicina, la nitazoxanida, las resinas de intercambio iónico como la colestiramina, inmunoglobulinas, el colestipol y el tolevamer tienen estudios muy limitados o no son muy efectivos9,61,79,141,142.
PrevenciónLos pacientes con ICD deben estar en habitaciones con baño de uso individual. En caso de limitación de estas habitaciones deben ser priorizadas para pacientes con deterioro cognitivo e incontinencia fecal. El personal que entre en estas habitaciones debe llevar guantes y batas, y quitárselos antes de salir de la habitación. Estas medidas de aislamiento deben mantenerse hasta al menos 48h tras la resolución de la diarrea31,61,143.
El lavado de manos con agua y jabón es preferible al uso de soluciones antisépticas para manos, pues estas no erradican las esporas de CD144-149. En cambio, estas soluciones son más eficaces para las formas no esporuladas de la bacteria.
Las esporas pueden mantenerse en las superficies o equipos durante meses, por lo que el uso de sustancias desinfectantes, como lejía diluida con agua al 1/10 o derivados, es necesario (el amoniaco y el alcohol no son eficaces) en aquellos materiales en que sea posible su empleo. Por eso es recomendable, siempre que sea posible, el uso de material desechable o el lavado con agua y jabón del fonendoscopio, tensiómetro o termómetros usados con estos enfermos150,151.
Las heces siguen siendo positivas para la detección del CD tras 6 semanas de ICD tratadas, pero aún no está claro el papel de los portadores de la bacteria en la diseminación de la enfermedad. En algún estudio su detección y aislamiento ha reducido la incidencia de ICD152.
La restricción del uso de antibióticos implicados con la ICD ha demostrado disminuir su incidencia31.
Como se ha comentado, el papel de la limitación de los IBP en la ICD es discutido28,29.
Probióticos en la profilaxis de la infección por Clostridium difficileEn los estudios realizados en mayores sobre el uso de probióticos como profilaxis de la ICD se han obtenido resultados controvertidos. La amplia variedad de probióticos, dosis, duración de tratamiento, comorbilidad de los pacientes, y las pocas publicaciones en población solo anciana, hacen poco valorable la bibliografía actual153,154. El único estudio doble ciego, aleatorizado, multicéntrico del empleo de probióticos en mayores de 65 años no demostró reducir la diarrea por antibióticos ni ICD155.
Hay trabajos que han relacionado su uso con complicaciones infecciosas como Saccharomyces, que se ha relacionado con funguemias, y otros aún más raros como el Lactobacillus, Bifidobacterium o Bacillus156,157.
ConclusionesA pesar de ser una patología con una alta incidencia en países desarrollados y claramente en aumento, en pacientes mayores los estudios aleatorizados, doble ciego son escasos.
Los trabajos que hay publicados presentan diversidad en los criterios diagnósticos de ICD, en los métodos diagnósticos microbiológicos empleados y en los criterios de gravedad de la ICD manejados.
La elección del tratamiento debe realizarse de forma individualizada, atendiendo al riesgo de recurrencia (edad avanzada, recurrencia previa y gravedad de la misma, enfermedad concomitante grave, necesidad de continuar con antibióticos) y a la gravedad de cada paciente.
Hay evidencia moderada de la superioridad de la vancomicina sobre el metronidazol, y fundamentalmente en el menor riesgo de recurrencia con la fidaxomicina respecto a los previos. Probablemente la teicoplanina sea superior a la vancomicina, pero solo hay un estudio en pacientes mayores y no se incluye en las guías más actualizadas, que son las americanas, por no estar comercializado en Estados Unidos.
No hay ninguna guía clínica de ICD específica en población mayor, en los cuáles claramente se ha demostrado un mayor riesgo de fracaso terapéutico, recurrencia y gravedad de la enfermedad. Sin embargo, con la evidencia disponible en el momento actual se podría recomendar:
- 1)
Tratamiento ICD no grave: vancomicina vía oral a dosis de 125mg cada 6h.
- 2)
ICD grave: vancomicina 500mg cada 6h vía oral/sonda nasogástrica (teicoplanina a dosis de 100-200mg cada 12h como alternativa) asociada a metronidazol intravenoso 500mg cada 8h. Si presenta íleo: metronidazol intravenoso junto con vancomicina rectal (500mg diluidos en 100ml cada 6h).
- 3)
ICD fulminante: pauta anterior. Valorar cirugía.
- 4)
Primera recurrencia: fidaxomicina 200mg cada 12h o vancomicina pauta prolongada con reducción gradual (ver tabla 4).
- 5)
Segunda recurrencia o sucesivas: TMF tras tratamiento con vancomicina, o si no está disponible, se podría utilizar cualquiera de las opciones no empleadas en la primera recurrencia. Tratamiento adyuvante con bezlotoxumab de forma intravenosa (10mg/kg) con precaución en pacientes con cardiopatía o antecedente de insuficiencia cardiaca.
Son necesarios estudios de fragilidad en pacientes con ICD para valorar si contribuye al riesgo de su desarrollo, en su respuesta al tratamiento y pronóstico, al margen de la mayor probabilidad de recurrencia y complicaciones posquirúrgicas ya demostrada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.