La xantina oxidasa (XO) es la enzima que cataliza la oxidación de hipoxantina a xantina y de esta a ácido úrico, por lo que desempeña un importante papel en el catabolismo de las purinas. El alopurinol, un análogo de las purinas, es un conocido inhibidor de la XO ampliamente utilizado en la práctica clínica para el tratamiento de la gota.
Estudios recientes indican que el alopurinol reduce el estrés oxidativo y mejora la función vascular en diversas enfemedades cardiometabólicas, aumenta el tiempo de ejercicio en pacientes con angina de pecho y mejora la eficiencia de la contractilidad miocárdica en la insuficiencia cardiaca. La XO también ejerce un papel importante en la generación de radicales libres durante la contracción muscular, y por tanto se ha relacionado con el daño muscular asociado al ejercicio físico agotador. Diversos grupos de investigación han demostrado el efecto protector del alopurinol en la prevención de este tipo de daño.
Teniendo en cuenta estos antecedentes, en este trabajo nos hemos planteado revisar el posible papel del alopurinol en el tratamiento de la sarcopenia, un síndrome geriátrico caracterizado por la progresiva y generalizada pérdida de masa y fuerza muscular, que supone un aumento del riesgo de discapacidad, baja calidad de vida y muerte.
Xanthine oxidase (XO) is an enzyme that catalyzes the oxidation of hypoxanthine to xanthine and uric acid and plays an important role in purine catabolism. The purine analogue, allopurinol, is a well-known inhibitor of XO widely used in the clinical management of gout and conditions associated with hyperuricemia. More recent data indicate that allopurinol reduces oxidative stress and improves vascular function in several cardiometabolic diseases, prolongs exercise time in angina, and improves the efficiency of cardiac contractility in heart failure. XO also plays an important role in free radical generation during skeletal muscle contraction and thus, it has been related to the muscle damage associated to exhaustive exercise. Several research groups have shown the protective effect of allopurinol in the prevention of this type of damage.
Based on this background, a critical overview is presented on the possible role of allopurinol in the treatment of sarcopenia, a geriatric syndrome characterized by progressive and generalized loss of skeletal muscle mass and strength with a risk of adverse outcomes, such as physical disability, poor quality of life and death.
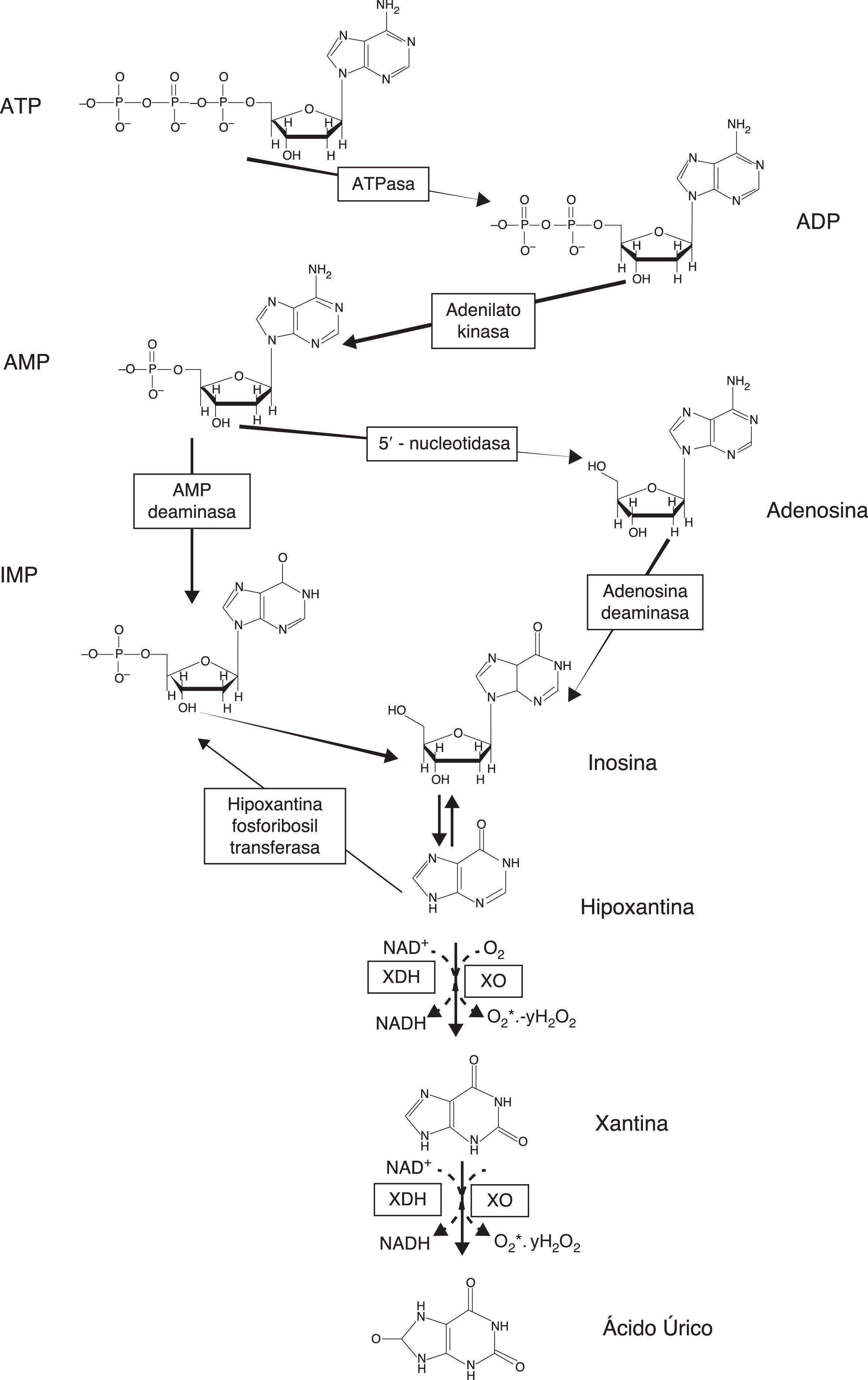
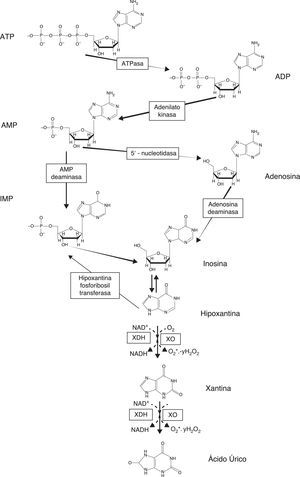
El alopurinol (1,5-dihidro-4H-pirazolo[3,4-d]pirimidin-4-ona) es un análogo estructural de la base púrica hipoxantina y actúa como un inhibidor de la xantina oxidasa (XO), la enzima responsable de la conversión de hipoxantina a xantina y de esta a ácido úrico, el producto final del catabolismo de las purinas1 (fig. 1). El alopurinol fue uno de los fármacos más importantes obtenidos a través del programa privado de la fundación dedicada a la investigación biomédica Burroughs Wellcome Fund2. Este programa se inició en los años 40 y culminó con el premio Nobel en Fisiología y Medicina concedido en 1988 a los científicos Gertrude B. Elion, George H. Hitchings y James W. Black, por su descubrimiento de los principios básicos en el tratamiento farmacológico. Tal y como se puede comprobar en la conferencia de recepción del premio, el programa se desarrolló alrededor de la idea de que los análogos sintéticos de las bases púricas y pirimidínicas pueden interferir en la biosíntesis de los ácidos nucleicos2. De este programa se obtuvieron fármacos tan exitosos como aciclovir, trimetoprima y los compuestos antineoplásicos tioguanina y 6-mercaptopurina (6-MP), así como el inhibidor de la XO objeto de esta revisión, el alopurinol. La 6-MP emergió como un fármaco con una elevada actividad frente a la leucemia. La inhibición de la XO se postuló que podía inhibir la oxidación de 6-MP y potenciar sus propiedades antitumorales. Se testaron diversos inhibidores de la XO entre los que se incluyó el alopurinol (como análogo de la hipoxantina) para comprobar la hipótesis. Se sabía que la XO estaba implicada en la formación de ácido úrico por la xantina y la hipoxantina3 (fig. 1). Por tanto, y aunque originalmente el alopurinol se sintentizó en un intento de producir nuevos agentes antineoplásicos por Falco, experimentos posteriores mostraron un control efectivo de los niveles séricos y urinarios de ácido úrico (así como con el uso de su metabolito oxipurinol) y, por tanto, su potencial para el tratamiento de la hiperuricemia2. Aunque el programa de búsqueda de inhibidores de la XO continuó en Burroughs Wellcome Fund durante varios años, ninguno de los compuestos posteriores encontrados pudo superar al alopurinol en eficacia y tolerancia2. El alopurinol fue aprobado por la Agencia de Alimentos y Medicamentos (FDA) en 1966 para el tratamiento de la gota y permanece como un pilar básico en la terapia de la gota primaria y secundaria2.
En relación con su farmacocinética, el alopurinol se absorbe con rapidez y alcanza concentraciones plasmáticas pico a los 30-60min tras su administración oral. El oxipurinol tiene una biodisponibilidad por vía oral menor que el alopurinol. La vida media del alopurinol en plasma es de 2-3h, mientras que la del oxipurinol es mucho mayor, 14-30h, debido a la reabsorción renal4.
Cada vez son más las evidencias que demuestran el papel de la XO en la isquemia y en otro tipo de enfermedad vascular, inflamatoria, así como en insuficiencia cardiaca crónica5. Su posible papel, mucho más novedoso, en la prevención de la pérdida de masa y de fuerza muscular asociada a la edad (sarcopenia)6 o a los procesos de inmovilización7, mediante la inhibición de la misma, es el objeto de esta revisión.
Estructura de la enzima xantina oxidorreductasaLa enzima xantina oxidorreductasa (XOR) es una enzima descrita originalmente como una aldehído oxidasa en 19028. Esta enzima está ampliamente distribuida entre seres vivos de distinta complejidad, habiéndose demostrado su existencia desde en organismos tan sencillos como las bacterias hasta los mamíferos más evolucionados como el hombre5. Esta enzima en las distintas especies cataliza la hidroxilación de una amplia gama de sustratos como purinas, pirimidinas, pterinas y aldehídos. La XOR es sintetizada como xantina deshidrogenasa (XDH) y se mantiene mayoritariamente como tal en la célula, pero puede convertirse rápidamente en la forma XO mediante oxidación de los residuos sulfhidrilo o mediante proteólisis9. Esta conversión solo ocurre en la XOR de los mamíferos, incluida la humana y la de rata10, en contraposición a otras especies, como las aves, en las que no se ha visto conversión a XO. Ambas formas enzimáticas, la XDH y la XO, son el producto del mismo gen, tienen un tamaño similar, el mismo número de subunidades y requieren los mismos cofactores10.
Así como la XO se relaciona con diversos procesos patológicos y produce un daño oxidativo a los tejidos, la XDH puede ser un importante componente de la defensa del organismo contra el daño provocado por los radicales libres (RL) a través de la acción del ácido úrico, que es un potente antioxidante11.
En 1963 Berne12 y Gerlach13 demostraron que, en órganos aislados, los productos de degradación de los nucleótidos de adenina se acumulaban durante la hipoxia, y uno de los productos liberados desde la célula era la hipoxantina. Posteriormente, la atención se dirigió hacia el papel fisiopatológico de la XOR por Granger, McCord et al. que relacionaron la producción de RL por parte de la XOR y el daño asociado a los procesos de isquemia-reperfusión9,14. Como hemos mencionado en el apartado anterior, en los mamíferos la enzima cataliza la hidroxilación de hipoxantina a xantina y de esta a su vez para dar lugar a ácido úrico5. La XO utiliza hipoxantina y oxígeno (como aceptor de electrones) para dar lugar a xantina (eventualmente ácido úrico) y a radical superóxido, mientras que la XDH, que es la forma predominante en condiciones fisiológicas, utiliza xantina y NAD+ (como aceptor de electrones)15. La XDH es capaz de utilizar tanto el NAD+como el oxígeno como aceptor de electrones, aunque tiene preferencia por el primero. La XO solo es capaz de utilizar el oxígeno como aceptor de electrones. Durante esta reacción catabólica se generan RL, por lo que la XO se relaciona con diversos procesos patológicos en los que se induce un daño oxidativo a los tejidos11, tal y como veremos en los apartados siguientes (fig. 1).
Papel de la xantina oxidasa en el daño muscular asociado al ejercicio agotadorLa práctica de ejercicio físico aporta múltiples beneficios para la salud, ya que previene la mortalidad prematura y el desarrollo de enfermedad cardiovascular, hipertensión, cáncer, diabetes, obesidad y osteoporosis, entre otras16. Sin embargo, uno de los aspectos más importantes en la prescripción del ejercicio físico es la intensidad a la que este debe realizarse17.
En 1954 se publicó el primer trabajo en el que se demostró la presencia de RL en el músculo esquelético mediante resonancia paramagnética electrónica18. Sin embargo, su importancia biológica no fue evidente hasta años más tarde cuando se identificó la relación entre la función muscular y la biología de los RL. En 1978 se asoció el ejercicio físico con el aumento de la peroxidación lipídica19. Dos años más tarde Koren et al. mostraron que los RL aumentan en el músculo esquelético como consecuencia de la contracción muscular20. En el año 1982 el grupo de Lester Packer publicó el que se considera el trabajo más influyente en el área y en el que demuestran que el contenido de RL aumenta entre 2 y 3 veces en los músculos de animales ejercitados hasta el agotamiento, y que estos se relacionan con la fatiga muscular21. Cinco años después Jackson et al. orientan el efecto de los RL hacia el daño muscular inducido por ejercicio físico y demuestran el papel protector de la vitamina E22.
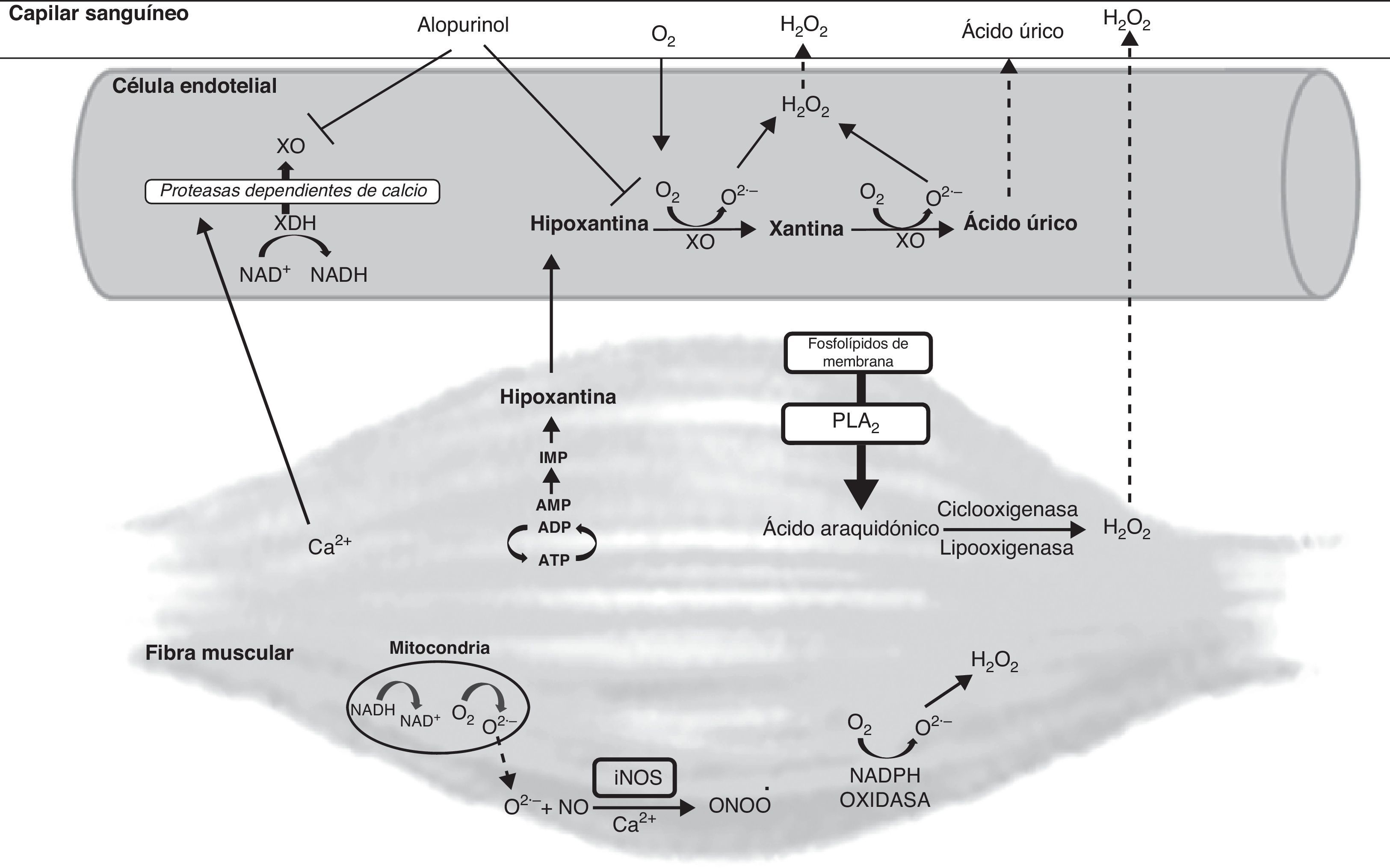
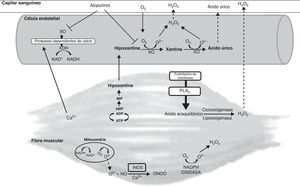
Son diversas las vías de producción de RL en el musculo esquelético durante la contracción muscular23 (fig. 2). La mitocondria se ha considerado durante años como una de las principales fuentes de RL en el músculo esquelético debido a su papel en la producción de superóxido en los complejos i y iii de la cadena de transporte electrónico24,25. Sin embargo, hallazgos recientes sugieren que la mitocondria puede no tener un papel crítico como fuente de RL en el ejercicio26.
Otra fuente de RL son las NAD(P)H oxidasas. Diversos estudios han identificado estas enzimas asociadas al retículo sarcoplásmico, a los túbulos transversos y a la membrana plasmática en el músculo esquelético y cardiaco23. Esta enzima utiliza preferentemente NADH como sustrato. El superóxido generado por estas enzimas influye sobre la liberación de calcio por el retículo sarcoplásmico mediante la oxidación del receptor rianodina27.
La fosfolipasa A2 es otra posible fuente de RL en el músculo esquelético. Esta enzima produce ácido araquidónico, que es un sustrato para la activación de enzimas generadoras de RL como la lipooxigenasa, a partir de fosfolípidos de la membrana23. Por otra parte, la activación de la fosfolipasa A2 puede estimular a las NAD(P)H oxidasas23.
Otra importante fuente de RL en el músculo esquelético es la XO. Como hemos comentado en apartados anteriores existen muchas evidencias que demuestran el papel de la XO en la isquemia5. Las condiciones metabólicas del músculo esquelético durante el ejercicio agotador emulan a las de un tejido isquémico en muchos aspectos28, lo que favorecerá la conversión de la XOR en su forma oxidasa en condiciones de estrés metabólico tales como la isquemia28. Durante el ejercicio de alta intensidad o en las últimas fases de un ejercicio físico prolongado se produce un estrés metabólico con un descenso de los niveles de nucleótidos de adenina y un aumento en la formación de hipoxantina29, sustrato de la XO. La presencia de elevados niveles del sustrato hipoxantina, por tanto, permitiría la producción de elevados niveles de RL en el músculo por vía de esta enzima.
El interés en la posibilidad de que los RL pudiesen estar implicados en el daño muscular que ocurre tras el ejercicio físico agotador se gestó con la observación de que la miopatía asociada a la deficiencia de vitamina E en animales se precipitaba por el ejercicio físico30. En el año 1982 se relacionaron por primera vez los RL producidos durante el ejercicio agotador con el daño tisular en animales de experimentación31. Un año más tarde se demostró que la deficiencia de vitamina E provoca una reducción significativa de la resistencia aeróbica32, y que esta a su vez potencia el daño muscular que se produce en condiciones de estrés en estudios tanto in vivo como in vitro33,34.
Son muchos los trabajos más recientes en los que se han relacionado los RL producidos durante la contracción muscular de elevada intensidad con el daño muscular35,36. Estas evidencias han fundamentado el uso de antioxidantes (la vitamina C y E han sido de las más utilizadas) en la prevención del daño muscular asociado al ejercicio37. En concreto, en nuestro grupo de investigación, hemos utilizado el alopurinol en diversos modelos animales y humanos para prevenir el daño muscular asociado al ejercicio físico. En los estudios iniciales comprobamos que la administración de alopurinol disminuía la oxidación de glutatión, la peroxidación lipídica, así como los aumentos en los niveles de enzimas de daño muscular, creatinquinasa (CK) y aspartato amino transferasa (GOT), tanto en humanos como en animales de experimentación ejercitados hasta el agotamiento38,39. En estudios posteriores realizados con ciclistas profesionales y con maratonianos, confirmamos la prevención del daño muscular asociado al ejercicio con la administración de 300mg de alopurinol durante la competición40,41. Otros grupos de investigación han encontrado un efecto protector de la administración de alopurinol, sobre el daño muscular, en otras especialidades deportivas tales como en participantes en la Copa América42.
Así mismo, nuestro grupo ha evidenciado que el estrés oxidativo asociado al ejercicio físico hasta el agotamiento activa vías de señalización como las MAP quinasas y la cascada inflamatoria de NF-кB en el músculo esquelético, las cuales son inhibidas con la administración de alopurinol previamente a la realización de este tipo de ejercicio43. Estos resultados han sido parcialmente corroborados recientemente44.
Al observar que la administración de alopurinol tiene un efecto positivo en la prevención del daño muscular, su uso se ha extendido a otras condiciones en las que el daño o atrofia muscular se encuentra mediado por estrés oxidativo, como las que se describen a continuación.
Papel del alopurinol en el tratamiento de la sarcopenia primaria y secundariaLa sarcopenia es un síndrome geriátrico caracterizado por una pérdida progresiva y generalizada de la fuerza y de la masa muscular esquelética, que se acompaña con un aumento del riesgo de eventos adversos tales como la discapacidad, la baja calidad de vida y la muerte45,46. La sarcopenia puede ser clasificada como primaria (relacionada con la edad) cuando no existe una evidente causa que la explique que no sea el envejecimiento per se. Se clasifica como secundaria cuando una o más causas son las responsables. En este sentido la sarcopenia secundaria puede estar relacionada con una baja actividad física (estilo de vida sedentario, inmovilización, condiciones de ingravidez), con enfermedades (fallo orgánico avanzado, enfermedades inflamatorias o endocrinas) o con aspectos nutricionales (inadecuada ingesta de proteínas, malaabsorción, desórdenes gastrointestinales)45.
El envejecimiento humano está asociado a una pérdida de masa muscular que se inicia en la cuarta década de la vida con una pérdida de la fuerza de un 1% al año y que se acelera con en el transcurso de los años47. La debilidad funcional asociada a la sarcopenia afecta aproximadamente al 7% de los adultos de más de 70 años y al 20% de los mayores de 80 años48,49. El proceso de envejecimiento está asociado no solo con la reducción de la masa muscular y la fuerza máxima, sino también con el descenso en la capacidad del sistema neuromuscular para producir la fuerza explosiva. Esta disminución es incluso más drástica que la observada en la producción de fuerza máxima para el mismo grupo muscular, y llega a ser aproximadamente de un 3,5% de pérdida al año, entre los 65 y 84 años50. Del mismo modo, con el envejecimiento se observa una mayor disminución de la proporción del área ocupada por las fibras musculares de contracción rápida (tipo ii) en comparación con las que ocupan las fibras musculares de contracción lenta (tipo i)51.
Entre los factores implicados en la pérdida de funcionalidad del músculo esquelético podemos destacar: alteraciones en la síntesis y degradación de proteínas, inflamación, alteraciones hormonales y disfunción mitocondrial6. La mayor parte de estas alteraciones se relacionan con el estrés oxidativo52,53.
Diversos grupos de investigación, incluyendo el nuestro54, han observado un aumento de la actividad XO en los músculos de animales viejos (Lambertucci et al., 2007; Hofer et al., 2008; Ryan et al., 2011a). Estos estudios han relacionado este aumento de la actividad XO con el estrés oxidativo, el descenso de la masa muscular (Hofer et al., 2008), de la máxima velocidad aeróbica (Lambertucci et al., 2007), así como de la fuerza muscular (Ryan et al., 2011).
En esta misma línea, recientemente en un estudio realizado en personas mayores se examinó la asociación entre el uso de alopurinol y los resultados funcionales en el test de Barthel después de la rehabilitación en 3.593 pacientes ingresados, de los cuales un 3% (102 pacientes) eran tratados con alopurinol. Los resultados mostraron puntuaciones en el Barthel más altas en el grupo tratado con alopurinol (4,7 puntos) frente al no tratado (3,6 puntos), lo que sugiere que los pacientes tratados eran más independientes y tenían mayor funcionalidad a la hora de desempeñar tareas de la vida cotidiana55. Estos resultados sugieren que el uso de alopurinol se asocia con un mayor grado de mejora en la función, medida por el índice de Barthel durante la rehabilitación en una población de pacientes ancianos.
En relación con la sarcopenia secundaria existen evidencias de que el tratamiento con alopurinol puede mejorarla. El primer estudio en el que se administró alopurinol como agente anticancerígeno se demostró que su uso inducía drásticamente la apoptosis en células de cáncer de próstata en humanos56. Posteriormente, se ha usado para disminuir los altos niveles de ácido úrico producidos por ciertos medicamentos en el tratamiento del cáncer. Recientemente, se ha empezado a administrar alopurinol para el tratamiento de la caquexia asociada al cáncer. Springer et al. demostraron, mediante la inducción de una caquexia experimental por inyección de células cancerosas de hepatoma en animales de experimentación, que la inhibición de la actividad de la XO redujo significativamente los niveles de estrés oxidativo y de la actividad del sistema ubiquitín proteasoma. Ello derivó en la conservación de la masa muscular y, por tanto, en la reducción de la caquexia en los animales que desarrollaron tumores tratados con alopurinol u oxipurinol frente a los no tratados57,58.
Como hemos comentado anteriormente, la atrofia muscular puede darse en ausencia de enfermedad durante periodos prolongados de actividad muscular reducida59, como estilos de vida sedentarios, sujetos encamados, la inmovilización de miembros, la descarga del diafragma a través de la ventilación mecánica, o los vuelos espaciales45,60. En estas condiciones también se ha demostrado la relevancia del estrés oxidativo en la pérdida de masa muscular y, en concreto, el papel de la XO. En 1998 Kondo midió la actividad de la XO en el músculo sóleo de ratas inmovilizadas durante 12 días y se comprobó que la XO aumentaba 2,3 veces en los soleos inmovilizados, los cuales mostraron un descenso del 51% de su peso respecto a los músculos controles. También midieron parámetros de estrés oxidativo y la actividad de las enzimas antioxidantes, cuyas modificaciones concordaban con la activación de la XO61. Posteriormente, Matuszczaky et al. demostraron la eficacia del alopurinol en la prevención del daño muscular durante la suspensión de las extremidades posteriores en ratones. Aunque, en este estudio, la inhibición de la XO no disminuyó la atrofia causada por la inmovilización, sí que previno la pérdida de la fuerza muscular62. Sin embargo, en un estudio reciente de nuestro grupo de investigación demostramos que el tratamiento con alopurinol previene significativamente la atrofia del músculo sóleo tras 14 días de suspensión de extremidades posteriores en ratas63. En este mismo estudio observamos que el alopurinol prevenía el aumento de diversos parámetros de estrés oxidativo (carbonilación de proteínas y MDA en plasma), así como la activación de las quinasas activadas por mitógenos (p38 MAPK) y de una E3 ubiquitín ligasa implicada en la atrofia muscular (MAFbx). La inhibición de esta vía redundó en una disminución de la proteólisis de la cadena pesada de miosina, por parte del sistema ubiquitín-proteasoma, en el sóleo de los animales tratados con alopurinol7.
Cada vez son más las evidencias que demuestran el papel de la inhibición de la XO en la prevención de la pérdida de masa y de fuerza muscular por lo que, en nuestra opinión, el alopurinol debería ser considerado como un posible tratamiento en la sarcopenia. Sin embargo, consideramos relevante ajustar las dosis del fármaco en personas de edad avanzada. Estudios comparativos de la farmacocinética y farmacodinámica del alopurinol en personas mayores frente a jóvenes demuestran que la disminución en la función renal asociada a la edad afecta la eliminación renal del oxipurinol64. Los niveles de oxipurinol, por tanto, alcanzan valores plasmáticos más elevados tras un tratamiento con alopurinol en sujetos de edad avanzada cuando se comparan con jóvenes. Sin embargo, la inhibición de la XO por oxipurinol parece estar reducida con el envejecimiento. Se sabe que la estructura de diversas proteínas se altera con el envejecimiento por modificaciones postraduccionales65. Una XO estructuralmente modificada puede modificar su sensibilidad frente al alopurinol y el oxipurinol. Debido a los aumentos de la concentración de oxipurinol con la edad existe un mayor riesgo de aparición de toxicidad en el envejecimiento. Los efectos adversos incluyen reacciones de hipersensibilidad (demartitis, fiebre, eosinofilia, alteraciones en la función hepática, daño renal), problemas gastrointestinales (naúseas, diarrea) y síntomas neurológicos (dolor de cabeza, somnolencia). Se han propuesto modificaciones en la dosificación del alopurinol, de acuerdo con el aclaramiento de creatinina, para reducir su toxicidad en insuficientes renales66.
Se considera que estas indicaciones deberían ser observadas durante el envejecimiento64. Si la monitorización terapéutica es posible, las dosis se deben ajustar a valores plasmáticos de concentración de oxipurinol de 5-8μgml−1 (40-60μM). Es importante reseñar que se encuentran niveles muy superiores a los requeridos para inhibir la actividad XO cuando se determina la concentración plasmática de oxipurinol en pacientes tratados de forma crónica con alopurinol67. Por lo tanto parece que, en general, este tipo de pacientes reciben dosis excesivas de alopurinol.
ConclusiónExisten múltiples evidencias en la bibliografía acerca del papel de los radicales libres derivados de la XO en la aparición y desarrollo dela sarcopenia primaria y secundaria. La inhibición de la enzima mediante la administración de alopurinol ha mostrado unos prometedores efectos en el mantenimiento de la fuerza y masa muscular tras periodos de inmovilización o en modelos experimentales de caquexia. Del mismo modo se ha demostrado el papel del alopurinol en el mantenimiento de la independencia y de la funcionalidad en sujetos ancianos. En nuestra opinión el alopurinol puede ser considerado como un posible tratamiento en la sarcopenia, aunque su dosis debería ser muy bien ajustada para evitar sus posibles efectos adversos.
FinanciaciónEste trabajo ha sido realizado gracias a la financiación obtenida con las ayudas: ISCIII2006-RED13-027 de la Red temática de investigación cooperativa en envejecimiento y fragilidad (RETICEF); PROMETEO 2010/074 de la Conselleria de Sanidad de la Generalitat Valenciana; 35NEURO GentxGent de la Fundación Gent Per Gent de la Comunidad Valenciana; PI11/01068 del ISCIII y EU Funded COSTB35 y CM1001.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.