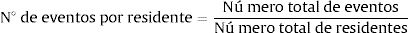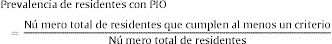La prescripción potencialmente inadecuada de un fármaco por omisión se define como la no utilización de fármacos que sí están clínicamente indicados. El objetivo de este artículo es analizar y describir la evolución de las prescripciones inadecuadas por omisión en los residentes de los centros sociosanitarios de un departamento de salud.
Material y métodosEstudio descriptivo observacional retrospectivo realizado en los centros sociosanitarios del departamento de salud Valencia-Clínico-Malvarrosa durante el periodo 2016-2018. Se incluyeron todos los pacientes institucionalizados durante este periodo. Se evaluó la prevalencia de prescripciones potencialmente inadecuadas por omisión en base a la versión 2 de los criterios START. Las variables provienen de las historias clínicas electrónicas de atención ambulatoria de la Conselleria de Sanitat (Abucasis).
ResultadosUn total de 2.251 pacientes diferentes formaron parte del estudio en el periodo seleccionado, edad media de 79,53años, 69% mujeres, y consumo medio de fármacos crónicos de 4,60 fármacos/residente. Se identificaron un total de 2.647 prescripciones potencialmente inadecuadas por omisión en el periodo de estudio, obteniendo datos similares durante los tres años. Los criterios START más prevalentes fueron los vinculados al sistema musculoesquelético y al sistema cardiovascular, y los relacionados con el consumo de analgésicos. El valor medio de prevalencia de prescripciones inadecuadas por omisión en el periodo estudiado fue del 39,54%.
ConclusiónLos resultados de nuestro estudio confirman una elevada prevalencia de prescripciones potencialmente inadecuadas por omisión en los residentes de centros sociosanitarios, y el mantenimiento de dicha prevalencia durante los tres años de estudio.
The potentially inappropriate prescription by omission of a drug is defined as the failure to prescribe drugs that are clinically indicated. The objective of this article is to describe and analyse the evolution of inappropriate prescriptions by omission in nursing homes of a health department.
Material and methodsRetrospective observational descriptive study carried out in nursing homes of the Valencia-Clínico-Malvarrosa health department during the period 2016-2018. All institutionalized patients during this period were included. The prevalence of potentially inappropriate prescriptions by omission was assessed based on version 2 of the START criteria. The variables came from the electronic medical records of ambulatory care of the Conselleria de Sanitat (Abucasis).
Results2251 different patients were selected, mean age of 79,53years, 69% women, and an average of 4,60 chronic drugs/resident. A total of 2647 inappropriate prescriptions by omission were identified during the study period, and the results were similar during these 3years. The most prevalent START criteria were those related to the musculoskeletal system and the cardiovascular system, and those related to analgesic consumption. The mean value of inappropriate prescriptions by omission prevalence for the period studied were 39.54%.
ConclusionThe results of our study confirm a high prevalence of potentially inappropriate prescriptions by omission in residents of nursing homes, and the maintenance of this prevalence during the 3years of the study.
La prescripción potencialmente inadecuada (PPI) de un fármaco se define como aquella prescripción farmacológica en la que el riesgo de sufrir efectos adversos es superior al beneficio clínico obtenido. También se consideran PPI las prescripciones inadecuadas por omisión (PIO), que se definen como la no utilización de fármacos beneficiosos que sí están clínicamente indicados pero que a menudo no se prescriben en pacientes mayores por diferentes razones, entre ellas evitar la polifarmacia1,2.
Durante las últimas décadas se han desarrollado diferentes estrategias para identificar las PPI: criterios implícitos en los que interviene el juicio clínico del profesional, y criterios explícitos que son una batería de criterios establecidos en base a la evidencia científica y el consenso de los expertos2. Entre estos últimos se encuentran los criterios STOPP/START (Screening Tool of Older Person's potentially inappropriate Prescriptions/Screening Tool to Alert doctors to the Right Treatment), descritos por primera vez en el año 2008 por Gallagher et al.3, que describen los errores más comunes de prescripción y omisión de fármacos. Avalados por la Sociedad Europea de Geriatría, en 2009 Delgado Silveira et al.4 publicaron la versión en castellano, que fue actualizada posteriormente en 20145.
Los pacientes que presentan múltiples PPI utilizan más los recursos sanitarios. Hay un aumento significativo de visitas a urgencias en pacientes que presentan dos o más PPI, en comparación con aquellos que no cumplen ningún criterio. Además, la presencia de estos criterios se relaciona con la aparición de reacciones adversas, reingresos hospitalarios y un mayor deterioro funcional de los pacientes6,7.
La frecuencia de las PPI varía ampliamente dependiendo del ámbito asistencial que estemos estudiando y la herramienta de evaluación utilizada: oscila entre el 7,9 y el 70,4% en pacientes que viven en la comunidad8-11 y entre el 42 y el 74% en pacientes que residen en centros sociosanitarios12.
Los criterios STOPP/START han sido utilizados en los estudios publicados hasta ahora para determinar la prevalencia de PPI en la comunidad, en hospitales y en centros sociosanitarios, pero a pesar de la elevada prevalencia de PPI en pacientes institucionalizados13-16, los estudios en estos centros son escasos y en general con poca población1,17-24.
La informatización de las historias clínicas de los pacientes y la puesta en marcha de las prescripciones electrónicas hace más de una década supone una oportunidad para el análisis de las PPI en amplios grupos de población y en cualquier ámbito sanitario25.
El objetivo de este artículo es analizar y describir la evolución de las PIO en los residentes de los centros sociosanitarios del departamento de salud Valencia-Clínico-Malvarrosa, a partir de las historias clínicas electrónicas de los residentes y en base a los criterios START.
Material y métodosEstudio descriptivo observacional retrospectivo llevado a cabo en los centros sociosanitarios del departamento de salud Valencia Clínico-Malvarrosa durante el periodo 2016-2018.
Se incluyó a todas las personas institucionalizadas en los 13 centros sociosanitarios del Departamento Clínico Malvarrosa de Valencia, con tratamiento farmacológico crónico y con información en la historia clínica electrónica.
Los datos de las variables provinieron de las historias clínicas electrónicas de atención ambulatoria suministradas por el programa corporativo Abucasis de la Conselleria de Sanitat, agrupados en variables demográficas (edad y sexo) y variables clínicas, que incluyen tratamientos farmacológicos por residente (grupo terapéutico y principio activo) y diagnósticos por residente.
Para el análisis de las PIO se utilizó la última adaptación al castellano de los criterios STOPP/START, publicados por Delgado Silveira et al. en 20145, que definen 34 criterios START.
Para el cálculo de la prevalencia por criterio START se dividió el número de eventos del criterio START seleccionado entre el número total de residentes afectados por el entorno clínico del criterio. En el proceso de tratamiento de datos se evitaron duplicidades de recuento de criterios para un mismo residente, de tal forma que el número de eventos coincidió con el número de residentes con presencia del evento (Eq. A.1).
Eq. A.1. Cálculo de la prevalencia por criterio START
Para el cálculo del número de eventos por residente se dividió el número total de eventos entre el total de residentes de los centros sociosanitarios (Eq. A.2).
Eq. A.2. Cálculo del número de eventos por residente.
Por último, para el cálculo de la prevalencia de residentes con PIO, se dividió el número total de residentes que cumplen al menos un criterio entre el número total de residentes (Eq.A.3.).
Eq. A.3. Cálculo de la prevalencia de residentes con PIO.
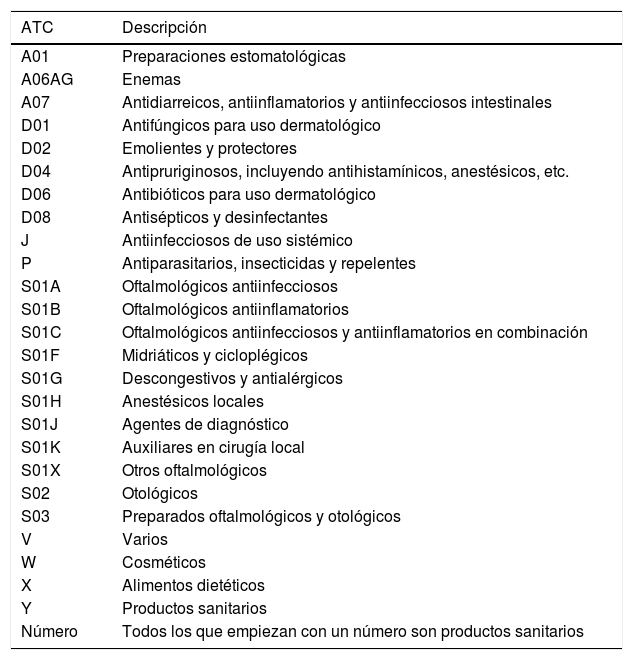
Los criterios se desglosaron según la clasificación ATC26(Anatomical, Therapeutic, Chemical classification system) y el código de principio activo (perteneciente a una codificación interna del Ministerio de Sanidad) para los fármacos y se utilizó el código CIE 927 (Clasificación Internacional de las Enfermedades) para clasificar los problemas de salud (tabla 1), estos últimos seleccionados en base a dos factores: la definición del diagnóstico en el criterio START y el número de residentes que tenían un determinado diagnóstico desglosado en tres niveles (nivel 3, 4 y 5).
Descripción de los criterios START. Desglose de criterios según el código ATC, código de principio activo y código CIE 9
| Criterios START | ATC | Código principio activo (descripción) | CIE 9 | |
|---|---|---|---|---|
| A | Sistema cardiovascular | |||
| A1 | Antagonistas de la vitamina K, inhibidores directos de la trombina o inhibidores del factor Xa en presencia de fibrilación auricular crónica | B01AA, B01AE, B01AF | 427.31 | |
| A3 | Antiagregantes (AAS, clopidogrel, prasugrel o ticagrelor) con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica | B01AC | 176A (AAS) 7300A (clopidogrel) 201129A (AAS+clopidogrel) | 410-414, 430-438, 443 |
| A5 | Estatinas con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica, salvo que el paciente esté en situación de final de vida o su edad sea >85años | C10AA | 410-414, 430-438, 443 | |
| A6 | IECA en la insuficiencia cardiaca sistólica y/o cardiopatía isquémica bien documentada | C09AA, C09BA, C09BB | 428.0,428.2, 428.4, 428.9, 402.0, 402.1, 402.9, 404.0, 404.1, 404.9, 410-414 | |
| A7 | Betabloqueantes en la cardiopatía isquémica | C07 | 410-414 | |
| A8 | Betabloqueantes apropiados (bisoprolol, nebivolol, metoprolol o carvedilol) en la insuficiencia cardiaca sistólica estable | C07 | 2328A (bisoprolol) 2741A (nevibolol) 201076A (nevibolol+tiazidas) 200306A (metoprolol+otros) 2431A (carvedilol) | 428.0,428.2, 428.4, 428.9, 402.0, 402.1, 402.9, 404.0, 404.1, 404.9 |
| B | Sistema respiratorio | |||
| B1 | Agonista beta-2 o antimuscarínico (p.ej., ipratropio, tiotropio) inhalado pautado en el asma o la EPOC leve a moderada | R03AB, R03AC, R03BB, R03AL | 493, 496, 491.20, 491.21, 491.22 | |
| C | Sistema nervioso central y ojos | |||
| C1 | Levodopa o un agonista dopaminérgico en la enfermedad de Parkinson idiopática con deterioro funcional y discapacidad secundarias | N04BC | 200277A (levodopa+carbidopa) 200276A (levodopa+benserazida) 200730A (levodopa +carbidopa +entacapona) | 332.0 |
| C2 | Antidepresivos no tricíclicos en presencia de síntomas depresivos mayores persistentes | N06AB, N06AG, N06AF, N06AX | 296.2, 296.3 | |
| C3 | Inhibidores de la acetilcolinesterasa (donepezilo, rivastigmina, galantamina) para la enfermedad de Alzheimer leve-moderada o la demencia por cuerpos de Lewy (rivastigmina) | N07AA | 2780A (donepezilo) 1075A (rivastigmina) 2446A (galantamina) | 331.0, 331.82 |
| C4 | Prostaglandinas, prostamida o betabloqueantes tópicos para el glaucoma primario de ángulo abierto | S01ED, S01EE, S01EX | 365.11 | |
| C5 | ISRS (ISRN o pregabalina si los ISRS está contraindicados) para la ansiedad grave persistente que interfiere con la independencia funcional | N06AB, N06AX | 3897A (pregabalina) | 300.00, 300.02 |
| D | Sistema gastrointestinal | |||
| D1 | IBP en la enfermedad por reflujo gastroesofágico grave o la estenosis péptica que precise dilatación | A02BC | 530.81, 530.11, 530.3, 537.0, 750.3, 750.5 | |
| E | Sistema musculoesquelético | |||
| E1 | Fármacos antirreumáticos modificadores de la enfermedad en la artritis reumatoide activa incapacitante | M01C, M01B, L04A, L01XC02, A07EC01, P01BA01 | 418A (metotrexato) 2143A (hidrocloroquina) | 714.0, V82.1 |
| E2 | Bifosfonatos y vitaminaD y calcio en pacientes que reciben corticosteroides orales a largo plazo | M05BA, M05BB, A11CC, H02AB | ||
| E7 | Suplementos de ácido fólico en pacientes que toman metotrexato | B03BB | 418A (metotrexato) | |
| H | Analgésicos | |||
| H2 | Laxantes en pacientes que reciben opioides de forma regular | A06A, N02A | ||
Solo aparecen descritos los códigos de principio activo prescritos en nuestra población de estudio.
Para el cálculo del consumo medio de fármacos por paciente se tuvieron en cuenta solamente los fármacos de utilización crónica, dejando fuera los de utilización no crónica y los no considerados como medicamentos (cosméticos, alimentos dietéticos y productos sanitarios) (tabla 2).
Medicamentos, productos sanitarios, alimentos dietéticos y cosméticos no incluidos en el análisis
| ATC | Descripción |
|---|---|
| A01 | Preparaciones estomatológicas |
| A06AG | Enemas |
| A07 | Antidiarreicos, antiinflamatorios y antiinfecciosos intestinales |
| D01 | Antifúngicos para uso dermatológico |
| D02 | Emolientes y protectores |
| D04 | Antipruriginosos, incluyendo antihistamínicos, anestésicos, etc. |
| D06 | Antibióticos para uso dermatológico |
| D08 | Antisépticos y desinfectantes |
| J | Antiinfecciosos de uso sistémico |
| P | Antiparasitarios, insecticidas y repelentes |
| S01A | Oftalmológicos antiinfecciosos |
| S01B | Oftalmológicos antiinflamatorios |
| S01C | Oftalmológicos antiinfecciosos y antiinflamatorios en combinación |
| S01F | Midriáticos y cicloplégicos |
| S01G | Descongestivos y antialérgicos |
| S01H | Anestésicos locales |
| S01J | Agentes de diagnóstico |
| S01K | Auxiliares en cirugía local |
| S01X | Otros oftalmológicos |
| S02 | Otológicos |
| S03 | Preparados oftalmológicos y otológicos |
| V | Varios |
| W | Cosméticos |
| X | Alimentos dietéticos |
| Y | Productos sanitarios |
| Número | Todos los que empiezan con un número son productos sanitarios |
Los datos recogidos se trataron con Microsoft Acces Office 365. Se realizó un análisis descriptivo mediante variables cualitativas (frecuencias) y variables cuantitativas (medias aritméticas), expresándose los estadísticos con un intervalo de confianza del 95%.
Esta investigación ha sido clasificada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) con el código IDP-ANT-2018-01 y ha sido aprobada por el Comité Ético de Investigación Clínica del departamento de salud Valencia Clínico Malvarrosa (2019/079).
Los datos obtenidos fueron previamente anonimizados por la Conselleria de Sanitat a través del procedimiento PROSIGA28,29 para preservar en todo momento la confidencialidad de los pacientes.
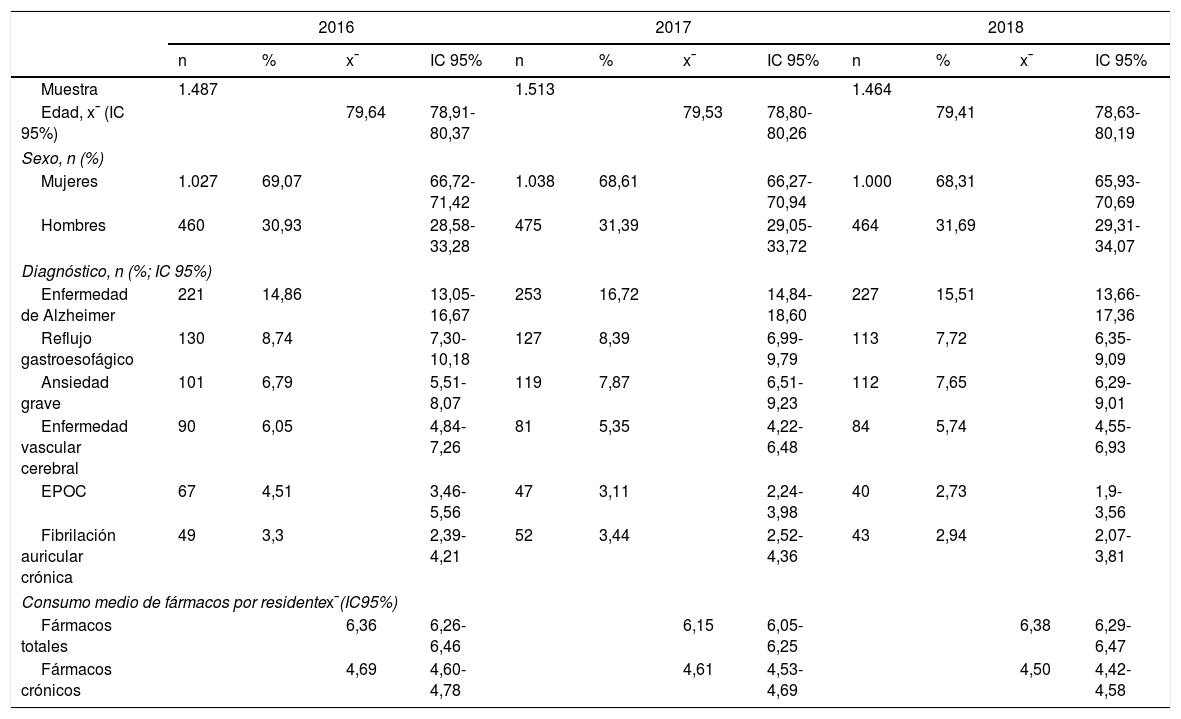
ResultadosUn total de 2.251 pacientes diferentes formaron parte del estudio en el periodo seleccionado, repartidos por años de la siguiente forma: 1.487 residentes en el año 2016, 1.513 en el año 2017 y 1.464 en el año 2018 (tabla 3).
Resultados poblacionales, prevalencia de diagnósticos y consumo medio de fármacos
| 2016 | 2017 | 2018 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | x¯ | IC 95% | n | % | x¯ | IC 95% | n | % | x¯ | IC 95% | |
| Muestra | 1.487 | 1.513 | 1.464 | |||||||||
| Edad, x¯ (IC 95%) | 79,64 | 78,91-80,37 | 79,53 | 78,80-80,26 | 79,41 | 78,63-80,19 | ||||||
| Sexo, n (%) | ||||||||||||
| Mujeres | 1.027 | 69,07 | 66,72-71,42 | 1.038 | 68,61 | 66,27-70,94 | 1.000 | 68,31 | 65,93-70,69 | |||
| Hombres | 460 | 30,93 | 28,58-33,28 | 475 | 31,39 | 29,05-33,72 | 464 | 31,69 | 29,31-34,07 | |||
| Diagnóstico, n (%; IC 95%) | ||||||||||||
| Enfermedad de Alzheimer | 221 | 14,86 | 13,05-16,67 | 253 | 16,72 | 14,84-18,60 | 227 | 15,51 | 13,66-17,36 | |||
| Reflujo gastroesofágico | 130 | 8,74 | 7,30-10,18 | 127 | 8,39 | 6,99-9,79 | 113 | 7,72 | 6,35-9,09 | |||
| Ansiedad grave | 101 | 6,79 | 5,51-8,07 | 119 | 7,87 | 6,51-9,23 | 112 | 7,65 | 6,29-9,01 | |||
| Enfermedad vascular cerebral | 90 | 6,05 | 4,84-7,26 | 81 | 5,35 | 4,22-6,48 | 84 | 5,74 | 4,55-6,93 | |||
| EPOC | 67 | 4,51 | 3,46-5,56 | 47 | 3,11 | 2,24-3,98 | 40 | 2,73 | 1,9-3,56 | |||
| Fibrilación auricular crónica | 49 | 3,3 | 2,39-4,21 | 52 | 3,44 | 2,52-4,36 | 43 | 2,94 | 2,07-3,81 | |||
| Consumo medio de fármacos por residentex¯(IC95%) | ||||||||||||
| Fármacos totales | 6,36 | 6,26-6,46 | 6,15 | 6,05-6,25 | 6,38 | 6,29-6,47 | ||||||
| Fármacos crónicos | 4,69 | 4,60-4,78 | 4,61 | 4,53-4,69 | 4,50 | 4,42-4,58 | ||||||
N: número de residentes; x¯: media; IC: intervalo de confianza.
Aproximadamente el 69% fueron mujeres, y la edad media fue de 79,53años, datos que se mantuvieron relativamente estables durante los tres años de estudio. La población mayor de 65años representó casi el 85% de los residentes.
El diagnóstico más prevalente en nuestra población fue la enfermedad de Alzheimer, que osciló entre el 15 y el 17% y que duplicó al reflujo gastroesofágico, que apareció en segundo lugar, seguidos en relevancia por la ansiedad grave, la enfermedad vascular cerebral, la fibrilación auricular crónica y la enfermedad pulmonar obstructiva crónica (EPOC) (tabla 3)
El consumo medio de fármacos totales fue aproximadamente de 6,30 por residente, valor que se redujo en 2 puntos cuando solo consideramos los tratamientos crónicos (4,5 fármacos/residente) (tabla 3).
Con la información clínica disponible en las historias electrónicas se pudieron analizar 18 criterios START de los 34 descritos. Se identificó al menos un paciente en cada uno de los criterios calculados.
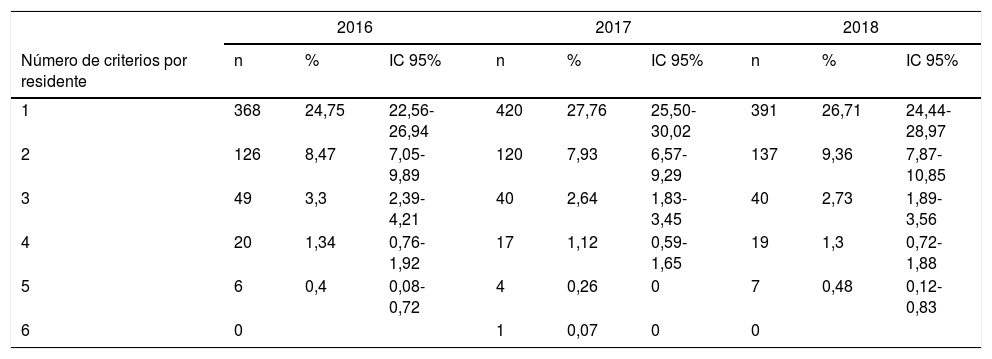
Aproximadamente uno de cada 4 residentes tuvo al menos un PIO en cada uno de los tres años de estudio. A medida que aumentó el número de PIO disminuyó el número de residentes que incumplía algún criterio, hasta encontrar únicamente un residente con 6PIO en el año 2017 (tabla 4).
Número de criterios por residente
| 2016 | 2017 | 2018 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Número de criterios por residente | n | % | IC 95% | n | % | IC 95% | n | % | IC 95% |
| 1 | 368 | 24,75 | 22,56-26,94 | 420 | 27,76 | 25,50-30,02 | 391 | 26,71 | 24,44-28,97 |
| 2 | 126 | 8,47 | 7,05-9,89 | 120 | 7,93 | 6,57-9,29 | 137 | 9,36 | 7,87-10,85 |
| 3 | 49 | 3,3 | 2,39-4,21 | 40 | 2,64 | 1,83-3,45 | 40 | 2,73 | 1,89-3,56 |
| 4 | 20 | 1,34 | 0,76-1,92 | 17 | 1,12 | 0,59-1,65 | 19 | 1,3 | 0,72-1,88 |
| 5 | 6 | 0,4 | 0,08-0,72 | 4 | 0,26 | 0 | 7 | 0,48 | 0,12-0,83 |
| 6 | 0 | 1 | 0,07 | 0 | 0 | ||||
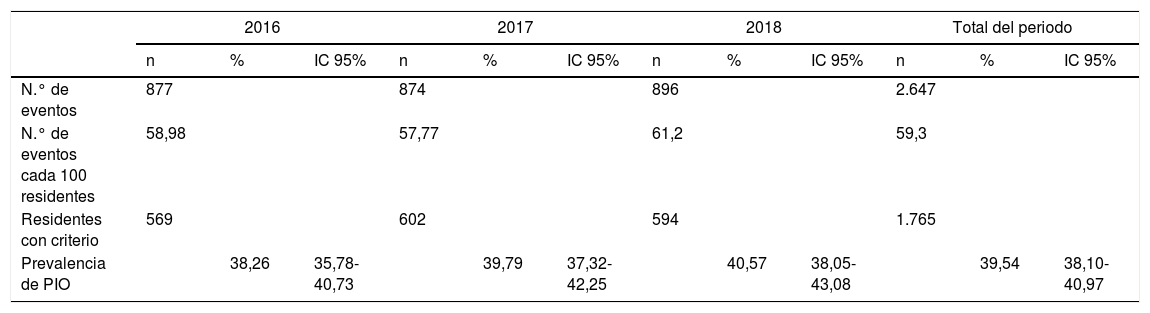
En total, se identificaron 2.647PIO en los tres años de estudio, lo que supuso que 59,3 de cada 100 residentes incumplían al menos un criterio START. Estas PIO correspondieron a 1.765 residentes, siendo la prevalencia de residentes con PIO del 39,54% (tabla 5).
Número de eventos por paciente y por año. Prevalencia de pacientes con criterio
| 2016 | 2017 | 2018 | Total del periodo | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | % | IC 95% | n | % | IC 95% | n | % | IC 95% | n | % | IC 95% | |
| N.° de eventos | 877 | 874 | 896 | 2.647 | ||||||||
| N.° de eventos cada 100 residentes | 58,98 | 57,77 | 61,2 | 59,3 | ||||||||
| Residentes con criterio | 569 | 602 | 594 | 1.765 | ||||||||
| Prevalencia de PIO | 38,26 | 35,78-40,73 | 39,79 | 37,32-42,25 | 40,57 | 38,05-43,08 | 39,54 | 38,10-40,97 | ||||
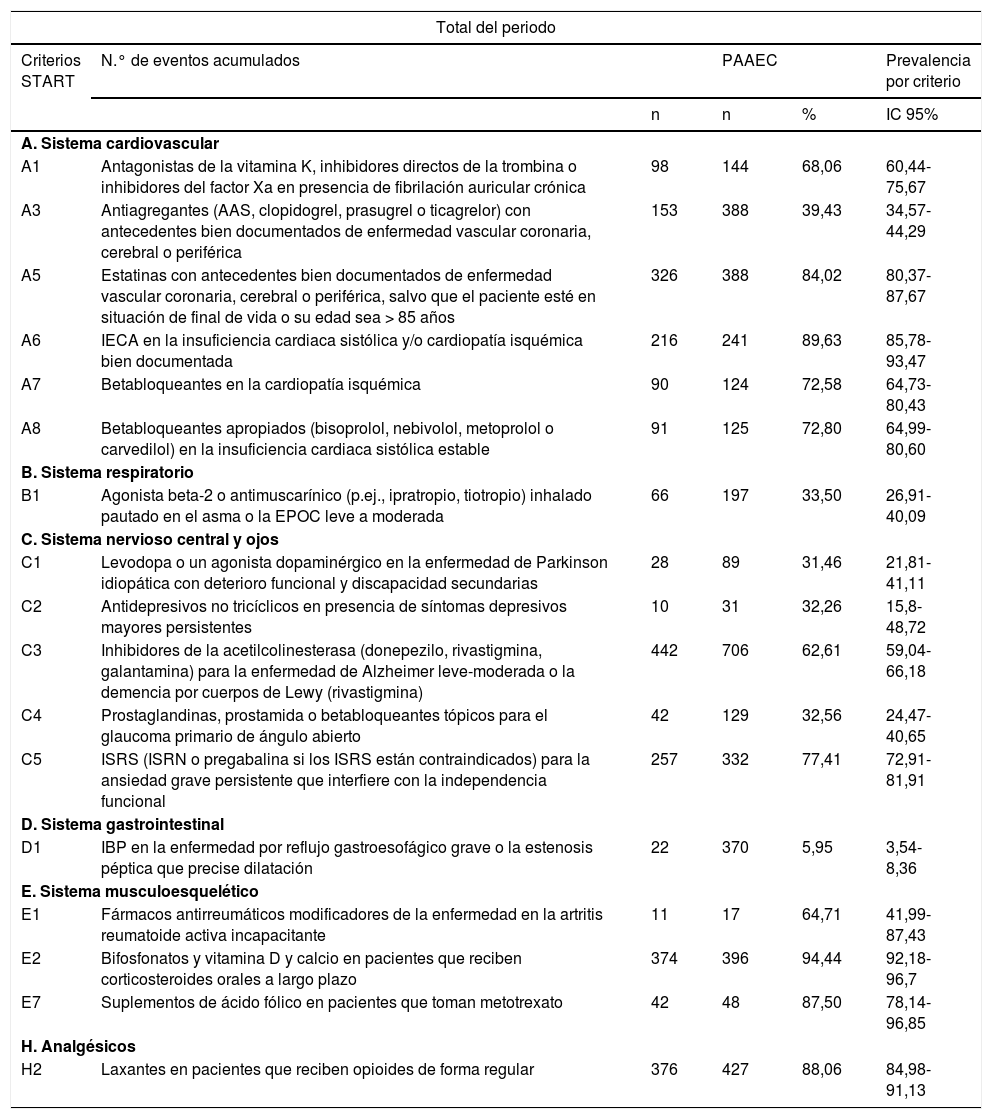
Los criterios START con mayor prevalencia se presentaron vinculados al sistema musculoesquelético, E2 (94,44%) y E7 (87,50%); en los relacionados con el consumo de analgésicos, H2 (88,06%), y en los criterios vinculados al sistema cardiovascular, en concreto el criterio A5 (84,02%), relacionado con la ausencia de estatinas en pacientes menores de 85años con antecedentes de enfermedad vascular coronaria, cerebral o periférica, y al criterio A6 (89,63%) relacionado con la ausencia de IECA en pacientes con insuficiencia cardíaca sistólica y/o cardiopatía isquémica (tabla 6).
Número de eventos por paciente y prevalencia por criterio START
| Total del periodo | |||||
|---|---|---|---|---|---|
| Criterios START | N.° de eventos acumulados | PAAEC | Prevalencia por criterio | ||
| n | n | % | IC 95% | ||
| A. Sistema cardiovascular | |||||
| A1 | Antagonistas de la vitamina K, inhibidores directos de la trombina o inhibidores del factor Xa en presencia de fibrilación auricular crónica | 98 | 144 | 68,06 | 60,44-75,67 |
| A3 | Antiagregantes (AAS, clopidogrel, prasugrel o ticagrelor) con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica | 153 | 388 | 39,43 | 34,57-44,29 |
| A5 | Estatinas con antecedentes bien documentados de enfermedad vascular coronaria, cerebral o periférica, salvo que el paciente esté en situación de final de vida o su edad sea > 85 años | 326 | 388 | 84,02 | 80,37-87,67 |
| A6 | IECA en la insuficiencia cardiaca sistólica y/o cardiopatía isquémica bien documentada | 216 | 241 | 89,63 | 85,78-93,47 |
| A7 | Betabloqueantes en la cardiopatía isquémica | 90 | 124 | 72,58 | 64,73-80,43 |
| A8 | Betabloqueantes apropiados (bisoprolol, nebivolol, metoprolol o carvedilol) en la insuficiencia cardiaca sistólica estable | 91 | 125 | 72,80 | 64,99-80,60 |
| B. Sistema respiratorio | |||||
| B1 | Agonista beta-2 o antimuscarínico (p.ej., ipratropio, tiotropio) inhalado pautado en el asma o la EPOC leve a moderada | 66 | 197 | 33,50 | 26,91-40,09 |
| C. Sistema nervioso central y ojos | |||||
| C1 | Levodopa o un agonista dopaminérgico en la enfermedad de Parkinson idiopática con deterioro funcional y discapacidad secundarias | 28 | 89 | 31,46 | 21,81-41,11 |
| C2 | Antidepresivos no tricíclicos en presencia de síntomas depresivos mayores persistentes | 10 | 31 | 32,26 | 15,8-48,72 |
| C3 | Inhibidores de la acetilcolinesterasa (donepezilo, rivastigmina, galantamina) para la enfermedad de Alzheimer leve-moderada o la demencia por cuerpos de Lewy (rivastigmina) | 442 | 706 | 62,61 | 59,04-66,18 |
| C4 | Prostaglandinas, prostamida o betabloqueantes tópicos para el glaucoma primario de ángulo abierto | 42 | 129 | 32,56 | 24,47-40,65 |
| C5 | ISRS (ISRN o pregabalina si los ISRS están contraindicados) para la ansiedad grave persistente que interfiere con la independencia funcional | 257 | 332 | 77,41 | 72,91-81,91 |
| D. Sistema gastrointestinal | |||||
| D1 | IBP en la enfermedad por reflujo gastroesofágico grave o la estenosis péptica que precise dilatación | 22 | 370 | 5,95 | 3,54-8,36 |
| E. Sistema musculoesquelético | |||||
| E1 | Fármacos antirreumáticos modificadores de la enfermedad en la artritis reumatoide activa incapacitante | 11 | 17 | 64,71 | 41,99-87,43 |
| E2 | Bifosfonatos y vitamina D y calcio en pacientes que reciben corticosteroides orales a largo plazo | 374 | 396 | 94,44 | 92,18-96,7 |
| E7 | Suplementos de ácido fólico en pacientes que toman metotrexato | 42 | 48 | 87,50 | 78,14-96,85 |
| H. Analgésicos | |||||
| H2 | Laxantes en pacientes que reciben opioides de forma regular | 376 | 427 | 88,06 | 84,98-91,13 |
PAAEC: población acumulada afectada por el entorno clínico del criterio.
El criterio START con mayor número de eventos acumulados fue el START C3, relacionado con la no prescripción de inhibidores de la colinesterasa en la enfermedad de Alzheimer, con 442 eventos. Le siguen por orden el criterio START H2, relacionado con la no prescripción de laxantes en pacientes en tratamiento con opioides, con 376 eventos acumulados; el criterio START E2, relacionado con la no prescripción de bifosfonatos, vitaminaD y calcio en pacientes que están tomando corticosteroides orales a largo plazo, con 374 eventos acumulados, y en cuarto lugar el START A5, relacionado con la no prescripción de estatinas en pacientes con enfermedad vascular, con 326 eventos acumulados (tabla 6).
Los resultados obtenidos en el periodo se replicaron en cada uno de los años de estudio de forma individual.
DiscusiónLos resultados de nuestro estudio estimaron una prevalencia de PIO del 39,54%. Esta prevalencia fue similar a la encontrada en otros estudios que utilizaron la segunda versión de los criterios, como el de Moncada et al.18, con una prevalencia de PIO del 40,4%, o el de Bo et al.14, con una prevalencia de PIO en pacientes geriátricos del 35,2%.
Otros estudios llevados a cabo en ámbitos sanitarios similares, como en el de Hernandez et al.30, realizado en pacientes admitidos en un centro sociosanitario durante un periodo de 6meses, y en el de Inzitari et al.19, realizado en dos centros sociosanitarios, obtuvieron prevalencias superiores (56,3 y 61,97%, respectivamente). Esta diferencia en los porcentajes puede deberse a que en estos estudios se utilizó la primera versión de los criterios, mientras que en nuestro trabajo se utilizó la versión actualizada, en la que se han suprimido algunos criterios, a pesar de tener una elevada prevalencia, por considerar que existía poca evidencia científica sobre el beneficio del paciente31.
Los resultados obtenidos en nuestro análisis coincidieron con estudios recientes en que los criterios START más prevalentes se relacionaron con la omisión de fármacos de los sistemas musculoesquelético y cardiovascular17-19,30,32,33. En nuestros resultados llamó la atención la elevada prevalencia de incumplimiento del criterio START E2, dada la evidencia científica disponible que avala la administración de bifosfonatos, y vitaminaD y calcio, en pacientes que reciben corticosteroides34. Lo mismo ocurrió con los criterios START A535 y A636,37.
La elevada prevalencia del criterio START H2, relacionado con el no uso de laxantes en pacientes que reciben opioides de manera regular, pudo deberse a que la mayoría de los laxantes recomendados no están financiados por la seguridad social y, por tanto, a que no aparezcan en la historia clínica.
Hasta la fecha, en la literatura solo se ha encontrado un estudio que estima la prevalencia por criterios de la misma forma en que se ha calculado en el presente estudio38. No obstante, los resultados no son comparables, dado que en ese caso se incluyeron no solo residentes en instituciones geriátricas sino también pacientes ambulatorios y domiciliarios.
A pesar de no ser el criterio con una de las prevalencias más elevadas, el criterio START C3, relacionado con la no prescripción de fármacos en la enfermedad de Alzheimer leve-moderada y demencia de los cuerpos de Lewy, fue el criterio con más número de eventos acumulados. Hay un gran número de residentes que no tomaban una medicación indicada para su enfermedad, y esto pudo deberse a que los fármacos fueran retirados previamente, bien por su limitada eficacia en determinados pacientes o por los efectos secundarios que pueden provocar39. Igual hay que considerar la revisión de este criterio en futuras versiones.
Los resultados obtenidos en el número de PIO por paciente coincidieron con estudios recientes realizados en diferentes ámbitos sanitarios. Los pacientes con una PIO representaron entre el 19,7 y el 29,2%, los pacientes con 2PIO oscilaron entre el 9,3 y el 16,2%, mientras que los pacientes con 3 o más PIO los encontramos entre el 4 y el 16,6% del total de la población estudiada8,13,38.
En referencia a nuestra población de estudio, la media de edad de nuestros pacientes coincidió con la bibliografía consultada en el mismo ámbito sanitario, igual que la prevalencia de diagnósticos, siendo los trastornos mentales y las enfermedades cerebrovasculares los más prevalentes en estos pacientes17. Sin embargo, el consumo medio de fármacos crónicos fue de 4,60 fármacos por residente, muy inferior a la media del resto de estudios realizados en centros sociosanitarios, que oscila entre los 8 y los 12 fármacos por paciente4,19-21. Quizás esta diferencia pudo deberse a la forma de cálculo del parámetro y la medicación que se ha tenido en cuenta para realizarlo.
La principal fortaleza de nuestro trabajo es que aporta una visión global y real de las incidencias de prescripción por omisión en todas las residencias sociosanitarias de un departamento de salud concreto. El uso de registros electrónicos nos ha permitido acceder a una gran cantidad de población, y hemos analizado los datos de más de 2.200 residentes y más de 38.000 prescripciones durante un periodo de tres años.
Nuestro estudio presenta algunas limitaciones. Por un lado, los criterios STOPP/START no están diseñados específicamente para un perfil de población institucionalizada; por otro, la historia clínica no siempre recoge toda la información necesaria para el cálculo de todos los criterios.
Finalmente, hubiera sido interesante evaluar también otras variables, como la relación entre la presencia de PIO y el gasto farmacéutico, la aparición de problemas relacionados con los medicamentos y la calidad de vida del paciente. Sin embargo, no disponíamos de suficientes datos para ello.
En conclusión, los resultados de nuestro estudio confirman una elevada prevalencia de PIO por omisión en los residentes de centros sociosanitarios y el mantenimiento de dicha prevalencia durante los tres años de estudio, siendo los más predominantes los relacionados con los sistemas cardiovascular y musculoesquelético, y los relacionados con el consumo de analgésicos.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríaToda la autoría firmante ha contribuido significativamente a la concepción del trabajo, la organización del contenido, la redacción y la revisión crítica del manuscrito con importantes aportaciones, y ha aprobado su versión final.
Conflicto de interesesTodos los autores y autoras declaran no tener conflicto de intereses.
Nuestro agradecimiento a los sistemas de información de la Conselleria de Sanitat Universal i Salut Pública, a la Dirección Médica del Hospital Clínico-Malvarrosa, al Área de Farmacia de Atención Primaria del Hospital Clínico.