INTRODUCCION
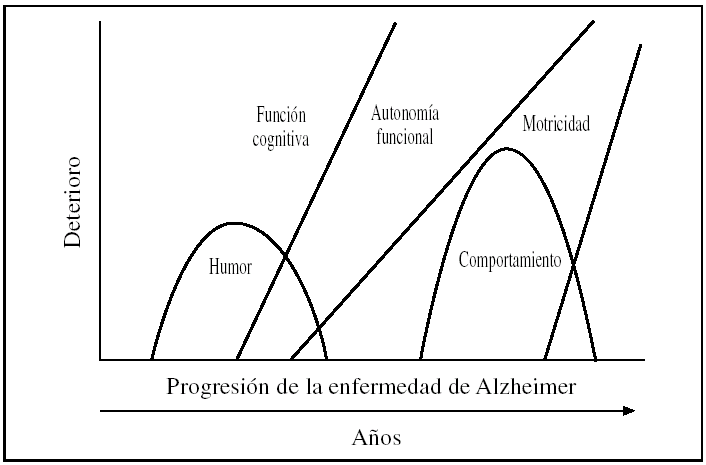
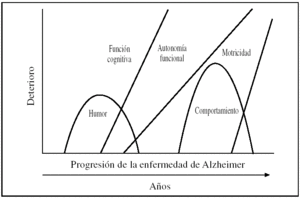
La demencia se define como una enfermedad caracterizada por cambios cognoscitivos y conductuales progresivos que provoca una incapacidad para vivir de forma independiente, lo que lleva a la necesidad continua de cuidados por parte de los familiares no profesionales1, generalmente mediante una serie de estadios evolutivos, como se refleja en la figura 1.
Figura 1.A medida que la enfermedad de Alzheimer progresa, la memoria y otras deficiencias cognoscitivas se hacen cada vez más notorias hasta tal punto que interfieren en las actividades funcionales básicas (fuente propia).
La enfermedad de Alzheimer (EA) es la principal causa de demencia2, cuyo diagnóstico se basa no sólo en el deterioro de la función cognoscitiva o en la presencia de síntomas psicológicos y conductuales, sino también en la capacidad del individuo de mantener su autonomía en las actividades cotidianas. Esta información se obtiene con escalas apropiadas y se complementa con la exploración física y los resultados de las pruebas complementarias3.
El tratamiento de la EA se dirige a retrasar la presencia de los síntomas de la enfermedad, reducir el deterioro funcional, mejorar la calidad de vida de los pacientes y aliviar la carga que soportan los familiares y los cuidadores. La memantina, antagonista del receptor N-metil-D-aspartato, ha mostrado un beneficio clínico en todos los síntomas de la EA, incluida la impresión general por parte de los cuidadores y del clínico4. El objetivo de esta revisión es conocer más en detalle todos los ensayos clínicos de memantina para el tratamiento de la EA, en los que se haya investigado su beneficio en la autonomía y actividades cotidianas de los pacientes.
MATERIAL Y MÉTODOS
Se realiza una revisión sistemática de las citas bibliográficas sobre ensayos clínicos controlados y aleatorizados (ECA) de memantina en el tratamiento de la EA en los que se incluya, como variables de eficacia, determinadas medidas de funcionalidad, especialmente escalas de actividades cotidianas básicas e instrumentales.
Se realizó una búsqueda electrónica en Medline (Pubmed), bases de la Biblioteca Cochrane (Cochrane Database of Systematic Review y CENTRAL), con las palabras clave (Mesh): Alzheimer, dementia y memantine, y se contactó con la compañía farmacéutica que manufactura memantina para solicitar datos no publicados sobre ensayos clínicos o de difícil localización en la búsqueda electrónica habitual de tratamiento de EA con memantina.
Como criterios de inclusión se tuvo en cuenta ECA de memantina que cumplieran los criterios de calidad de Jadad5 y que incluyeran variables resultado de función. Se excluyó los estudios observacionales y ensayos clínicos abiertos, así como los ECA de memantina en una patología diferente a la EA.
Para determinar la funcionalidad en los diversos ensayos clínicos se emplearon las siguientes escalas de evaluación:
Escala de Actividades de la Vida Diaria del Estudio Cooperativo de la EA modificada para demencia grave (Alzheimer Disease Cooperative StudyActivities Daily Living severe [ADCS-ADLsev]), que incluye preguntas sobre 42 aspectos de actividades cotidianas6. Esta medida se diseñó para valorar a pacientes en todos los estadios de la EA y cada apartado incluye una valoración del rendimiento que varía desde el nivel más alto hasta la completa pérdida de función. Se realiza entrevistando a los cuidadores o allegados y se centra en el rendimiento de las principales actividades de la vida diaria en las últimas 4 semanas. En uno de los ECA de memantina7 se seleccionó un grupo de 19 apartados, con una puntuación máxima de 54, que corresponden con la capacidad de la población de estudio y muestran una alta fiabilidad test-retest y se correlacionan bien con las puntuaciones del Minimental State Examination (tabla 1).
El test de las actividades cotidianas (Activities Daily Living Test [ADL test]), instrumento no validado, evalúa la capacidad de los pacientes para hacer frente a cinco tareas instrumentales con la supervisión de un psicólogo8.
La escala conductual de pacientes geriátricos (Behaviour Geriatric Patients [BGP]) consta de 45 apartados enjuiciados por personal de enfermería y creada para la evaluación de trastornos funcionales y de comportamiento de individuos mayores. Es una medida que contiene diversas escalas: cuidado, dependencia, agresividad, incapacidad física y mental, tendencia a la depresión e inactividad9. En un ECA, la función se evaluó mediante la subescala de dependencia de cuidado BGP que es la mayor de las cuatro subescalas de la BGP e incluye 23 apartados, y es la que mayor fiabilidad y validez tiene de toda la medida BGP. Cada uno de estos apartados puntúa entre 0 y 2, siendo 26 la peor puntuación total10.
El D-test modificado (Dementia Scale)11, que se utilizó en un ECA para medir el estado funcional y el comportamiento, evalúa 16 aspectos funcionales, considerados los más importantes para el mantenimiento de cierto grado de independencia. La escala la pasaron las enfermeras que evaluaban a los pacientes mediante una escala de 6 puntos que va desde el funcionamiento normal hasta la completa dependencia en el cuidado12.
La escala Gottfries-Bräne-Steene (GBS) tiene 26 apartados con tres subescalas: rendimiento motor, capacidad intelectual y estado emocional junto con la detección de seis síntomas habituales de la demencia. La reparte un médico cuando entrevista al paciente y recoge la información de un cuidador13.
RESULTADOS
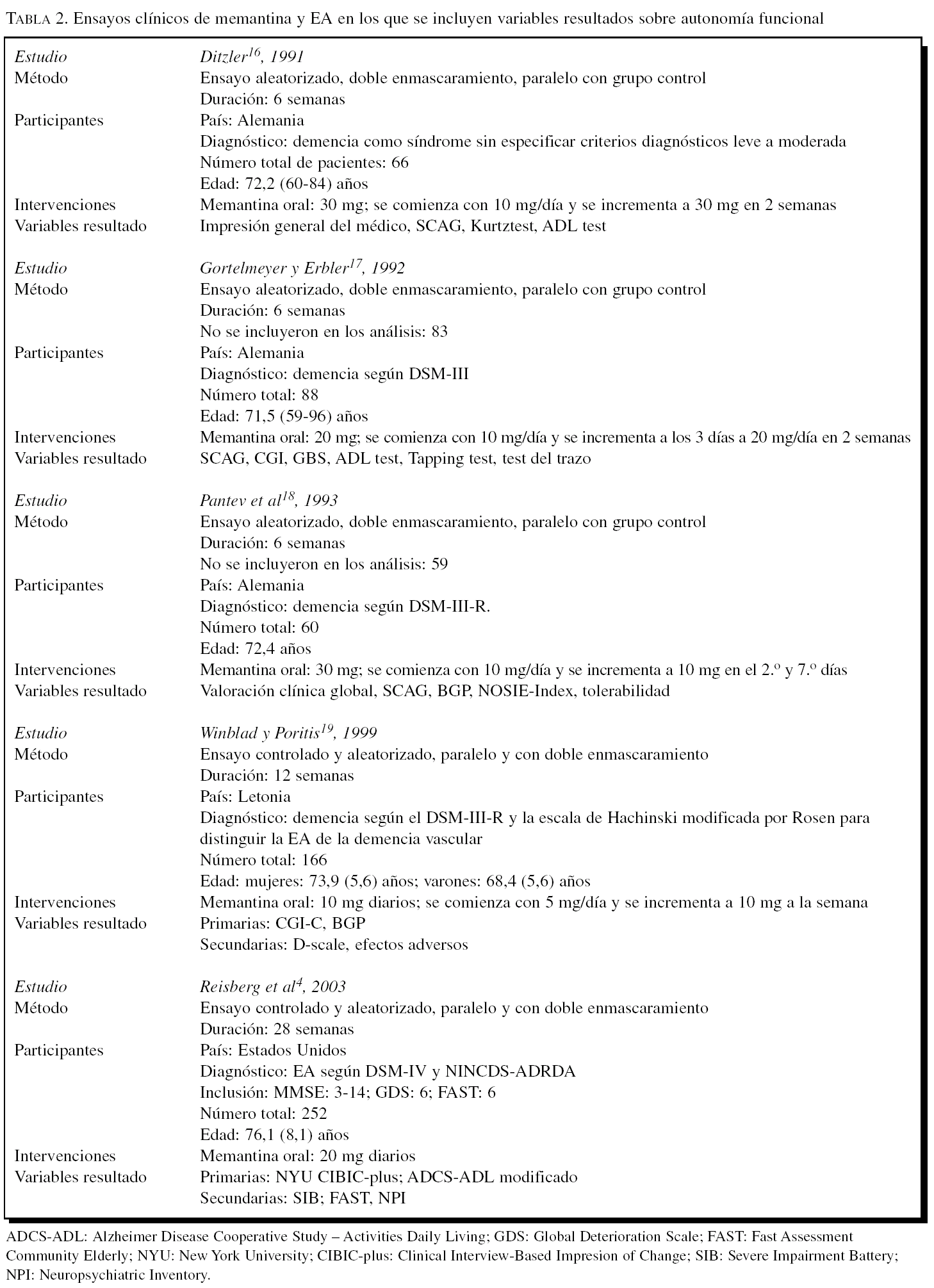
Se localizaron nueve ECA de memantina en demencia, de los cuales dos no se incluyen en esta revisión por tratarse exclusivamente de pacientes con demencia vascular14,15. De los siete restantes, cuatro son ECA sobre el tratamiento en demencia con memantina16-19, en el que se incluye tanto demencia degenerativa como vascular, y tres ECA sobre el tratamiento de EA con memantina sola4,20 y combinada con donepecilo7. También se incluye un metaanálisis sobre memantina en demencia8 que ha localizado dos ECA completos pero sin publicar21,22 y un estudio que agrupa los resultados de la puntuación de una escala funcional en dos ECA en el que se analiza el beneficio del tratamiento de memantina y EA en la autonomía en las actividades cotidianas23.
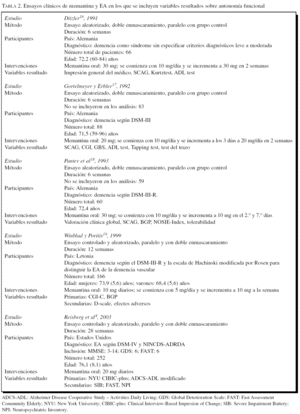
Las características de los siete ECA se resumen en la tabla 2. En total se incluye a 1.439 pacientes, con una mediana de edad de 72 años y edades extremas de 59 y 96 años. La dosis de memantina oral varió entre 10 y 30 mg, repartida en dos tomas al día. La dosis más habitual fue 20 mg/día. La duración de los ECA fue de 6 semanas en tres ECA, 12 semanas en un ECA, 24 semanas en dos ECA y 28 semanas en un ECA. Las variables resultado utilizadas para evaluar el beneficio en la autonomía funcional fueron: ADL test8 en dos ECA, GBS13 en dos ECA, BGP9 en un ECA, D-scale11 en un ECA y la ADCS-ADL6 en tres ECA, en versiones modificadas y abreviadas del original.
A continuación se muestra de modo esquemático un resumen de los principales resultados obtenidos en los diversos estudios, y se revisa su eficacia en función de las distintas pautas posológicas de memantina utilizadas:
Eficacia de 20 mg diarios de memantina en pacientes con enfermedad de Alzheimer moderada y grave durante 24-28 semanas: se localizaron dos ECA, uno que comparaba memantina y placebo durante 28 semanas4 y otro, memantina y placebo en pacientes tratados con donepecilo durante 24 semanas7. Se encontró una diferencia estadísticamente significativa a favor de memantina a las 28 semanas con la escala ADCS-ADL (diferencia ponderada de medias, 1,70; intervalo de confianza (IC) del 95%, 0,63-2,76; p = 0,002).
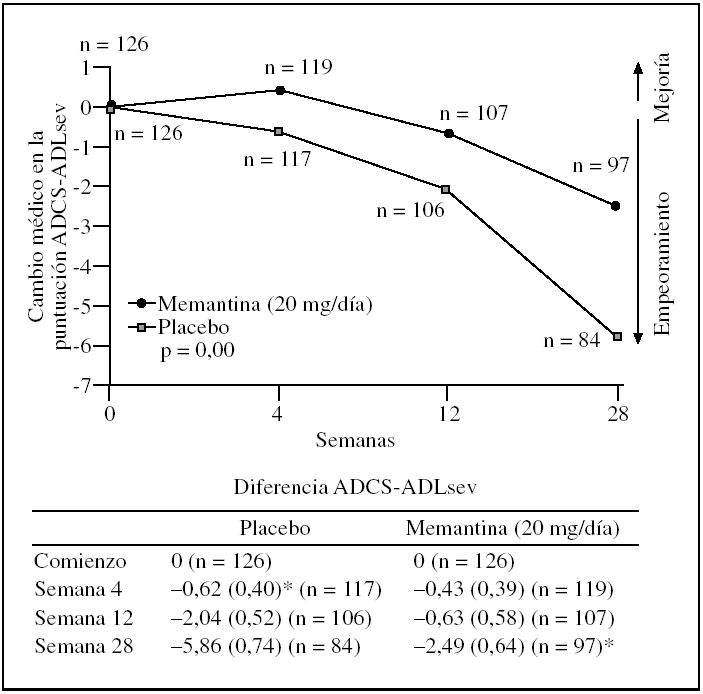
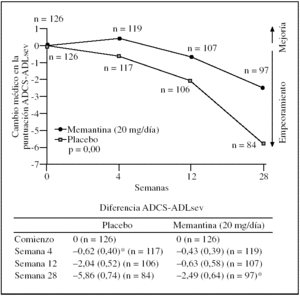
Eficacia de 20 mg diarios de memantina en pacientes con enfermedad de Alzheimer moderada y grave durante 28 semanas: el tratamiento con memantina redujo significativamente el deterioro funcional; en la semana 28 la diferencia de la media de la puntuación ADCS-ADLsev entre los grupos fue de 3,4 puntos a favor de memantina (p = 0,003)4. Los pacientes tratados con memantina mostraron de forma significativa menor deterioro en su autonomía funcional comparados con los pacientes del grupo placebo. El cambio medio desde el comienzo de memantina en la ADCS-ADLsev fue de 2,5 puntos en el grupo de memantina comparado con 5,9 puntos en el grupo placebo4, lo que da una diferencia media estadísticamente significativa de 3,4 puntos a favor de la memantina (p = 0,003) (fig. 2).
Figura 2.Cambio medio (DE) desde el comienzo en la puntuación ADCS-ADLsev durante las 28 semanas de tratamiento con memantina (20 mg/día) o placebo, análisis de casos observados. *p < 0,01.ADCS-ADL: Alzheimer's Disease Cooperative Study Activities of Daily Living.
Eficacia de 20 mg diarios de memantina en pacientes con enfermedad de Alzheimer moderada y grave durante 24 semanas: se encontró un ECA17, aunque hay al menos otros dos finalizados pero sin publicar. No se encontró diferencia significativa en el ADCL-ADLsev (diferencia ponderada de medias, 0,10; IC del 95%, 0,01-0,25; p = 0,2).
Eficacia de 10 mg diarios de memantina en pacientes con enfermedad de Alzheimer, demencia vascular y demencia mixta a las 12 semanas: se localizó un ECA16 que estudió la eficacia de memantina a esa dosis y duración, en residentes de unidades de larga estancia con EA, demencia vascular y demencia mixta. Usando el test de Wilcoxon, los autores encontraron diferencia significativa en la subescala de dependencia de cuidados de la BGP a favor de memantina. No se obtuvieron los mismos resultados al utilizar odds ratio.
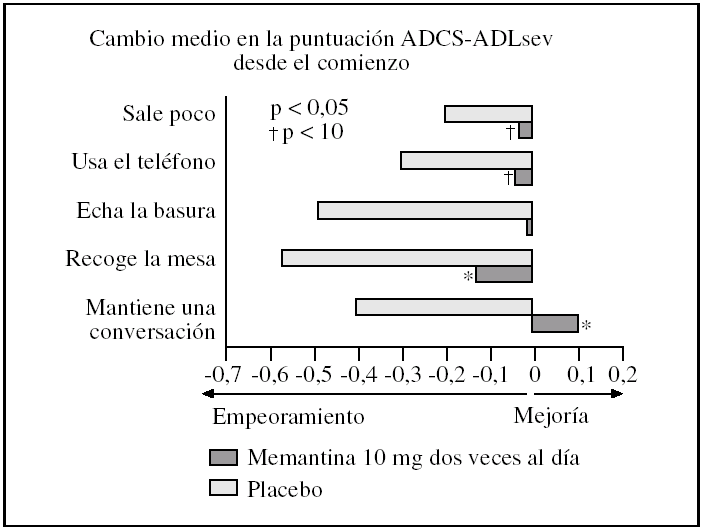
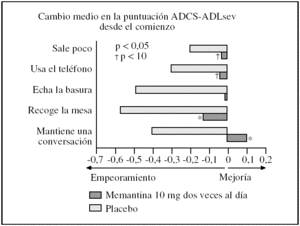
Eficacia de 20 o 30 mg diarios de memantina en pacientes con enfermedad de Alzheimer, demencia vascular o demencia mixta a las 4-6 semanas: un ECA ofreció datos de una escala no validada que mide 5 tareas instrumentales simples realizadas con la supervisión de un investigador (ADL test)16. Cuando se analizaron junto con los resultados de otro ECA15 que utilizaba la subescala del BGP, los análisis sobre los que completaron el ECA mostraron resultados estadísticamente significativos a favor de memantina a dosis de 30 mg diarios durante 6 semanas (diferencia estándar de medias, 1,34; IC del 95%, 1,73 a 0,94; p < 0,00001). Los apartados que más contribuyeron a la mejoría funcional en el grupo memantina fueron: la capacidad de los pacientes para mantener una conversación, recoger la mesa y preparar la basura, todos significativamente mejor que el placebo (fig. 3). Hubo tendencia a favor de memantina en la capacidad para usar el teléfono y en salir fuera de casa.
Figura 3.Cambio medio desde el comienzo en la puntuación ADCS-ADLsev tras 28 semanas de tratamiento con memantina (20 mg/día) o placebo, análisis de casos observados. ADCS-ADL: Alzheimer's Disease Cooperative Study Activities of Daily Living.
DISCUSION
Esta revisión no ha podido incluir los datos de dos ECA finalizados y no publicados19,20. Este hecho conocido como sesgo de publicación añade un grado de incertidumbre en las conclusiones de esta revisión sistemática. Los ECA de pequeño tamaño mostraban cierto grado de heterogeneidad, en cuanto a los individuos incluidos con diferentes tipos y grados de demencia, pero este inconveniente se ha tendido a compensar con los ECA homogéneos de mayor tamaño4,7,17.
Los resultados de los análisis agrupados muestran que la memantina tiene efectos positivos en las actividades de la vida diaria de los pacientes con EA moderada y grave. Estos resultados están apoyados por el efecto positivo de memantina en la impresión clínica general, lo que indica que este efecto es clínicamente significativo. La falta de heterogeneidad en los resultados de los tres ECA principales demuestra que el tratamiento con donepecilo no está influido por la memantina.
En comparación con placebo, los pacientes que fueron tratados con memantina mostraron una declinación menor en las funciones básicas, como por ejemplo mantenerse de pie, moverse, vestirse, comer o ir al cuarto de baño. En el tratamiento de la EA, la mejoría funcional instrumental en el grupo memantina se observó en los principales ECA de memantina4,7,17, que muestran no sólo mejoría en la puntuación total de la escala ADCS-ADL, sino también mejoría en cada uno de los apartados de la escala (fig. 3), lo que traducido en términos prácticos indica beneficio en la preservación de tareas como: mantener una conversación, recoger la mesa después de comer o echar la basura, todas significativamente mejor que el placebo. Además hubo una tendencia a favor de memantina en la capacidad para usar el teléfono y en salir fuera de casa8. Esta mejoría también se ha demostrado en individuos con EA institucionalizados en residencias12.
Los resultados de estos dos ECA muestran que la mejoría esperada de memantina se observa tanto en dementes institucionalizados como en los que viven en su domicilio. En este caso el efecto lo perciben directamente los familiares cuidadores, como se ha demostrado midiendo el tiempo dedicado al cuidado de los pacientes de EA.
La mejoría funcional del paciente debe tener efectos directos en los costes de la enfermedad y en el cuidador. Con el fin de cuantificar los recursos y la carga en el cuidador en la EA moderada-grave a grave, en un ensayo clínico se utilizó el instrumento Utilización de Recursos en la Demencia (URD) 4. El URD se basa en una entrevista estructurada con los cuidadores en la que se les pregunta por el tiempo que utilizan para cuidar al paciente, sobre su salud, su situación laboral, disposición de residencia y sobre la utilización de recursos asistenciales para ellos y para los pacientes a quienes cuidan24.
En términos generales, los análisis sobre la URD muestran que los cuidadores de los pacientes del grupo memantina ocupan 52 h menos al mes en las tareas de cuidado que los cuidadores de los pacientes del grupo placebo (p = 0,02)25. Estas tareas incluyen ir al cuarto de baño, comer, vestirse, asearse, deambular, ir de compras, cocinar, hacer la colada, labores domésticas en general, responsabilidad sobre la medicación, salir fuera del domicilio, manejo de las finanzas y supervisión general. Más aún, hubo diferencia en el número de pacientes que permanecieron en su domicilio en vez de institucionalizarse, a favor de la memantina. Sólo se ingresó a un paciente del grupo memantina en residencia frente a 5 del grupo placebo (p = 0,052). Esta mejoría con memantina se encontró tanto en pacientes institucionalizados como en los que vivían en su domicilio.
El tratamiento de los casos de demencia grave conlleva implicaciones éticas y puede ser controvertido26. No disponemos todavía de datos que apunten a que los fármacos influyan en la esperanza de vida, aunque es posible que una pequeña mejoría en los estadios avanzados tenga mayor repercusión en la calidad de vida que en fases más tempranas de la demencia. Por eso es importante incluir en los ECA también medidas de calidad de vida del paciente, sobrecarga del cuidador y costes de la enfermedad, todas directamente relacionadas con el grado de autonomía del paciente o, lo que es lo mismo, por el grado de dependencia funcional.
En conclusión, el tratamiento con memantina a los pacientes con EA moderada y grave ofrece un claro beneficio clínico en las diferentes actividades básicas de la vida diaria. Estos beneficios se observan tanto en pacientes con EA ingresados en residencias como en los pacientes que viven en su domicilio. Esta mejoría puede tener repercusiones positivas en cuanto a la reducción del tiempo de cuidado, utilización de recursos asistenciales y retraso en la institucionalización.
El autor recibe en la actualidad becas para la investigación en la enfermedad de Alzheimer y ayudas para el funcionamiento de la Unidad de Deterioro Cognoscitivo y Demencia.
Correspondencia: Dr. J.M. López Arrieta.
Unidad de Deterioro Cognoscitivo y Demencia.
Servicio de Geriatría. Hospital de Cantoblanco.
Carretera de Colmenar, Km 14.500. 28049 Madrid. España.
Correo electrónico: jlopezar.hgugm@salud.madrid.org
Recibido el 20-05-05; aceptado el 23-11-05.