INTRODUCCIÓN
La enfermedad de Alzheimer (EA) es un proceso neurodegenerativo asociado al envejecimiento que se caracteriza clínicamente por un inicio insidioso y un deterioro cognitivo y funcional progresivo, y afecta sobre todo a áreas de memoria, lenguaje y capacidad visuoespacial. Se ha convertido en los últimos años en uno de los problemas sociosanitarios más relevantes debido a las repercusiones sociales y económicas que conlleva. La llamada «cascada del amiloide» es hasta el momento la hipótesis más aceptada para explicar la patogenia de la EA. Recientemente se ha demostrado la implicación del péptido beta-amiloide en toxicidad intracelular, además de su papel en la formación de las placas seniles extracelulares1. Se sabe que además produce muerte neuronal por apoptosis y alteraciones mitocondriales que tendrían como consecuencia un incremento en la producción de radicales libres y una reducción de la producción de energía, posiblemente por disminución en la actividad de la enzima del citocromo C oxidasa2.
Por otro lado, cada vez son más los estudios encaminados a buscar marcadores de esta enfermedad en fluidos biológicos y en células periféricas como los leucocitos3 ya que suponen métodos no invasivos y de fácil reproducibilidad. En este sentido, diversos trabajos han demostrado que existe daño oxidativo no sólo a nivel cerebral sino también de forma sistémica. Además se sabe que el daño oxidativo ocurre muy pronto, incluso antes de aparecer las placas seniles y los ovillos neurofibrilares4.
En este trabajo nos planteamos encontrar un modelo celular humano para estudiar la susceptibilidad a la toxicidad del péptido beta-amiloide. Para ello, usamos linfocitos, célula componente de sangre periférica y, por tanto, muy accesible.
MATERIAL Y MÉTODOS
Seres humanos
Reclutamos a 6 voluntarios sanos, 3 varones y 3 mujeres, con edades comprendidas entre los 25 y 35 años, sin antecedentes familiares de EA ni antecedentes patológicos personales de interés, ni situaciones que pudieran relacionarse con una modificación del estrés oxidativo como ingesta de tóxicos o fármacos. Todos los participantes en este estudio firmaron un consentimiento informado previo a la extracción sanguínea. En todo momento seguimos las indicaciones de la Declaración de Helsinki de 1975, revisada en el 2000.
Aislamiento de linfocitos
Realizamos una extracción sanguínea de 10 ml a cada sujeto utilizando tubos BD Vacutainer CPT con heparina sódica. Estos tubos separan plasma, células blancas y eritrocitos tras centrifugar durante 20 min a 3.000 rpm a temperatura ambiente, gracias a un fluido denso de Ficoll Histopaque y una barrera de gel de poliéster. Obtuvimos la capa de células blancas y realizamos 2 lavados con tampón fosfato salino centrifugando durante 10 min a 1.300 rpm. Posteriormente cultivamos las células en placas de Petri estériles con 10 ml de medio RPMI con suero bovino fetal al 10%, que permanecieron en la cámara de cultivo a 37 ºC y 5% CO2 durante 24 h. De este modo, conseguimos separar los linfocitos ya que éstos quedan flotando en la superficie. El resto de las células blancas se fijan a la placa. A continuación incubamos la mitad de los linfocitos de cada sujeto con beta-amiloide 1-42 a una concentración 10 μmolar (Sigma Aldrich Química) durante 6 h. A la otra mitad de los linfocitos no le añadimos el péptido, y correspondió a la muestra control.
Estudios de microscopia confocal
Se realizó la microscopia confocal con una unidad de barrido láser confocal Leica TCS-SP2 (Leica SA, Mannheim) con un láser de argón y otro de neón-helio unido a un microscopio invertido de Leica DM1RB. Se utilizó placas Lab-Tek de la casa Nalge Nunk International tratadas con poly-L-lisina (Sigma Aldrich Quimica).
Los fluorocromos utilizados fueron: anexina V como marcador de apoptosis temprana, ya que se une a la fosfatidilserina, molécula que es transportada a la cara externa de la membrana celular durante la apoptosis; yoduro de propidio como marcador de necrosis y apoptosis tardía, pues se une a las cadenas de ADN para lo cual precisa la rotura de la membrana celular; Bibenzimida Hoechst 34580 como marcador nuclear, ya que se une a la cromatina; finalmente, MitoTracker green, que se une a las membranas mitocondriales. La empresa Molecular Probes (Invitrogen Corporation) proporcionó todos los fluorocromos.
Se realizó la cuantificación de fluorescencia de los distintos fluorocromos utilizando el Leica Confocal Software (LCS Lite Version).
Estudios de citometría de flujo
Realizamos los estudios de citometría de flujo en un EPICS ELITE cell sorter. Medimos cambios en el potencial de membrana mitocondrial empleando el fluorocromo rodamina 123.
Cuantificación de los resultados
Se realizó la cuantificación de la apoptosis temprana contando el porcentaje de linfocitos marcados con anexina V, respecto del total de linfocitos. Asimismo, la apoptosis tardía se cuantificó contando el porcentaje de linfocitos marcados tanto con anexina V como con yoduro de propidio.
Para la cuantificación de mitocondrias utilizamos el sumatorio de fluorescencia de MitoTracker de cada linfocito. Posteriormente sumamos estos valores y los dividimos por el número total de linfocitos. Así, las unidades que utilizamos son cantidad de fluorescencia por linfocito.
Análisis estadístico de los resultados
El análisis estadístico se realizó con el programa estadístico SPSS versión 11.5. Para la comparación de las poblaciones aplicamos la prueba de la t de Student de normalidad. Para la comparación de medias usamos el test W de Wilcoxon.
RESULTADOS
Estudio de la muerte celular inducida por el péptido beta-amiloide
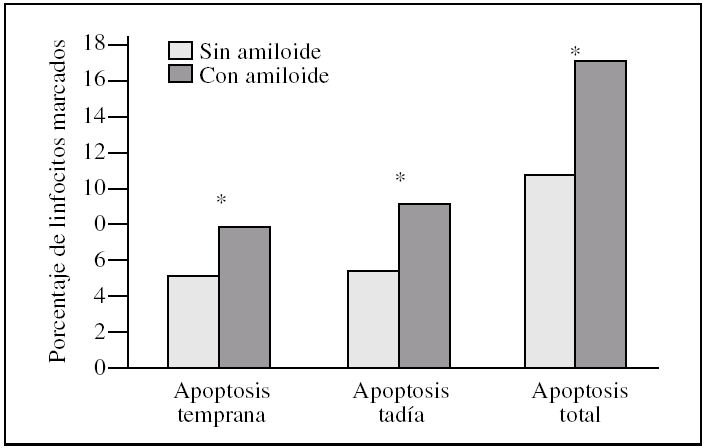
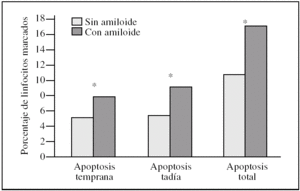
Los linfocitos controles presentaron un 5,4 ± 1,8% de apoptosis temprana (anexina V) frente a un 7,9 ± 3,1% en las muestras tratadas; este resultado fue estadísticamente significativo (p = 0,046) (fig. 1).
Figura 1.Porcentaje de muerte celular en linfocitos tras la incubación con péptido beta-amiloide. La apoptosis se determinó marcando linfocitos con los fluorocromos yoduro de propidio y/o anexina V. Los histogramas corresponden a las medias de 6 individuos. La significación se expresa como *p < 0,05 linfocitos control frente a linfocitos incubados con beta-amiloide.
Para estudiar la apoptosis tardía se contabilizó el porcentaje de linfocitos marcados con anexina V y yoduro de propidio conjuntamente. Encontramos una media del 5,4 ± 3,0% en el control frente a un 9,1 ± 7,9% en las muestras tratadas, con una significación p = 0,028 (fig. 1).
Cuando expresamos los resultados como muerte celular (apoptosis temprana + apoptosis tardía) presentaron un 10,8 ± 3,0% en los controles frente al 17,0 ± 7,2% en las muestras tratadas; estos resultados fueron estadísticamente significativos (p = 0,028) (fig. 1).
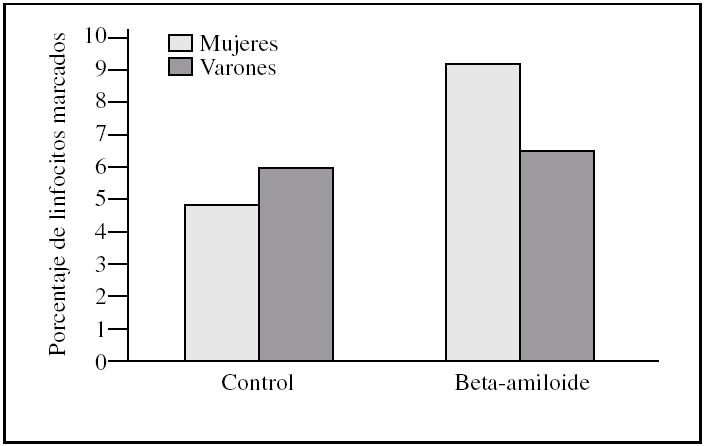
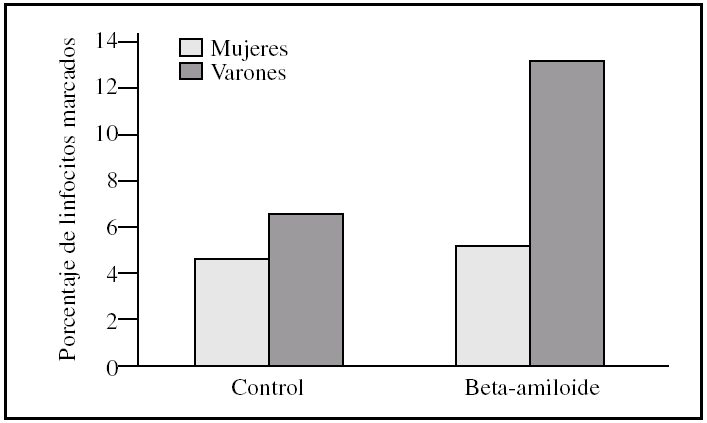
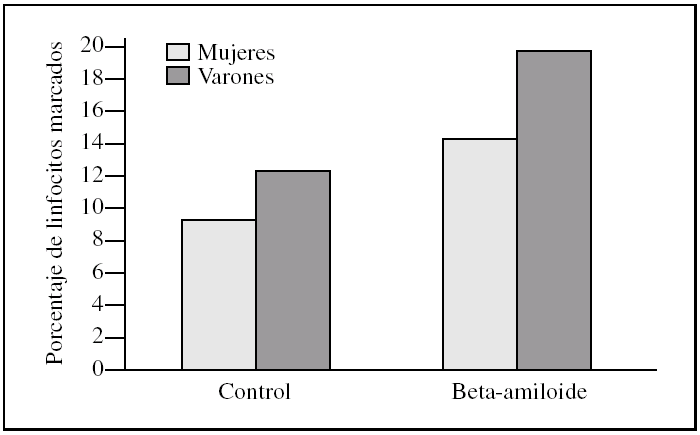
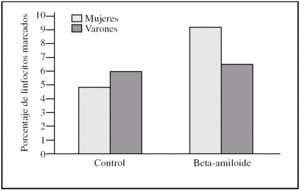
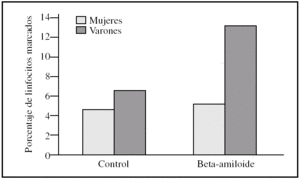
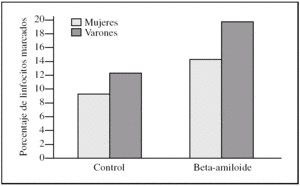
Al estudiar las diferencias entre sexos encontramos que los linfocitos procedentes de varones presentaron una tendencia a ser más susceptibles a la toxicidad del péptido beta-amiloide que los procedentes de mujeres (figs. 2-4). Esta tendencia se observó en el número de linfocitos que mueren tras la incubación. Pero además, los linfocitos procedentes de varones antes de someterlos a tratamiento alguno (control) también presentaron un porcentaje mayor de muerte que los procedentes de mujeres. También cabe destacar que observamos una distinta respuesta a dicho péptido, pues mientras que en las muestras de las mujeres predominó la apoptosis temprana, en las de los varones encontramos que prevalecía la apoptosis tardía (figs. 2-4).
Figura 2.Porcentaje de apoptosis temprana en linfocitos procedentes de varones y mujeres, tras la incubación con péptido beta-amiloide. La apoptosis se determinó marcando linfocitos con anexina V antes y después de la incubación con beta-amiloide 10μM. Los histogramas corresponden a las medias de mujeres (n = 3) y varones (n = 3).
Figura 3.Porcentaje de apoptosis tardía en linfocitos procedentes de varones y mujeres, tras la incubación con péptido beta-amiloide. La apoptosis se determinó marcando linfocitos con yoduro de propidio antes y después de la incubación con beta-amiloide 10μM. Los histogramas corresponden a las medias de mujeres (n = 3) y varones (n= 3).
Figura 4. Porcentaje de apoptosis total en linfocitos procedentes de varones y mujeres, tras la incubación con péptido beta-amiloide. La apoptosis se determinó marcando linfocitos con anexina V y/o yoduro de propidio antes y después de la incubación con beta-amiloide 10μM. Los histogramas corresponden a las medias de mujeres (n = 3) y varones (n = 3).
Estudio de la toxicidad del péptido beta-amiloide en organelas celulares
La incubación de linfocitos con beta-amiloide aumentó el potencial de membrana mitocondrial (3,2 ± 0,6 en ausencia de beta-amiloide frente a 4,0 ± 0,7 en la muestra con beta-amiloide) y esta diferencia fue estadísticamente significativa (p = 0,028). Además, observamos que el potencial de membrana en los linfocitos de los varones fue mayor tanto en los controles (3,4 ± 0,6 en varones frente a 3,0 ± 0,6 en mujeres) como en las muestras tratadas (4,43 ± 0,64 en varones frente a 3,59 ± 0,63 en mujeres), aunque estas diferencias no son estadísticamente significativas.
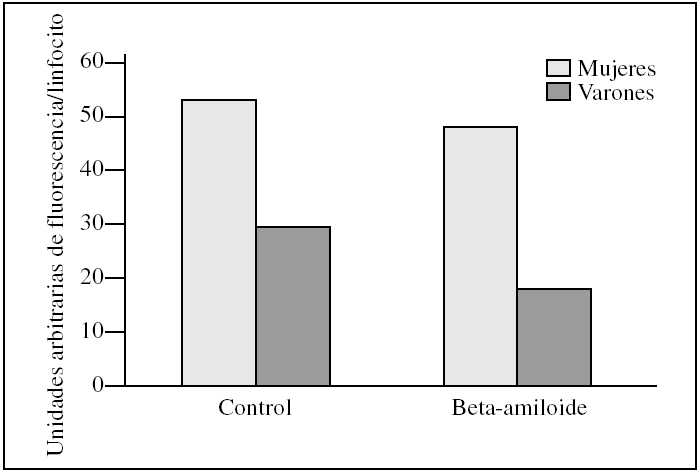
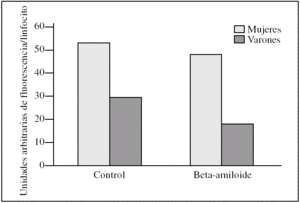
En cuanto a la cuantificación de organelas, hubo mayor número de mitocondrias en las muestras controles procedentes de mujeres. Así las mitocondrias de linfocitos en las mujeres presentaron una media de 53.000 ± 2.200 unidades arbitrarias de fluorescencia por linfocito frente a los varones que tienen 29.700 ± 15.400, con una significación estadística p = 0,06. Al añadir beta-amiloide se observó una disminución de mitocondrias del 9,4% en las mujeres frente al 37,4% en los varones (fig. 5).
Figura 5.Cantidad de mitocondrias presentes en linfocitos de varones y mujeres tras la incubación con el péptido beta-amiloide. Las unidades representan la suma de la fluorescencia (MitoTraker) de todos los linfocitos de la muestra dividido por el número de linfocitos. Se compara esta fluorescencia entre varones y mujeres antes y después de la incubación con beta-amiloide. Los histogramas corresponden a las medias de mujeres (n = 3) y varones (n = 3).
DISCUSIÓN
El beta-amiloide es un péptido que proviene de la proteólisis de la proteína precursora del amiloide. Se sabe que este péptido es excretado al exterior de la neurona y forma las placas seniles. Además existe evidencia sobre la toxicidad intracelular del péptido beta-amiloide1 que produce estrés oxidativo y activa la apoptosis por medio de una alteración en la función mitocondrial5.
Encontrar marcadores periféricos en la enfermedad de Alzheimer es el objetivo de muchos trabajos desde hace tiempo, tanto en fluidos biológicos como líquido cefalorraquídeo, plasma y orina6,7, y en células periféricas como son los leucocitos y fibroblastos3,4,8. Pese a que los leucocitos tienen el inconveniente de ser más susceptibles que los fibroblastos a factores como la dieta o los fármacos, también tienen la enorme ventaja de poder obtenerse sin necesidad de utilizar métodos invasivos. Estos marcadores periféricos no sólo son útiles para ayudar al clínico en la ardua tarea del diagnóstico de las enfermedades neurodegenerativas sino que también ayudan al estudio de la patología y al ensayo de nuevas dianas terapéuticas.
También en este sentido encontramos muchos trabajos que intentan detectar alteraciones en sujetos presintomáticos, así se ha visto alteraciones funcionales cerebrales utilizando la tomografía de emisión de positrones (PET) en sujetos jóvenes con riesgo genético de EA. Estos trabajos son muy útiles a la hora de encontrar tratamientos preventivos en grupos de riesgo9.
En este trabajo hemos descrito un buen modelo celular periférico útil para estudiar la toxicidad del péptido beta-amiloide ya que los linfocitos son células periféricas nucleadas, de gran accesibilidad y de fácil aislamiento y cultivo.
Hemos demostrado que el péptido beta-amiloide provoca muerte celular por apoptosis, corroborando los resultados de otros autores en neuronas o líneas celulares2,10,11. Además, hallamos linfocitos en distintas fases de apoptosis: una apoptosis muy precoz, como demuestra el aumento del potencial de membrana mitocondrial12, una apoptosis precoz marcada por la captación de anexina V13,14 y que estaría mostrando la externalización de la fosfatidilserina, y una apoptosis tardía que ponemos de manifiesto con la captación del yoduro de propidio y que indica la rotura de la membrana celular15,16.
También confirmamos una toxicidad intracelular que afecta directamente a las mitocondrias, como demuestra el aumento del potencial de membrana mitocondrial. En este sentido, diversos estudios han encontrado que en las primeras fases del proceso apoptótico, previo a la externalización de la fosfatidilserina y a la disrupción de la membrana celular, se produce un aumento del potencial de membrana mitocondrial asociado a un aumento de radicales libres. Nuestros resultados corroboran estos experimentos12,17.
Cuando comparamos los resultados obtenidos en varones y mujeres, encontramos mayor muerte celular y mayor potencial de membrana mitocondrial en los linfocitos controles procedentes de los varones así como una tendencia a la disminución de la cantidad de mitocondrias. Tras la incubación con el péptido beta-amiloide también existe mayor daño en los linfocitos de los varones, así encontramos más apoptosis tardía y apoptosis total en éstos. Además, observamos una tendencia a presentar menor número de mitocondrias que en las mujeres. Probablemente debido al tamaño de la muestra, las diferencias mencionadas no son estadísticamente significativas. Creemos que estos hallazgos están relacionados con el papel protector de los estrógenos en las mujeres. Muchos son los estudios en esta línea y se ha visto que los estrógenos disminuyen la muerte celular en cultivos asociada a excitotoxicidad, estrés oxidativo o exposición a tóxicos. Este efecto tiene relación con la menor producción de radicales libres y mayor expresión de genes antioxidantes en las mitocondrias de las mujeres premenopáusicas18,19. Además, se sabe que los estrógenos desempeñan una función importante en la enfermedad de Alzheimer20,21. Haber detectado estas diferencias de sexo en nuestra muestra indica que los estudios que utilizan como modelo linfocitos aislados son válidos para analizar la toxicidad del beta-amiloide.
Este estudio nos da la base para realizar nuevos experimentos, con muestras de linfocitos, para el estudio de la toxicidad del péptido beta-amiloide.
CONCLUSIONES
Los linfocitos son un buen modelo periférico para estudiar la toxicidad celular del beta-amiloide.
Pensamos que estos hallazgos son importantes para iniciar vías de investigación sobre patogenia, detección y prevención de la EA utilizando muestras de fácil acceso y reproducibilidad.
Este trabajo ha sido financiado gracias al Premio de la SEGG 2004 de investigación en Geriatría y Gerontología concedido a JVR, como investigador principal, y gracias a los proyectos SAF2004-03755 cuyo investigador principal es el Dr. José Viña y el proyecto GV2004-A-112 cuya investigadora principal es la Dra. Ana Lloret.
Correspondencia: Dr. J. Viña Ribes.
Departamento de Fisiología. Facultad de Medicina. Universidad de Valencia.
Avda. Blasco Ibáñez, 15. 46010 Valencia. España.
Correo electrónico: jose.vina@uv.es
Recibido el 23-12-05; aceptado el 24-01-06.