La edad es el mayor factor de riesgo para el cáncer colorrectal, encontrándose un 70% de los casos en mayores de 70 años. Por este motivo nos propusimos realizar una revisión del tratamiento quirúrgico y quimioterápico del cáncer de colon y recto en el anciano. Para ello se realizó una búsqueda en PubMed incluyendo palabras como elderly, surgery, colorectal cancer, chemotherapy, radiotherapy y oncogeriatrics, y se seleccionaron los artículos de revisión y originales sobre tratamiento del cáncer colorrectal en el anciano. Con los resultados obtenidos se desarrolla de forma narrativa la evidencia más actualizada en el tratamiento de esta patología. Aunque el tratamiento del cáncer colorrectal está estandarizado, en el caso del anciano es necesario realizar una valoración geriátrica integral previa antes de decidir el tipo de tratamiento, con el objetivo de ofrecer estas pautas estandarizadas a ancianos robustos y adaptarlas en los pacientes frágiles.
Age is the biggest risk factor for colorectal cancer, with 70% of the cases in patients over 70 years old. For this reason, a review is presented on the surgical treatment and chemotherapy of cancer of colon and rectum in the elderly. A search was performed in PubMed, including words such as elderly, surgery, colorectal cancer, chemotherapy, radiotherapy, and oncogeriatrics, and review articles and originals on treatment of colorectal cancer in the elderly were selected. A narrative form was developed from the latest evidence with the results obtained on the treatment of this pathology. Although the treatment of colorectal cancer is standardised, a prior comprehensive geriatric assessment is required in the case of the elderly, before deciding the type of treatment in order to offer these robust elderly-standardised guidelines for the robust elderly and adapt them for use in fragile patients.
El cáncer colorrectal es el tercer tipo de cáncer más frecuente en el hombre, después del de pulmón y próstata y el segundo en la mujer, después del de mama. El 8% de todas las muertes por cáncer se atribuyen al cáncer de colon, situándose en la cuarta causa de muerte por cáncer1.
Se estima que la incidencia aumentará un 45% para el año 2030, y que el aumento será mayor para los más viejos (hasta un aumento del 67% para los ancianos, mientras que en los adultos se espera un aumento del 11%). En el año 2030 alrededor del 70% de los cánceres serán diagnosticados en ancianos2.
La edad es el mayor factor de riesgo para el cáncer colorrectal. La incidencia aumenta con la edad, con una mediana de edad de los diagnosticados de 70 años. Como se estima en la base de datos The Surveillance, Epidemiology, and End Results (SEER), aproximadamente el 70% de los casos se desarrollan en mayores de 65 años y el 40% en mayores de 753,4. El estudio European Cancer Registry EUROCARE-55 ha publicado datos de supervivencia del 59,5% en pacientes con cáncer de colon de 65-74 años, mientras que en los pacientes entre 45 y 54 años fue del 62,4%, resultando una pequeña diferencia, aunque en este trabajo la población de estudio no es muy mayor.
El mismo estudio EUROCARE ha mostrado una mejoría de la supervivencia por cualquier tipo de cáncer —excepto el cervical— en el periodo de 1988-1999, pero esta mejoría es más lenta en el anciano6. Estos peores resultados medidos en menor supervivencia se han atribuido a varios factores, como menor estatus socioeconómico, acceso limitado al sistema de salud y comorbilidad que puede condicionar el manejo del paciente.
En la misma línea, otros autores sugieren que la realización de pruebas diagnósticas e intervenciones terapéuticas menos agresivas puede ser uno de los factores que más afecten a la peor supervivencia del cáncer colorrectal (26,05 vs. 36, 41 meses) en este grupo de edad en edades 81,8 vs. 63,1 años respectivamente7,8. De hecho, se ha observado una menor mortalidad estandarizada por edad entre 1998 y 2005 en los ancianos americanos con cáncer colorrectal respecto a los europeos (158,7 vs. 208,5), atribuida a que los primeros realizan el diagnóstico más precoz y un abordaje más agresivo mediante cirugía y quimioterapia adyuvante9,10. Por otro lado, según los resultados de un estudio holandés, el pronóstico a largo plazo de los pacientes mayores con cáncer colorrectal (60-89 años) que sobrevivieron al primer año es parecido al de los adultos11.
Con todos estos datos se puede deducir que a los pacientes mayores con buen estado de salud, se les debe ofrecer un tratamiento de cirugía, quimioterapia o radioterapia adyuvante o paliativa similar al de los adultos para evitar la menor supervivencia relacionada con menos oportunidades terapéuticas. La clave estará en distinguir entre la edad biológica y cronológica de los ancianos y seleccionar el tratamiento más adecuado para cada paciente. De manera añadida, la Sociedad de Oncología Geriátrica (SIOG) ha recomendado que los pacientes mayores de 65 años con cáncer colorrectal subsidiarios de cirugía deberían ser evaluados antes de la intervención desde el punto de vista integral (físico, mental y social), y en aquellos que se detecte deterioro de la función física o psicológica, se recomienda implicar a un geriatra en su manejo12.
Por estos motivos nos propusimos realizar una revisión del tratamiento quirúrgico y quimioterápico del cáncer de colon y recto en el anciano. Para ello se realizó una búsqueda incluyendo palabras relacionadas con el tema. Combinando elderly, surgery y colorectal cancer se encontraron 3.068 artículos; sustituyendo surgery por chemotherapy y radiotherapy se encontraron 204, y cambiando estas 2 palabras por oncogeriatrics se obtuvieron 616 referencias bibliográficas. Se seleccionaron 118 artículos, algunos de revisión sobre cáncer colorrectal en ancianos y otros en los que se incluían ancianos o comparaban el tratamiento entre adultos y ancianos.
Tratamiento del cáncer colorrectalCirugía de cáncer de colon en el ancianoLa mayoría de los pacientes con estadios I y II de cáncer colorrectal se tratan y curan con cirugía. Para pacientes con estadio III de cáncer de colon el tratamiento estándar es cirugía seguido de quimioterapia adyuvante. En cáncer de colon metastásico la quimioterapia sola o en combinación con tratamientos biológicos es la elección, aunque cada vez se recomienda más el abordaje multidisciplinar para elegir la mejor opción terapéutica adaptada al perfil del paciente, especialmente ante la valoración de la resección de metástasis.
En el cáncer de recto el tratamiento va desde cirugía solamente hasta quimiorradioterapia previa a cirugía y posterior quimioterapia adyuvante.
En las últimas décadas, el porcentaje de pacientes mayores intervenidos por cáncer colorrectal ha subido del 57,5 al 72,1%, lo que puede haber contribuido a mejorar la supervivencia13. Pero, por otro lado, la edad se asocia con mayor mortalidad perioperatoria tras resección colorrectal electiva (5,9% en mayores de 75 años frente al 2,1% en pacientes entre 55-75 años)14, junto con mayor frecuencia de complicaciones y estancia hospitalaria que pueden ser esperables en ancianos con alto grado de comorbilidad15. La mitad de los pacientes mayores de 80 años que fallecen tras cirugía de cáncer colorrectal lo hacen en el primer año y un tercio en el primer mes, sin embargo, la mortalidad cáncer específica es similar en mayores y menores de 75 años, relacionándose más con complicaciones cardiorrespiratorias14,16.
Octogenarios y nonagenarios suelen tener peores resultados en términos de morbimortalidad y reingresos, resultando predictores de mala evolución la cirugía urgente, el número de comorbilidades y el estadio avanzado. Por ello, sugieren que el tratamiento de casos complejos se realice en hospitales con mucha experiencia y recursos para atender a estos pacientes en el perioperatorio17.
La cirugía en cáncer colorrectal avanzado, estadio IV, está indicada si se presentan algunas complicaciones como sangrado, obstrucción o perforación o si tienen metástasis potencialmente resecables. Durante la evaluación inicial se debe considerar la resección de la metástasis pulmonar o hepática, cambiando el objetivo de paliativo a curativo. Pero de los pacientes que optan a este tipo de cirugía, solo el 6% eran mayores de 70 años en los años noventa, aunque ese porcentaje ha ascendido hasta el 25,8% en 2007. Los resultados de mortalidad son algo superiores al adulto, pero no inaceptables (la mortalidad 2 meses después de la cirugía en >70 años fue de 3,8% versus 1,6% en adultos, y la supervivencia a 3 años fue de 57,1% vs. 60,2% para jóvenes)18.
Estos datos sugieren que la edad no es la única variable que influye en la mortalidad o mala evolución, por lo que no debe ser una variable determinante a la hora de seleccionar el tratamiento. Pero sí es cierto que el anciano, cuando se complica, evoluciona peor. Por tanto se deben tener en cuenta factores como estadio de la enfermedad, comorbilidad, esperanza de vida, situación cognitiva y funcional basal antes de decidir el tratamiento e intervenir en la detección precoz y tratamiento de complicaciones y en la vigilancia hasta el primer año, que es el periodo de tiempo en que se concentra el riesgo.
Medidas pre y posquirúrgicas que pueden reducir el riesgo de complicaciones en el paciente geriátricoEvitar cirugía de urgencia y utilizar métodos poco invasivos (stent y laparoscopia)La presencia de obstrucción o perforación triplica la mortalidad perioperatoria en pacientes mayores. Varios estudios muestran correlación entre edad avanzada, mortalidad y cirugía de urgencia19. Otras complicaciones que también aumentan tras cirugía urgente colorrectal son insuficiencia respiratoria, fallo renal, sepsis y dehiscencia de sutura, todas ellas relacionadas también con mayor mortalidad20, por ello la cirugía de urgencia debería evitarse en la medida de lo posible.
La realización de una colostomía es una opción fácil, pero solo en la mitad de los ancianos se revierte en un segundo tiempo21.
Una alternativa posible para el manejo urgente de la obstrucción colónica podría ser colocar un stent metálico expandible vía endoscópica, especialmente si es en el colon izquierdo, liberando temporalmente la obstrucción. Este procedimiento permite tiempo extra para mejorar la situación clínica del paciente, el estado nutricional, las comorbilidades y a veces permite una cirugía programada, aunque con resultados controvertidos respecto a morbimortalidad comparada con la cirugía urgente22. Algunos estudios han mostrado mayor porcentaje de anastomosis primaria sin riesgo de más complicaciones locales23 y menor morbilidad con menos estancia utilizándolo como puente a la cirugía programada (5-7 días después)24, y sin embargo la Cochrane no encuentra beneficio en morbimortalidad comparada con la cirugía urgente25.
Técnicas mínimamente invasivas, como cirugía laparoscópica, han demostrado mayor beneficio en el anciano en términos de estancia hospitalaria, morbimortalidad, mejor recuperación funcional y menos dolor, con menos uso de opioides, por lo que algunos autores lo consideran de primera elección en el anciano26. Además, este tipo de cirugía conlleva menos complicaciones cardiovasculares, pulmonares, íleo posquirúrgico, menor pérdida hemática y una recuperación gastrointestinal más rápida27,28.
Aunque no se dispone de suficiente evidencia por infrarrepresentación de los ancianos en los estudios de cirugía laparoscópica, se piensa que la menor respuesta inflamatoria secundaria a una menor agresión quirúrgica puede contribuir a sufrir menos complicaciones29.
Programas de prehabilitación y rehabilitación multimodalLos programas de prehabilitación consisten en una evaluación física y psicológica desde el momento del diagnóstico para conocer los riesgos del paciente e introducir medidas previas a la intervención terapéutica del cáncer con el fin de corregir la malnutrición, optimizar complicaciones cardiopulmonares, diabetes, racionalizar el tratamiento farmacológico, promover el abandono del tabaco y mejorar la situación funcional mediante ejercicio30. Medidas como el inspiratory muscle training (IMT), programas de mantenimiento de la función cardiovascular y entrenamiento mediante ejercicio físico aeróbico y de resistencia, en el periodo desde el diagnóstico hasta la intervención, han logrado disminuir complicaciones cardiorrespiratorias y una mejor recuperación funcional con menos dolor y menor estancia hospitalaria31.
De todas formas, la Enhanced recovery after surgery guidelines (ERAS) para pacientes con cirugía de cáncer colorrectal ha descrito estas medidas de prehabilitación como inconsistentes por falta de estudios aleatorizados, falta de adherencia y necesidad de prolongar el tiempo prequirúrgico para conseguir el beneficio32.
Los programas de rehabilitación multimodal y los programas de recuperación rápida o fast track comparten algunas medidas como mínimo ayuno perioperatorio, evitan la preparación intestinal, retirada precoz de sondas nasogástrica y vesical, anestesia y analgesia adaptadas al paciente y movilización y dieta precoz en el postoperatorio. Aunque, a pesar de todo ello, el número total de complicaciones es superior en los más mayores33, las ventajas de este abordaje son una recuperación funcional más rápida, menos complicaciones cardiopulmonares por utilizar el neumoperitoneo a baja presión (8mmHg), menos estancia, reingresos y visitas a urgencias34.
La asociación de laparoscopia y programas fast track ofrece mejores resultados en términos de estancia, costes, reingresos y reintervenciones28.
Intervención geriátrica especializadaLa intervención geriátrica especializada, organizada y coordinada en el hospital mejora aspectos como la supervivencia hasta un año después de la cirugía y la posibilidad de continuar en su domicilio un año después de la intervención35-37, por lo que la colaboración entre Oncología y Geriatría puede ser muy útil en el manejo de estos pacientes38.
Quimioterapia para cáncer de colon en el ancianoLas circunstancias fisiopatológicas asociadas al envejecimiento como una menor función hepatorrenal, menor reserva de médula ósea, mayor prevalencia de deterioro cognitivo, comorbilidades, polifarmacia y mayor riesgo cardiovascular favorecen la toxicidad secundaria a la quimioterapia, con la consiguiente repercusión en la calidad de vida del paciente y en su adherencia al tratamiento. Se han utilizado los puntos de corte de algunas escalas como 60 puntos o menos del Karnofski o 3-4 en Eastern Cooperative Oncology Group (ECOG) para desestimar la quimioterapia en estos pacientes considerados frágiles y con alto riesgo de complicaciones, aunque, como se comentará posteriormente, una valoración geriátrica puede aportar más información pronóstica útil para ayudar a la toma de decisiones39-42.
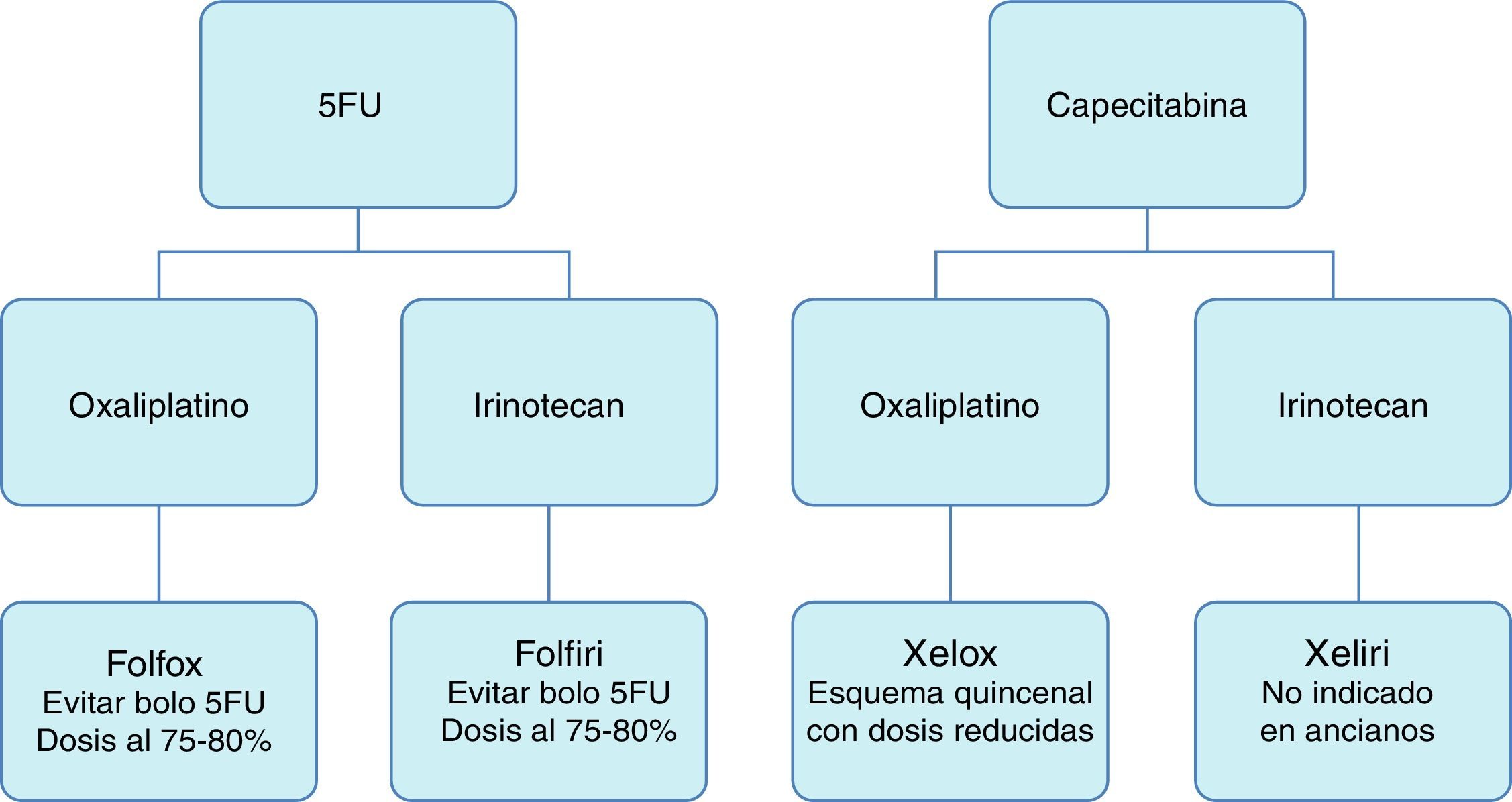
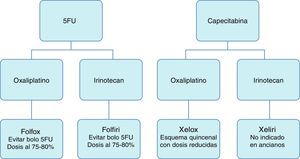
En la figura 1 aparecen las combinaciones de quimioterápicos más habituales.
El objetivo de la quimioterapia en el estadio II sería erradicar las posibles micrometástasis de enfermedad residual posterior a la cirugía y se ofrece a pacientes con cáncer colorrectal estadio II con factores de riesgo (T4, perforación, CEA preoperatorio elevado, <12 ganglios regionales resecados, invasión linfovascular o perineural o histología pobremente diferenciada). Se ha estandarizado la medición de la inestabilidad de microsatélites (MMR gene deficiency) como factor pronóstico y predictivo. Los tumores con déficit de los genes de reparación de microsatélites tienen mejor pronóstico y no obtienen beneficio con la administración de 5-fluorouracilo (5FU) y derivados43-45.
Algunos estudios muestran similar supervivencia con o sin quimioterapia en estadio II46 y otros muestran un beneficio marginal del 3,6% en mayores de 70 años47. Un estudio aleatorizado comparando la adición de oxaliplatino a un esquema de quimioterapia basada en 5FU mostró ausencia de beneficio con el esquema de oxaliplatino (supervivencia global a 5 años del 75,8% vs. 76,1% con 5FU), por lo que en el estadio II solo se recomienda tratamiento de quimioterapia con FU o derivados en pacientes con factores de riesgo (alto riesgo) o con estabilidad o inestabilidad baja de los genes de MMR (IMS-L o MSS)48,49.
Quimioterapia adyuvante en estadio IIIEl uso de 5 fluorouracilo-leucovorina (5FU/LV) comparado con cirugía sin quimioterapia consigue una reducción del riesgo de muerte a 5 años del 29%, así como reducción de supervivencia libre de enfermedad (SLE). Este beneficio se observa en todas las edades y con similar toxicidad, salvo hallazgo de algún estudio con mayor neutropenia en ancianos50,51, sin embargo, la necesidad de colocación de un reservorio subcutáneo para la administración de 5FU en infusión continua hace que habitualmente sea preferible el uso de capecitabina cuando existe indicación de monoterapia.
La capecitabina es tan eficaz como 5FU en mayores de 70 años, como se demuestra en la actualización del estudio X-ACT y en el estudio inicial de Twelves et al. con una supervivencia global o supervivencia libre de enfermedad que se mantienen en ≥70 años en los estadios III. En cuanto a la toxicidad, la diarrea y el síndrome mano-pie son más frecuentes con capecitabina y, sin embargo, la administración actual de 5FU/LV en infusiones continuas ha disminuido mucho la neutropenia, fiebre neutropénica, náuseas y estomatitis respecto a la administración en bolo52,53.
Según los resultados de 3 estudios (MOSAIC, NSABP-C-07 y XELOXA)54-56, el tratamiento combinado de quimioterápicos con oxaliplatino es considerado un estándar de tratamiento en pacientes adultos con estadio III de cáncer de colon. En el estudio MOSAIC, se consiguen resultados de supervivencia a 6 años sobre el 78,5%, reducción del riesgo de recurrencia del 20% (estadísticamente significativa para estadios II y III) y reducción del riesgo de muerte a 6 años del 16% (significativa solo para estadios III), con beneficio dudoso para mayores de 65 años. Estas dudas sobre el potencial beneficio en población de edad avanzada tampoco se resuelven en los otros 2 estudios.
Analizando un subgrupo del estudio MOSAIC48, al igual que en NSABP-C-0755 y el análisis de la base de datos de ACCENT que incluyen regímenes con oxaliplatino57, no se encontró que este fármaco aportara beneficio en supervivencia global o supervivencia libre de enfermedad, en el estadio II o en pacientes mayores de 70-75 años en estadios II o III, pero sí mayor toxicidad grado 4 (20% vs. 13%)48,54,58. En la misma línea apunta la actualización de los datos de la base ACCENT publicada en 201358.
A pesar de que el oxaliplatino es ampliamente aceptado y utilizado en la adyuvancia en estadios III, su uso es incierto en ancianos y no se debe olvidar la neuropatía que produce a largo plazo, años después del tratamiento59.
Quimioterapia en cáncer de colon metastásicoQuimioterápicosEl manejo del cáncer colorrectal en estadio IV ha cambiado en la última década con el creciente uso de los agentes biológicos y el desarrollo de los avances quirúrgicos. El 20% de los pacientes tienen metástasis hepáticas cuando se les diagnostica y, de esos, el 33-50% son mayores de 70 años60.
Existen guías europeas y americanas que recogen recomendaciones de tratamiento para los diferentes estadios de la enfermedad desde un punto de vista multidisciplinar. Concretamente, la ESMO (europea) clasifica a los pacientes con enfermedad metastásica en grupos «fit» y «unfit». Los «fit»(clasificados con base en características del tumor y del paciente) se tratan con todos los medios disponibles, independientemente de la edad. Los «unfit» (catalogados así por su comorbilidad y escasa reserva orgánica) se subdividen en recuperables, si tienen condiciones médicas que son susceptibles de mejorar, y no recuperables. Los recuperables pueden recibir tratamientos estándar con dosis reducidas o con fármacos con menor toxicidad, y a los «unfit» no recuperables se les debería ofrecer solamente tratamiento de soporte, ya que la toxicidad sería más evidente que el posible beneficio.
Los pacientes ancianos pueden entrar en cualquiera de los grupos y entre los objetivos terapéuticos hay que tener en cuenta la curación (posible en enfermedad oligometastásica), la disminución máxima y rápida de la carga tumoral (ya sea para intentar una resección curativa o para controlar los síntomas) y el enlentecimiento de la progresión de la enfermedad cuando esta no es curable o el paciente es frágil, intentando prolongar la supervivencia con la mejor calidad de vida61.
El beneficio en porcentajes de respuesta y supervivencia global hasta 24 meses de 5FU está probado y establecido, y es similar en jóvenes y mayores62. Los efectos adversos son similares en ambos grupos de edad, salvo más mucositis, diarrea y leucopenia en el anciano, especialmente con los bolos63.
Con respecto a la capecitabina, es la alternativa oral más importante y usada en monoterapia para cáncer colorrectal avanzado tras demostrar efectividad y buena tolerancia en ancianos robustos64. Pero es más tóxica que 5FU en terapia combinada, especialmente por la diarrea. La toxicidad cardiológica de estos fármacos (5FU y derivados) siempre debe tenerse presente por el mayor riesgo de patología cardiaca silente en edades más avanzadas.
Los resultados en cuanto a supervivencia global y supervivencia libre de progresión con irinotecán no son diferentes según la edad cronológica65, pero sí se puede intuir una mayor toxicidad hematológica y digestiva que requieren reducciones de dosis frecuentes. Las combinaciones de irinotecán con capecitabina no se contemplan en los pacientes ancianos de forma habitual por la toxicidad digestiva y astenia. Sin embargo, los esquemas de combinación con 5FU en infusión continua demuestran de forma no consistente mejor tasa de respuesta y supervivencia libre de progresión66,67.
Regímenes combinados que contienen oxaliplatino como FOLFOX (con 5FU) o XELOX (con capecitabina) son ampliamente utilizados en los pacientes ancianos a pesar de estar muy poco representados en los estudios iniciales (solo aproximadamente un 20% de los pacientes incluidos tenían ≥70 años). Esto se debe a que presentan una adecuada tolerancia y eficacia, pero con frecuentes reducciones de dosis. En estos esquemas, como en los jóvenes, la toxicidad limitante es la neuropatía periférica.
Se han diseñado algunos estudios para pacientes mayores frágiles (FOCUS2 y FFCD 2001-2002)68,69 observándose buena tolerancia y eficacia de las combinaciones descritas previamente, pero en un grupo de enfermos muy seleccionados.
El estudio FOCUS2 incluye a 459 pacientes (un 43% de ≥75 años frágiles) descartados para quimioterapia a dosis plenas y comparan 5FU solo en infusión, o con oxaliplatino, capecitabina sola o con oxaliplatino (todos con dosis al 80% de las dosis estándar). Concluye que la adición de oxaliplatino a cualquiera de los 2 (5FU o capecitabina) no mejora de forma significativa la supervivencia libre de progresión (5,8 meses vs. 4,5 meses) ni aumenta significativamente la toxicidad (quizá porque se administró una dosis menor). Lo que sí aumenta la toxicidad es reemplazar 5FU por capecitabina, repercutiendo negativamente en la calidad de vida. El FOCUS2 muestra que la valoración integral supone un predictor de que el paciente se puede beneficiar del tratamiento68.
El estudio FFCD 2001-2002 es un estudio prospectivo aleatorizado con 282 pacientes ≥75 años con cáncer colorrectal multimetastásico tratados con primera línea de quimioterapia paliativa con 5FU con o sin irinotecán que evalúa los factores relacionados con toxicidad. En el brazo de asociación con irinotecán hubo mayor toxicidad grado 3 y 4 (61% vs. 39%) requiriendo más hospitalización y reducción de dosis. En el análisis multivariante, los predictores de toxicidad grado 3, 4 fueron ser tratado con irinotecán, deterioro funcional y cognitivo MMSE <27/3069.
La quimioterapia a dosis plenas, por tanto, ha de ser una decisión muy cautelosa en mayores de 75 años, con baja autonomía y deterioro cognitivo, además de considerar la comorbilidad y el perfil de toxicidad farmacológica.
Agentes biológicosTambién han demostrado beneficio los nuevos agentes biológicos (anticuerpos monoclonales anti-EGFR, frente al receptor de factor de crecimiento epidermoide y antiangiogénicos) en tratamiento del cáncer de colon metastásico en términos de tasa de respuesta y supervivencia, pero siempre en combinación con quimioterapia. Se les denomina «biológicos» porque actúan sobre una diana específica, que se supone «alterada» de alguna manera en el cáncer de colon (sobreexpresión, mutación, etc.).
El bajo perfil de toxicidad de los anticuerpos anti-EGFR (cetuximab y panitumumab), los convierte en fármacos muy interesantes para esta población. De hecho se utilizan ampliamente en este contexto en segunda-tercera línea cuando han fracasado los tratamientos previos o de entrada en aquellos pacientes que son frágiles y no pueden soportar un esquema de quimioterapia estándar. Sin embargo, solo el 40% de la población puede acceder a este fármaco, ya que solo es activo en pacientes que no tienen una mutación de la molécula intracitoplasmática RAS (en sus isoformas Kras y Nras).
Se dispone de más datos en la población anciana con bevacizumab (anticuerpo monoclonal dirigido contra el factor de crecimiento endotelial vascular [VEGF]), que está demostrando aumentos de supervivencia libre de enfermedad y global cuando se compara con la quimioterapia sola, aunque con más efectos secundarios tromboembólicos, HTA y hemorragias en mayores de 65 años70.
Datos del reciente estudio AVEX, aleatorizado, multicéntrico en fase III, que investigó la eficacia y seguridad de añadir bevacizumab a capecitabina o capecitabina solo en pacientes mayores, demostró que la supervivencia libre de progresión era significativamente mayor en el grupo de bevacizumab (9,1 vs. 5,1 meses p<0,0001), con mayor tasa de respuesta (19% vs. 10% p=0,04) pero sin diferencia en la supervivencia global. Los 280 pacientes del estudio eran mayores de 70 años y se les consideró no susceptibles de tratarles con oxaliplatino o irinotecán. Los pacientes con tratamiento combinado tuvieron más hemorragia, HTA, eventos tromboembólicos y proteinuria (40% vs. 22%), aunque la toxicidad grado 3/4 fue similar, sugiriendo que capecitabina con bevacizumab aporta eficacia y buena tolerancia, independientemente de la edad (hasta 85 años)71. Los resultados fueron consistentes con otros estudios72-74 y en general se consideró un tratamiento seguro, siendo en la actualidad una de las combinaciones preferidas para el tratamiento de los ancianos en este estadio. También se dispone de medicación eficaz para los ancianos cuando existe una progresión a una primera línea de quimioterapia con oxaliplatino, ya que el anticuerpo monoclonal anti-VEGFR aflibercept, en combinación con FOLFIRI (irinotecán+5FU) como segunda línea de tratamiento en cáncer de colon metastásico mejora la tasa de respuesta (19,8% vs. 11,1%) y la supervivencia (13,5 meses vs. 12,1 meses) frente a FOLFIRI solo, y se benefician todos los subgrupos, incluidos los pacientes mayores (≥65 años) y los tratados previamente con otro antiangiogénico (bevacizumab). Sin embargo, también se observan más efectos secundarios, sobre todo vasculares: hemorragia, tromboembolismo, HTA y proteinuria75.
Tras los diversos estudios aleatorizados realizados inicialmente con cetuximab (anticuerpo monoclonal anti-EGFR murino) y panitumumab (anticuerpo monoclonal anti-EGFR humanizado) que demostraban aumento de la tasa de respuesta y supervivencia en cáncer de colon metastásico RAS no mutado o nativo cuando se combinaban con esquemas de quimioterapia basadas en 5FU en infusión continua, se ha querido indagar su eficacia en población anciana.
En el estudio de Jehn et al.76, la población, habitualmente ≥65años, se comparaba con jóvenes, en distintas combinaciones de cetuximab con quimioterapia, en monoterapia y en varias líneas de tratamiento, demostrando de forma persistente el mismo beneficio en respuesta y supervivencia que los jóvenes (tasa de respuesta 37,9% vs. 35,4% y supervivencia libre de progresión similar en ambos grupos de edad (entre 6,5 y 7 meses). Folprecht et al.77, en un análisis conjunto de pacientes ancianos ≥70 años de 2 estudios aleatorizados de cetuximab con FOLFIRI y FOLFOX respectivamente (CRYSTAL y OPUS), demostraron que la edad no interfería en el beneficio y tampoco aumentaba la toxicidad (supervivencia global equivalente para ambos grupos de 23 meses).
Otro estudio español78 fase II dirigido específicamente a la población anciana frágil (no candidata a quimioterapia), tratados con panitumumab, con una mediana de edad de 81 años, mostró también ser un tratamiento seguro y eficaz (54,5% de estabilizaciones, con una mediana de supervivencia libre de progresión de 7,9 meses y de supervivencia global de 12,3 meses).
Por tanto, pacientes mayores con mala situación funcional y comorbilidades se pueden tratar de forma segura y efectiva con cetuximab como segunda o tercera línea de tratamiento.
En resumen, la mejora de la supervivencia conseguida por la utilización secuencial de combinaciones de quimioterápicos más biológicos en cáncer colorrectal metastásico ha sido importante, siendo actualmente de más de 30 meses desde el diagnóstico. Este beneficio se ha relacionado con la utilización de todos los fármacos activos y disponibles para el cáncer de colon (5FU y/o derivados, irinotecán, oxaliplatino, cetuximab o panitumumab en RAS nativos, bevacizumab, aflibercept), siendo similar en jóvenes y mayores robustos. Aunque los resultados no son los mismos para pacientes frágiles, tampoco se puede dejar de ofrecer un tratamiento ajustado a este grupo de población (quimioterapia en monoterapia, combinaciones de quimioterapia a dosis reducidas o combinaciones de biológicos con quimioterapia) dado que también pueden obtener beneficios en términos de retraso en la progresión y/o control de síntomas, especialmente si el deterioro que presenten estuviera más relacionado con la enfermedad oncológica que con su comorbilidad previa. En estos casos las opciones de tratamiento son: monoterapia con capecitabina, ocasionalmente irinotecán, con o sin asociación de cetuximab, anticuerpos anti-EGFR en monoterapia (siempre en pacientes RAS nativo, ya que los mutados obtienen peores resultados), o la combinación de capecitabina con bevacizumab; sin olvidar los cuidados de soporte y/o paliativos, que en ocasiones son la única opción44,79.
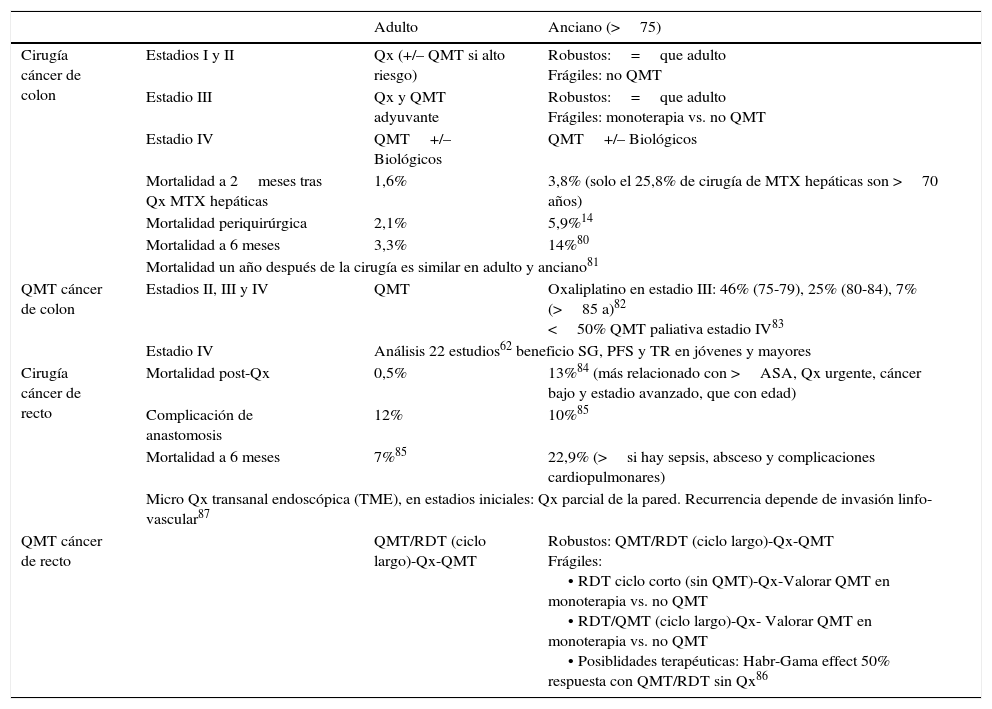
En la tabla 1 se resumen algunas diferencias entre el cáncer colorrectal del adulto y el del anciano14,62,80-87.
Diferencias en el cáncer colorrectal entre adultos y ancianos
| Adulto | Anciano (>75) | ||
|---|---|---|---|
| Cirugía cáncer de colon | Estadios I y II | Qx (+/– QMT si alto riesgo) | Robustos:=que adulto Frágiles: no QMT |
| Estadio III | Qx y QMT adyuvante | Robustos:=que adulto Frágiles: monoterapia vs. no QMT | |
| Estadio IV | QMT+/– Biológicos | QMT+/– Biológicos | |
| Mortalidad a 2meses tras Qx MTX hepáticas | 1,6% | 3,8% (solo el 25,8% de cirugía de MTX hepáticas son >70 años) | |
| Mortalidad periquirúrgica | 2,1% | 5,9%14 | |
| Mortalidad a 6 meses | 3,3% | 14%80 | |
| Mortalidad un año después de la cirugía es similar en adulto y anciano81 | |||
| QMT cáncer de colon | Estadios II, III y IV | QMT | Oxaliplatino en estadio III: 46% (75-79), 25% (80-84), 7% (>85 a)82 <50% QMT paliativa estadio IV83 |
| Estadio IV | Análisis 22 estudios62 beneficio SG, PFS y TR en jóvenes y mayores | ||
| Cirugía cáncer de recto | Mortalidad post-Qx | 0,5% | 13%84 (más relacionado con >ASA, Qx urgente, cáncer bajo y estadio avanzado, que con edad) |
| Complicación de anastomosis | 12% | 10%85 | |
| Mortalidad a 6 meses | 7%85 | 22,9% (>si hay sepsis, absceso y complicaciones cardiopulmonares) | |
| Micro Qx transanal endoscópica (TME), en estadios iniciales: Qx parcial de la pared. Recurrencia depende de invasión linfo-vascular87 | |||
| QMT cáncer de recto | QMT/RDT (ciclo largo)-Qx-QMT | Robustos: QMT/RDT (ciclo largo)-Qx-QMT Frágiles: • RDT ciclo corto (sin QMT)-Qx-Valorar QMT en monoterapia vs. no QMT • RDT/QMT (ciclo largo)-Qx- Valorar QMT en monoterapia vs. no QMT • Posiblidades terapéuticas: Habr-Gama effect 50% respuesta con QMT/RDT sin Qx86 | |
MTX: metástasis; PFS: supervivencia libre de progresión; QMT: quimioterapia; Qx: cirugía; RDT: radioterapia; SG: supervivencia global; TR: tasa de respuesta.
La tabla 2 muestra recomendaciones generales de la SIOG y otros autores44,79.
Recomendaciones prácticas de quimioterapia en ancianos con cáncer de colon
| Cáncer de colon estadio II | Beneficio de QMT adyuvante es controvertido |
| Cáncer de colon estadio III: • Monoterapia capecitabina o 5FU en infusión continuaa, indicado en mayores de 70 años • XELOX y FOLFOX en estadio III: beneficio incierto en ancianos. Individualizar | Estadio III y esperanza de vida >5 años: • Sin comorbilidad: individualizar dosis plenas con oxaliplatino • Vulnerables: reducción de dosis (FOLFOX 6 modificado sin bolos o XELOX quincenal) • Pacientes frágiles no se benefician de poliquimioterapia |
| Quimioterapia paliativa, estadio IV | Ancianos robustos pueden beneficiarse de QMT combinada (FOLFIRI, FOLFOX o XELOX) añadiendo bevacizumab o cetuximab, con similar TR y PFS que adultos |
| Pacientes más vulnerables | Posibilidades: • Monoterapia con capecitabina • Esquemas de 5FU con dosis reducidas de oxaliplatino • Bevacizumab con menor dosis de capecitabina |
5FU: 5-fluorouracilo; FOLFIRI: leucovorina (ácido folínico), fluorouracilo e irinotecán; FOLFOX: leucovorina (ácido folínico), fluorouracilo y oxaliplatino; PFS: supervivencia libre de progresión; QMT: quimioterapia; TR: tasa de respuesta; XELOX: oxaliplatino y capecitabina.
Aproximadamente 1/3 de los cánceres colorrectales son de localización rectal, con grandes variaciones de manejo en los ancianos, que se traducen en el menor uso de radioterapìa y quimioterapia que en los adultos12.
El tratamiento estándar en el cáncer de recto es cirugía mesorrectal en los estadios I y II. En estadio III se plantea quimiorradioterapia preoperatoria, seguido de cirugía y de quimioterapia adyuvante, y en estadios avanzados se recomienda un abordaje multidisciplinar88,89.
CirugíaEl objetivo de la cirugía de cáncer rectal en ancianos no es solo evitar la recurrencia local, también es importante mantener la función y la salud en general. Algunos ancianos pueden aceptar mayor riesgo de recurrencia con tal de evitar un estoma.
Más que la edad, son la fragilidad y la función preoperatoria del esfínter (evaluado clínicamente y si es necesario con manometría) los que van a determinar la indicación y el tipo de cirugía. Preservar el esfínter puede provocar peor situación funcional con mayor riesgo de incontinencia anal pero también se debe considerar el efecto de la colostomía sobre la calidad de vida90, teniendo en cuenta que la edad se asoció con menor probabilidad de revertir una colostomía91.
La cirugía rectal es técnicamente más exigente que las colectomías. La escisión mesorrectal total es el tratamiento estándar y conlleva severas complicaciones en los ancianos. Esto condiciona un infratratamiento en este grupo de edad con menor acceso a cirugía radical y tratamiento multimodal, sustituyéndolo por una escisión local que conlleva peores resultados92.
Sin embargo, la mortalidad cáncer específica a 5 años es comparable entre adultos y ancianos, lo que apoya un pronóstico intrínseco de la enfermedad similar en ambos grupos de edad93.
A pesar de que la dehiscencia de sutura tiene una incidencia similar (10 y 12% de pacientes, ya sean mayores o jóvenes), la evolución de los ancianos con esta complicación fue mucho peor, dado que fallecieron más de la mitad (57,1%). La mortalidad en los 6 meses posteriores a la cirugía aumenta también desde el 7 al 22,9% en ancianos que han sufrido complicaciones como sepsis, absceso o complicaciones cardiorrespiratorias, frente a los jóvenes94.
Por otro lado, un estudio multicéntrico encontró un aumento en la morbilidad posquirúrgica y en la mortalidad en pacientes ancianos (13% en mayores de 80 años y 0,5% en menores de 50 años), resultados más relacionados con el grado ASA, cirugía de urgencia, cáncer rectal bajo y estadio del tumor, que con la edad en sí84.
Estos datos apoyan la necesidad que tienen estos pacientes de la estrecha vigilancia de un equipo multidisciplinar durante al menos el primer año por el elevado riesgo de complicaciones y de mortalidad, no siempre atribuida al propio cáncer.
La cirugía laparoscópica rectal podría ser una buena opción en el paciente anciano con riesgo de complicaciones cardiopulmonares que no superarían una cirugía radical y que rehúsan el estoma, aportando mejor recuperación de la función intestinal, y menor estancia con posibilidad de disminuir las recurrencias. Sin embargo, no hay evidencia de resultados en pacientes mayores porque la media de edad de los pacientes incluidos en los estudios es de 69 años95,96.
Quimioterapia y radioterapia en cáncer de rectoEl tratamiento estándar para el cáncer de recto con afectación locorregional (estadios III y >IIA) es la quimioterapia y radioterapia concomitante, previa a la cirugía, que reduce la mortalidad (por disminución de la tasa de recidiva a distancia y local) frente a la cirugía sola. El quimioterápico que se usa de forma más fecuente es la capecitabina, aunque algunos prefieren administrar 5FU en infusión continua con recambio semanal. La radioterapia sola mejora el control local, pero no aumenta la supervivencia. Tras la cirugía se ha de administrar un tratamiento de quimioterapia adyuvante. Algunos estadios IIA con factores de riesgo (debatidos ampliamente en los comités de tumores) también son susceptibles de este manejo terapéutico.
El tratamiento neoadyuvante (previo a la cirugía) disminuye de una forma muy significativa la toxicidad digestiva de la radioterapia respecto a su administración posterior (adyuvancia).
Con relación a la población anciana, la radioterapia neoadyuvante ha demostrado beneficio para el control local de la enfermedad en mayores de 70 años, comparado con no darlo o radioterapia posterior97, aunque otros muestran un beneficio inferior en mayores de 75 años98.
En algunos estudios han observado mayor mortalidad por causa no oncológica, especialmente cardiovascular, sobre todo en ancianos tras radioterapia99, así como mayor incidencia de enteritis, tromboembolismo venoso, fracturas de pelvis y fémur, obstrucción intestinal y fístulas en mayores de 80 años90,100.
Todavía nos falta evidencia sobre las pautas de quimiorradioterapia en ancianos, ya que en algunos estudios retrospectivos muestran similar tolerancia a la de los jóvenes101 y en otros trabajos, la mayoría de los ancianos precisan reducción de dosis, interrupción o finalización precoz del tratamiento102.
Sin embargo, como se ha comentado previamente en el cáncer de colon, si el paciente anciano no se considera frágil y tiene criterios de neoadyuvancia con quimiorradioterapia, se intenta aplicar el protocolo completo, aunque posteriormente requiera ajustes de dosis para llegar hasta el final con el tratamiento.
Se puede reducir la toxicidad de la radioterapia modulando su intensidad. Otra opción es la radioterapia de contacto endocavitaria aplicada localmente para estadios T1 y T2 en cáncer de recto medio y distal. Esta pauta se asocia con morbilidad tardía mínima y control de la enfermedad a largo plazo superior al 80%103. La braquiterapia intraluminal permite una dosis alta de radiación en la superficie de la mucosa rectal, reduciendo la exposición del resto de estructuras a la radiación, con resultados de hasta el 29% de respuesta completa104. En la tabla 3 se presentan pautas de radioterapia en caso de cirugía radical de cáncer de recto44.
RDT en casos de Qx radical de cáncer de recto
| RDT 5×5Gy una semana antes de la Qx o QMT/RDT 6-8 semanas antes de la Qx |
| Curso largo de RDT si no tolera QMT asociada a RDT |
| Tumores inextirpables QMT y RDT ciclo largo es de elección |
| Si se precisa disminución del tumor previo a Qx: esperar 6-12 semanas a la respuesta |
| RDT externa en tumores inoperables o con objetivo paliativo |
| Braquiterapia intraluminal a altas dosis, técnica útil en ancianos evitando el canal anal |
Gy: gray; Qx: cirugía; QMT: quimioterapia; RDT: radioterapia.
Fuente: Papamichael et al.44.
Hay un creciente interés en la búsqueda de un tratamiento más conservador para pacientes mayores frágiles. Varios autores han propuesto esperar y ver en los casos con respuesta patológica completa tras tratamiento neoadyuvante, especialmente para pacientes que se les presupone mala calidad de vida tras cirugía o si tienen bajo riesgo de recurrencia. Smith et al. publicaron un estudio comparando cirugía radical vs. observación tras tratamiento neoadyuvante en casos de respuesta patológica completa. Clasificaron 3 grupos de edad (60 años y 80 años saludables y 80 años con comorbilidad). Concluyeron que los ancianos con mayor riesgo quirúrgico se beneficiaron más de esperar y ver, con mejor supervivencia un año después105.
En la misma línea, teniendo en cuenta que la quimiorradioterapia neoadyuvante ha logrado en un grupo de pacientes (44%) respuesta clínica completa y reducción de las recurrencias, Habr-Gama et al. decidieron observar la evolución de la enfermedad sin cirugía posterior. Encontraron que el 51% estaban libres de enfermedad 56 meses después, por lo que no precisaron cirugía. Los pacientes que tras quimiorradioterapia tienen una regresión tumoral y regresión de los nódulos linfáticos podrían ser candidatos a observación sin escisión mesorrectal. Esta puede ser una opción para los pacientes que después de la valoración geriátrica multidimensional se decide que son vulnerables y que tendrían elevado riesgo de complicaciones perioperatorias86.
Estas decisiones son aproximaciones terapéuticas sin gran evidencia científica ya que el tratamiento definitivo que elimina el tumor es la cirugía, y la respuesta completa radiológica no condiciona una respuesta completa patológica. Por otro lado, en la práctica habitual, el tratamiento radioterápico se ofrece cuando se va a proceder a la intervención quirúrgica, de lo contrario no se les somete a la toxicidad de la radioterapia.
Lo que sí se suele hacer con más frecuencia es evitar la quimioterapia adyuvante posterior si el paciente es muy frágil.
Beneficio de la intervención de geriatría en el abordaje del cáncer en el ancianoA pesar de la alta prevalencia del cáncer colorrectal en ancianos y de su peor pronóstico, no se cuenta con suficiente evidencia científica para tratar esta patología en este grupo de población, ya que en los ensayos clínicos, con frecuencia excluyen a personas mayores106.
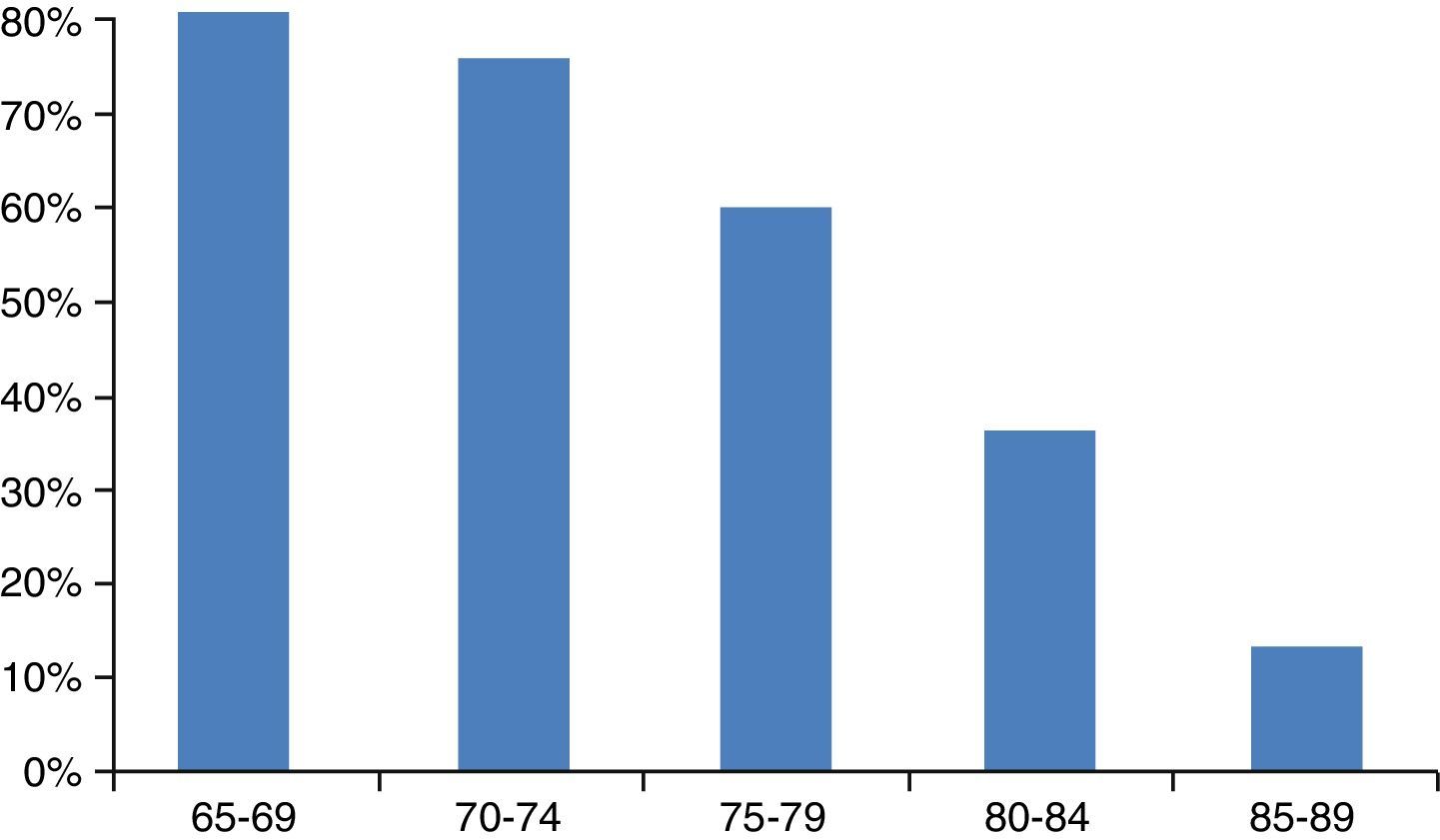
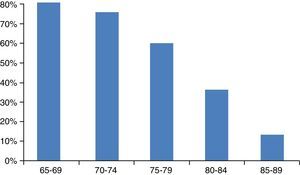
Por ello, tampoco hay guías de práctica clínica adaptadas a estos pacientes que ayuden a tomar las decisiones terapéuticas. El hecho de extrapolar los resultados de los ensayos realizados en adultos y utilizar quimioterápicos en ancianos con pluripatología conlleva alto riesgo de complicaciones. Pero tampoco se debe negar el tratamiento basado únicamente en el criterio de la edad (fig. 2)107. Por ello, una valoración geriátrica adecuada debe ayudar a dilucidar el riesgo-beneficio de cada actuación.
Probabilidad de recibir quimioterapia según la edad.
Fuente: Schrag et al.107.
El National Comprehensive Cancer Network (NCCN) de Estados Unidos y la SIOG han recomendado que la valoración geriátrica integral (VGI) puede ayudar a los oncólogos a decidir el mejor tratamiento para los pacientes ancianos12,108.
El principal objetivo de la valoración geriátrica integral es guiar las intervenciones geriátricas y seleccionar el tratamiento oncológico oportuno para cada paciente, evaluando el riesgo-beneficio de cada intervención terapéutica. Sin embargo, la colaboración del geriatra en la toma de decisiones es solo la punta del iceberg de todo el beneficio que puede aportar en la atención a estos pacientes38 (tabla 4).
Beneficio de la intervención del geriatra en el paciente oncogeriátrico
| 1. Tras la valoración geriátrica se puede individualizar en qué pacientes se mantienen los métodos de screening de determinados cánceres109 |
| 2. Screening de fragilidad |
| 3. Valoración y tratamiento de la situación cognitiva y del estado de ánimo y evaluar la capacidad del paciente en la toma de decisiones |
| 4. Estimación de la expectativa de vida110 |
| 5. Valoración del número y severidad de comorbilidades y ajuste terapéutico |
| 6. Evaluación y tratamiento de condiciones que influyen en la evolución y tolerancia al tratamiento oncoespecífico: malnutrición, polifarmacia, depresión, deterioro cognitivo y funcional, fragilidad, riesgo social110-112 |
| 7. Mediante la VGI, detección de problemas no identificados con la exploración habitual113 |
| 8. Capacidad para predecir efectos adversos: toxicidad de QMT, deterioro cognitivo y funcional, complicaciones posquirúrgicas, interacciones farmacológicas114-117 |
| 9. Informar al paciente del riesgo de complicaciones, deterioro funcional, cognitivo y posible necesidad de mayores cuidados tras el tratamiento quirúrgico y/o quimioterápico |
| 10. Participación en programas de prehabilitación y fast track, optimizando nutrición, cardiopulmonar y tratamiento farmacológico30 |
| 11. Seguimiento previo al tratamiento oncoespecífico y participación en los comités de tumores |
| 12. Seguimiento durante los ingresos, especialmente durante el periodo perioperatorio para detección precoz y tratamiento de las complicaciones médicas |
| 13. Seguimiento ambulatorio durante el primer año del diagnóstico, en el cual se concentra el mayor grado de morbimortalidad en el anciano |
| 14. Integración de los cuidados paliativos en los pacientes con síntomas, independientemente de la fase de la enfermedad |
| 15. Colaborar en la selección del tratamiento oncológico oportuno para cada paciente, evaluando el riesgo/beneficio de cada intervención terapéutica108 |
| 16. Valorar lo que el paciente espera del tratamiento118 |
QMT: quimioterapia; VGI: valoración geriátrica integral.
El tratamiento del cáncer colorrectal en el anciano consiste en ofrecer las pautas estandarizadas en el anciano robusto e individualizar el tratamiento en los pacientes frágiles. La elevada prevalencia de esta enfermedad en la población mayor hace recomendable investigar los tratamientos, sin excluir a los pacientes por edad o por fragilidad.
El geriatra debe colaborar en el equipo multidisciplinar para el tratamiento del anciano con cáncer desde el momento del diagnóstico, como asesoramiento en el tipo de tratamiento, en la prevención y detección precoz de complicaciones y en la recuperación física y funcional tras la cirugía o quimiorradioterapia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.