Se ha descrito que el riesgo de fractura en pacientes con diabetes mellitus (DM) esta aumentado. Nuestro objetivo fue investigar la posible asociación entre DM y fractura de cadera y los factores de riesgo asociados mediante una revisión sistemática de la literatura.
MétodosPara identificar los estudios relevantes publicados desde enero de 2001 hasta agosto de 2018 se utilizaron las bases PubMed y SCOPUS. Se seleccionaron los estudios en los cuales se evidenciaba el riesgo estimado de fractura de cadera comparando grupos de pacientes diabéticos con no diabéticos. También se seleccionaron los estudios que investigaban los posibles factores de riesgo para dicha asociación.
ResultadosSe evaluaron un total de 27 artículos que cumplían los criterios de inclusión. Se observó una asociación entre DM y fractura de cadera en mujeres y hombres diabéticos con respecto a aquellos individuos no diabéticos. En cuanto a los factores de riesgo detectados, los más importantes fueron que la DM fuese de tipo 1, asociado probablemente a una mayor duración de la misma DM, y el ser mujer.
ConclusionesExiste un riesgo aumentado de tener una fractura de cadera en los pacientes diagnosticados de DM. Esta asociación es más importante en los pacientes con DM tipo 1 y en las mujeres.
It has been reported that the risk of fracture is increased in patients with diabetes mellitus (DM). The aim of this study was to investigate the possible relationship between DM and hip fracture, as well as any associated risk factors, by means of a systemic review of the literature.
MethodsPubMed and SCOPUS databases were used to search for relevant studies published from January 2001 to August 2018. Retrospective and prospective cohort studies were selected in which the estimated risk of hip fracture was demonstrated by comparing groups of diabetic patients with non-diabetics. A search was also made for risk factors independent from the association between DM and hip fracture.
ResultsA total of 27 articles that fulfilled the inclusion criteria were included. A clear association was observed in diabetic patients (women and men) compared to non-diabetics patients. Among the risk factors, the most important ones were the fact that diabetes was type 1, probably associated with greater risk to a longer duration of DM, and being a female.
ConclusionsThere is an increased risk of hip fracture in patients diagnosed with DM. This association is more significant in diabetes type 1 and women.
La incidencia global de diabetes mellitus (DM) ha ido aumentando sustancialmente en las últimas décadas. En España más de un tercio de la población mayor de 75 años es diabética1. Es este aumento de la incidencia y prevalencia de la diabetes lo que la convierte en un problema de salud pública de primer orden2. La mayoría de los pacientes con diabetes corresponden al tipo 2 (DM2), mientras que solo un 5-10% corresponden al tipo 1 (DM1).
Otro grave problema de salud pública, especialmente en las personas mayores, es el de la osteoporosis, siendo su complicación más temida la fractura de cadera por fragilidad3. La fractura de cadera en ancianos se asocia a un importante aumento en la morbimortalidad4,5.
En los últimos años ha aumentado el interés por conocer la posible interacción entre estas 2 patologías. Existen datos sobre los efectos adversos que produce la DM, tanto tipo 1 como tipo 2, en la integridad esquelética y el riesgo elevado de fractura6–8. Se ha demostrado, entre otros factores, que la hiperglucemia asociada con la acumulación de productos finales de glucosilación avanzada en la matriz del hueso produce inhibición en su formación6. Los niveles alterados de insulina y la resistencia a esta afectan a la remodelación del hueso de forma directa, efecto mediado a través de los receptores que presentan los osteoblastos, osteoclastos y osteocitos con el resultado final de un hueso de peor calidad, y por lo tanto, con mayor riesgo de fracturas7. La densidad mineral ósea (DMO) de los pacientes con DM suele ser normal o incluso elevada, y el riesgo de fractura parece depender de dicha peor calidad del hueso, además de otros factores como un mayor riesgo de caídas (hipoglucemias, neuropatías, retinopatías, etc.)8,9. También se ha reportado el posible efecto nocivo en el metabolismo óseo de alguno de los diferentes fármacos implicados en el tratamiento de la DM10. Por ello el objetivo de este estudio fue realizar una revisión sistemática de las publicaciones previas que evalúan la epidemiologia y los factores de riesgo entre la DM y la fractura de cadera.
Material y métodosRevisión sistemática de las referencias bibliográficasSe realizó una revisión sistemática de la literatura de acuerdo con las pautas consignadas en la guía PRISMA (http://prisma-statement.org) siguiendo las etapas de identificación, cribado, elegibilidad e inclusión expuestas en la misma. Para la gestión de la referencias se utilizó el gestor bibliográfico Mendeley versión 1.17.12.
Esta revisión está basada en un análisis cualitativo de referencias bibliográficas encontradas en las bases de datos y bibliotecas de PubMed/Medline y SCOPUS.
Se efectuó una búsqueda bibliográfica de los estudios publicados a partir de enero de 2001 hasta agosto de 2018. Se seleccionaron solo aquellos artículos publicados en castellano e inglés. La estrategia de búsqueda fue amplia, basada en las palabras clave «diabetes» o «diabetes mellitus» o «type 1 diabetes» o «type 2 diabetes» en combinación con palabras clave relacionadas con fractura de cadera («hip fracture»). Solo se evaluó la investigación en humanos y no en animales de experimentación. La revisión bibliográfica se completó con una búsqueda manual de las referencias bibliográficas identificadas en los artículos de la estrategia de búsqueda cuando fue necesario.
Selección de estudioEntre los estudios hallados solo se seleccionaron aquellos que cumplieron los siguientes criterios:
- 1.
Estudios epidemiológicos observacionales.
- 2.
Estudios que evaluaban factores de riesgo de fractura de cadera en DM.
- 3.
Estudios en poblaciones de personas de 18 o más años de edad.
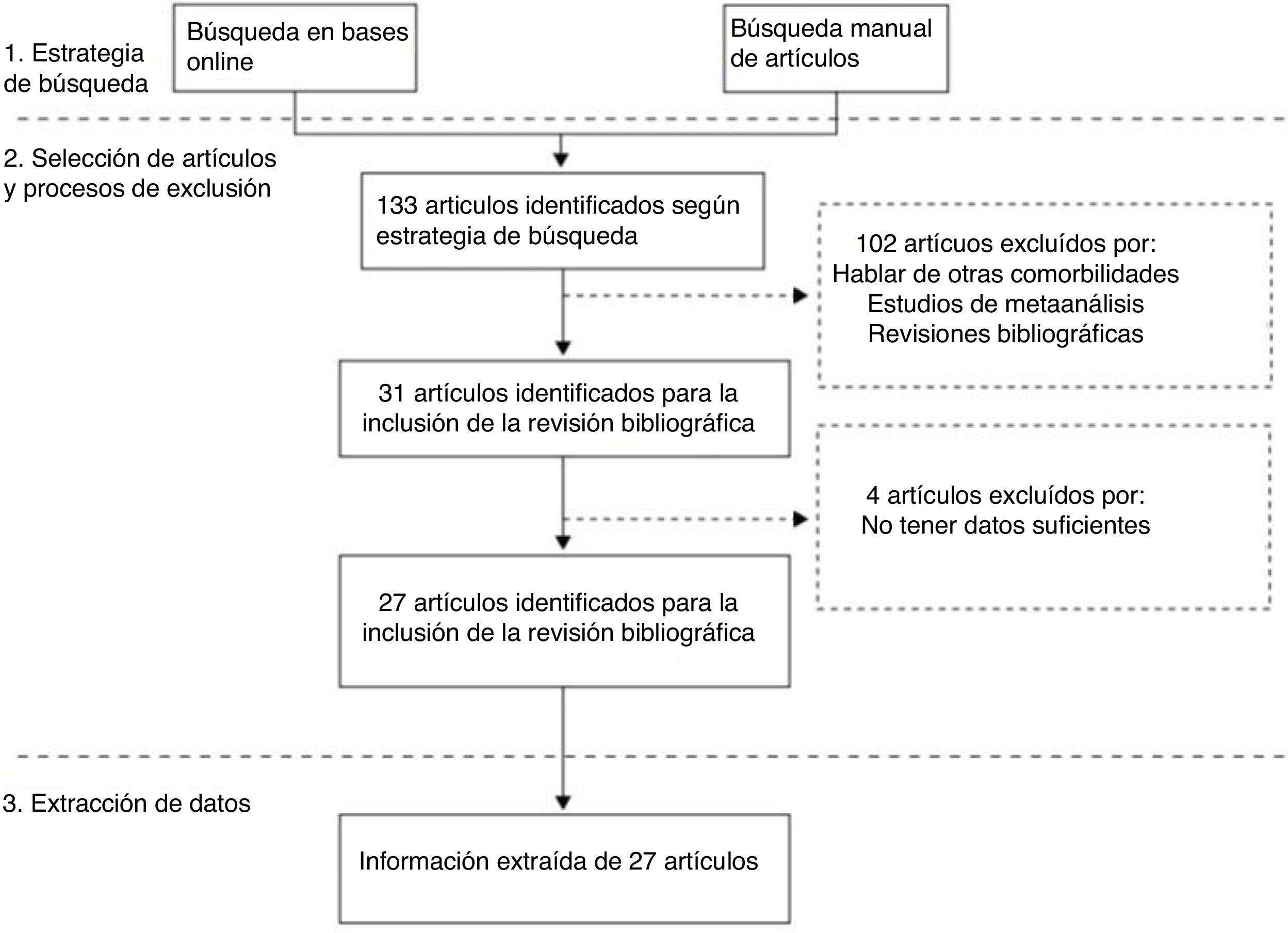
Se excluyeron los estudios que ya por sí eran una revisión sistemática y los metaanálisis. Tampoco se incluyó ningún estudio con citación duplicada. En cuanto a los artículos que evaluaban fracturas en general en personas con DM solo se evaluaron los que tenían datos específicos de fractura de cadera. Finalmente se incluyeron 27 artículos. En la figura 1 se muestra el diagrama de flujo de la selección final de los artículos incluidos.
Extracción de la información a partir de los estudios seleccionadosDos revisores, MDFF y FF extrajeron la información de los artículos. Las diferencias se resolvieron por consenso con otro investigador de medicina interna (AM). Los estudios seleccionados fueron agrupados para facilitar el análisis de los resultados. El control de calidad de la información se llevó a cabo mediante tablas, ordenadas por autor. Todos los datos relevantes se resumieron en dichas tablas, con la siguiente información: autores, año de publicación, diseño del estudio, edad de la población incluida, país, periodo de estudio, tipo de DM y sexo de los pacientes incluidos, cuantificación del riesgo de la asociación/factores de riesgo detectados y principales variables de control.
ResultadosEstudiosNuestra búsqueda identificó 133 estudios, se excluyeron 102 por no cumplir los criterios comentados anteriormente y 4 estudios por ser los datos insuficientes. Finalmente se incluyeron 27 que sí cumplían los criterios de inclusión (fig. 1). En la tabla 1 se han incluido 15 estudios con datos epidemiológicos de la asociación entre DM y fractura de cadera, mientras que la tabla 2 muestra los 22 estudios que incluían además información de los diversos factores de riesgo que se han reportado asociados a fractura de cadera en pacientes con DM.
Resumen de los hallazgos de los estudios epidemiológicos
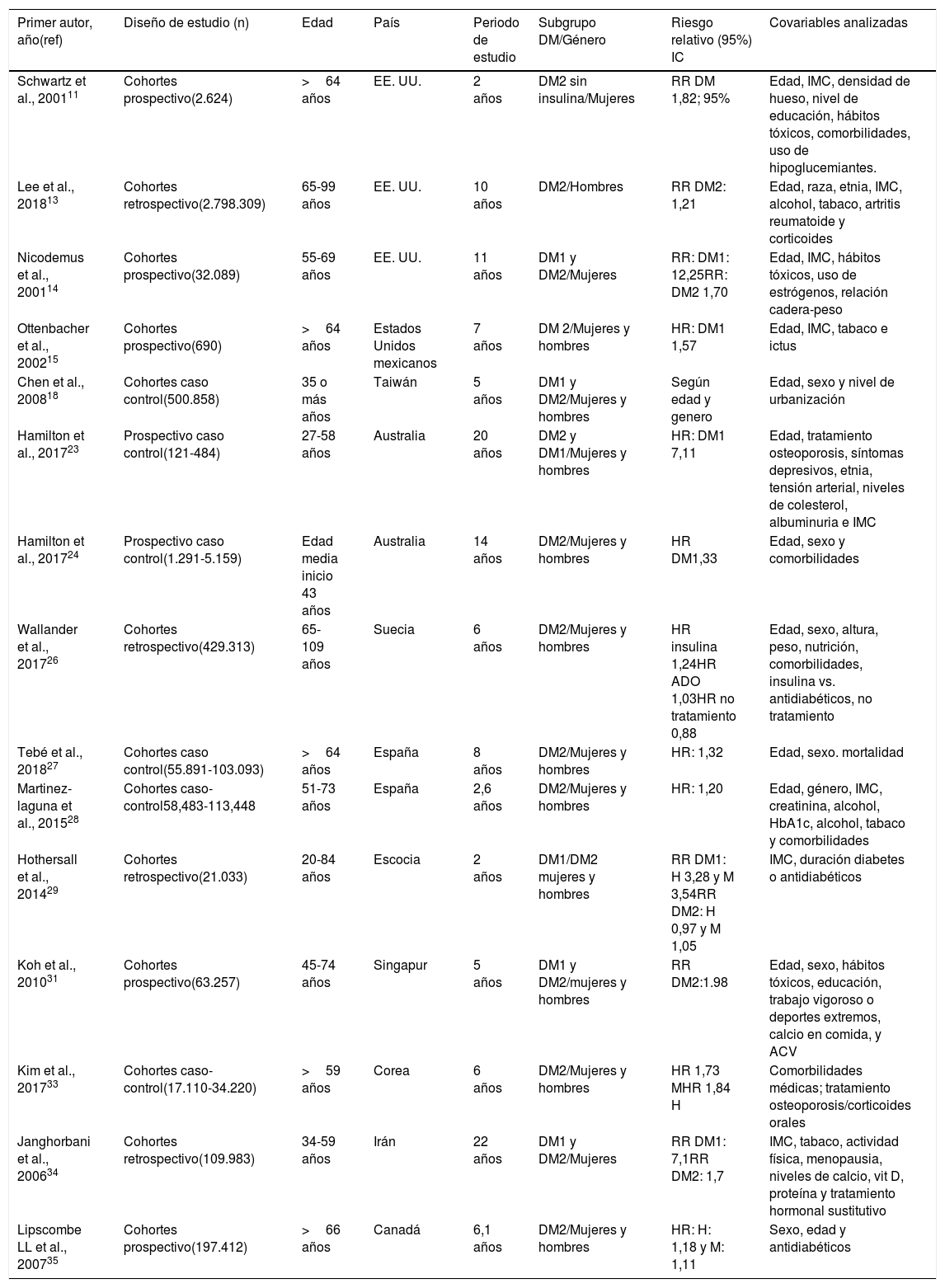
| Primer autor, año(ref) | Diseño de estudio (n) | Edad | País | Periodo de estudio | Subgrupo DM/Género | Riesgo relativo (95%) IC | Covariables analizadas |
|---|---|---|---|---|---|---|---|
| Schwartz et al., 200111 | Cohortes prospectivo(2.624) | >64 años | EE. UU. | 2 años | DM2 sin insulina/Mujeres | RR DM 1,82; 95% | Edad, IMC, densidad de hueso, nivel de educación, hábitos tóxicos, comorbilidades, uso de hipoglucemiantes. |
| Lee et al., 201813 | Cohortes retrospectivo(2.798.309) | 65-99 años | EE. UU. | 10 años | DM2/Hombres | RR DM2: 1,21 | Edad, raza, etnia, IMC, alcohol, tabaco, artritis reumatoide y corticoides |
| Nicodemus et al., 200114 | Cohortes prospectivo(32.089) | 55-69 años | EE. UU. | 11 años | DM1 y DM2/Mujeres | RR: DM1: 12,25RR: DM2 1,70 | Edad, IMC, hábitos tóxicos, uso de estrógenos, relación cadera-peso |
| Ottenbacher et al., 200215 | Cohortes prospectivo(690) | >64 años | Estados Unidos mexicanos | 7 años | DM 2/Mujeres y hombres | HR: DM1 1,57 | Edad, IMC, tabaco e ictus |
| Chen et al., 200818 | Cohortes caso control(500.858) | 35 o más años | Taiwán | 5 años | DM1 y DM2/Mujeres y hombres | Según edad y genero | Edad, sexo y nivel de urbanización |
| Hamilton et al., 201723 | Prospectivo caso control(121-484) | 27-58 años | Australia | 20 años | DM2 y DM1/Mujeres y hombres | HR: DM1 7,11 | Edad, tratamiento osteoporosis, síntomas depresivos, etnia, tensión arterial, niveles de colesterol, albuminuria e IMC |
| Hamilton et al., 201724 | Prospectivo caso control(1.291-5.159) | Edad media inicio 43 años | Australia | 14 años | DM2/Mujeres y hombres | HR DM1,33 | Edad, sexo y comorbilidades |
| Wallander et al., 201726 | Cohortes retrospectivo(429.313) | 65-109 años | Suecia | 6 años | DM2/Mujeres y hombres | HR insulina 1,24HR ADO 1,03HR no tratamiento 0,88 | Edad, sexo, altura, peso, nutrición, comorbilidades, insulina vs. antidiabéticos, no tratamiento |
| Tebé et al., 201827 | Cohortes caso control(55.891-103.093) | >64 años | España | 8 años | DM2/Mujeres y hombres | HR: 1,32 | Edad, sexo. mortalidad |
| Martinez-laguna et al., 201528 | Cohortes caso-control58,483-113,448 | 51-73 años | España | 2,6 años | DM2/Mujeres y hombres | HR: 1,20 | Edad, género, IMC, creatinina, alcohol, HbA1c, alcohol, tabaco y comorbilidades |
| Hothersall et al., 201429 | Cohortes retrospectivo(21.033) | 20-84 años | Escocia | 2 años | DM1/DM2 mujeres y hombres | RR DM1: H 3,28 y M 3,54RR DM2: H 0,97 y M 1,05 | IMC, duración diabetes o antidiabéticos |
| Koh et al., 201031 | Cohortes prospectivo(63.257) | 45-74 años | Singapur | 5 años | DM1 y DM2/mujeres y hombres | RR DM2:1.98 | Edad, sexo, hábitos tóxicos, educación, trabajo vigoroso o deportes extremos, calcio en comida, y ACV |
| Kim et al., 201733 | Cohortes caso-control(17.110-34.220) | >59 años | Corea | 6 años | DM2/Mujeres y hombres | HR 1,73 MHR 1,84 H | Comorbilidades médicas; tratamiento osteoporosis/corticoides orales |
| Janghorbani et al., 200634 | Cohortes retrospectivo(109.983) | 34-59 años | Irán | 22 años | DM1 y DM2/Mujeres | RR DM1: 7,1RR DM2: 1,7 | IMC, tabaco, actividad física, menopausia, niveles de calcio, vit D, proteína y tratamiento hormonal sustitutivo |
| Lipscombe LL et al., 200735 | Cohortes prospectivo(197.412) | >66 años | Canadá | 6,1 años | DM2/Mujeres y hombres | HR: H: 1,18 y M: 1,11 | Sexo, edad y antidiabéticos |
ACV: accidente cerebrovascular; ADO: antidiabéticos orales; DM1: diabetes mellitus 1; DM2: diabetes mellitus 2; H: hombre; HbA1c: hemoglobina glucosilada; HR: hazard ratio; IMC: índice de masa corporal; M: mujer, RR: riesgo relativo.
Resumen de los estudios evaluando los factores de riesgo
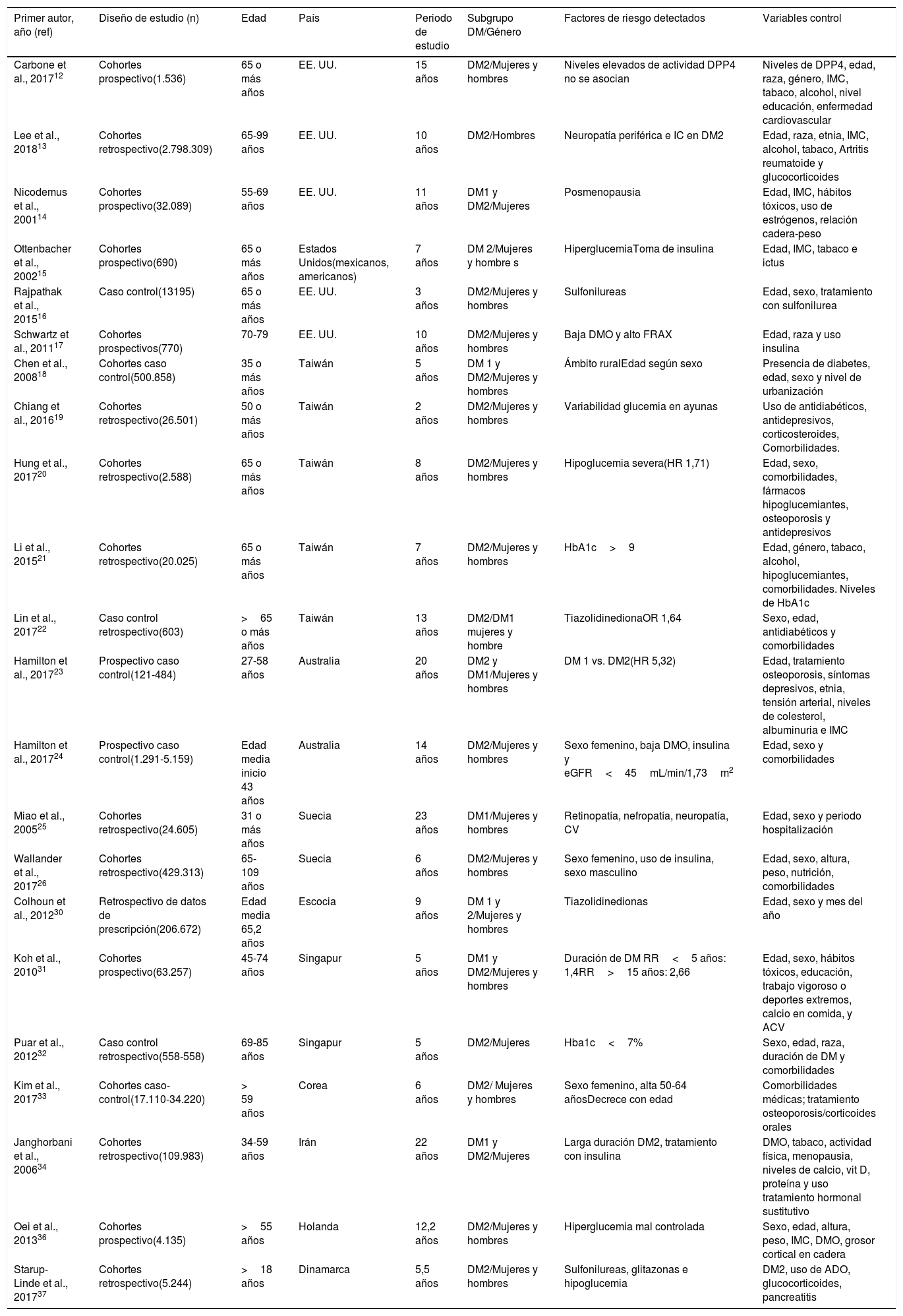
| Primer autor, año (ref) | Diseño de estudio (n) | Edad | País | Periodo de estudio | Subgrupo DM/Género | Factores de riesgo detectados | Variables control |
|---|---|---|---|---|---|---|---|
| Carbone et al., 201712 | Cohortes prospectivo(1.536) | 65 o más años | EE. UU. | 15 años | DM2/Mujeres y hombres | Niveles elevados de actividad DPP4 no se asocian | Niveles de DPP4, edad, raza, género, IMC, tabaco, alcohol, nivel educación, enfermedad cardiovascular |
| Lee et al., 201813 | Cohortes retrospectivo(2.798.309) | 65-99 años | EE. UU. | 10 años | DM2/Hombres | Neuropatía periférica e IC en DM2 | Edad, raza, etnia, IMC, alcohol, tabaco, Artritis reumatoide y glucocorticoides |
| Nicodemus et al., 200114 | Cohortes prospectivo(32.089) | 55-69 años | EE. UU. | 11 años | DM1 y DM2/Mujeres | Posmenopausia | Edad, IMC, hábitos tóxicos, uso de estrógenos, relación cadera-peso |
| Ottenbacher et al., 200215 | Cohortes prospectivo(690) | 65 o más años | Estados Unidos(mexicanos, americanos) | 7 años | DM 2/Mujeres y hombre s | HiperglucemiaToma de insulina | Edad, IMC, tabaco e ictus |
| Rajpathak et al., 201516 | Caso control(13195) | 65 o más años | EE. UU. | 3 años | DM2/Mujeres y hombres | Sulfonilureas | Edad, sexo, tratamiento con sulfonilurea |
| Schwartz et al., 201117 | Cohortes prospectivos(770) | 70-79 | EE. UU. | 10 años | DM2/Mujeres y hombres | Baja DMO y alto FRAX | Edad, raza y uso insulina |
| Chen et al., 200818 | Cohortes caso control(500.858) | 35 o más años | Taiwán | 5 años | DM 1 y DM2/Mujeres y hombres | Ámbito ruralEdad según sexo | Presencia de diabetes, edad, sexo y nivel de urbanización |
| Chiang et al., 201619 | Cohortes retrospectivo(26.501) | 50 o más años | Taiwán | 2 años | DM2/Mujeres y hombres | Variabilidad glucemia en ayunas | Uso de antidiabéticos, antidepresivos, corticosteroides, Comorbilidades. |
| Hung et al., 201720 | Cohortes retrospectivo(2.588) | 65 o más años | Taiwán | 8 años | DM2/Mujeres y hombres | Hipoglucemia severa(HR 1,71) | Edad, sexo, comorbilidades, fármacos hipoglucemiantes, osteoporosis y antidepresivos |
| Li et al., 201521 | Cohortes retrospectivo(20.025) | 65 o más años | Taiwán | 7 años | DM2/Mujeres y hombres | HbA1c>9 | Edad, género, tabaco, alcohol, hipoglucemiantes, comorbilidades. Niveles de HbA1c |
| Lin et al., 201722 | Caso control retrospectivo(603) | >65 o más años | Taiwán | 13 años | DM2/DM1 mujeres y hombre | TiazolidinedionaOR 1,64 | Sexo, edad, antidiabéticos y comorbilidades |
| Hamilton et al., 201723 | Prospectivo caso control(121-484) | 27-58 años | Australia | 20 años | DM2 y DM1/Mujeres y hombres | DM 1 vs. DM2(HR 5,32) | Edad, tratamiento osteoporosis, síntomas depresivos, etnia, tensión arterial, niveles de colesterol, albuminuria e IMC |
| Hamilton et al., 201724 | Prospectivo caso control(1.291-5.159) | Edad media inicio 43 años | Australia | 14 años | DM2/Mujeres y hombres | Sexo femenino, baja DMO, insulina y eGFR<45mL/min/1,73m2 | Edad, sexo y comorbilidades |
| Miao et al., 200525 | Cohortes retrospectivo(24.605) | 31 o más años | Suecia | 23 años | DM1/Mujeres y hombres | Retinopatía, nefropatía, neuropatía, CV | Edad, sexo y periodo hospitalización |
| Wallander et al., 201726 | Cohortes retrospectivo(429.313) | 65-109 años | Suecia | 6 años | DM2/Mujeres y hombres | Sexo femenino, uso de insulina, sexo masculino | Edad, sexo, altura, peso, nutrición, comorbilidades |
| Colhoun et al., 201230 | Retrospectivo de datos de prescripción(206.672) | Edad media 65,2 años | Escocia | 9 años | DM 1 y 2/Mujeres y hombres | Tiazolidinedionas | Edad, sexo y mes del año |
| Koh et al., 201031 | Cohortes prospectivo(63.257) | 45-74 años | Singapur | 5 años | DM1 y DM2/Mujeres y hombres | Duración de DM RR<5 años: 1,4RR>15 años: 2,66 | Edad, sexo, hábitos tóxicos, educación, trabajo vigoroso o deportes extremos, calcio en comida, y ACV |
| Puar et al., 201232 | Caso control retrospectivo(558-558) | 69-85 años | Singapur | 5 años | DM2/Mujeres | Hba1c<7% | Sexo, edad, raza, duración de DM y comorbilidades |
| Kim et al., 201733 | Cohortes caso-control(17.110-34.220) | > 59 años | Corea | 6 años | DM2/ Mujeres y hombres | Sexo femenino, alta 50-64 añosDecrece con edad | Comorbilidades médicas; tratamiento osteoporosis/corticoides orales |
| Janghorbani et al., 200634 | Cohortes retrospectivo(109.983) | 34-59 años | Irán | 22 años | DM1 y DM2/Mujeres | Larga duración DM2, tratamiento con insulina | DMO, tabaco, actividad física, menopausia, niveles de calcio, vit D, proteína y uso tratamiento hormonal sustitutivo |
| Oei et al., 201336 | Cohortes prospectivo(4.135) | >55 años | Holanda | 12,2 años | DM2/Mujeres y hombres | Hiperglucemia mal controlada | Sexo, edad, altura, peso, IMC, DMO, grosor cortical en cadera |
| Starup-Linde et al., 201737 | Cohortes retrospectivo(5.244) | >18 años | Dinamarca | 5,5 años | DM2/Mujeres y hombres | Sulfonilureas, glitazonas e hipoglucemia | DM2, uso de ADO, glucocorticoides, pancreatitis |
ACV: accidente cerebrovascular; ADO: antidiabéticos orales; CV: cardiovascular; DMO: densidad mineral ósea; DM1: diabetes mellitus 1; DM2: diabetes mellitus 2; DPP-4: dipeptidil peptidasa-4; eGFR: tasa de filtración glomerular estimada; FRA: fracaso renal agudo; HbA1c: hemoglobina glucosilada; HR: hazard ratio; IC: insuficiencia cardíaca; IMC: índice de masa corporal; OR: odds ratio.
Aunque el periodo de publicación evaluado fue desde el año 200111 hasta agosto del 201827, se debe destacar que la mayoría de las publicaciones son a partir del año 2015. Los estudios fueron realizados en personas de distintas etnias y de diferentes países de todo el mundo. Así en los Estados Unidos de América se llevaron a cabo 7 estudios11–17 y en Taiwán 5 estudios18–22, como países con más estudios, siguiendo Australia23,24 con 2 del Fremantle Diabetes Study y también Suecia25,26, España27,28, Escocia29,30 y Singapur31,32 con 2 estudios por país, y finalmente Corea33, Irán34, Canadá35, Holanda36, Dinamarca37 con una publicación en cada uno de estos países.
Las muestras incluidas fueron muy heterogéneas en cuanto al número de pacientes incluidos, existiendo estudios con 60322 hasta 2.798.30913 participantes. Las edades de los pacientes estudiados iban desde los 18 años37 hasta los 99 años13. Se estudiaron participantes de ambos sexos pero cabe destacar que existan más estudios únicamente con muestra de sexo femenino11,14,30,32. Por último, también existió una gran diversidad en el tiempo de seguimiento en los estudios en que se analizaba, así la duración iba desde los 2 años11 hasta los 23 años25, en el estudio más largo.
DiscusiónLos resultados de la presente revisión sistemática actualizan y confirman la asociación entre el diagnóstico de DM y un riesgo aumentado de fractura de cadera38.
Se ha descrito una DMO disminuida en la DM1 pero aumentada en DM25. Los mecanismos por los cuales la diabetes aumenta el riesgo de fractura en ambos tipos no están aún del todo definidos, aunque existen muchas hipótesis39. Uno de los mecanismos más investigados es el hecho de que la hiperglucemia crónica induce la acumulación de productos de la glucosilación avanzada en el colágeno tipo 1, que pueden llegar a afectar la calidad del hueso y contribuir a un esqueleto más frágil5. Investigaciones en humanos reflejan que el hueso de las personas con diabetes es más débil que el de las que no tienen diabetes, existiendo un probable deterioro mecánico y una disminución de la resistencia ósea7. Además la acción sobre el metabolismo óseo de algunos fármacos antidiabéticos y los posibles episodios de hipoglucemias son aspectos a tener en cuenta en el momento de evaluar la relación entre la DM y la fractura de cadera10. Finalmente, pero igual de importante, es el hecho de que algunas complicaciones de la diabetes, como la neuropatía o la retinopatía, pueden considerarse también factores de riesgo, ya que se asocian a un aumento del riesgo de caídas y por ello pueden comportar una fractura de cadera9.
Al interpretar esta revisión sistemática hay que tener en cuenta como fortaleza que la mayoría de los artículos seleccionados corresponden a estudios con muestras de pacientes amplias y con una importante diversidad de países representados. Como limitación debe tenerse en cuenta el hecho de que muchos de los estudios son retrospectivos, de base poblacional o de compañías aseguradoras, con datos suficientes para responder a la pregunta principal de la investigación, pero que al no estar específicamente diseñados para el tópico de la asociación de diabetes con fractura de cadera, en ocasiones los datos recogidos son insuficientes para conocer en profundidad el porqué de esta asociación.
Datos epidemiológicosEn la tabla 1 se muestran los estudios seleccionados que evalúan la asociación entre DM y el riesgo de fractura de cadera. La mayoría de ellos comparan pacientes sin el diagnóstico de DM apareados con pacientes con DM. Los rangos de asociación son en la mayoría de las ocasiones positivos (RR: 12,25 la asociación más consistente para DM1)14. Sí que en un estudio se ha reportado la no existencia de dicha asociación en un subgrupo de los pacientes (HR: 0,88)26. Se trataba de un investigación realizada en pacientes suecos en que sí existía asociación en los pacientes en tratamiento con insulina y/o antidiabéticos orales (tabla 1), pero no en los pacientes diabéticos sin tratamiento farmacológico, situación que podría traducir una DM leve y con poco tiempo de evolución26.
Factores de riesgoEn los estudios analizados que investigaban los factores de riesgo para fractura de cadera se han identificado numerosos factores que se presentan en la tabla 2. Es importante destacar que aunque, como se ha comentado anteriormente, lo importante es la calidad del hueso del paciente con diabetes, sí que entre adultos mayores con DM2 se ha reportado el hecho de que el tener peores puntuaciones en la DMO del cuello femoral y puntuaciones más altas en el FRAX se asociaba con tener mayor riesgo de fractura de cadera17.
Tipo de diabetesSe ha descrito en múltiples investigaciones que el riesgo de fractura de cadera es mayor en los pacientes con DM1 que en los pacientes con DM213,14,23,29,34. Una de las posibles explicaciones de estas diferencias es el hecho de que una mayor duración temporal de la diabetes conlleva un impacto persistente de la glucemia en la DMO. Otros posibles factores implicados serían la presencia de una mayor pérdida de calcio por la orina y una mayor probabilidad de tener la función renal alterada. Finalmente existirían posibles diferencias fisiopatológicas asociadas al déficit de insulina y a la resistencia a esta en el metabolismo y la estructura ósea14,23,25,29.
Tiempo de evolución de la diabetes mellitusLa duración de la diabetes está asociada a un alto riesgo de fractura de cadera11. La DM debe ser considerada como un factor predictivo de fractura de cadera incluso en los primeros años de la enfermedad después de su diagnóstico11,28. Para pacientes con evolución<5 años el RR es de 1,4 [1,08-1,82] y en aquellos con evolución>15 años el RR es mucho más alto (2,66 [2,04-3,47]), por lo tanto a más tiempo de evolución más riesgo31. No obstante incluso en pacientes diagnosticados de nuevo y después de una media de seguimiento de solo 2,6 años, ya se ha reportado un riesgo aumentado del 20% para fractura de cadera28. Un estudio de cohortes prospectivo en mujeres posmenopáusicas demostró que las paciente con DM1 tenían un riesgo 12,25 veces [5,05-29,73] más que sin DM1, y con DM2 1,70 veces [1.21-2,38] más que las sin DM214.
Complicaciones de la diabetes mellitusLos pacientes con DM presentan un riesgo mayor de caídas que pueden conllevar fracturas por fragilidad como la fractura de cadera9. Las causas son multifactoriales como la retinopatía diabética, que puede conducir a una disminución de la agudeza visual o ceguera, la neuropatía periférica con alteraciones de la marcha y/o del equilibrio y los episodios de hipoglucemia, entre otros9,11,16,25. También se ha asociado un mayor riesgo de fractura de cadera a la presencia de nefropatía dabética24,25.
Control glucémicoUn estudio investigó el riesgo de fractura de cadera en pacientes con DM2 según los niveles de HbA1c, concluyendo que niveles de HbA1c>9% se correlacionaban con un riesgo aumentado de fractura de cadera (24-31%)21. De forma similar, Oei et al.36 demostraron que los pacientes diabéticos con un mal control glucémico (definido como tener una HbA1c≥7,5%) asociaban un mayor riesgo de fractura respecto a los diabéticos bien controlados, a pesar de tener valores más altos en la DMO (1,1-5,6%) y una cortical femoral más gruesa (4,6-5,6%) pero con cuellos femorales más estrechos (−1,2 a −1,8%).
Por otro lado, Puar et al.32 reportan que una HbA1c<7% también puede ser un factor de riesgo importante en la fractura de cadera en pacientes adultos. Así un control glucémico muy estricto puede ser factor de riesgo para ocasionar caídas probablemente por la asociación con hipoglucemias32. Se ha reportado también la asociación entre tener hipoglucemia severa y el riesgo de fractura de cadera (HR: 1.71 [1.35-2.16])20. Es importante comentar que el tener un alto coeficiente de variabilidad en los niveles de glucosa en ayunas también se ha asociado a mayor riesgo de fractura de cadera19.
EdadLa edad es uno de los factores más importantes demostrados de asociación en los trabajos revisados18,33, en parte por la posible asociación con mayor duración de la DM, y en parte por su asociación con una posible mayor pérdida ósea. En algunos de ellos también se demuestra un efecto significativo en el riesgo de fractura de cadera en pacientes jóvenes, con edades entre 35-54 años y 50-64 años, aumentado el doble y el triple en hombres y mujeres respectivamente comparado con el grupo control18. Sin embargo en un estudio realizado en Taiwán en los hombres diabéticos mayores de 74 años y en las mujeres mayores de 84 años el riesgo de fractura de cadera fue similar al grupo control18.
Sexo femeninoLas fracturas en la población general son más comunes en las mujeres que en los hombres, lo cual refleja la habitual menor DMO subyacente, con una rápida pérdida de hueso que ocurre durante y después de la menopausia40. Así, algunas investigaciones demuestran que el sexo femenino es un factor de riesgo muy importante, con mayor riesgo de fractura al ser mujer y diabética, especialmente posmenopáusica14. Las mujeres con DM deberían beneficiarse especialmente de estrategias para evitar fracturas11,14,18,24,26,33.
Al analizar las causas se ha hipotetizado que las pacientes en edad menopáusica con diabetes recibían en menor porcentaje terapia hormonal sustitutiva que aquellas que no tenían diabetes y por ello presentaban mayor incidencia de fractura de cadera, ya que la terapia hormonal podría disminuir el riesgo de fractura. Sin embargo, la asociación positiva entre la diabetes y la fractura de cadera se mantuvo incluso después del ajuste de recibir tratamiento hormonal sustitutivo34.
A pesar de esta mayor asociación en mujeres, es evidente que también es importante evaluar el riesgo de fracturas osteoporóticas en varones con DM213, ya que también tienen riesgo aumentado y hay una tendencia a ser subdiagnosticados y poco tratados para la osteoporosis33,35.
Lugar y país de residenciaSe ha demostrado que el lugar de residencia (urbano o rural) se asocia de manera significativa con el riesgo de fractura de cadera, existiendo un riesgo moderadamente más elevado en aquellos que viven en zonas rurales, independientemente del tipo y duración de la diabetes18.
Respecto al país de residencia, las investigaciones demuestran una evidencia epidemiológica de un mayor riesgo de fractura de cadera en aquellos individuos con DM1 que viven en el nordeste de Europa comparados con el sudeste de Europa. Factores como la ingesta de calcio, la exposición a la luz solar, niveles de vitamina D, el tabaquismo, el consumo de alcohol o los niveles de actividad física pueden influir38,39.
ObesidadLa obesidad está íntimamente relacionada con la DM2 por la resistencia insulínica que conlleva. Aunque, por otro lado, la obesidad se asocia a mayores niveles de estrógenos, que pueden proteger de la osteoporosis y por tanto disminuir el riesgo de fractura de cadera entre las mujeres obesas0,24,40. A pesar del aparente efecto protector de la obesidad, en varios análisis se ha evidenciado que la DM2 aumenta el riesgo de fractura de cadera independientemente de la obesidad31,33.
Actividad de la dipeptidil peptidasa-4La dipeptidil peptidasa-4es una proteína que actúa degradando las hormonas incretinas como el polipéptido inhibidor gástrico y el péptido similar al glucagón tipo 1, que se relacionan con la ingesta de alimentos y que estimulan la secreción de insulina por el páncreas y la disminución de los niveles plasmáticos de glucosa. Una investigación valoró su actividad y evidenció que no hay asociación entre la actividad de la dipeptidil peptidasa-4 y un mayor riesgo de fractura de cadera12.
Fármacos: tiazolidinedionas (glitazonas), sulfonilureas e insulinaTiazolidinedionas (glitazonas)Las glitazonas (tiazolidinedionas) actúan uniendo y activando la molécula PPAR gamma (receptor de proxisoma-proliferador-activado gamma) teniendo como resultado la disminución de la resistencia a la insulina30, fundamentalmente a nivel de tejidos periféricos (tejido graso y muscular), aunque también tienen un cierto efecto a nivel del tejido hepático (inhibición gluconeogénesis hepática). Existen datos sobre la asociación de estos fármacos con la fractura de cadera22,30. Un estudio realizado en Escocia evidencia este efecto en ambos sexos, siendo el riesgo similar tanto con pioglitazona como con rosiglitazona30. Los autores concluyen que existe un 18% de aumento en fractura de cadera por año de exposición a tiazolidinedionas acumulado. En el mismo estudio no hubo evidencia de riesgo acumulado a la exposición de otros fármacos como sulfonilureas o metformina30. Otra investigación similar concluye que el uso de tiazolidinedionas está asociado con un aumento del riesgo de fractura de cadera en personas taiwanesas mayores con DM2 del 64%, sobre todo en función de la dosis22. En un estudio reciente danés también se confirmó que el uso de glitazonas en los últimos 90 días se asociaba a fractura de cadera (HR: 2,07)37.
SulfonilureasEn un estudio con una base de datos de una aseguradora evaluando a pacientes ancianos diagnosticados de DM2, la mayoría de los cuales habían sido tratados con sulfonilureas, se evidenció que aunque la fractura de cadera no fue algo común entre estos ancianos (1,7%), los participantes que fueron tratados con sulfonilureas fueron más propensos a presentar fractura de cadera (OR: 1,46) en comparación con aquellos que no las tomaban. El efecto estuvo probablemente asociado a eventos hipoglucémicos y fue de similar magnitud en ambos géneros16. Starup Linde et al.37 también evidencian esta asociación con el uso de sulfonilureas en los 90 días previos en Dinamarca. En otros estudios no se ha confirmado esta asociación30.
InsulinaLa asociación de toma de insulina y fractura de cadera en pacientes diabéticos ha sido evidenciada en pacientes mexicanos americanos (Texas), australianos y suecos entre otros paises15,24,26. Esta asociación probablemente sea multifactorial en pacientes con un posible diagnóstico temprano de la DM, o con un difícil control metabólico, o con episodios de episodios de hipoglucemia, o con complicaciones asociadas con riesgo de caídas y fractura de cadera como la retinopatía diabética25.
Sin embargo, hay que tener en cuenta que se han demostrado algunas propiedades anabólicas de la insulina en el hueso, a través de la estimulación de la diferenciación de los osteoblastos. El papel de la insulina en esta relación sigue siendo incierto41 y así Janghorbani et al.38 no han demostrado evidencias de aumento de riesgo en los pacientes en tratamiento con insulina. Realmente el tratamiento con insulina puede indicar un proceso más severo y grave de la enfermedad en lugar de ser un factor de riesgo para la fractura de cadera38.
ConclusiónEn definitiva, nuestra revisión sistemática ha evidenciado que la diabetes, tanto tipo 1 como 2, se asocia a un mayor riesgo de fractura de cadera. El efecto es superior en la DM1 principalmente debido a la mayor duración de la enfermedad. Se han descrito múltiples factores que influyen en ambos tipos de DM, como pueden ser el sexo femenino, la mayor edad, las hipoglucemias, el mal control de la glucemia o algunos fármacos entre los más destacados. Un mejor conocimiento de los mecanismos entre DM y fractura de cadera puede ayudar a desarrollar terapias que sean beneficiosas para el paciente con DM, prevenir sus complicaciones y aumentar su calidad de vida.
Contribución de los autoresTodos los autores han contribuido por igual en:
- 1.
Concepción y diseño del manuscrito.
- 2.
Recogida de datos.
- 3.
Análisis e interpretación de los datos.
- 4.
Redacción, revisión, aprobación del manuscrito remitido.
Los autores declaran no tener ningún conflicto de intereses.