La infección por Clostridium difficile es actualmente la principal causa de enfermedad gastrointestinal de origen nosocomial. Su prevalencia en la población anciana es superior por reunirse en este grupo etario gran cantidad de factores de riesgo como son comorbilidad, frecuente exposición al medio sanitario o residencial, inmunosenescencia y mayor consumo de antibióticos y antiácidos. En los últimos años, las técnicas diagnósticas han mejorado notablemente, lo que podría implicar un incremento de diagnósticos. Las nuevas pautas de consenso de expertos proponen la estratificación de la situación clínica del paciente en el momento del diagnóstico para la elección del tratamiento óptimo. Recientemente se han incluido en las guías clínicas nuevas opciones terapéuticas como la flidaxomicina o el trasplante de materia fecal con resultados alentadores, sobre todo para el control de las frecuentes recurrencias.
Infection due to Clostridium difficile is currently the main cause of hospital acquired gastrointestinal disease. Its prevalence in the elderly population is higher due to there being many associated risk factors in this age group, such as comorbidity, frequent exposure to the healthcare or residential home setting, immunosenescence, greater consumption of antibiotics, and antiacids. The diagnostic techniques have notably improved in the last few years, which could also account for an increase in its diagnosis. The new expert consensus recommendations propose stratifying the clinical situation of the patient in order to choose the treatment option. Therapeutic options have recently been included in the new Clinical Guidelines, such as flidaxomicin or fecal transplants, with encouraging results, particularly for the control of frequent recurrences.
La infección por Clostridium difficile (C. difficile) es la principal causa de enfermedad gastrointestinal de origen nosocomial. Su prevalencia global en España no es muy elevada, aunque muy superior en ancianos. Su importancia radica en las consecuencias que implica en términos de complicaciones y prolongación de estancia hospitalaria-costes y en el hecho de que se trata de una infección que causa brotes epidémicos hospitalarios, relacionados habitualmente con la diseminación a través de personal o material sanitario y por tanto potencialmente evitable. Su conocimiento es fundamental para el geriatra, que puede prevenir o tratar las condiciones que confieren a sus pacientes mayor sensibilidad y procurar un tratamiento precoz e individualizado que derive en una mínima diseminación, mediante un elevado índice de sospecha que permita un diagnóstico temprano. Recientemente nuevas técnicas microbiológicas han aumentado la sensibilidad y la especificidad del diagnóstico, por lo que es previsible un incremento futuro de casos. Las actuales guías de consenso de expertos proponen modificaciones al tratamiento clásico, como su elección de forma individualizada en función de la situación clínica del paciente. Nuevas terapias no antibióticas y por lo tanto más respetuosas con la flora intestinal, tan implicada en este proceso, están dando resultados alentadores en el tratamiento de esta afección.
EpidemiologíaC. difficile es un bacilo grampositivo anaerobio productor de esporas muy resistentes y de transmisión fecal oral. La destrucción de la flora intestinal favorecida por antibióticos permite su sobrecrecimiento y la generación de toxinas lesivas para el epitelio intestinal. El espectro clínico de la infección es muy amplio, variando desde un episodio de diarrea leve hasta un cuadro de abdomen agudo fulminante. El reservorio fundamental son los pacientes colonizados o infectados y la transmisión entre pacientes y a través del personal sanitario es clara1. C. difficile es el responsable del 25% de los casos de diarrea por antibióticos. Tras el brote de la cepa hipervirulenta 027 que sucede en EE. UU. en los años 2000-2005 y que no ha afectado a nuestro país, la incidencia global de las cepas no 027 sigue aumentando y pone de manifiesto las debilidades del sistema sanitario, en términos de prevención de diseminación de infección hospitalaria a pacientes especialmente vulnerables y el fracaso de las medidas de control de empleo de antibióticos de amplio espectro2. El incremento de prevalencia se produce fundamentalmente en ancianos, y la alta tasa de infección en centros sanitarios es esperable en relación con la concentración de pacientes susceptibles y reservorios de la enfermedad3.Sin embargo, es destacable el reciente incremento de casos ambulatorios que aparecen en pacientes sin los clásicos factores de riesgo para su adquisición. Globalmente, la incidencia de los casos en la comunidad se ha multiplicado por 5 y la que tiene relación hospitalaria por 2, considerándose infraestimados los casos que tienen lugar después del alta y los que suceden en residencias geriátricas4–7.Se valora la posibilidad de que existan medios de diseminación alternativos desconocidos hasta ahora o quizá originados en otros focos diferentes de los pacientes afectados (animales, comida, agua, etc.)5,7,8.
En España se desconoce la prevalencia real de la diarrea asociada al C. difficile (DACD) por diferencias regionales de detección muy importantes. El índice de sospecha es aún insuficiente y se emplean test diagnósticos de sensibilidad variable, por lo que la prevalencia está probablemente infraestimada. Todas las instituciones deberían desarrollar una mínima vigilancia para reportar los nuevos casos que permita medir y comparar incidencias y reconocer brotes8. Un estudio europeo estimó una prevalencia de 4 casos por cada 10.000 ingresos hospitalarios, siendo posible extrapolar los datos a nuestro país. El 80% son de origen hospitalario, el 14% comunitarios y el 6% de origen indeterminado2,8–10. Analizando el conjunto mínimo básico de datos se detectan 41 casos por cada 100.000 altas hospitalarias en 1999 con un incremento anual del 10%, hasta 122 casos por cada 100.000 altas en 2007, siendo la tasa 2,5 veces superior en mayores de 65 años7. Dentro del hospital, las unidades más involucradas son las de cuidados intensivos con 3,3 casos por cada 1.000 pacientes y las de geriatría con hasta 24 casos por cada 1.000 pacientes11,12. El incremento de afectados en España puede atribuirse al envejecimiento de la población con su correspondiente comorbilidad y a la amplia difusión de los antibióticos de amplio espectro, si bien la prevalencia no puede considerarse un índice de calidad de política antibiótica2,8. Algunos trabajos recientes apuntan a una ligera estabilización del número de casos en EE. UU. y Reino Unido tras la epidemia del ribotipo hipervirulento 027 que supuso un incremento de la incidencia del 300% en estos países7.
La mortalidad asociada a diarrea por C. difficile es del 22% y hasta en el 40% de los casos está directamente implicado en el desenlace si bien no hay estudios controlados al respecto7.
El coste que supone esta afección nosocomial en España se estima sobre cifras de prevalencia poco fiables en torno a 32 millones de euros anuales. Cada episodio inicial supone unos 3.900 euros, 4.900 la primera recurrencia y 5.900 la segunda, con un coste total por recidivas de unos 10 millones de euros anuales. Del total de los gastos, el 96% se debe al incremento de la estancia hospitalaria (8-16días), el 2,8% a las cirugías, el 1% a las medidas de control de la infección y el 0,5% a tratamientos farmacológicos. La detección de un caso de DACD supone un coste extra de entre 2.000 y 5.000 dólares (30-50% más)13.
Son portadores asintomáticos de C. difficile el 15% de los adultos sanos, el 25% de los hospitalizados, el 80% de los recién nacidos y el 50% de los ancianos de residencia1,3. De los adultos colonizados, el 30% desarrollarán diarrea. La infección se produce al poco tiempo de adquirir C. difficile y en los portadores de larga evolución es menos probable. Son factores de riesgo reconocidos para ser portador tener heces blandas sin diarrea, hospitalización en los últimos 6 meses y uso de inmunosupresores o glucocorticoides, pero no hay una clara relación con los antibióticos. El hallazgo de un portador hospitalario implica su aislamiento entérico pero no su tratamiento y no se harán screening de rutina1,14,15.
Factores de riesgo clínicosLa identificación de los factores de riesgo clínicos asociados a un episodio inicial de DACD y a la predisposición a recurrencias es determinante para la potencial prevención y el diagnóstico precoz3,7. Se han elaborado escalas de predicción en función de la asociación de varios parámetros de riesgo16. Se describen a continuación los más relacionados según la bibliografía:
- -
Exposición a antimicrobianos; es el factor más claramente implicado. Las terapias múltiples, simultáneas, seguidas o prolongadas aumentan el riesgo. A veces una sola dosis, como las profilaxis quirúrgicas, también puede desencadenarlo. Favorece la DACD en las primeras 2 semanas pero implica un aumento de riesgo hasta 3 meses tras su retirada. Es prioritario reforzar las políticas de control de antibióticos ya que, hasta en el 25% de los casos de DACD, los antibióticos desencadenantes no estaban justificados y podrían haberse evitado. Los antibióticos más relacionados son cefalosporinas de 3.a o 4.aª, combinados con betalactamasas, carbapenémicos, clindamicina y agentes anti-SAMR (tigeciclina, linezolid y daptomicina). Es excepcional que anaerobicidas como aminoglucósidos intravenosos, bacitracina, metronidazol o vancomicina causen este tipo de diarrea17,18.
- -
Consumo de antiácidos; su implicación es cada vez más evidente por impedir la adecuada esterilización del tracto digestivo superior17, favoreciendo el crecimiento de C. difficile a este nivel y la generación de esporas. Esta asociación se mantiene tanto para inhibidores de la bomba de protones como para anti-H+, sobre todo con dosis altas y a largo plazo. La revisión de su indicación en los casos de DACD determinó que más del 60% de las prescripciones no eran correctas. La FDA ha hecho una comunicación sobre el riesgo de su uso combinado con antibióticos19.
- -
Otros fármacos como los antisecretores, inmunosupresores, glucocorticoides, quimioterápicos y algunos antidepresivos también se han relacionado. Las estatinas podrían tener efecto protector20.
- -
La edad avanzada, por su relación con una respuesta inmune menor (IgG antitoxina A), comorbilidad, frecuente exposición a antibióticos y relación con el ambiente sanitario, es un factor de riesgo determinante. La presencia de deterioro funcional al ingreso se relaciona además con mayor gravedad21. La duración de la estancia hospitalaria22, el número de ingresos o el vivir en centros residenciales perpetúa la exposición a contactos e incrementa el riesgo8. Los cambios en la composición de la flora parecen determinantes y en los casos de más edad son superiores las secuelas, la mortalidad y las recidivas.
- -
Los procedimientos invasivos gastrointestinales como endoscopias, colocación de sonda nasogástrica o enemas son también predisponentes.
- -
Algunas enfermedades crónicas como insuficiencia renal, infección por VIH, enfermedad inflamatoria intestinal o trasplante suponen también incremento de riesgo. La malnutrición es un factor común para todas las infecciones nosocomiales, y en DACD los niveles bajos de albúmina se relacionan directamente con mayor mortalidad y número de recurrencias23.
El diagnóstico de DACD se basa en la presencia de signos o síntomas compatibles y en la evidencia de C. difficile productor de toxina, o la demostración de seudomembranas por colonoscopia14. Los test microbiológicos son la base del diagnóstico, siendo el cultivo el método más sensible (aunque crecen tanto cepas toxigénicas como no toxigénicas) y la demostración de la citotoxicidad de la toxina B el más específico, pero ambos exigen varios días para dar resultados. El mejor método diagnóstico está actualmente sin establecer y en la última década ha habido cambios importantes4. La detección de toxinas por ELISA era el método diagnóstico habitual, por su realización fácil e interpretación objetiva, si bien parece que la detección de glutamato deshidrogenasa (enzima producida por C. difficile en gran cantidad en relación con toxinas A y B) puede ofrecer una sensibilidad superior, con un VPN de hasta el 95%. En los positivos se realizará además PCR (detección de marcadores genéticos de toxinas A y B) como excelente test de confirmación. No se harán exámenes fecales de pacientes asintomáticos1,2,4 y no se deben repetir los test diagnósticos ni hacer cultivo para valorar curación .La repetición da resultado positivo en menos de un 5% e incrementa los falsos positivos, sin evidencia de mejoría en sensibilidad. Tanto ELISA como el cultivo pueden ser positivos hasta 30 días después de la resolución de los síntomas.
La presencia de leucocitos o hematíes en heces puede darse en el 50% de los casos y no es útil para el diagnóstico por su gran inespecificidad. La endoscopia diagnóstica se debe posponer en casos graves por el alto riesgo de perforación6. El diagnóstico diferencial con la diarrea por antibióticos (DAA) puede orientarse según algunos parámetros clínicos como son la aparición precoz, la buena respuesta a la retirada del antibiótico, la ausencia de clínica extraintestinal y no casos epidémicos en la DAA.
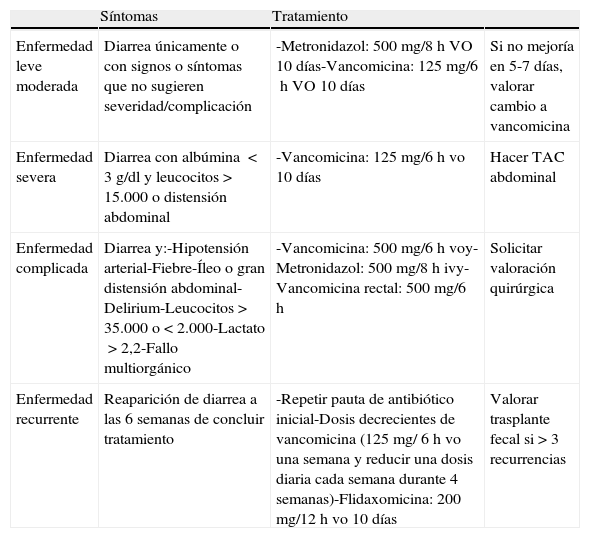
TratamientoEn el momento del diagnóstico de DACD se debe retirar el antibiótico inicialmente relacionado. Solo con esta medida y una adecuada reposición hidroelectrolítica pueden mejorar hasta el 25% de los casos. De lo contrario, se prolonga la clínica y se incrementan las recidivas. Si no es posible prescindir del antibiótico, es recomendable sustituirlo por otro menos lesivo para la flora intestinal, reevaluar la indicación de los inhibidores de la bomba de protones y evitar los agentes antiperistálticos. No hay evidencia del beneficio de usar metronidazol o vancomicina como prevención, y de hecho pueden incrementar riesgo. Cuando la sospecha diagnóstica es elevada se debe iniciar tratamiento empírico. Se recomienda la clasificación de los pacientes en función de la severidad de la enfermedad para seleccionar el tratamiento más adecuado1,14. La estratificación clínica y las pautas terapéuticas correspondientes se exponen en la tabla 11,2,4,14.
Estratificación de los síntomas de diarrea asociada a Clostridium difficile según severidad y tratamiento específico
| Síntomas | Tratamiento | ||
| Enfermedad leve moderada | Diarrea únicamente o con signos o síntomas que no sugieren severidad/complicación | -Metronidazol: 500mg/8h VO 10días-Vancomicina: 125mg/6h VO 10días | Si no mejoría en 5-7días, valorar cambio a vancomicina |
| Enfermedad severa | Diarrea con albúmina <3g/dl y leucocitos>15.000 o distensión abdominal | -Vancomicina: 125mg/6h vo 10días | Hacer TAC abdominal |
| Enfermedad complicada | Diarrea y:-Hipotensión arterial-Fiebre-Íleo o gran distensión abdominal-Delirium-Leucocitos>35.000 o<2.000-Lactato>2,2-Fallo multiorgánico | -Vancomicina: 500mg/6h voy- Metronidazol: 500mg/8h ivy-Vancomicina rectal: 500mg/6h | Solicitar valoración quirúrgica |
| Enfermedad recurrente | Reaparición de diarrea a las 6semanas de concluir tratamiento | -Repetir pauta de antibiótico inicial-Dosis decrecientes de vancomicina (125mg/ 6h vo una semana y reducir una dosis diaria cada semana durante 4 semanas)-Flidaxomicina: 200mg/12h vo 10días | Valorar trasplante fecal si>3 recurrencias |
Fuente: Surawicz et al.1.
Se define como respuesta al tratamiento la reducción de la frecuencia o el aumento de la consistencia de las deposiciones, sin aparición de datos clínicos de severidad, que se produce habitualmente en unos 3-5días, aunque puede tardar semanas en recuperarse la normalidad. Algunos estudios aleatorizados recientes refieren superioridad de la vancomicina frente al metronidazol en diarrea severa con mayor número de curaciones24,25. Sin embargo, el metronidazol sigue siendo el preferido para casos leves a moderados por su gran eficacia y coste inferior. La mayoría de las farmacias preparan la forma intravenosa de vancomicina para su administración oral para abaratar su coste, pero su sabor es desagradable. Ambas opciones se han relacionado con el incremento de enterococo resistente a vancomicina. No se recomienda continuar el tratamiento si ha habido respuesta al décimo día ni la prescripción prolongada en los casos en los que se mantiene el antibiótico causante.
La ausencia de respuesta al tratamiento con metronidazol a los 4-7 días debe hacer reconsiderar su sustitución por vancomicina, aunque no está bien documentado en las guías cuándo se debe modificar un tratamiento ya comenzado26. El 50% de los tratamientos con metronidazol proporciona respuesta completa a los 9días, el 28% respuesta inicial con recidiva posterior y el 22% no respuesta, precisando vancomicina a los 9días o tratamiento extendido con metronidazol sin diferencia entre ellos para resolución final. Casi todos responden al séptimo día, por lo que parece razonable mantenerlo ese tiempo en casos leves moderados. Si se decide iniciar la administración de vancomicina por no respuesta, no hay evidencia para mantener metronidazol hasta completar el ciclo, sobre todo porque sus efectos secundarios gastrointestinales pueden confundirse con íleo (náuseas, vómitos, alteración del sabor). El uso de dosis altas de vancomicina (500mg/6h) no ofreció ventajas en términos de días de diarrea o recaídas.
Es recomendable mantener dieta oral o por sonda nasogástrica mientras sea posible, enriquecida con hidratos de carbono fermentables esenciales para la flora. En los casos en los que la medicación no pueda llegar bien al colon (Hartman, ileostomía...) se pueden usar enemas de vancomicina. (500mg en 100-500ml de suero salino cada 6h) o administrarla mediante colonoscopia. El metronidazol oral no es adecuado en estos pacientes, pues se absorbe casi por completo en intestino delgado, excretándose el 5-15% en heces por lo que es preferible la vía intravenosa que llega bien a la mucosa inflamada que lo secreta .La respuesta al tratamiento deriva en la disminución de su concentración fecal, por lo que no hay motivo para prolongar 14 días la administración si ha mejorado la diarrea. No hay evidencia de que la terapia de combinación sea superior.
Algunos parámetros pueden ser predictores de mala evolución, como edad, leucocitosis, insuficiencia renal, gran comorbilidad, necesidad de continuar con antibiótico causal o antiácido, ingreso por motivo quirúrgico o hipoalbuminemia14,27,28. En pacientes ingresados en unidades de cuidados intensivos, una gran elevación de PCR, un bajo IMC, el uso de quinolonas o el sexo masculino se relacionaron con peor pronóstico29.
Precisan valoración quirúrgica todos los casos complicados o con deterioro en 5 días de tratamiento médico. Dados los pobres resultados asociados a la colectomía cuando se procede a ella en situación de shock séptico, con mortalidad del 35-80%, se recomienda la valoración quirúrgica precoz que puede mejorar algo el pronóstico1,4,14,30.
Nuevas opciones terapéuticasEn el año 2011 se aprueba el empleo de la flidaxomicina para el tratamiento de la DACD no grave gracias a una trabajo de no inferioridad frente a la vancomicina para curación y tendencia a mayor prevención de recidivas (evaluadas solo las 4 semanas posteriores)31. La flidaxomicina es un macrólido bactericida con un efecto postantibiótico prolongado y un espectro de actividad menos amplio, efectivo frente a grampositivos y activo frente a enteroco y estafilococo. Se administra vía oral a dosis de 200mg cada 12h. Tiene actividad in vitro frente a C. difficile con CMI muy bajas y alcanza alta concentración fecal. Favorece la preservación de la flora y reduce la generación de citotoxinas y esporas. Su coste es muy superior al del metronidazol o la vancomicina, si bien puede ser beneficiosa en casos en los que se prevean recurrencias. Por su reducida disponibilidad no es preciso ajuste por insuficiencia renal o hepática, tiene escasas interacciones y efectos secundarios graves32. Su coste efectividad podría ser favorable para prevención de recurrencias en casos con pobre respuesta a tratamiento previo, eliminando los costes de tratamientos futuros y la diseminación. Dada la limitación de datos, su indicación se debe establecerse de forma individualizada33–35, si bien podría ser interesante en ancianos con múltiples comorbilidades en los que sea previsible la recidiva8. No tiene evidencia en cepas ribotipo 02732.
Otros agentes antibacterianos como teicoplanina, tigeciclina, ácido fusídico, colestiramina, rifampicina, rifaximina o bacitracina se han evaluado para el tratamiento de DACD, sin suficiente evidencia para establecer una recomendación. El empleo de inmunoglobulinas o la posibilidad de inmunización activa están aún en fase experimental2,4,36,37. El tolevamer es un polímero quelante de las toxinas de C. difficile que dio resultados de no inferioridad frente a la vancomicina en un estudio americano, cuya rama europea, en comparación con el metronidazol o la vancomicina no ha obtenido diferencias significativas, siendo posiblemente eficaz en prevención de recidivas, en relación con su respeto por la flora38,39.
Tratamiento de las recidivasLa recurrencia de la DACD es elevada; tras el primer episodio es del 10-20% y después del segundo del 40-65%. Suele producirse en los primeros 30días aunque para algunos autores puede ocurrir hasta 8semanas después de concluir el primer ciclo de tratamiento14. El metronidazol y la vancomicina tienen el mismo índice de primeras recurrencias; para segundas o más, la vancomicina o la flidaxomicina tienen menos. En casos de terceras recidiva se recomienda valorar trasplante fecal1,3,14,40.
El tratamiento de la DACD recidivante mediante infusión duodenal de heces de donante o TMF ha sido objeto de publicaciones recientes con resultados muy favorables para recurrencia en trabajos con poco volumen de pacientes. Consiste en la administración terapéutica de heces de donante sano mediante sonda nasogástrica o colonoscopia41. El más significativo es un estudio aleatorizado que compara la eficacia de 3 tratamientos: vancomicina (500mg/6h durante 4días), seguido de limpieza colónica e infusión de heces de donante mediante sonda nasoyeyunal, tratamiento estándar con vancomicina (500mg/6h durante 14días) o tratamiento con vancomicina seguido de lavado intestinal. La limpieza colónica pretende reducir el contenido de patógenos y favorecer la colonización por la flora del donante sano. La elevada tasa de respuestas al TMF obligó a la interrupción precoz del estudio por la diferencia significativa en curación y recidiva, si bien la pobre respuesta a la vancomicina puede favorecer la sobrevaloración de los resultados42,43. Se excluyeron pacientes graves, inmunodeprimidos y los que continuaron con la antibioterapia de base. Los donantes son voluntarios sanos a los que se hace un screening de de parásitos, C. difficile y enteropatógenos y serología de VIH, hepatitis, CMV,VEB y lúes .Las heces se recogen el mismo día del trasplante, son diluidas en suero y filtradas para obtener una solución uniforme que pueda administrarse por sonda. Los pacientes casi siempre habían tenido más de una recaída (probable rechazo a usar esta técnica terapéutica inicialmente). La FDA ha reconocido el trasplante fecal como agente terapéutico biológico y su uso debe regularse para asegurar la seguridad del paciente. Se han publicado pautas protocolizadas de donación y administración del TMF44,45. Es desconocido su efecto a medio-largo plazo y su potencial asociación con enfermedades autoinmunes46. Están en estudio actualmente mezclas artificiales de probióticos que puedan tener un efecto similar47. Un metaanálisis de publicación reciente sobre trabajos en pacientes mayores que habían sido tratados con metronidazol y terapias prolongadas de vancomicina concluye que el TMF es una terapia efectiva y segura en este grupo de edad, aun en pacientes con gran deterioro de calidad de vida41. Se debería valorar un posible trasplante fecal en todos los casos de 2 o más recidivas48,49.
Utilidad de los probióticosEl empleo de probióticos para la prevención de la DACD ha sido objeto de gran cantidad de estudios recientes con resultados prometedores, cuya variabilidad dificulta su comparación50. Se evalúan frente a placebo cuando se administran a pacientes con antibióticos y se valora la aparición de diarrea, siendo importante un seguimiento de 4-6semanas después del cese del antibiótico. Se han analizado sobre todo Sacaromices boulardii (S. boulardii), Lactobacillus casei, Streptococcus thermophilus y Lactobacillus bulgaricus y Lactobacillus rhamnosus (L. rhamnosus). Algunos estudios ofrecen resultados positivos, si bien su metodología, tamaño o tiempo de seguimiento son insuficientes para establecer la indicación de su empleo51. No se ha conseguido identificar las 40.000 cepas componentes de la flora normal cuya función es ser barrera frente a patógenos mediante competencia por receptores, nutrientes, generación de enzimas, regulación de respuesta inmune o estimulación de sistema nervioso entérico, ni saber cuáles son las ideales para elaborar una mezcla probiótica. Algunas cepas de bacterias que forman parte de la flora intestinal generan proteasas que degradan directamente las toxinas de C. difficiles o pueden incrementar la respuesta inmune del huésped frente a él. Parece que S. boulardii y L. rhamnosus pueden ser los más útiles en la DAA, pero para DACD no hay evidencias52. Otros trabajos dan resultados favorables no concluyentes empleando dosis altas simultáneamente con vancomicina o metronidazol; S. boulardii ha demostrado beneficio en prevención de recurrencias, como coadyuvante del antibiótico en pequeños trabajos53. Un gran estudio prospectivo reciente evalúa el efecto de la administración de lactobacilus y bifidobacterias en ancianos en tratamiento antibiótico con seguimiento a 12semanas sin demostrar beneficios estadísticamente significativos para la prevención de DAA o DACD54. Los efectos secundarios son escasos pero deben evitarse en pacientes inmunodeprimidos por riesgo de fungemia o bacteriemia y usar con cautela en portadores de vía central, alteraciones de la barrera intestinal, en casos de administración por yeyunostomía, enfermedad valvular cardíaca, etc.55. Ocasionalmente producen nauseas, dolor abdominal, diarrea o estreñimiento. Aunque no se conoce bien la dosis, se deben administrar al menos 1010 UFC al día, siempre separados de los antibióticos. Una gran desventaja de su empleo es la ausencia de regulación formal. Si bien los de farmacia son de elaboración más controlada, en la mayoría de los productos de supermercado no se aportan el número ni el tipo de bacterias indicadas en su etiqueta56.
Otras medidas preventivasLa prevención de la transmisión de C. difficile en el medio hospitalario es un problema epidemiológico de vital importancia. Es fundamental un diagnóstico precoz y certero, vigilancia específica y educación del personal1. Medidas como aislamiento entérico, lavado cuidadoso de manos con agua y jabón más clorhexidina, uso de guantes y termómetros desechables, desinfección de equipo médico y de las instalaciones con lejía son imprescindibles para el control de esta infección nosocomial en cuya transmisión el personal e instalaciones sanitarias tienen una responsabilidad evidente57,58.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.