La edad del paciente suele limitar los esfuerzos terapéuticos del oncólogo. El objetivo de este estudio es determinar si la quimioterapia se emplea con menos frecuencia en mujeres mayores de 70 años de edad con cáncer de mama, que en pacientes con una edad menor.
Material y métodosSe llevó a cabo un estudio retrospectivo a partir de las historias clínicas de las mujeres mayores de 65 años de edad, con diagnóstico de cáncer de mama no metastático, tratadas en un hospital universitario. Las pacientes se clasificaron en dos grupos, de 65-69 años y ≥ 70 años. En ambos, analizamos las diferencias en cuanto a las características de las pacientes y del tumor, el tipo de tratamiento con quimioterapia, y la toxicidad asociada a la misma.
ResultadosSe analizó un total de 164 mujeres, con una edad mediana de 73,7 años. No había diferencias significativas en cuanto a las características de las pacientes o de sus neoplasias. Sin embargo, se trató con quimioterapia el 75% de las mujeres entre 65-69 años, frente al 34% de las pacientes mayores (p <0,001). La toxicidad secundaria a la quimioterapia fue similar en ambos grupos de edad.
ConclusionesLas mujeres con más de 70 años de edad se tratan con quimioterapia con menos frecuencia, a pesar de que las características de las neoplasias entre ambos grupos de edad son similares, así como la toxicidad secundaria a la quimioterapia.
Patient age often limits the therapeutic efforts of the oncologist. The aim of this study was to determine whether chemotherapy is used less frequently in elderly women aged 65-69 years diagnosed with breast cancer, compared to younger women.
MethodsA retrospective study was performed including women greater than 65 years old who had localised breast cancer and were treated at a University Hospital. Patients were classified into two groups, 65-69 years old and ≥ 70 years old. The differences in patient characteristics, tumour characteristics, chemotherapy treatment and chemotherapy-associated toxicity were analysed in both groups.
ResultsA total of 164 women, with an average age of 73.7 years, were included in this study. There were no significant differences in the characteristics of the patients or their tumours. However, 75% of women <70 years old were treated with chemotherapy compared to just 34% of the older women (P<.001). The resulting levels of toxicity were similar between age groups.
ConclusionsWomen ≥ 70 years old were treated with chemotherapy less frequently, even though the features and tumour characteristics of the women, as well as the toxicity of the treatment, were similar to that in younger women.
El cáncer de mama es la neoplasia más habitual en mujeres en todo el mundo, con un total de 1,15 millones de casos nuevos al año. De estos, 361.000 (27,3% de todas las neoplasias en mujeres) ocurren en Europa1. También es la principal causa mundial de muerte por cáncer entre mujeres. De hecho, en el año 2002, 411.000 mujeres fallecieron por esta neoplasia2. Su principal factor de riesgo es la edad. Aproximadamente, el 34% de todas las neoplasias ocurren en mujeres por encima de los 70 años3.
En distintos estudios, las ancianas con cáncer de mama reciben quimioterapia adyuvante con menos frecuencia que las más jóvenes4, aunque la edad no debiera ser una contraindicación, per se, para recibir un tratamiento adecuado5. La ausencia de un tratamiento en ancianas reduce su supervivencia específica6.
Este estudio pretende comparar las características histológicas del cáncer de mama en dos grupos de edad (65-69 años y ≥ 70 años), así como los patrones de tratamiento y la toxicidad de los mismos, en un hospital universitario.
Material y métodosSe analizaron, de forma retrospectiva, las historias clínicas de todas las pacientes, mayores de 65 años de edad, diagnosticadas de cáncer de mama, estadios I-III (American Joint Committee on Cancer; sixth edition) entre el 1 de junio de 2003 y el 31 de diciembre de 2006, en el Hospital General Universitario de Elche.
Las principales condiciones que debían recoger los casos clínicos eran las siguientes: 1) edad superior a 65 años de edad, 2) tener diagnóstico de cáncer de mama no metastático entre junio de 2003 y diciembre de 2006. Se excluyeron aquellas historias clínicas en las que se indicara que la paciente había recibido radioterapia y quimioterapia de forma concomitante, ya que, en estos casos, la toxicidad es mayor, y podría sesgar las conclusiones relacionadas con la toxicidad de la quimioterapia.
Se analizaron variables referentes a la paciente (edad, situación basal medida mediante la escala ECOG, consumo de fármacos, comorbilidad medida mediante el índice de Charlson), referentes al tumor (tipo histológico, tamaño tumoral, grado de diferenciación, estado de expresión de receptores hormonales y de HER2, estadio tumoral y criterios de St Gallen), referentes al tipo de tratamiento (toxicidad de la quimioterapia, uso de tratamiento de soporte y modificaciones de dosis).
Los datos se dividieron y se analizaron en dos categorías: pacientes entre 65 y 69 años y pacientes ≥ 70 años.
Se empleó un test de Chi-cuadrado para llevar a cabo las comparaciones de las distintas variables entre ambos grupos de edad. En el análisis estadístico, se consideró significativa una p ≤ 0,05. Todos los análisis se llevaron a cabo utilizando la versión 15.0 de SPSS para Windows.
ResultadosEntre junio de 2003 y diciembre de 2006, se diagnosticó un total de 164 mujeres mayores de 65 años de edad con cáncer de mama no metastático. La mediana de edad al diagnóstico fue de 73,7 años. Un total de 95 pacientes (60,5%) superaban los 70 años de edad.
La situación basal de las pacientes correspondía a un ECOG de 0 (74,5%) y ECOG 1 (17,8%). Había 44 pacientes (30,3%) que consumían entre 3 o 4 fármacos, y 41 mujeres (2,3%) consumían 5 fármacos o más. La comorbilidad, medida mediante el índice de Charlson, correspondía a una puntuación de 1-2 en 77 casos (47%) y a una puntuación de 3-4 en 75 pacientes (46%).
La histología tumoral correspondía a carcinoma ductal infiltrante en el 82,8% de los casos (n=135). Había 85 pacientes sin afectación axilar (60,7%). Los receptores de estrógenos (RE) eran positivos en 119 casos (75,8%) y los receptores de progesterona (RP) se expresaban en el 59,9% (n=94). Además, 37 casos (24,7%) presentaban amplificación de HER2.
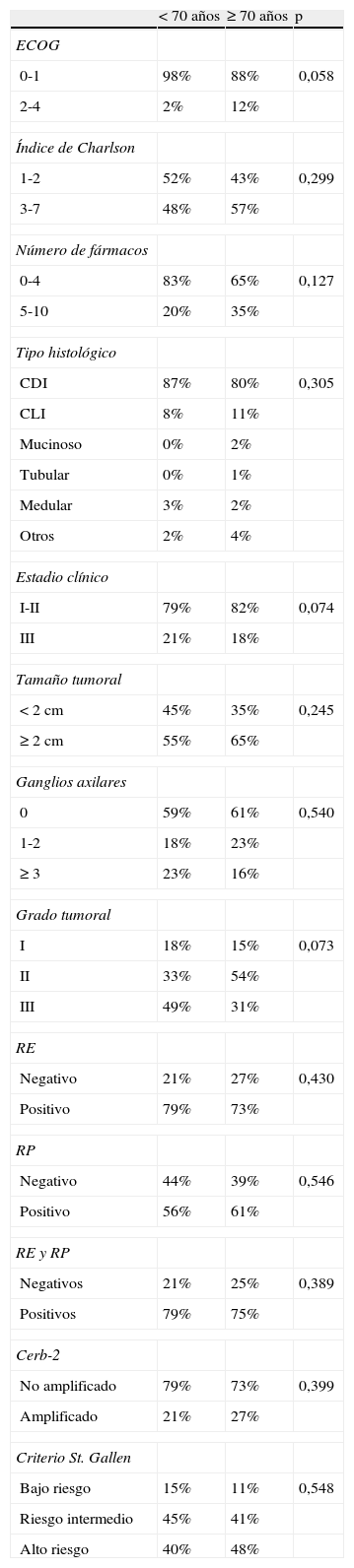
No se observaron diferencias estadísticamente significativas en cuanto al tipo histológico, el grado de diferenciación, el tamaño tumoral, el número de ganglios, la expresión de RE y/o RP, la sobreexpresión de HER2, el estadio clínico y los grupos de riesgo según los criterios de St Gallen (p>0,05) (tabla 1).
Características basales por grupos de edad
| < 70 años | ≥ 70 años | p | |
| ECOG | |||
| 0-1 | 98% | 88% | 0,058 |
| 2-4 | 2% | 12% | |
| Índice de Charlson | |||
| 1-2 | 52% | 43% | 0,299 |
| 3-7 | 48% | 57% | |
| Número de fármacos | |||
| 0-4 | 83% | 65% | 0,127 |
| 5-10 | 20% | 35% | |
| Tipo histológico | |||
| CDI | 87% | 80% | 0,305 |
| CLI | 8% | 11% | |
| Mucinoso | 0% | 2% | |
| Tubular | 0% | 1% | |
| Medular | 3% | 2% | |
| Otros | 2% | 4% | |
| Estadio clínico | |||
| I-II | 79% | 82% | 0,074 |
| III | 21% | 18% | |
| Tamaño tumoral | |||
| <2cm | 45% | 35% | 0,245 |
| ≥2cm | 55% | 65% | |
| Ganglios axilares | |||
| 0 | 59% | 61% | 0,540 |
| 1-2 | 18% | 23% | |
| ≥3 | 23% | 16% | |
| Grado tumoral | |||
| I | 18% | 15% | 0,073 |
| II | 33% | 54% | |
| III | 49% | 31% | |
| RE | |||
| Negativo | 21% | 27% | 0,430 |
| Positivo | 79% | 73% | |
| RP | |||
| Negativo | 44% | 39% | 0,546 |
| Positivo | 56% | 61% | |
| RE y RP | |||
| Negativos | 21% | 25% | 0,389 |
| Positivos | 79% | 75% | |
| Cerb-2 | |||
| No amplificado | 79% | 73% | 0,399 |
| Amplificado | 21% | 27% | |
| Criterio St. Gallen | |||
| Bajo riesgo | 15% | 11% | 0,548 |
| Riesgo intermedio | 45% | 41% | |
| Alto riesgo | 40% | 48% | |
CDI: carcinoma ductal infiltrante; CLI: carcinoma lobulillar infiltrante; RE: receptores de estrógenos; RP: receptores de progesterona.
Se trató con quimioterapia adyuvante un total de 78 mujeres (41,8%). Cincuenta y una de ellas (65,4%) recibieron un esquema de tratamiento con antraciclinas, con o sin taxanos. De entre todas éstas, solo 10 (18,5%) recibieron una fórmula liposomal.
En el 97,3% de los casos (n=75), la quimioterapia se administró a dosis plenas. Ocho pacientes (10,3%) finalizaron el tratamiento antes de lo esperado como consecuencia de su toxicidad. Fue necesario retrasar el tratamiento en 27 casos (34,6%), un total de 31 veces. La densidad de dosis fue menor a la unidad en 8 casos, y el 89,2% de las pacientes recibió la dosis planificada de citostáticos (n=66). No fue necesario reducir la dosis inicial de tratamiento en 61 pacientes (81,3%). Siete pacientes ingresaron en el hospital como consecuencia de complicaciones derivadas de la quimioterapia.
Treinta y seis de las pacientes tratadas con quimioterapia (48%) recibieron tratamiento de soporte, incluyendo factores estimulantes de colonias (G-CSF) en el 38,7% de los casos (n=29), y eritropoyetina en 7 pacientes (9,6%).
Se incluyó en ensayo clínico un total de 8 pacientes, una de las cuales tenía más de 70 años de edad.
Toxicidad asociada al uso de quimioterapia y diferencias entre grupos de edadTrece pacientes (16,7%) tratadas con quimioterapia presentaron toxicidad hematológica grado 4, y 22 pacientes (28,2%) presentaron toxicidad no hematológica grado 3-4 (Common Toxicity Criteria. NCI-CTC Version 2.0; 30 abril 1999).
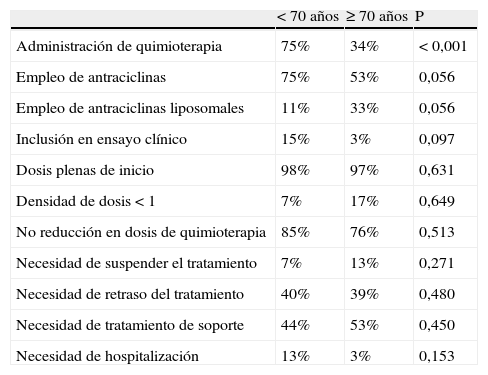
La quimioterapia se empleó con más frecuencia en el grupo de menor edad en comparación con las mayores de 70 años; sin embargo, no había diferencias en cuanto al empleo de antraciclinas, ni en cuanto al uso de dosis plenas de citostáticos. Tampoco había diferencias en las repercusiones negativas de la quimioterapia, medidas mediante el número de veces en las que se redujo la dosis de tratamiento, la necesidad de tratamiento de soporte, y la hospitalización. Había cierta tendencia a incluir con más frecuencia en ensayo clínico a las pacientes del grupo de menor edad, aunque no se alcanzó la significación estadística (tabla 2).
Tratamiento con quimioterapia por grupos de edad. Diferencias en su empleo y en las repercusiones
| <70 años | ≥70 años | P | |
| Administración de quimioterapia | 75% | 34% | <0,001 |
| Empleo de antraciclinas | 75% | 53% | 0,056 |
| Empleo de antraciclinas liposomales | 11% | 33% | 0,056 |
| Inclusión en ensayo clínico | 15% | 3% | 0,097 |
| Dosis plenas de inicio | 98% | 97% | 0,631 |
| Densidad de dosis <1 | 7% | 17% | 0,649 |
| No reducción en dosis de quimioterapia | 85% | 76% | 0,513 |
| Necesidad de suspender el tratamiento | 7% | 13% | 0,271 |
| Necesidad de retraso del tratamiento | 40% | 39% | 0,480 |
| Necesidad de tratamiento de soporte | 44% | 53% | 0,450 |
| Necesidad de hospitalización | 13% | 3% | 0,153 |
Dado que los ancianos están infrarrepresentados en los ensayos clínicos7, y considerando que, a medida que aumenta la edad, el beneficio derivado de la quimioterapia adyuvante es menor8, el tratamiento con quimioterapia en ancianas con cáncer de mama debe limitarse a casos seleccionados. Hay numerosos estudios retrospectivos que han mostrado distintos porcentajes de administración de quimioterapia adyuvante en ancianas: 5%9, 11%10, 17%11, 31,5%12 y 34% en las pacientes mayores de 70 años de edad de nuestra muestra. Se trata, por tanto, de una serie en la que el porcentaje de tratamiento con quimioterapia es de los más altos descritos en la literatura. Sin embargo, es evidente que no es posible hacer una comparación entre las distintas series, debido a que no coinciden en cuanto a la distribución de la edad de las pacientes ni en cuanto a las características de los tumores. En los estudios publicados, la edad y los estereotipos creados por los propios oncólogos en torno a la misma, normalmente son los factores que conducen a la elección de la quimioterapia adyuvante en la práctica clínica. Y suelen prevalecer dichos criterios por encima de los factores pronósticos del tumor o de la valoración geriátrica13. Dada la naturaleza retrospectiva de nuestro estudio, no es posible determinar los motivos por los que, a pesar de que no había diferencias en cuanto a las características del tumor, y tampoco en cuanto a las características basales de la muestra, se trató con menos frecuencia al grupo de mayor edad. Hay que considerar que se carece de datos derivados de la aplicación de una Valoración Geriátrica Integral (VGI). En la práctica rutinaria, generalmente, no se tiene en cuenta la VGI para recomendar la administración de quimioterapia adyuvante en ancianas con cáncer de mama14, a pesar de que esta herramienta ha demostrado su utilidad como instrumento predictivo de tolerancia y/o toxicidad de la quimioterapia en este grupo de edad15.
En nuestra serie, aunque no se ha producido ningún caso de muerte por la administración de la quimioterapia, el porcentaje de casos en los que se produjo toxicidad hematológica grado 4 fue del 16,7%. En el 28,2% de los casos, hubo toxicidad no hematológica grados 3-4. Los resultados, aun siendo imposible una comparación directa por tratarse de estudios diferentes, son inferiores a los de otras series de la literatura científica12, lo cual puede hacernos pensar que la selección de los pacientes no fue totalmente inadecuada.
A pesar de que las conclusiones que se pueden extraer de este estudio son limitadas, sería interesante tener en cuenta dichas limitaciones para el diseño ulterior de estudios, prospectivos, multicéntricos, y multidisciplinares, que permitan profundizar en el ámbito de los ancianos con cáncer y optimizar su manejo y su tratamiento. Y en estos estudios, sería imprescindible utilizar la VGI como herramienta para conseguir una selección más adecuada de las pacientes que podrían tolerar el tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.