El envejecimiento afecta a todas las estructuras y procesos de los organismos, incluyendo el sistema circadiano y su principal manifestación, los ritmos biológicos. El sistema circadiano organiza temporalmente la vida de los organismos y está formado por estructuras receptoras de la información del ambiente externo (que sincronizan el reloj circadiano), el marcapasos circadiano central y los relojes periféricos dependientes de éste, y una serie de salidas, que son los ritmos manifiestos. En el envejecimiento se produce un deterioro en el funcionamiento de esos tres componentes: receptores (el ojo en su capacidad de transmisión de la información luminosa más activa para el sistema circadiano), el marcapasos central (por alteración de la función neuronal), y en las salidas. Esto lleva a la alteración de los ritmos manifiestos, con pérdida de la relación de fase existente entre ellos, reducción de su amplitud, aumento de la fragmentación y adelanto de su fase.
Ageing affects all organic structures and processes, including the circadian system and its principal sign, the biological rhythms. The circadian system temporarily organizes the living organisms. It is made up of structures receiving information from the external environment (that synchronize the circadian clock), the central circadian pacemaker and the peripheral clocks that depends on it, and several outputs that are the overt rhythms. Ageing produces losses in function of all these three components: receptors (the eye in its capacity to transmit the more active light information to the circadian system), the central pacemaker (due to alterations in neuronal function) and the outputs. This leads to the alteration of overt rhythms, with losses in the phase relationship between them, a reduction in amplitude, an increase in fragmentation and an advancement of its phase.
Desde sus orígenes como especie, los humanos se han interesado por la medición del tiempo. En un primer momento los esfuerzos se centraron en anticipar los cambios estacionales (desarrollo de calendarios) y más adelante en calcular la hora del día (invención de relojes)1.
Sin embargo, los relojes gobernaban la vida mucho antes de su invención por los humanos. De hecho todos los seres vivos tienen relojes internos que les permiten predecir las oscilaciones del medio ambiente para que su fisiología responda de forma preventiva y anticipatoria, con la ventaja adaptativa que ello conlleva. El sistema del que forma parte principal este reloj interno se denomina sistema circadiano. Cuando a los organismos se les aísla del ambiente, sus ritmos difieren ligeramente de 24 horas, de ahí la denominación circa-diano. Por ello, para su correcto funcionamiento, el sistema requiere que se le ponga en hora cada día. Este sistema, al igual que el resto de órganos y sistemas del organismo, madura durante los primeros meses de vida, alcanza la madurez plena durante la vida adulta y muestra síntomas de envejecimiento en las últimas décadas de ésta.
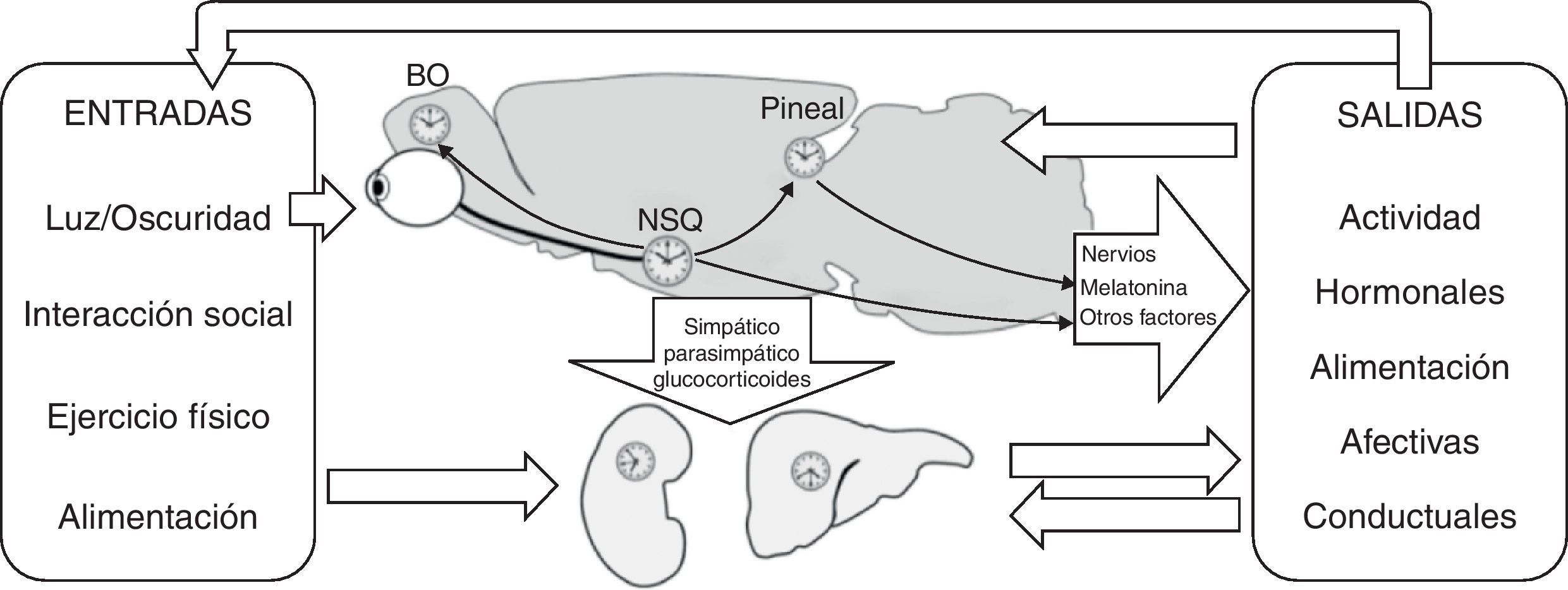
Estructura y organización funcional del sistema circadianoEl sistema circadiano está formado por las vías de entrada que reciben la información de los sincronizadores externos o zeitgebers (factores que ponen en hora el sistema circadiano) y la envían al marcapasos circadiano central, el cual va a transmitir la información temporal al resto del organismo. En esta actividad el marcapasos central está auxiliado por numerosos osciladores circadianos, tanto centrales (retina u otros núcleos cerebrales) como periféricos (riñón, hígado, tejido adiposo, etc.)2–4 (fig. 1).
Estructura general del sistema circadiano. Se representan los principales sincronizadores en el recuadro izquierdo y la vía simplificada de transmisión de la información temporal procedente del ciclo luz/oscuridad ambiental que, a través de los núcleos supraquiasmáticos (NSQ) llega al resto de osciladores, tanto centrales (bulbo olfatorio [BO-], pineal, etc.) como periféricos (riñón, hígado, etc.). La pineal a través de la melatonina, o los núcleos supraquiasmáticos a través de nervios u otros factores humorales, ponen en hora al resto del organismo y, por tanto, a los ritmos manifiestos entre los que se encuentran los presentes en el recuadro derecho.
Los principales sincronizadores del sistema circadiano son el ciclo luz-oscuridad, el ejercicio físico, la alimentación y las interacciones sociales. Sin embargo, el más importante es la información luminosa, recibida por una subpoblación de células ganglionares de la retina que contienen melanopsina5, un pigmento fotosensible que generalmente está ausente en conos y bastones; estas neuronas emiten la información a los núcleos supraquiasmáticos del hipotálamo por medio del tracto retinohipotalámico6.
El ciclo de actividad-reposo en general, y el ejercicio físico regular en particular, representan un elemento sincronizador muy importante, ya que la regularidad en el patrón diario de actividad mejora el descanso durante el sueño y la calidad de la vigilia, reflejo de una potenciación general de los ritmos circadianos7–9.
El horario de alimentación es capaz de sincronizar a los relojes presentes en el sistema gastrointestinal, de modo que un horario irregular de alimentación afecta a todas las funciones digestivas, incluyendo la motilidad, las secreciones y la absorción de nutrientes10.
En el caso de los elementos sincronizadores no fóticos, éstos actúan sobre otros núcleos cerebrales, como los del rafe que, a través de la producción de serotonina, modulan la actividad del marcapasos circadiano central11.
Marcapasos centralEl marcapasos circadiano en mamíferos lo forman los núcleos supraquiasmáticos del hipotálamo, un par de núcleos constituidos por aproximadamente 20.000 neuronas muy pequeñas y densamente empaquetadas. La estructura de estos núcleos es heterogénea, con una región dorsomedial, cuyas neuronas expresan arginil-vasopresina (AVP), y una región ventrolateral, que se caracteriza por la expresión de péptido intestinal vasoactivo (VIP)12. La región ventrolateral es la que recibe la información procedente de las vías de entrada principalmente y actuaría, por tanto, procesando la información sincronizadora, transmitiéndola a la región dorsomedial, que actúa como un verdadero marcapasos, poniendo en hora al resto del organismo13.
Vías de salidaLos núcleos supraquiasmáticos transmiten la información temporal a otras regiones del cerebro que regulan el comportamiento, los sistemas neuroendocrino y nervioso autónomo y estos, a su vez, regularán el resto de relojes presentes en los distintos órganos y tejidos. De este modo, los núcleos supraquiasmáticos marcan los tiempos de la fisiología y el comportamiento del individuo, como si de un director de orquesta se tratasen, mediante señales nerviosas y humorales11.
La salida más importante de los núcleos supraquiasmáticos es el ritmo de melatonina plasmática, hormona que es sintetizada durante el período nocturno y en ausencia de luz por la glándula pineal14; por tanto, la producción de esta hormona presenta un ritmo circadiano con valores altos durante la noche y bajos durante el día14. Estas propiedades de la melatonina han llevado a los organismos a utilizarla como reloj diario, de modo que unas concentraciones plasmáticas elevadas indican que es de noche y valores bajos que es de día. Además, la duración de la secreción elevada de melatonina es utilizada por los animales para identificar la estación, de forma que una concentración de melatonina alta durante más tiempo cada día indica invierno y si el tiempo que permanece elevada es más breve es señal de verano15. Todas estas propiedades han hecho del ritmo circadiano de la melatonina un ritmo marcador del sistema circadiano.
El ritmo de temperatura corporal central (temperatura existente en el interior de cabeza, tórax y abdomen) es otro de los ritmos más robustos de los mamíferos. Los núcleos supraquiasmáticos, por medio del área preóptica medial del hipotálamo, regulan el ritmo de temperatura corporal central16, alcanzando valores altos durante el período de actividad de los organismos y bajos durante el período de descanso, de este modo los valores elevados del período de actividad permiten velocidades de transmisión nerviosa más elevadas y mayor rendimiento muscular17 y la bajada de temperatura durante el descanso es necesaria para poder iniciar el sueño18. Las dos horas de máxima temperatura central en la especie humana coinciden con la zona de mantenimiento de la vigilia, que suele situarse entre las 20:00 y las 22:00 horas y es el momento en el que los individuos jóvenes presentan la mayor dificultad para dormir19.
El ritmo de actividad-reposo es un ritmo marcador muy relacionado con el ritmo de temperatura corporal central y con el de sueño-vigilia20. Obviamente, los individuos presentan valores más bajos de actividad cuando están en reposo y más altos cuando están activos.
Evaluación del funcionamiento del sistema circadianoDebido a la localización anatómica del reloj central, puede resultar muy difícil o imposible acceder a él y estudiarlo directamente (sobre todo en la especie humana). Por ello hay que recurrir a métodos indirectos para determinar su funcionamiento, generalmente mediante el estudio de las vías de salida del reloj, a través del análisis de aquellos ritmos manifiestos de procesos fisiológicos que están controlados directamente por el reloj central. Para que sean buenos ritmos marcadores del sistema circadiano, estos deben ser robustos y fácilmente medibles, lo que implica fácil acceso, técnicas de medición sencillas, preferentemente no invasivas, y que permitan el registro de varios ciclos consecutivos21.
Los ritmos manifiestos más estudiados han sido los comportamentales, como los ritmos actividad motora, sueño-vigilia, o los ritmos alimentarios. También se han estudiado ritmos hormonales y de expresión génica, siendo los más utilizados los de las hormonas melatonina14 y cortisol22, y los genes reloj Clock, Per y Bmal23.
Además, las oscilaciones rítmicas de la temperatura corporal (central o periférica)24,25, la presión arterial, las frecuencias cardiaca y respiratoria también resultan útiles para la evaluación funcional del sistema circadiano.
Por otro lado, es necesario la utilización de modelos animales para la obtención de datos experimentales acerca de diversos aspectos, debido a las obvias limitaciones que presenta la experimentación con humanos. Los criterios más importantes para seleccionar una especie animal como modelo en este sentido son: una esperanza de vida reducida, ideales para estudiar el proceso de envejecimiento26, o que desarrollen algún tipo de enfermedad común al ser humano27.
Técnicas de monitorizaciónPara que una técnica sea adecuada para medir una variable, debe interferir lo menos posible con el organismo, es decir, deben ser métodos no invasivos, cómodos y que sean capaces de obtener largos registros de datos.
La actividad motora ha sido uno de los ritmos comportamentales más estudiados. En humanos se ha empleado la actimetría, capaz de detectar cambios en la posición del individuo mediante la utilización de sensores externos, de forma similar a un reloj de pulsera o brazalete. Se pueden obtener un elevado número de datos en un plazo de tiempo relativamente corto. Además, estos registros deben ir acompañados de diarios en los que los sujetos indican a qué hora realizan determinadas actividades (levantarse, interacciones sociales, dormir la siesta, etc.)28. En modelos animales, el método más usado para obtener registros motores ha sido la utilización de fotosensores eléctricos. Se basan en el número de veces que el haz de luz infrarroja emitido por el sensor es interrumpido por el animal. Los registros de video también son útiles para este fin. En el caso de roedores, se suele emplear, en parte por su relativa sencillez, el registro de actividad voluntaria en una rueda giratoria29.
Los ritmos alimentarios pueden extraerse indirectamente a partir de los registros de actividad locomotora. Al igual que éstos, pueden obtenerse mediante el diario de actividades, o en el caso de animales, mediante fotosensores. Modificando la disponibilidad de alimento o midiendo su demanda pueden determinarse los mejores momentos de aprovechamiento de determinados alimentos30.
Otras variables fisiológicas, como la temperatura corporal central o periférica, pueden ser medidos mediante sensores automáticos y programables, obteniendo así largas series de datos para una correcta caracterización. Además, en el caso de la temperatura periférica, tienen la ventaja de no ser invasivos. Con el mismo principio pueden ser medidas otras variables como la presión arterial o frecuencia respiratoria.
La detección de cortisol en muestras de saliva obtenidas a lo largo del día mediante RIA o ELISA es un procedimiento sencillo. Además, se están empleando cada vez más técnicas para la detección de expresión génica en muestras fáciles de obtener, como en saliva.
Parámetros indicadores del funcionamientoDespués de la obtención de los datos de las variables medidas y analizados éstos como series temporales mediante las correspondientes herramientas estadísticas, podemos extraer una serie de parámetros que nos indiquen el correcto funcionamiento del sistema circadiano.
En general, los ritmos con una amplitud elevada, regulares y con una rápida capacidad de adaptación a nuevas condiciones, lo que se conoce como ritmos robustos, son marcadores de un correcto funcionamiento del sistema circadiano.
El sistema circadiano envejecido. Cambios globalesEl envejecimiento afecta a todas las estructuras y sistemas del organismo, entre ellos el sistema circadiano31. Además, alteraciones en el sistema circadiano pueden contribuir a acelerar el proceso de envejecimiento32. Cómo se ve afectado el sistema circadiano por el envejecimiento puede ser cuantificado mediante los métodos descritos en el apartado 2.
En general, se pueden observar tres fenómenos comunes en todos los ritmos circadianos envejecidos: pérdida de amplitud, aumento en la fragmentación, y cambio de fase, generalmente adelanto (fig. 2)33.
Izquierda: cambios en la onda media de la actividad locomotora diaria de individuos Nothobranchius korthausae adultos (línea continua) y envejecidos (línea discontinua). Derecha: actogramas dobles con individuos representativos del grupo de peces del que se han obtenido las ondas medias. En conjunto, se observa una disminución de la amplitud del ritmo y un incremento en la fragmentación (Lucas-Sánchez et al.26).
Además de la pérdida de agudeza visual característica de la senescencia y la reducción del área pupilar, el cristalino humano va perdiendo progresivamente su capacidad de transmisión de luz azulada (menor de 500nm), que es la más activa para el sistema circadiano. De este modo, los individuos mayores de 55 años reciben menos de la mitad de la información lumínica que llega a sus ojos si lo comparamos con individuos de 25 años34.
Los niveles medios de iluminación artificial de interiores se encuentran en torno a 100 lux o menos, muy inferiores a los niveles de iluminación natural e incapaces de sincronizar a un individuo adulto35,36 y, por tanto, tendrán un menor efecto en ancianos debido a la disminución de la transmisión de la información circadiana. De hecho, se necesitarían intensidades luminosas iguales o superiores a 500-1.000 lux para que un anciano pudiera permanecer sincronizado al ciclo luz-oscuridad37. Además, los niveles de iluminación percibidos por el individuo se relacionan también con su bienestar; así, individuos con escasa exposición a la luz tienen más problemas de sueño, mayor incidencia de depresiones, menores niveles de melatonina nocturnos y alteración general de los ritmos que pueden recuperarse si se exponen a niveles de iluminación adecuados38.
Alteraciones en marcapasos y osciladores circadianosAunque está ampliamente aceptado que el deterioro del sistema nervioso con el envejecimiento se produce por la disminución del número de neuronas39, últimamente está surgiendo la hipótesis de que esté más relacionado con la pérdida de funcionalidad de las mismas por medio de la alteración de las sinapsis o la reducción del número de sinapsis39.
El deterioro de los núcleos supraquiasmáticos no se debe tanto a una disminución del volumen o del número de neuronas como a una alteración en la actividad eléctrica, según se ha descrito en trabajos realizados en animales de experimentación y a la alteración de ciertos péptidos como la AVP, que presenta un ritmo circadiano hasta los 50 años de edad y a partir de ahí comienza su deterioro40,41. Sin embargo, todas estas alteraciones ocurren en una edad muy avanzada (a partir de los 80 años normalmente) y el deterioro en la organización circadiana suele ocurrir mucho antes (a partir de los 50-60 años aproximadamente)40,41.
Alteraciones en las salidasLas alteraciones que pueden ocurrir en las salidas pueden ser debidas por efecto directo del envejecimiento o por efecto indirecto por deterioro de las entradas y/o el reloj central. Hay que tener en cuenta que, al ser el último eslabón de la cadena del sistema, el deterioro observado en los ritmos manifiestos puede ser debido a daños en cualquier punto del sistema circadiano: entradas, marcapasos central y/o salidas.
De forma general, podemos detectar un ritmo deteriorado/envejecido por reducción en la amplitud, incremento en la fragmentación, cambio de fase, pérdida de la capacidad de adaptación a nuevas condiciones y anticipación a eventos (horario de alimentación, fotoperiodo)33 (fig. 2).
De todos los ritmos manifiestos, el ritmo de sueño-vigilia es uno de los que mejor reflejan el estado de un individuo. Con el envejecimiento, el sueño se fragmenta y el estado de alerta diurna disminuye, atenuándose las diferencias entre día y noche y por tanto la amplitud se reduce. Además, hay una tendencia a tener periodos de sueño antes de lo normal o a despertarse antes de lo normal. También se ve afectada la capacidad cognitiva42,43.
El ritmo de temperatura corporal central sufre un proceso similar, y la presión arterial pasa a ser un ritmo ultradiano. La secreción rítmica de hormonas como la melatonina o GH también sufren cambios, todos relacionados con una disminución en la amplitud42,44.
En animales modelo, la pérdida de capacidad de anticipar un evento previamente fijado a la misma hora día tras día (fotoperiodo, alimentación, estrés puntual, etc.) es reflejo de que los mecanismos de memoria rítmica están afectados.
ConclusionesEl sistema circadiano tiene una estructura y, por tanto, una funcionalidad complejas y difusas, ya que, si bien una parte está ubicada en el sistema nervioso central, otra lo está en los tejido periféricos (hígado, riñón). Por ello, existen muchos aspectos tocantes a las vías de entrada, las estructuras centrales, como a las vías de conexión del marcapasos central con los ritmos funcionales manifiestos por desvelar. Mucha de la información que se está obteniendo en este sentido proviene de la experimentación con animales, en los que actualmente existen varias especies que utilizan como modelo debido a sus peculiaridades (proximidad filogenética con la especie humana, ciclos de vida de corta duración, etc.). El sistema circadiano, como otros del organismo de un animal, se ve afectado por los procesos de envejecimiento, con una pérdida en general de la robustez de los ritmos (pérdidas de amplitud, aumento de la fragmentación, etc.). En este sentido, a la complejidad del sistema circadiano hay que añadir el hecho de que se ha demostrado que ciertas alteraciones en el funcionamiento de aquel aceleran los procesos de envejecimiento.
FinanciaciónEste trabajo ha sido financiado por: el Instituto de Salud Carlos III (RETICEF, D06/0013/0019, RD06/0013/0008, el Ministerio de Educación y Ciencia (BFU2010-21945-C02-01), la Fundación Séneca de la Región de Murcia (12005/PI/09) y la Junta de Andalucía (P07-CTS-03135).
Gracias a J.A Madrid por su revisión crítica del manuscrito y sus aportaciones. La participación de los 4 autores en el trabajo ha sido equivalente.







![Estructura general del sistema circadiano. Se representan los principales sincronizadores en el recuadro izquierdo y la vía simplificada de transmisión de la información temporal procedente del ciclo luz/oscuridad ambiental que, a través de los núcleos supraquiasmáticos (NSQ) llega al resto de osciladores, tanto centrales (bulbo olfatorio [BO-], pineal, etc.) como periféricos (riñón, hígado, etc.). La pineal a través de la melatonina, o los núcleos supraquiasmáticos a través de nervios u otros factores humorales, ponen en hora al resto del organismo y, por tanto, a los ritmos manifiestos entre los que se encuentran los presentes en el recuadro derecho. Estructura general del sistema circadiano. Se representan los principales sincronizadores en el recuadro izquierdo y la vía simplificada de transmisión de la información temporal procedente del ciclo luz/oscuridad ambiental que, a través de los núcleos supraquiasmáticos (NSQ) llega al resto de osciladores, tanto centrales (bulbo olfatorio [BO-], pineal, etc.) como periféricos (riñón, hígado, etc.). La pineal a través de la melatonina, o los núcleos supraquiasmáticos a través de nervios u otros factores humorales, ponen en hora al resto del organismo y, por tanto, a los ritmos manifiestos entre los que se encuentran los presentes en el recuadro derecho.](https://static.elsevier.es/multimedia/0211139X/0000004700000002/v1_201305031954/S0211139X11003209/v1_201305031954/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

