El lupus eritematoso sistémico (LES) del anciano se refiere, en general, a la enfermedad que aparece después de los 65 años y presenta unas características diferenciales respecto al LES clásico de pacientes más jóvenes. Así, es aceptado que el LES de inicio tardío, responsable del 10-20% de los casos de lupus entre la población general, tiene un curso clínico diferente y unas primeras manifestaciones clínicas inespecíficas. En general, se ha descrito que el curso clínico del LES de inicio tardío es más indolente que el del LES clásico. Por otra parte, la incidencia significativamente mayor de varones con LES de inicio tardío y el curso más benigno de la enfermedad en mujeres postmenopáusicas sugieren que el estatus estrogénico puede influir de forma significativa en la actividad de la enfermedad. Debido al inicio insidioso y la poca especificidad de las manifestaciones al inicio de la enfermedad, se produce a menudo un diagnóstico tardío de la enfermedad. En el anciano, la presencia de comorbilidades y terapias concomitantes limita a menudo las opciones terapéuticas del LES. El tratamiento de elección para las manifestaciones articulares y la serositis son los antiinflamatorios no esteroideos o dosis bajas de corticosteroides durante un corto período de tiempo. Además de la necesidad de adoptar un enfoque multidisciplinar, obtener información sobre la capacidad funcional, el estado cognitivo y la situación social son elementos importantes que ayudarán en la toma de decisiones asistenciales en estos pacientes.
Late-onset systemic lupus erythematosus (SLE) usually appears in patients older than 65 years and has clinical features different from the classical form observed in younger patients. In the elderly, SLE represents 10-20% of all SLE cases, shows a different and less aggressive clinical evolution and the first manifestations are non-specific. A significantly higher incidence of late-onset SLE in males, and the fact that postmenopausal women have a more benign disease, suggests that the estrogenic status may influence the activity of the disease. Owing to the insidious onset and the non-specific clinical manifestations on presentation, there is commonly a delayed diagnosis of late-onset SLE. Furthermore, the presence of comorbidities and concomitant therapies in elderly patients may limit the therapeutic options for SLE. The treatment of choice of joint symptoms and serositis includes non-steroidal anti-inflammatory drugs and low-dose steroids for short periods. In addition to the need for adopting a multidisciplinary approach, it is fundamental to obtain information about the functional, cognitive and social status of these patients in order to make appropriate healthcare decisions.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune que afecta habitualmente a personas jóvenes con predominio del sexo femenino. En los diversos estudios publicados hasta la actualidad, se aprecia que la edad puede tener un efecto en la expresión clínica de la enfermedad y sugieren, en general, que el LES de inicio tardío es menos grave en lo que respecta a su presentación y curso clínico. Asimismo, el clásico predominio en mujeres disminuye progresivamente con la edad, de tal manera, que en el lupus de inicio precoz la relación mujeres/varones es 9:1,, mientras que esta proporción disminuye a 7:1 en el LES tardío. Por otra parte, el retraso que se produce entre la aparición de los primeros síntomas y el diagnostico de la enfermedad es mayor en los pacientes ancianos. Otras diferencias se refieren a circunstancias étnicas y raciales. Así, en el LES de inicio tardío suele haber un predominio de pacientes caucásicos, en contraste con el lupus en pacientes más jóvenes que afecta mayoritariamente a individuos afroamericanos. En general, el lupus de inicio tardío hace referencia a la enfermedad que empieza después de los 50 años, si bien no existe un acuerdo en este sentido y estudios más recientes proponen que el límite sea de 65 o más años. Si tenemos en cuenta la mayor edad media de la población general que se da en la actualidad, la segunda definición (>65 años) reflejaría de forma más exacta la realidad, por lo que a partir de ahora nos referiremos indistintamente a esta entidad como lupus de inicio tardío o del anciano1,2.
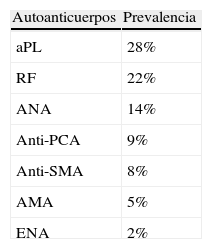
Inmunidad y envejecimientoDesde un punto de vista clínico, las consecuencias del deterioro de la función inmunológica durante el envejecimiento incluyen una mayor susceptibilidad al padecimiento de enfermedades infecciosas y neoplasias, así como un aumento de la incidencia de las enfermedades autoinmunes. Cabe resaltar, que las consecuencias de estas enfermedades autoinmunes pueden ser de mayor relevancia y afectar de forma notoria la calidad de vida de las personas mayores.El envejecimiento se asocia típicamente a un incremento en la presencia sérica de autoanticuerpos, hecho que contrasta con la disminución de la respuesta inmune que se produce con la edad. Los pacientes ancianos muestran habitualmente una mayor prevalencia de autoanticuerpos no órgano específicos que órgano específicos, entre los que cabe destacar: los anticuerpos antifosfolípido, el factor reumatoide y los anticuerpos antinucleares (tabla 1). Por otra parte, es razonable asumir que estas anomalías «fisiológicas» que forman parte del proceso de envejecimiento, se asocian a una mayor incidencia de enfermedades autoinmunes, neoplásicas e infecciosa en este período de la vida. Es importante resaltar, que tanto la forma de presentación como el curso clínico de las enfermedades autoinmunes en los pacientes ancianos, suele ser más atípica que en los individuos jóvenes o de mediana edad, especialmente en el caso del LES, la artritis reumatoide y el síndrome de Sjögren3–5.
Prevalencia de autoanticuerpos en ancianos según diversos estudios
| Autoanticuerpos | Prevalencia |
| aPL | 28% |
| RF | 22% |
| ANA | 14% |
| Anti-PCA | 9% |
| Anti-SMA | 8% |
| AMA | 5% |
| ENA | 2% |
AMA: anticuerpos antimitocondriales; ANA: anticuerpos antinucleares; anti-PCA: anticuerpos anticélula parietal; anti-SMA: anticuerpos antimúsculo liso; aPL: anticuerpos antifosfolípido; ENA: anticuerpos antiantígeno nuclear extraíble; RF: factor reumatoide.
En el transcurso de la vida de una persona, el sistema inmunológico sufre constantes cambios morfológicos y funcionales, de tal forma que, como ya se ha comentado, la habilidad del sistema inmune para defender el organismo de patógenos exógenos decrece y la respuesta a antígenos aumenta. Durante el envejecimiento, el número de linfocitos T CD45RA nativos disminuye, mientras que el número de linfocitos T CD45RO de memoria aumenta. Por otra parte, la proporción entre los linfocitos T CD4+ y CD8+ que expresan el receptor CD28 se modifica, y la habilidad de los linfocitos de la sangre periférica de proliferar ante la estimulación por mitógenos decrece6. La concentración sérica de citocinas y reactantes de fase aguda aumenta de dos a 4 veces en este período (tabla 2). Aunque los mediadores de la inflamación representan de forma general las interconexiones que se producen entre los factores ambientales, las infecciones y los cambios fisiológicos del envejecimiento, éstos constituyen también factores de riesgo para el desarrollo de las distintas enfermedades qua aparecen durante este período. Asimismo, los diferentes cambios en la homeostasis inmunológica que sobrevienen a lo largo de la vida pueden contribuir a que la presentación y evolución de la enfermedad sean atípicas1,3.
Anomalías de la autoinmunidad en la vejez
| 1. Anomalías de la inmunidad celular |
| - Disminución de células T supresoras |
| - Disminución de células T helper |
| - Disminución de la expresión de factores de crecimiento linfocitarios |
| - Disminución de la expresión de receptores linfocitarios específicos |
| 2. Anomalías de la inmunidad mediada por anticuerpos |
| - Incremento de la respuesta policlonal contra diversos mitógenos |
| - Disminución de la respuesta antígeno específica |
| - Anomalías intrínsecas en la madurez de las células B |
| - Frecuencia incrementada de la síntesis de autoanticuerpos |
| 3. Otras anomalías del sistema inmune |
| - Efecto de factores extrínsecos (dieta, fármacos, ejercicio) |
| - Incremento de la expresión CD95 con la edad |
| - Disminución de citocinas Th1/Incremento de citocinas Th2 |
| - Desórdenes de la apoptosis de los polimorfonucleares |
| - Incremento de las concentraciones séricas de IgG, IgM e IgA |
| - Atrofia tímica progresiva |
La menopausia y la disminución de la síntesis de estrógenos podrían explicar la menor incidencia de LES de inicio tardío, así como la disminución en la proporción de mujeres que padecen la enfermedad durante el envejecimiento7.
En un estudio de una serie de 47 pacientes con LES de inicio tardío (en el que se analizaron también otras series publicadas con anterioridad), Boddaert et al.8 observaron que la menopausia se había producido en el 86% de los pacientes antes o en el momento del diagnóstico de LES. Por otra parte, entre los 10 pacientes de este estudio en los que la menopausia sobrevino antes del inicio de la enfermedad, ninguno de ellos tenía afectación renal, mientras que solamente un paciente recibió corticosteroides a dosis altas por la presencia de fibrosis pulmonar y otro paciente había recibido una combinación de esteroides y ciclofosfamida por la existencia de mielitis. Cabe mencionar en este sentido, que se han descrito disminuciones significativas de brotes de LES postmenopáusico tanto en pacientes con LES de inicio en la etapa premenopáusica como en aquellos casos en que el inicio de la enfermedad se produjo en la fase postmenopáusica. Estos resultados están en concordancia con la menor gravedad de las manifestaciones clínicas del LES del anciano, especialmente en mujeres postmenopáusicas.
La incidencia significativamente mayor de varones con LES de inicio tardío y el curso más benigno de la enfermedad en mujeres postmenopáusicas sugiere, en definitiva, que el estatus estrogénico puede influir de forma significativa en la actividad de la enfermedad7.
Finalmente, cabe también destacar que el LES de inicio tardío se presenta con relativa frecuencia como una forma de LES inducido por fármacos. Por esta razón, es muy importante realizar una anamnesis dirigida a la búsqueda de posibles fármacos inductores en este grupo de pacientes, sin olvidar los colirios que contienen beta-bloqueantes1.
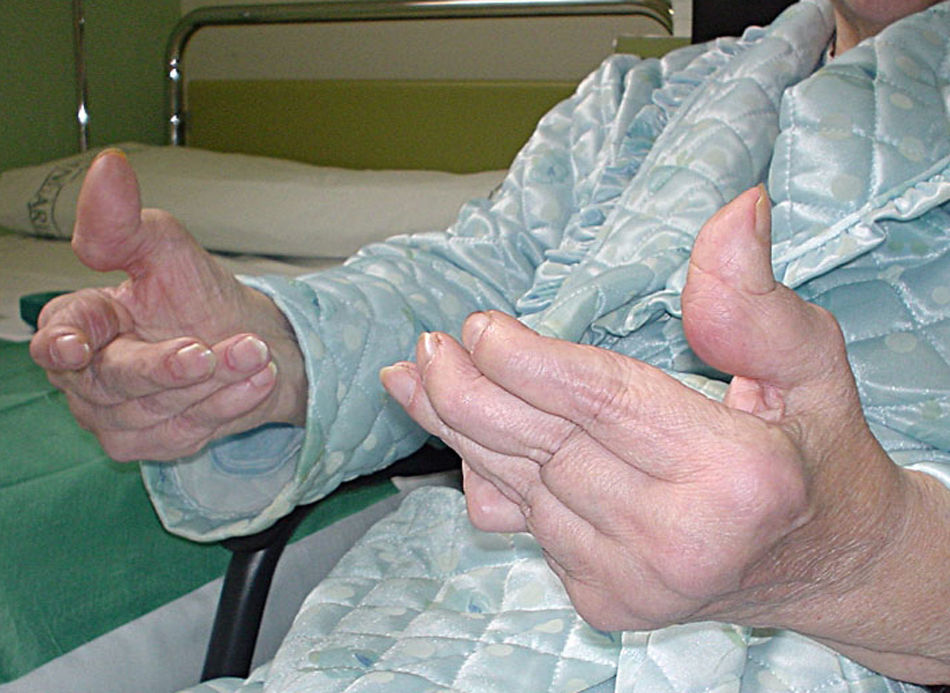
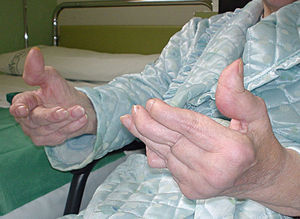
Características clínicasVarios estudios han puesto de manifiesto que el LES de inicio tardío es responsable del 10-20% de casos entre la población general de lupus. Es aceptado que el LES de inicio tardío tiene un curso clínico diferente, con un inicio insidioso y unas primeras manifestaciones clínicas inespecíficas. Estas manifestaciones incluyen artralgias, artritis, en algunos casos infrecuentes artropatía degenerativa deformante de Jaccoud (fig. 1), astenia, mialgias, pérdida de peso, fiebre o disminución de la función cognitiva (tabla 3)9,10. Una forma rara característica de la afectación pulmonar en el LES de inicio tardío consiste en la aparición de disnea progresiva y elevación del diafragma con pérdida importante de volumen (shrinking lungs). En general, se ha descrito que el curso clínico del LES de inicio tardío es más indolente que el del LES clásico.
Prevalencia de diversas manifestaciones clínicas en el lupus eritematoso sistémico de inicio tardío
| Mayor prevalencia |
| Serositis |
| Afectación pulmonar |
| Afectación neurológica |
| Raynaud |
| Síndrome de Sjögren |
| Miositis |
| Citopenias |
| Anticuerpos anti-Ro/La |
| Menor prevalencia |
| Eritema malar |
| Fotosensibilidad |
| Alopecia |
| Artritis |
| Nefropatía |
| Trombosis |
| Miocardiopatía |
| Livedo reticularis |
| Linfadenopatía |
| Hipocomplementemia |
| Anticuerpos anti-RNP |
RNP: ribonucleoproteina.
En 1991, Font et al.11 publicaron una de las primeras series de LES de inicio tardío. En 40 (16%) de 250 pacientes, el lupus fue diagnosticado después de los 50 años. El intervalo entre el inicio de los síntomas y el diagnóstico fue de 5 años en este grupo, comparado con tres años en los pacientes menores de 50 años. Durante el seguimiento, los pacientes con un inicio tardío de la enfermedad presentaron una menor prevalencia de artritis, eritema malar, fotosensibilidad y nefropatía, y una mayor prevalencia de miositis. Asimismo, los pacientes de más de 50 años mostraron una menor frecuencia de anticuerpos anti-dsDNA y anticuerpos anti-Ro.
En un estudio de Cervera et al.12 en que los autores siguieron prospectivamente a una cohorte de 1.000 pacientes con LES, la enfermedad había comenzado después de los 50 años en 90 pacientes (9%). En las fases iniciales de la enfermedad, estos pacientes habían presentado una menor prevalencia de artritis, lesiones cutáneas exantemáticas y nefropatía. Durante el curso de la enfermedad, la prevalencia de artritis, exantema lúpico, fotosensibilidad y nefropatía disminuyó a la vez que aumentó la incidencia del síndrome de Sjögren asociado.
Por otra parte, Maddison et al.13 realizaron un estudio en 86 pacientes con LES de inicio después de los 54 años, que fueron comparados con 155 pacientes cuyo inicio de la enfermedad se había producido antes de los 45 años. En este trabajo, la incidencia de daño orgánico valorado mediante el índice SDI (Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index) fue mayor en los pacientes con lupus tardío que en aquellos más jóvenes, lo que cuestiona la presunción de que la forma tardía de LES es más benigna que la forma clásica.
En el estudio de Boddaert et al.8 previamente mencionado, los autores compararon las manifestaciones clínicas y autoanticuerpos de un grupo de 714 pacientes con LES de inicio tardío con las de 4.700 pacientes en los que la enfermedad empezó a una menor edad. Los resultados demostraron que en el grupo de inicio tardío presentaban, de forma significativa, una mayor prevalencia de serositis, afectación pulmonar y positividad para factor reumatoide, así como una menor ocurrencia de eritema malar, fotosensibilidad, vasculitis cutánea, alopecia, fenómeno de Raynaud, manifestaciones neuropsiquiátricas, linfadenopatía, síndrome nefrótico y glomerulonefritis.
En un metaanálisis realizado por Ward et al.14, se apreció una mayor prevalencia de enfermedad pulmonar intersticial, serositis, síndrome de Sjögren asociado y positividad para anticuerpos anti-La en pacientes con LES de inicio tardío. En estos pacientes, se observó también una menor frecuencia de trastornos neuropsiquiátricos, fenómeno de Raynaud, alopecia, fiebre, adenopatías periféricas e hipocomplementemia. Por el contrario, no se observaron diferencias en la ocurrencia de nefritis, fotosensibilidad, mialgias, leucopenia y positividad para factor reumatoide y anticuerpos anti-dsDNA séricos.
Formiga et al.15 estudiaron un grupo de 12 pacientes en los que el lupus se había iniciado después de los 50 años (10 mujeres y dos varones) y los compararon con pacientes más jóvenes. La actividad de la enfermedad en el momento del diagnóstico y en el primer año del curso de la enfermedad, medida mediante el Systemic Lupus Erythematosus Disease Activity Index (SLEDAI), fue significativamente mayor en los pacientes en los que el LES se había iniciado antes de los 50 años.
Por el contrario, los resultados de un estudio reciente publicado por Bertoli et al.16 han mostrado ciertas discrepancias. En este estudio, se incluyeron pacientes en los que el LES se había iniciado a partir de los 50 años (n=73). En relación con los pacientes que habían desarrollado LES antes de los 49 años, los pacientes «caso» tuvieron una mayor frecuencia de afectación neurológica, eventos trombóticos arteriales e hipertrigliceridemia y una menor frecuencia de afectación renal. Asimismo, entre los pacientes «caso» (edad>50 años), la actividad basal de la enfermedad fue inferior y, por otra parte, estos pacientes presentaban una mayor frecuencia de daño ocular y cardiovascular. En realidad, ningún trabajo previo había demostrado que existiera una mayor incidencia de manifestaciones neurológicas en pacientes con LES de inicio tardío. De hecho, la aparición de manifestaciones neurológicas y psiquiátricas como, por ejemplo, convulsiones y psicosis se han descrito con menor frecuencia en pacientes con LES de inicio tardío. Una posible explicación de los resultados de Bertoli et al.16 es que las manifestaciones clínicas fueron incluidas con independencia de su causa y, por otra parte, se incluyeron también a pacientes que presentaban deterioro cognitivo.
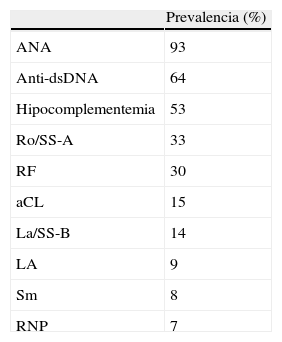
Autoanticuerpos circulantesAdemás de las manifestaciones clínicas, la edad puede modificar también las manifestaciones serológicas del LES. El LES de inicio tardío difiere con frecuencia en la frecuencia y tipo de autoanticuerpos séricos (tabla 4). Así, en estos pacientes se ha observado una mayor prevalencia de factor reumatoide y de anticuerpos anti-Ro y anticuerpos anti-La, mientras que se suele observar una presencia menor de anticuerpos anti-RNP e hipocomplementemia17. Por otra parte, los anticuerpos anti-dsDNA se detectan con menor frecuencia en el lupus de inicio tardío si bien se han observado resultados dispares en este sentido1,3. En un estudio realizado por Padovan et al.18 se observó una mayor frecuencia de anticuerpos anti-dsDNA en pacientes con LES de inicio tardío, si bien este hallazgo no se correlacionó con una mayor frecuencia de afectación orgánica. Los mismos autores reconocieron que este resultado contradictorio podía deberse a un sesgo en la selección de los pacientes. En el estudio de Formiga et al.15 mencionado con anterioridad, se observó una menor prevalencia de anticuerpos anti-dsDNA e hipocomplementemia, lo que sugería una menor actividad de la enfermedad en los pacientes de mayor edad, como de hecho, habían demostrado estos autores mediante la medición de la actividad de la enfermedad con el índice SLEDAI.
Prevalencia de autoanticuerpos y anomalías séricas autoinmunes en el lupus eritematoso sistémico de inicio tardío
| Prevalencia (%) | |
| ANA | 93 |
| Anti-dsDNA | 64 |
| Hipocomplementemia | 53 |
| Ro/SS-A | 33 |
| RF | 30 |
| aCL | 15 |
| La/SS-B | 14 |
| LA | 9 |
| Sm | 8 |
| RNP | 7 |
aCL: anticuerpos anticardiolipina; ANA: anticuerpos antinucleares; anti-dsDNA: anticuerpos anti-ADN nativo; LA: anticoagulante lúpico; RF: factor reumatoide; RNP: anticuerpos antirribonucleoproteina.
El diagnóstico de LES en cualquier grupo de edad se basa lógicamente en la presencia de manifestaciones clínicas y de laboratorio que cumplan los criterios de definición. Debido al inicio insidioso y a la poca especificidad de las manifestaciones al inicio de la enfermedad (así como la menor prevalencia general del LES en lo ancianos), se produce a menudo un diagnóstico tardío de la enfermedad. De hecho, el intervalo de tiempo entre las primeras manifestaciones y el establecimiento del diagnóstico del LES es mayor en los pacientes de mayor edad (19-50 meses) que en los pacientes más jóvenes (5-24 meses)1. En estos pacientes de edad más avanzada, los diagnósticos erróneos que se realizan con mayor frecuencia incluyen polimialgia reumática, artritis reumatoide, artrosis, infecciones y neoplasias19. Otros diagnósticos erróneos menos frecuentes incluyen el fenómeno de Raynaud primario, lupus discoide, hepatitis crónica activa, alveolitis fibrosante, endocarditis infecciosa, tuberculosis, púrpura trombocitopénica idiopática, insuficiencia renal crónica y fotodermatitis. Como ya hemos comentado, debido al hecho de que el LES en el anciano afecta a pacientes que tienen una mayor incidencia de comorbilidades y que reciben, como consecuencia, múltiples fármacos, el diagnóstico diferencial debe incluir también al LES inducido por fármacos. El lupus de inicio tardío inducido por fármacos se manifiesta como una enfermedad con afectación muscular, articular y pulmonar, positividad para anticuerpos antinucleares y negatividad para anticuerpos anti-dsDNA, así como ausencia de hipocomplementemia. Los fármacos implicados con mayor frecuencia en el LES del anciano son la procainamida, isoniazida, metildopa, carbamazepina, acebutolol, hidralazina, clorpromazina y D-penicilamina1,3.
Factores pronósticosA pesar de la frecuente discrepancia que existe en lo que respecta a la prevalencia de complicaciones orgánicas en el LES de inicio tardío, cabe remarcar que la causa de muerte en estos pacientes no es habitualmente el LES en sí mismo, sino la coexistencia de otros procesos frecuentes en la vejez como son las enfermedades cardiovasculares, neoplasias e infecciones20.
En el estudio mencionado previamente de Boddaert et al.8, la probabilidad de supervivencia a los 5 años desde el diagnóstico en el grupo de pacientes con LES de inicio tardío fue del 84%, mientras que ésta fue del 71 y 59% a los 10 y 15 años. Claramente inferiores a las probabilidades de supervivencia en el grupo con LES de inicio más precoz, que fueron del 95, 95 y 92%, respectivamente, para los mismos períodos de seguimiento. De manera general, puede afirmarse que la disminución de la supervivencia observada en el grupo de inicio tardío puede reflejar simplemente las consecuencias del envejecimiento.
Un aspecto muy importante en relación con el pronóstico de los pacientes con LES, hace referencia a la repercusión que la enfermedad produce en la capacidad funcional de los pacientes. En este sentido, una reciente publicación Katz et al.21, analiza la situación funcional en una cohorte de 829 pacientes con LES, a través de un cuestionario específico que evalúa 21 actividades de la vida diaria. Casi la mitad de los pacientes tienen dificultad en realizar una o más de una de estas actividades y el principal factor pronóstico de empeoramiento funcional es la actividad de la enfermedad.
Opciones terapéuticasEn el anciano, la presencia de comorbilidades y terapias concomitantes limita a menudo las opciones terapéuticas del LES. El tratamiento de elección para las manifestaciones articulares y la serositis consiste en administrar antiinflamatorios no esteroideos (AINE) o dosis bajas de corticosteroides durante un período corto de tiempo. El tratamiento con AINE debe empezarse, preferentemente, a dosis bajas. Ante la aparición de manifestaciones cutáneas y artritis, los antimaláricos (clorocina e hidroxiclorocina) representan los fármacos de elección, debido a su eficacia y menor incidencia de efectos secundarios. Sin embargo, en un estudio reciente que analizó la utilización a largo plazo de antimaláricos en 57 pacientes ancianos con LES, si bien el empleo de los mismos se asoció de forma significativa a una remisión clínica de la enfermedad, en 21 casos estos fármacos tuvieron que retirarse después de un período medio de 5,2 años como consecuencia de los efectos secundarios (principalmente maculopatía)22.
En el LES del anciano, la presencia de neumonitis lúpica y alteraciones hematológicas puede indicar la administración de dosis elevadas de corticosteroides, y, probablemente, de inmunosupresores23. El desarrollo de nefritis lúpica conlleva la administración de esteroides y ciclofosfamida de forma similar al LES clásico. En caso de que la ciclofosfamida esté contraindicada, se debe administrar la azatioprina. Las complicaciones neuropsiquiátricas deben tratarse de forma sintomática y, en el caso que representen manifestaciones orgánicas por el propio LES, se deben añadir inmunosupresores a la terapia de base. Por otra parte, en los casos que con presencia de anticuerpos antifosfolípido e hipertensión arterial, el riesgo de accidente vascular cerebral está incrementado, por lo que se recomienda un tratamiento adecuado de la hipertensión y la administración de antiagregantes plaquetarios o incluso anticoagulantes orales1.
Un elemento importante a tener en cuenta en el tratamiento del LES del anciano es la necesidad de adoptar, siempre que sea posible, un enfoque multidisciplinar. En este sentido, puede ser particularmente útil la colaboración entre reumatólogos, internistas, geriatras y otros especialistas como hematólogos, neumólogos, nefrólogos, y neurólogos. Obtener información sobre la capacidad funcional de estos pacientes para realizar actividades básicas e instrumentales de la vida diaria, sobre su estado cognitivo y la situación social (existencia o no de un cuidador cualificado), son elementos claves que nos ayudarán en la toma de las decisiones asistenciales más adecuadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.