Aproximadamente un tercio de los pacientes que han sufrido un ictus desarrollan espasticidad. Ante la impresión clínica por parte de los autores de menor proporción de pacientes espásticos entre la población de mayor edad tras un ictus y la falta de consenso en la literatura, se procedió a contrastar aquellas variables que influyen en el desarrollo de espasticidad a partir de los datos de dos centros de neurorrehabilitación.
El objetivo del estudio es determinar los factores que influyen en el desarrollo de la espasticidad a los tres meses de evolución del ictus y la prevalencia de espasticidad en los pacientes que han sufrido un ictus y que requieren tratamiento rehabilitador intensivo.
Material y métodoEstudio retrospectivo observacional de 554 pacientes atendidos en dos centros de neurorrehabilitación. Se recogieron datos sociodemográficos; naturaleza, etiología y localización del ictus; déficit motóricos, sensitivos, del lenguaje y deglución; incontinencia; estado cognitivo y anímico. El grado de espasticidad se evaluó al ingreso y al tercer mes en 462 pacientes mediante la escala de Ashworth. Se empleó el análisis de regresión multivariante para determinar qué variables influyen en la evolución de la espasticidad al tercer mes de la instauración del ictus.
ResultadosEdad media: 67,3 años; 67,1%, de estos eran hombres; 76,5% tuvo un origen isquémico. Al ingreso el 31,4% de los pacientes presentaban espasticidad y a los tres meses el 54,8%. Los pacientes con un mayor índice motor al ingreso, mejoraban en mayor proporción su espasticidad a los tres meses (OR 1,04; IC 95% 1,03-1,05). En el caso de no tener en cuenta el índice motor, las variables relacionadas con la evolución de la espasticidad fueron: edad < 75 años (OR 0,52; IC 95% 0,30-0,90), alteración sensitiva (OR 0,66; IC 95% 0,37-1,20) e índice de Barthel (OR 1,02; IC 95% 1,01-1,03). No se encontró la existencia de relación significativa para las variables sexo, mecanismo fisiopatológico (isquémico/hemorrágico), localización del ictus, presencia de afasia o deterioro cognitivo.
ConclusionesLa prevalencia de espasticidad en pacientes que han sufrido un ictus es del 54,8% al tercer mes de evolución. El índice motor al ingreso es predictor independiente de espasticidad a los tres meses de evolución. Los pacientes menores de 75 años, con alteración sensitiva y bajo índice de Barthel tienen más probabilidad de empeorar la espasticidad a los tres meses.
Approximately one third of patients who have suffered a stroke develop spasticity. Since clinical observations that spasticity in the elderly population is lower after stroke, and disagreement about risk factors between different authors, an analysis is performed on the variables that influence the development of spasticity.
The objective of the study is to determine the how many factors influence spasticity outcome, and the prevalence of spasticity in patients who have suffered a stroke and require intensive rehabilitation treatment.
MethodA retrospective assessment was carried out on a total of 554 patients from two neurorehabilitation centres. A record was made of sociodemographic data, aetiology, type and location of stroke, motor and sensory deficits, language and swallowing impairment, incontinence, cognitive and mood state. Spasticity levels at admission and at the third month were studied in 462 patients using the Ashworth scale. Multivariate regression analyses were used to assess the risk factors for spasticity present at the third month after stroke.
ResultsThe mean age of the patients was 67.3 years, of which 67.1% were men, and with ischemic aetiology in 76.5%. On admission 31.4% of patients had spasticity, and this increased to 54.8% at the 3rd month. The absolute risk factor for spasticity was motor index (OR 1.04; 95% CI 1.03-1.05). When this factor was omitted, the variables with predictive ability were: age less than 75 years (OR 0.52; 95% CI 0.30-0.90), sensory impairment (OR 0.66; 95% CI 0.37-1.20), and lower Barthel index score (OR 1.02; 95% CI 1.01-1.03). There was no significant relationship for gender, physiopathological mechanism (ischaemic/haemorrhagic), stroke location, aphasia, or cognitive impairment.
ConclusionThe prevalence of spasticity in stroke at third month of follow-up was 54.8%. Motor index is the independent predictor of spasticity. Patients younger than 75 years old, with sensory impairment and low Barthel index score are more likely to develop spasticity.
La espasticidad es un trastorno motor presente en el síndrome de la motoneurona superior como consecuencia de la lesión de las vías corticófugas y constituye una manifestación frecuente en las afecciones del sistema nervioso central. Clásicamente lo definitorio de la espasticidad es la resistencia muscular al estiramiento dependiente de la velocidad, como manifestación de la hiperexcitabilidad del reflejo tónico de estiramiento1. Sin embargo y contrariamente a esta definición clásica, se ha visto que el reflejo tónico de estiramiento tiene escasa correlación con el reflejo de estiramiento fásico y que la hiperexcitabilidad muscular refleja puede deberse tambien a cambios reológicos en el músculo evidenciado mediante electromiografía2,3.
La espasticidad afecta al 17-43% de los pacientes que han sufrido un ictus según diversos estudios3-8; hay cierta controversia en cuanto al número de pacientes que desarrollarán espasticidad y discapacidad secundaria a esta. En los últimos años diversos autores han desarrollado estudios prospectivos y retrospectivos para identificar los factores que influyen en la evolución de la espasticidad tras ictus, lo que facilitaría la racionalización de los recursos sanitarios ajustando los recursos terapéuticos a las necesidades de los pacientes.
En la literatura se han considerado factores que influyen en el desarrollo de espasticidad: la gravedad de la paresia, bajo índice de Barthel al inicio, presencia de dolor, déficits sensitivos, lesiones extensas en neuroimagen, localización del ictus, etiología hemorrágica del ictus y edad ≤ 65 años. Aunque la mayoría de los autores coinciden como factor de espasticidad el grado de paresia incial y la mayor afectación de la extremidad superior frente la inferior9, hay mayor controversia con otros factores como la edad, el sexo o los déficits sensitivos derivados del ictus5,10,11.
Un reciente estudio epidemiológico observacional en nuestro país constata que, de una muestra de pacientes con patología del sistema nervioso central, presentan espasticidad el 62,9% de los casos tras ictus12.
Ante la percepción clínica por parte de los autores del presente trabajo de menor proporción de pacientes espásticos entre la población de mayor edad tras un ictus y la falta de consenso en la literatura, planteamos el presente estudio cuyo objetivo es determinar cuáles son los factores que influyen en la evolución de espasticidad tras ictus en nuestro medio y así poder efectuar un abordaje precoz de la misma que evite las complicaciones a largo plazo, con el consiguiente consumo de recursos y merma de la calidad de vida de los pacientes. Como objetivo secundario del presente estudio se pretende contribuir al conocimiento de la prevalencia de espasticidad en la población española a partir de los datos de dos centros públicos de neurorrehabilitación. El trabajo ha sido aprobado por el Comité de Ética con el dictamen que se ajusta a la normativa ética sobre investigación biomédica con sujetos humanos.
Material y métodoEstudio retrospectivo longitudinal observacional de dos centros hospitalarios de media-larga estancia con pacientes ingresados tras sufrir primer ictus para tratamiento rehabilitador multidisciplinar en fase subaguda, entre septiembre del 2000 a abril de 2011 y entre diciembre de 2011 a septiembre de 2017 respectivamente. El tratamiento multidisciplinar incluye fisioterapia, terapia ocupacional (cognitiva y funcional) y logopedia. Los pacientes fueron derivados desde los servicios de neurología tras tratamiento oportuno, estabilización clínica y una vez completado el protocolo de estudio correspondiente. Las bases de datos, idénticas en ambos centros, estaban confeccionadas previamente por los autores para la recogida protocolizada, sistemática y exhaustiva de los parámetros relacionados con el proceso rehabilitador de pacientes que han sufrido un ictus.
El protocolo de recogida de datos incluye:
Datos administrativos (edad, sexo, estado civil, situación laboral, características de la vivienda).
Datos clínicos relacionados con el ictus: naturaleza (isquémico o hemorrágico), etiología, localización del área cerebral afecta, focalidad neurológica; déficits derivados del ictus: déficit motor, déficits perceptivos y sensitivos, alteraciones del lenguaje, de la deglución (evaluada mediante test MEC-V13); incontinencia; presencia o no de dolor de hombro; estado cognitivo (valorado mediante test de cribado -Minimental14, Pfeiffer15, MoCA16 o valoración neurocognitiva ad hoc-). Los puntos de corte para los respectivos test de escrining son 24/30, 3/10, 21/30. La existencia de depresión se estableció mediante valoración clínica.
Valoración escalar al ingreso de funciones motóricas de tronco y extremidades, grado de espasticidad, capacidad de marcha y funcional para las actividades básicas de la vida diaria. Para ello se emplearon respectivamente las escalas: control de tronco (CT)17, índice motor (IM)17, capacidad de marcha (mediante Functional Ambulation Categories, FAC)18, grado de discapacidad en actividades básicas de la vida diaria (mediante Índice de Barthel) y valoración del grado de espasticidad (medida con escala de Ashworth19).
El índice motor valora la actividad voluntaria de segmentos musculares claves para la función motora de la extremidad superior e inferior desde 0 (ausencia de movimiento) a 100 (movilidad completa) y la escala de control de tronco mide la habilidad del paciente hemipléjico para voltear en supino, transferir a la sedestación y el equilibrio en esta posición desde 0 (completa imposibilidad) a 100 (total autonomía y equilibrio sentado sin apoyo). La escala FAC es una escala ordinal que puntúa la habilidad para deambular desde 0 (completa imposibilidad) a 5 (total autonomía, con independencia del empleo o no de ayudas para la marcha). Todas ellas presentan propiedades psicométricas ampliamente contastadas en validez y fiabilidad y son de uso habitual en las procesos de rehabilitación20,21.
La escala de Ashworth19 es una escala clínica diseñada en 1964 para valorar espasticidad por el autor que le da nombre. Gradúa el tono muscular al movimiento pasivo de la extremidad desde 0 (no espasticidad = normalidad) hasta 4 (extremidad rígida en flexión o extensión). En 1987, Bohanson y Smith modificaron la escala disgregando el primer nivel en dos, según el ángulo en el que se detectaba el aumento de tono. Es una escala muy sencilla de utilizar, está ampliamente difundida y posee una alta fiabilidad interobservador, así como una buena reproductibilidad. Se considera la existencia de espasticidad cuando la puntuación de la escala de Ashworth es ≥ 1.
Todos los pacientes siguieron terapia de rehabilitación multidisciplinar según los déficits presentados la cual incluye, en ambos centros, fisioterapia, terapia ocupacional y logoterapia. Uno de los centros también cuenta con abordaje neuropsicológico por una profesional especializada (neuropsicóloga), el cual se aplicó según las necesidades individuales. Ninguno de los pacientes estudiados presentaba alteraciones cognitivas previas al ictus ya que éstas eran criterio de exclusión para el ingreso en las unidades de neurorrehabilitación.
Tratamiento estadístico: estudio descriptivo de la muestra mediante los estadísticos media y desviación típica (DT) para las variables cuantitativas, y frecuencia absoluta y relativa para las variables cualitativas al ingreso. El estudio estadístico de la medición de la espasticidad a partir de la escala de Ashworth, tanto basal como a los tres meses, (12-14 semanas desde la instauración del ictus) se recogió en 462 de los 554 pacientes.
Aunque en el protocolo de recogida de datos las variables clínicas y escalares susceptibles de cambio estaban recogidas al ingreso y al tercer mes (control de tronco, índice motor, valoración sensitiva, alteraciones de la deglución y lenguaje, alteraciones cognitivas, capacidad de marcha, índice de Barthel), para el tratamiento estadísticos se incluyeron las valoraciones al ingreso estudiándose estadísticamente qué influencia tienen en la evolución de la espasticidad reevaluada al tercer mes.
Para ello, se efectuó test de los rangos con signo de Wilcoxon para comprobar la evolución a los tres meses de evolución respecto del momento del ingreso del tono muscular. Test U Mann-Whitney para comprobar si la evolución a los tres meses respecto el momento del ingreso en el tono muscular es diferente en cada grupo de edad considerando el punto de corte en 75 años (< 75, ≥ 75 años). Test de la χ2 para ver si el porcentaje de pacientes que variaba el tono muscular a los tres meses respecto el momento del ingreso es diferente en cada grupo de edad (< 75, ≥ 75 años). Análisis de regresión logística para analizar el impacto de los posibles factores en el cambio del tono muscular a los tres meses de evolución respecto el momento del ingreso. Las variables analizadas son: edad, sexo, tipo de ictus, índice motor al ingreso global y desglosado para la extremidad superior e inferior, sensibilidad algésica y artrocinética al ingreso (normal/alterada), hemianopsia al ingreso (sí/no), afasia la ingreso (sí/no), presencia de déficits cognitivos (sí/no), índice de Barthel al ingreso. El procedimiento para identificar los factores pronóstico independientes fue un proceso de selección hacia atrás (backward selection procedure). Se calcularon los odds ratio (OR) y su intervalo de confianza al 95% (IC95%) de las variables seleccionadas.
Para el tratamiento estadístico se ha empleado programa SAS® 9.4. Se ha considerado el grado de significación para p = 0,05.
ResultadosAnálisis descriptivoLa muestra está compuesta por 554 pacientes de 67,3 años de edad media (DT = 11,9), siendo el 67,1% hombres.
Respecto los datos clínicos relacionados con el ictus, el 76,5% fue de naturaleza isquémica y el 23,5% hemorrágico. Respecto al perfil etiológico, en los ictus isquémicos, el 45,3% se debió a causa trombótica y el 15,4% fueron embólicos. El 11.4% fue de origen indeterminado, el 4,9% fueron ictus lacunares y el 1,1% se consideraron hemodinámicos. Cuando la etiología fue hemorrágica, del total de la muestra, el 18,4% tuvo origen hipertensivo, el 2% fue por rotura de malformación arteriovenosa y el 0,5% de causa yatrógena (tratamiento anticoagulante). En un caso el origen de la hemorragia fue por disección carotídea.
En cuanto a la localización del ictus, en el caso de los de etiología isquémica, el 41,3% correspondieron al grupo TACI (total anterior carotídeo), el 4,8% al grupo PACI (parcial anterior carotídeo), el 17,1% al grupo LACI (lacunar) y el 21,6% al grupo POCI (territorio posterior vertebrobasilar). En el caso de las hemorragias, del total de ictus, el 11,4% correspondió a hemorragias intraparenquimatosas, el 1,3% a hemorragias subaracnoideas y el 0-6% a hemorragias intraventriculares.
En el 50,6% de los casos el lado afecto fue el izquierdo, en el 44,6%, el lado derecho y en el 4,7% la paresia fue bilateral.
En el conjunto de la muestra el tiempo medio de demora desde la instauración del ictus al ingreso en la Unidad de Rehabilitación fue de 26,3 de media (± 22,2) días con mediana de 20,97 días (rangos intercuartílicos: 13,5, 31,0) y la duración media de ingreso en esta unidad fue de 60,1 (± 37,9) días.
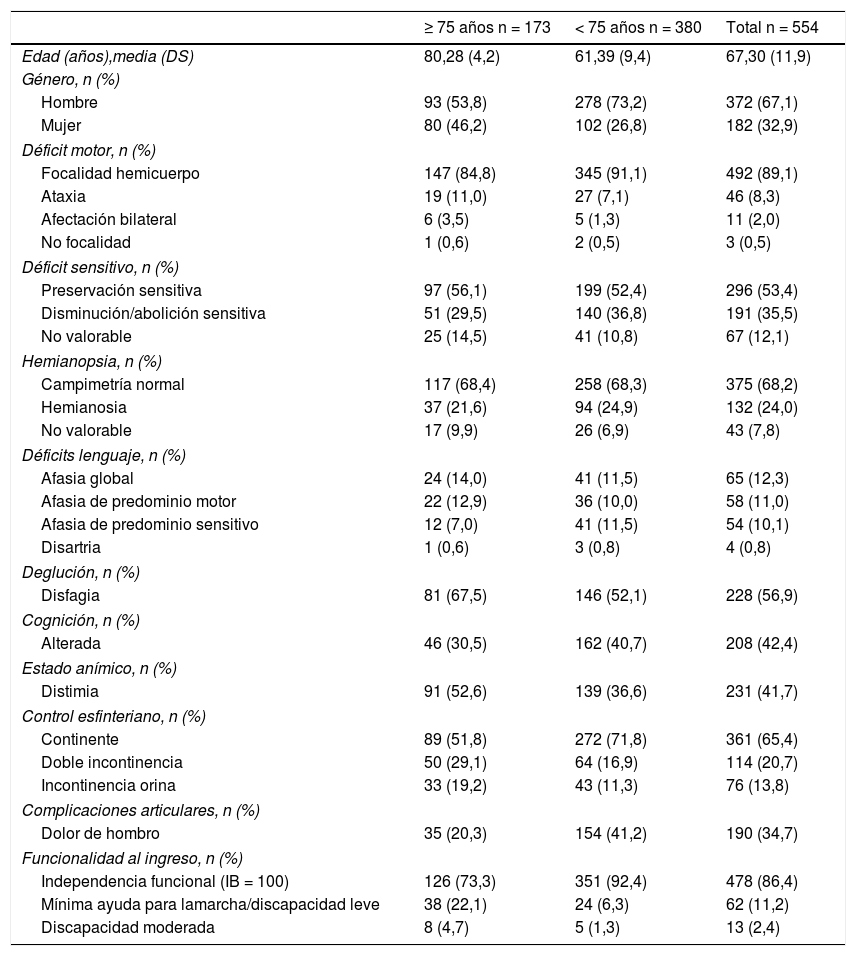
En la tabla 1 se especifican los datos clínicos basales de la muestra estratificado en mayor y menor de 75 años. A nivel motor, el 97,5% de los pacientes presentaron afectación en un hemicuerpo (plejia/paresia). En el 8,3% el déficit predominante fue la ataxia y en el 2,0% de los casos estaban afectados ambos hemicuerpos.
Datos clínicos basales de la muestra
| ≥ 75 años n = 173 | < 75 años n = 380 | Total n = 554 | |
|---|---|---|---|
| Edad (años),media (DS) | 80,28 (4,2) | 61,39 (9,4) | 67,30 (11,9) |
| Género, n (%) | |||
| Hombre | 93 (53,8) | 278 (73,2) | 372 (67,1) |
| Mujer | 80 (46,2) | 102 (26,8) | 182 (32,9) |
| Déficit motor, n (%) | |||
| Focalidad hemicuerpo | 147 (84,8) | 345 (91,1) | 492 (89,1) |
| Ataxia | 19 (11,0) | 27 (7,1) | 46 (8,3) |
| Afectación bilateral | 6 (3,5) | 5 (1,3) | 11 (2,0) |
| No focalidad | 1 (0,6) | 2 (0,5) | 3 (0,5) |
| Déficit sensitivo, n (%) | |||
| Preservación sensitiva | 97 (56,1) | 199 (52,4) | 296 (53,4) |
| Disminución/abolición sensitiva | 51 (29,5) | 140 (36,8) | 191 (35,5) |
| No valorable | 25 (14,5) | 41 (10,8) | 67 (12,1) |
| Hemianopsia, n (%) | |||
| Campimetría normal | 117 (68,4) | 258 (68,3) | 375 (68,2) |
| Hemianosia | 37 (21,6) | 94 (24,9) | 132 (24,0) |
| No valorable | 17 (9,9) | 26 (6,9) | 43 (7,8) |
| Déficits lenguaje, n (%) | |||
| Afasia global | 24 (14,0) | 41 (11,5) | 65 (12,3) |
| Afasia de predominio motor | 22 (12,9) | 36 (10,0) | 58 (11,0) |
| Afasia de predominio sensitivo | 12 (7,0) | 41 (11,5) | 54 (10,1) |
| Disartria | 1 (0,6) | 3 (0,8) | 4 (0,8) |
| Deglución, n (%) | |||
| Disfagia | 81 (67,5) | 146 (52,1) | 228 (56,9) |
| Cognición, n (%) | |||
| Alterada | 46 (30,5) | 162 (40,7) | 208 (42,4) |
| Estado anímico, n (%) | |||
| Distimia | 91 (52,6) | 139 (36,6) | 231 (41,7) |
| Control esfinteriano, n (%) | |||
| Continente | 89 (51,8) | 272 (71,8) | 361 (65,4) |
| Doble incontinencia | 50 (29,1) | 64 (16,9) | 114 (20,7) |
| Incontinencia orina | 33 (19,2) | 43 (11,3) | 76 (13,8) |
| Complicaciones articulares, n (%) | |||
| Dolor de hombro | 35 (20,3) | 154 (41,2) | 190 (34,7) |
| Funcionalidad al ingreso, n (%) | |||
| Independencia funcional (IB = 100) | 126 (73,3) | 351 (92,4) | 478 (86,4) |
| Mínima ayuda para lamarcha/discapacidad leve | 38 (22,1) | 24 (6,3) | 62 (11,2) |
| Discapacidad moderada | 8 (4,7) | 5 (1,3) | 13 (2,4) |
Descriptivos de la muestra al ingreso (datos basales). Se especifica el número total de pacientes y la media (± SD) o el porcentaje (%) respecto al total (554 pacientes) para cada variable (resaltado en cursiva). En material y método queda descrito el criterio diagnóstico para cada variable.
El 53,4% de los pacientes no mostraron alteración de la sensibilidad propioceptiva, frente el 19,9% con abolición completa. En el 12,1% de los casos no fue valorable generalmente por dificultades comunicativas en contexto de afasia. El 24% de la muestra presentó hemianopsia tras la instauración del ictus.
En cuanto a los trastornos del lenguaje, el 33,4% presentó algún tipo de afasia y el 0,5% de los casos se catalogó como alteración articulatoria del habla sin afectación lingüística. Se constató disfagia en 56,9% de la muestra. En cuanto al control esfinteriano el 65,4% no presentaron incontinencia, frente al 20,7% con incontinencia urinaria y fecal. El 34,7% de la muestra presentó dolor de hombro durante el ingreso.
La valoración cognitiva mostró deterioro en el 42% de los casos. La valoración neuropsicológica se efectuó por profesional experta en neuropsicología en 349 pacientes, correspondiente a uno de los centros estudiados; de ellos, se detectó algún déficit cognitivo en el 46,4%. En el segundo centro, al no contar con profesional especializado se efectuó screening cognitivo mediante test Pfeiffer en pacientes mayores de 65 años, test Minimental o test de MOCA en menores de 65 años. En este grupo se detectaron déficits cognitivos en el 42,4% de la muestra. Se valoró la existencia de trastornos distímicos en 231 pacientes y de estos se trató farmacológicamente con inhibidores de la recaptación de serotonina a 91 (39,4%).
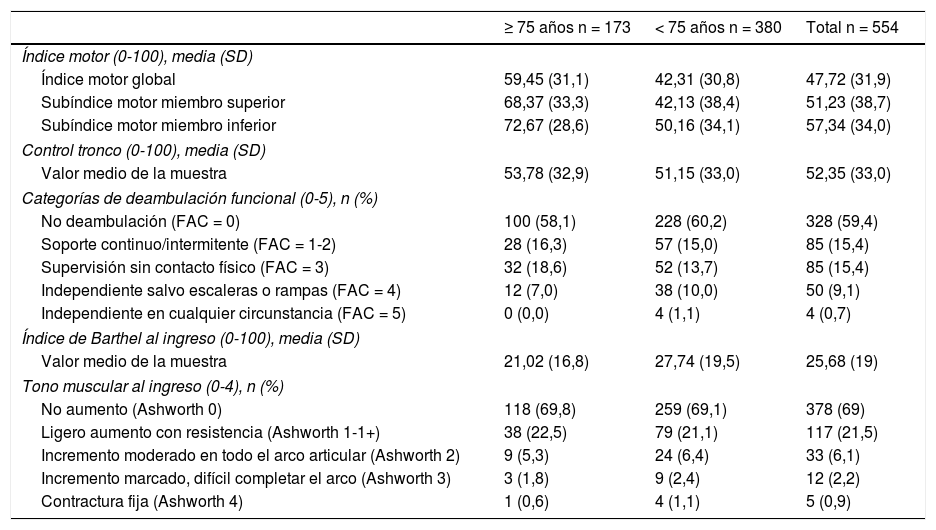
En relación con las valoraciones escalares (tabla 2), al ingreso la media del índice motor del hemicuerpo afecto fue de 47,72 (± 31,9) y la puntuación media en la escala de control de tronco de 52,4 (± 33). Respecto la habilidad para la marcha medida mediante la escala Functional Ambulation Categories, el 74,8% de los pacientes no deambulaban o requerían soporte continuo o intermitente (FAC 0-2), frente al 35,2 con habilidad para la deambulación en diferentes grados (FAC 3-5). El grado medio de discapacidad valorado mediante el índice de Barthel fue de 25,7 puntos (± 19,9).
Valoración de la situación funcional, tono muscular, índice motor y control de tronco al ingreso (basal) en función de la edad
| ≥ 75 años n = 173 | < 75 años n = 380 | Total n = 554 | |
|---|---|---|---|
| Índice motor (0-100), media (SD) | |||
| Índice motor global | 59,45 (31,1) | 42,31 (30,8) | 47,72 (31,9) |
| Subíndice motor miembro superior | 68,37 (33,3) | 42,13 (38,4) | 51,23 (38,7) |
| Subíndice motor miembro inferior | 72,67 (28,6) | 50,16 (34,1) | 57,34 (34,0) |
| Control tronco (0-100), media (SD) | |||
| Valor medio de la muestra | 53,78 (32,9) | 51,15 (33,0) | 52,35 (33,0) |
| Categorías de deambulación funcional (0-5), n (%) | |||
| No deambulación (FAC = 0) | 100 (58,1) | 228 (60,2) | 328 (59,4) |
| Soporte continuo/intermitente (FAC = 1-2) | 28 (16,3) | 57 (15,0) | 85 (15,4) |
| Supervisión sin contacto físico (FAC = 3) | 32 (18,6) | 52 (13,7) | 85 (15,4) |
| Independiente salvo escaleras o rampas (FAC = 4) | 12 (7,0) | 38 (10,0) | 50 (9,1) |
| Independiente en cualquier circunstancia (FAC = 5) | 0 (0,0) | 4 (1,1) | 4 (0,7) |
| Índice de Barthel al ingreso (0-100), media (SD) | |||
| Valor medio de la muestra | 21,02 (16,8) | 27,74 (19,5) | 25,68 (19) |
| Tono muscular al ingreso (0-4), n (%) | |||
| No aumento (Ashworth 0) | 118 (69,8) | 259 (69,1) | 378 (69) |
| Ligero aumento con resistencia (Ashworth 1-1+) | 38 (22,5) | 79 (21,1) | 117 (21,5) |
| Incremento moderado en todo el arco articular (Ashworth 2) | 9 (5,3) | 24 (6,4) | 33 (6,1) |
| Incremento marcado, difícil completar el arco (Ashworth 3) | 3 (1,8) | 9 (2,4) | 12 (2,2) |
| Contractura fija (Ashworth 4) | 1 (0,6) | 4 (1,1) | 5 (0,9) |
Descriptivos de las puntuaciones de las escalas correspondientes a la capacidad motora, capacidad funcional y tono muscular al ingreso del total de la muestra estudiada (554 pacientes) estratificada por edad (punto corte: 75 años). Para cada variable, se especifica el número total de pacientes y la media o el porcentaje respecto al total (especificado en las filas resaltadas en cursiva).
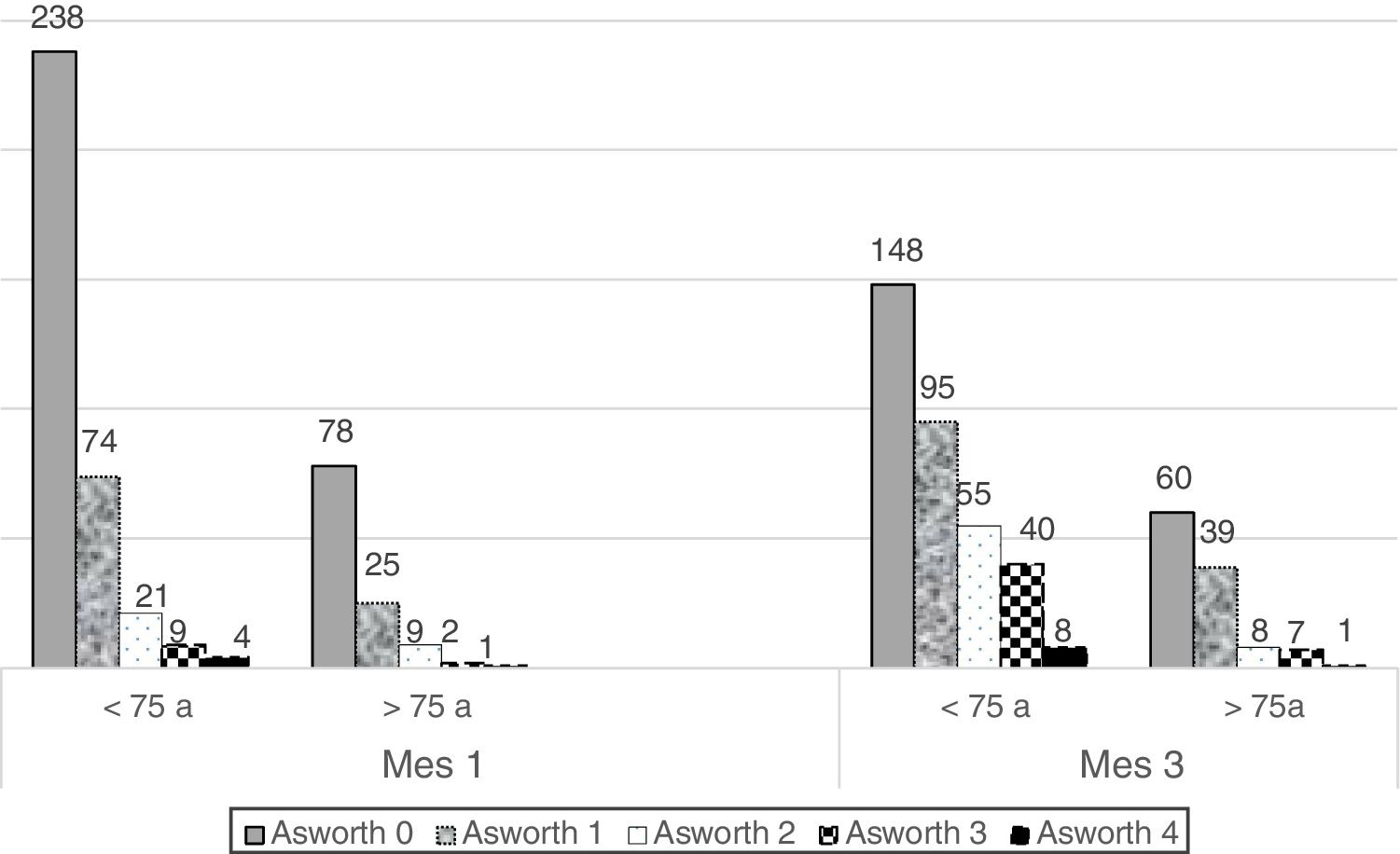
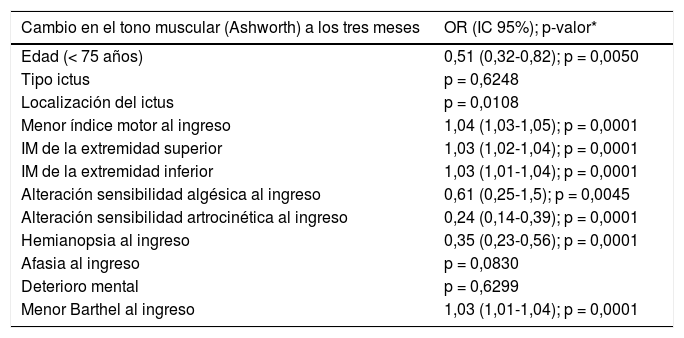
El estudio estadístico de la medición de la espasticidad a partir de la escala de Ashworth, tanto basal como a los tres meses, se recogió en 462 de los 554 pacientes. Al ingreso el 31,4% de los pacientes presentaban espasticidad; a los tres meses de evolución, el porcentaje aumentó hasta el 54,8%. Entre los pacientes que presentaban espasticidad a los tres meses, más de la mitad (53,0%) puntuaron 1 en la escala de Ashworth; el 24,9% puntuaron 2; el 18,6% de los pacientes presentaron espasticidad en grado 3 y el 3,6% puntuaron 4. La figura 1 representa las variaciones de la espasticidad según la escala de Ashworth para cada grupo de pacientes, tomando como punto de corte los 75 años. Además, respecto la evolución del tono muscular a los tres meses tras el ingreso, se observó que a mayor demora del ingreso en la Unidad respecto la instauración del ictus, mayor probabilidad de presentar espasticidad (p < 0,001).
Distribución de pacientes en relación a su puntuación en la escala Ashworth en función de la edad, basal y a las 12-14 semanas del ictus.Cada columna corresponde a una puntuación en la escala Ashworth. Sobre ella se especifica el número de pacientes para cada grado de espasticidad. Las dos columnas de la izquierda muestran la distribución del tono muscular al ingreso diferenciado por grupos de edad, y las dos de la derecha, el grado de espasticidad al tercer mes diferenciado por grupos de edad (punto de corte: 75 años).
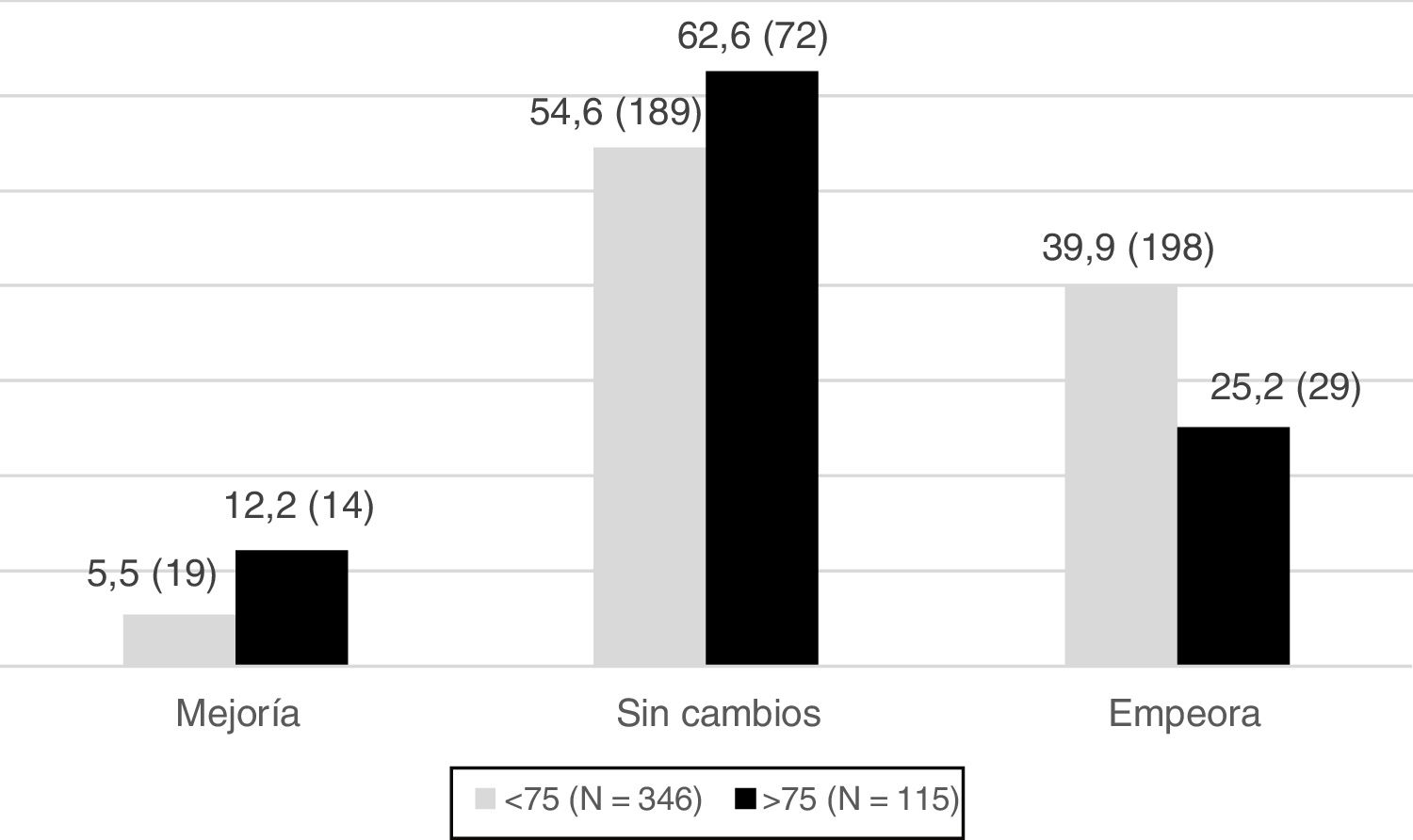
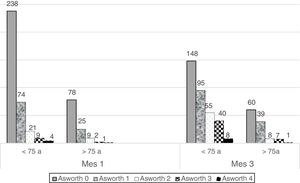
La figura 2 es la expresión gráfica del análisis de regresión logística de la evolución del tono muscular (aumento, disminución, ausencia de cambios) en función de la edad, tomando como punto de corte 75 años. Los pacientes menores de 75 años tienen estadísticamente mayor grado de espasticidad a los tres meses respecto a los mayores de 75 años (test U Mann-Whitney; p = 0,0006). En el grupo más joven, el 57,3% presentó espasticidad a los tres meses, con empeoramiento de la misma en el 39,9% de los casos (198 pacientes). Los mayores de 75 años presentaron aumento de tono a los tres meses en el 47,9% (55 pacientes) lo que supone un empeoramiento del tono muscular en menor proporción: el 25,2% de los casos. Si se toma como punto de corte de edad los 65 años, no se encuentran diferencias significativas en la disminución del tono muscular entre los pacientes < 65 y los pacientes ≥ 65.
Variación del tono muscular desde el ingreso al tercer mes según edad (mayor o menor de 75 años). Sobre las columnas se representa el porcentaje y el número de pacientes (entre paréntesis) respecto al global para cada grupo de edad. El tono muscular se evalúa mediante la escala de Ashworth (0-4). Un grupo muscular se considera espástico cuando la puntuación Ashworth es ≥ 1. La mejoría significa disminución de la puntuación Ashworth y, empeoramiento, lo contrario.
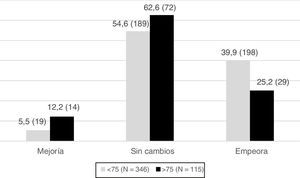
Previo a la regresión logística, se realizó un análisis univariante que mostró significación estadística en el desarrollo de espasticidad a los tres meses de evolución del ictus para las variables: déficit motor medido mediante el índice motor, global y desglosado en extremidad inferior y superior; existencia de déficits sensitivos; edad; afectación campimétrica (hemianopsia) e índice de Barthel. No existe relación significativa para las variables sexo, mecanismo fisiopatológico (isquémico/hemorrágico), localización del ictus, presencia de afasia o deterioro cognitivo (tabla 3). De esta manera, el desarrollo de espasticidad a se debe a la mayor afectación de las vías corticoespinal y espinotalámica tras el ictus. En cambio, las variables relacionadas con déficits cognitivos, deglutorios y del lenguaje no mostraron relación con el aumento del tono muscular. La variable edad mostró relación con el desarrollo de espasticidad según el punto de corte considerado. A partir de los 75 años, la posibilidad de desarrollar espasticidad fue menor.
Variables asociadas con el desarrollo de espasticidad a las 12-14 semanas del ictus. Análisis univariante
| Cambio en el tono muscular (Ashworth) a los tres meses | OR (IC 95%); p-valor* |
|---|---|
| Edad (< 75 años) | 0,51 (0,32-0,82); p = 0,0050 |
| Tipo ictus | p = 0,6248 |
| Localización del ictus | p = 0,0108 |
| Menor índice motor al ingreso | 1,04 (1,03-1,05); p = 0,0001 |
| IM de la extremidad superior | 1,03 (1,02-1,04); p = 0,0001 |
| IM de la extremidad inferior | 1,03 (1,01-1,04); p = 0,0001 |
| Alteración sensibilidad algésica al ingreso | 0,61 (0,25-1,5); p = 0,0045 |
| Alteración sensibilidad artrocinética al ingreso | 0,24 (0,14-0,39); p = 0,0001 |
| Hemianopsia al ingreso | 0,35 (0,23-0,56); p = 0,0001 |
| Afasia al ingreso | p = 0,0830 |
| Deterioro mental | p = 0,6299 |
| Menor Barthel al ingreso | 1,03 (1,01-1,04); p = 0,0001 |
El cambio del tono muscular se evalúa mediante la escala de Ashworth (0-4). El tono muscular está aumentado si la puntuación de Ashworth es ≥ 1. A mayor puntuación, mayor grado de espasticidad, es decir, empeoramiento del tono muscular.
El análisis multivariante (regresión logística) de las variables que en el análisis univariante habían mostrado significación estadística muestra que los pacientes con un mayor índice motor global al ingreso mejoraban en mayor proporción su espasticidad a los tres meses del ictus (OR 1,04; IC 95% 1,03-1,05). En el caso de no disponer de la medición del índice motor global, las variables relacionadas con un empeoramiento en el grado de espasticidad fueron: edad < 75 años, alteración sensitiva y menor puntuación en el índice de Barthel (tabla 4).
Factores pronóstico que facilitan el desarrollo de espasticidad. Análisis por regresión logística
| Cambio en el tono muscular (Ashworth) a los tres meses | OR (IC 95%); p-valor* |
|---|---|
| Índice motor al ingreso | 1,04 (1,03-1,05); p = 0,001 |
| Edad (años) | |
| < 75 vs. ≥ 75 | 0,52 (0,30-0,90); p = 0,018 |
| Sensibilidad artrocinética al ingreso | |
| Abolida vs. preservada | 0,29 (0,17-0,49); p = 0,001 |
| Disminuida vs. preservada | 0,66 (0,37-1,20); p = 0,462 |
| Barthel (puntos) | 1,02 (1,01-1,03); p = 0,009 |
El cambio del tono muscular se evalúa mediante la escala de Ashworth (0-4). El tono muscular está aumentado si la puntuación de Ashworth es ≥ 1. A mayor puntuación, mayor grado de espasticidad, es decir, empeoramiento del tono muscular.
De los 554 pacientes, se ha valorado la evolución del tono muscular al ingreso en la Unidad y a los tres meses en 462 pacientes, habiendo excluído aquellos casos en los que no estuviera registrada la espasticidad en los dos momentos estudiados. Consideramos que a pesar de ello, el tamaño muestral es lo suficientemente amplio para no restar potencia estadística al análisis.
De los 462 pacientes analizados, al ingreso presentaron espasticidad (Ashworth ≥ 1) el 31,4%, aumentando hasta el 54,8%, a los tres meses. En general, se considera que un tercio de los pacientes que han sufrido un ictus desarrollaran espasticidad en los tres primeros meses de evolución. Nuestra muestra presenta, de inicio, mayor porcentaje de espasticidad que otros autores ya que Sommerfeld et al.3 registra espasticidad inicial en el 21% de los pacientes y Wissel et al. en el 24,5% de los casos en la primera semana tras la instauración del ictus8, empleando la escala Ashworth como es nuestro caso. En nuestra muestra el tiempo de evolución desde la instauración del ictus hasta el ingreso y valoración basal de la espasticidad es de 26,3 días de media; de esta manera puede presuponerse que el tono muscular ha comenzado a aumentar frente a los citados autores que efectuaron la valoración en un estadio más precoz.
A partir de los tres meses nuestra muestra presenta espasticidad en porcentaje superior a los registrados en la literatura, que puede variar entre el 19%3 y el 43%10. Cabe destacar que la muestra presentada por nuestro equipo es mucho más amplia que las de los estudios previos, asemejándonos a Urban et al.10 quienes encuentran que el 43% de los pacientes presentan espasticidad a los tres meses del ictus. Nuestro trabajo también presenta semejanzas con este último autor en la media de edad de nuestra muestra, una década más joven que las de otros autores que estudian pacientes con edades medias igual o superiores a los 75 años3,5,6, así como en el tamaño muestral, ya que evalúa a 211 pacientes frente a otros autores que no llegan al centenar de pacientes.
El seguimiento evolutivo de la espasticidad en los pacientes que han sufrido un ictus es variable en las series publicadas, ya que la mayoría valoran esta condición a partir de los 12-18 meses sin haber registrado los valores de la misma en las fases iniciales5-7,22. En ellos el porcentaje de espasticidad a los 12-18 meses de evolución varía entre el 17-18% de Lundström y Welmer en Suecia y el 78,6% de Kong en Singapur, si bien en este último caso solo se valora la espasticidad en el miembro superior. Garreta-Figuera et al.12, en nuestro país, describen espasticidad en el 62,9% tras ictus, si bien este estudio epidemiológico incluye todas las patologías donde se pueda desarrollar espasticidad además del ictus, abarcando diferentes momentos evolutivos, desde un mes hasta más de un año.
Entendemos que los márgenes de demora de ingreso en Neurorrehabilitación son amplios debido al amplio periodo de tiempo estudiado, hay que tener en cuenta que el inicio de recogida de datos fue anterior a la implementación de las Unidades de Ictus; tras la puesta en marcha de las mismas, los pacientes llegaban a las Unidades de Neurorrehabilitación derivados igualmente de los Servicios de Neurología tras completar el tratamiento fibrinolítico en su caso y el estudio protocolizado correspondiente. Esta variabilidad en los días de demora no consideramos que sea relevante en la interpretación de los resultados ya que el margen de tiempo de ingreso (mediana de 20,97 días) entra dentro de los estándares aceptados en la literatura como tiempo propicio de inicio del tratamiento rehabilitador23.
Para el análisis estadístico se han empleado test no paramétricos estándar (Wilcoxon, U Mann-Whitney) ya que permiten el mejor ajuste para una variable cualitativa ordinal, como la escala de Ashworth, siendo test equivalente a t-Student de muestras pareadas y t-Student de muestras independientes, respectivamente. En relación a los factores apuntados por diferentes autores, todos coinciden en el grado de paresia como factor determinante de la espasticidad a largo plazo3,5,8,10,24, resultado concordante con nuestros datos en los que el grado de paresia valorado mediante el índice motor es la variable que explica de manera independiente y absoluta la aparición de espasticidad a los tres meses de evolución del ictus. El índice motor puntúa la función motora de manera que, cuanto más se aproxime a 100, más cercana está la fuerza de las extremidades a la normalidad y por tanto más «normal» será el tono muscular, esto es menos espástico (podríamos decir que índice motor y espasticidad son inversamente proporcionales; hay menos alteración de la primera motoneurona). Nuestro análisis interpreta que por cada punto del índice motor al ingreso, aumenta un 4% la posibilidad de mejorar el tono muscular a los tres meses (OR 1,04; IC95% 1,03-1,05).
El análisis univariante detecta las variables que al ingreso condicionarán la aparición de espasticidad (tabla 3) y el multivariante (backward selection [tabla 4]) analiza las variables que del primer análisis tuvieron significación estadística para comprobar si son predictoras independientes de espasticidad.
De esta manera, el índice motor al ingreso es la única variable que se ha asociado con espasticidad de manera independiente al resto de variables. La alteración sensitiva y baja puntuación en el índice de Barthel no son variables independientes pero, tras excluir el índice motor en el análisis multivariante, la edad menor de 75 años, la alteración sensitiva y baja puntuación en el índice de Barthel sí influyen en el aumento del tono muscular a los tres meses de evolución del ictus.
Así, suponiendo el mismo índice de Barthel y la misma sensibilidad propioceptiva al ingreso en los pacientes con edad menor de 75 años se reduce un 52% la posibilidad de mejorar el tono muscular tras tres meses respecto a los pacientes con edad mayor a 75 años. Para Welmer25 y Opheim et al.24 la edad es un factor que influye en la evolución de la espasticidad a los tres meses, de manera que los pacientes más jóvenes tienen más probabilidad de desarrollar espasticidad que los pacientes de mayor edad. Sin embargo, otros autores no encuentran esta relación si se estudia la muestra a más largo plazo (12-18 meses)5,10. En nuestro trabajo, la variable edad tiene relación según el punto de corte considerado, de manera que a partir de los 75 años, los pacientes tienen menos probabilidad de empeorar la espasticidad a los tres meses; si el punto de corte se fija en 65 años, no se encuentran diferencias significativas en la disminución del tono muscular entre los pacientes menores de 65 años y los pacientes con ≥ 65 años. La razón de estas diferencias podrían deberse a que la fuerza muscular desarrollada como respuesta al reflejo de estiramiento es más débil en personas de mayor edad, de manera que el reflejo tónico de estiramiento asociado a la espasticidad también es menor en pacientes mayores24. En un primer momento se consideró la edad de 65 años por relacionarla con el fin de la edad laboral en términos sociológicos, sin embargo, con base en la mayor expectativa vital de la población española y al progresivo aumento del rango de edad en la aplicación de técnicas médico-quirúrgicas para el tratamiento agudo del ictus, se consideró una mejor elección como punto de corte la edad de 75 años. De esta manera resulta relevante el factor edad considerando el punto de corte en 75 años como demuestra el análisis de regresión logística tras excluir el índice motor. Esta circunstancia explicaría la semejanza entre nuestros resultados y los de Urban y la concordancia de otros autores entre sí con muestras de edad media, igual o superiores a 75 años.
La influencia de la alteración sensitiva en el desarrollo de la espasticidad es un aspecto controvertido ya que algunos autores encuentran relación (Wissel, Urban, Opheim)8,10,24 mientras que otros no (Lundström)5. Para Urban, los pacientes con hemihipoestesia presentan espasticidad con mayor frecuencia en las extremidades superior e inferior; para Opheim la alteración sensoriomotora es el factor más importante de espasticidad a largo plazo tras un ictus. En nuestra muestra, la alteración sensitiva explica el desarrollo de espasticidad en el caso de no tener la medición de la función motora; de esta manera, suponiendo el mismo índice de Barthel y la misma categoría de edad, en los pacientes con la sensibilidad abolida se reduce un 50,4% la posibilidad de mejorar el tono muscular tras tres meses respecto a los pacientes con una sensibilidad preservada.
El análisis de la variable índice de Barthel no suele estar considerada de manera independiente por la mayoría de los autores ya que la funcionalidad es consecuencia del grado de afectación y por tanto resulta lógico que, a mayor índice motor y menor espasticidad, mayor independencia funcional reflejada en el índice de Barthel. En nuestra muestra el análisis de regresión logística concluye que suponiendo la misma sensibilidad artrocinética al ingreso y la misma categoría de edad, por cada punto de la escala Barthel aumenta un 2,0% la posibilidad de mejorar el tono muscular tras tres meses de evolución.
En relación al sexo, la lateralidad del hemicuerpo afecto o la etiología, nuestros resultados son coincidentes con la mayoría de los autores en que estas variables no influyen en el desarrollo de espasticidad5,8,10,24.
Tradicionalmente la escala de Ashworth ha sido considerada como el gold standard para valorar la espasticidad y aunque tienen sus limitaciones como escala ordinal, no requiere de ningún equipamiento sofisticado y tiene una óptima fiabilidad interobservador. Más allá de los tres meses, la resistencia al movimiento pasivo es la suma del reflejo tónico de estiramiento aumentado y los cambios tisulares que acontecen en el músculo cuestionando la validez de este método de valoración, aspecto a tener en cuenta en la práctica clínica2. En nuestro caso el empleo de la escala de Ashworth se ajusta a los estándares aceptados para la valoración de la espasticidad por el periodo en el que han sido evaluados los pacientes.
Consideramos, como sesgo del presente trabajo, que la muestra no es representativa de la totalidad de los ictus en cifras brutas, pero sí de los ictus moderados-graves, que son los que requieren tratamiento rehabilitador con alto consumo de recursos sanitarios.
Como conclusión podemos afirmar que en la muestra estudiada la espasticidad aumenta a partir del primer mes, alcanzando una prevalencia del 54,8% a los tres meses de evolución del ictus. El índice motor al ingreso es la variable que explica de manera independiente el desarrollo de espasticidad tras sufrir un ictus. Excluyendo este factor en caso de no tener la medición, los pacientes menores de 75 años con alteración sensitiva y bajo índice de Barthel, tienen más probabilidad de empeorar la espasticidad tras ictus.
Conflicto de interesesLos autores manifiestan la ausencia de conflicto de intereses en el desarrollo del presente trabajo, así como la aprobación por parte del Comité de Ética del Departament de Salut la Fe por cumplir la normativa ética en investigación humana.