REVISION
Estudio de las lesiones precancerosas de la mucosa bucal en el paciente geriátrico
López Jornet, P.; Saura Ingles, A. y Cozar Fernández, A.
Medicina bucal. Universidad de Murcia.
Correspondencia: Dra. Pía López Jornet. Hospital Morales Meseguer. Clínica Odontológica Universitaria 2ª planta. Unidad de Medicina Bucal. Avda. Marques de los Velez, s/n. 30008 Murcia.
Recibido el 24-2-98; aceptado el 10-3-99.
RESUMEN
La prevalencia del cáncer oral es significativamente más alta en el grupo de población adulta. La edad cronológica (estilo de vida, tabaco, etc.) puede tener una fuerte influencia en el cáncer bucal. Desdichadamente a pesar del fácil acceso a la exploración clínica de la cavidad oral, muchos cánceres orales son diagnosticados en estadios avanzados ensombreciendo el pronóstico. La finalidad de este trabajo de revisión es analizar la importancia del conocimiento de las lesiones y estados precancerosos, su diagnóstico, así como ofrecer unas pautas de actuación sobre tratamiento.
Palabras clave
Edad. Precancer oral. Leucoplasia. Eritroplasia.
Precancerous lesions of oral mucosa in geriatric patient
SUMMARY
The prevalence of oral cancer is significantly higher in elderly people. The chronological age (life style, tobacco, etc.) can have a strong influence on oral cancer. Unfortunately despite easy access to the oral cavity during clinical exploration, many oral cancer have diagnosed in advanced states. The aim of this study is to analyze the importance of knowledge of the oral precancerous lesions and their diagnosis so to be able to offer aid their treatment.
Key words
Age. Oral precancerous lesions. Leukoplakia. Eritroplakia.
INTRODUCCION
El rápido aumento de la población anciana afectará considerablemente la práctica clínica en las próximas décadas. Los expertos predicen un aumento sustancial y continuado del grupo de edad de 85 años o más. Los índices de crecimiento justifican cada vez más el que los facultativos dispongan de mecanismos fiables que les permitan tomar las decisiones clínicas oportunas en este tipo de pacientes (1-3).
Numerosos estudios sobre la fisiología en el envejecimiento confirman que la principal característica de la senescencia es el deterioro de los numerosos procesos reguladores que mantienen la integración funcional entre los diferentes órganos y sistemas de la economía, siendo por lo tanto más vulnerables.
Existen aspectos distintivos de la patología en el anciano: la presentación atípica de la enfermedad, pérdida de la independencia funcional, elevada prevalencia de pluripatología y la polifarmacia que obligan a un planteamiento diagnóstico y terapéutico de la enfermedad diferente y distinto al del joven. Es muy frecuente que existan actitudes negativas hacia las personas mayores. En los profesionales, probablemente sea un reflejo de la sensación de impotencia que sienten cuando se les pide que respondan a las complejas necesidades de los pacientes ancianos, a lo que se añade, la inquietud del enfrentamiento a la realidad del envejecimiento. Es necesario rebatir y superar todas las concepciones erróneas y prejuicios que existen en relación con el envejecimiento (3).
Los cambios que presenta la mucosa oral en relación con el envejecimiento son difíciles de valorar debido a su amplitud. Con la edad la mucosa oral experimenta modificaciones similares a los que afectan a la mucosa de otras partes del organismo, pero factores locales adquiridos a lo largo de la vida (dieta, hábitos como el tabaco y alcohol, prótesis, etc.), pueden influir en dichos cambios, provocando alteraciones en la mucosa. Clásicamente, se ha considerado que con la edad, la mucosa oral sufre un grado variable de atrofia, se vuelve un poco más delgada, lisa y seca, adquiere un aspecto satinado, y menos elástica, siendo más susceptible a los factores irritativos. Se produce un aplanamiento o adelgazamiento de las células epiteliales, una disminución de la queratinización y alteraciones en la morfología de la unión conectivo-epitelial, en el sentido de presentar una arquitectura menos papilar, atrofia del tejido conectivo con pérdida de elasticidad (4, 5).
Los problemas orales en los pacientes ancianos, deberían centrarse en áreas, resaltando que la edad es el factor pronóstico más coherente y firme de riesgo de cáncer. El cáncer oral constituye el 2,2 por ciento de todos los casos nuevos de cáncer estimados en 1995 en los Estados Unidos. Los índices de cáncer oral casi se triplican entre los grupos de edad de 55 a 64 años y de 85 años o más. Típicamente éstos son asintomáticos a menos que se infecten secundariamente o que afecten estructuras neurales, por lo que hay que investigar a conciencia cualquier lesión sospechosa. Es más probable que los ancianos presenten leucoplasias, que son las lesiones orales premalignas más prevalentes (1, 6). Se piensa que casi el 0,13-17% de las leucoplasias sufren transformación maligna (7), y las lesiones blancas con un componente rojo (eritroleucoplasia) tienen un riesgo notablemente mayor de malignización (8, 9).
La enfermedad en los ancianos tiende a ser diagnosticada en fases tardías, las posibles explicaciones de esta actitud son la atribución de la sintomatología a la vejez, evitar molestias a la familia, miedo a la hospitalización o institucionalización. Las razones que justifican el estudio del precáncer de la mucosa oral se relacionan con algunas características propias del cáncer oral. La localización del cáncer oral en una zona de tan fácil exploración, el diagnóstico de un alto porcentaje de tumores se debería detectar en fases precoces de la evolución de la enfermedad. Desdichadamente la mayoría de estos tumores se diagnostican en fase avanzada y los pronósticos son sombríos. En líneas generales, la mortalidad por cáncer oral oscila entre el 50% y el 60% a los cinco años (9). La responsabilidad de estos resultados decepcionantes probablemente se relaciona tanto con características inherentes al propio tumor, como con una falta de información pública sobre la enfermedad, con la consiguiente excesiva lentitud de los pacientes en la demanda de tratamiento (10).
Este trabajo de revisión tiene fundamentalmente unos objetivos dirigidos a analizar la importancia del conocimiento de la patología precancerosa oral en todas sus vertientes y a enfatizar los aspectos diagnósticos y las pautas terapéuticas más importantes.
DEFINICIONES Y TERMINOLOGIA
La OMS define el término precáncer haciendo referencia al concepto de lesión precancerosa y condición o estado precanceroso. Ambos implican un incremento del riesgo del desarrollo de cáncer, aunque conllevan connotaciones clínicas diferenciales.
Para la OMS una lesión precancerosa es un tejido morfológicamente alterado en el que el cáncer oral puede aparecer más fácilmente que en el tejido equivalente de apariencia normal.
Una condición precancerosa es un estado generalizado del organismo asociado con un incremento significativo del riesgo de desarrollo de cáncer oral. Ambos conceptos implican que en una zona concreta de la mucosa oral es estadísticamente más probable el desarrollo de un cáncer, aunque éste no sea el final (11).
Las lesiones precancerosas de la OMS son la leucoplasia y la eritroplasia oral. Se consideran estados precancerosos: sífilis, fibrosis oral submucosa, queilitis actínica, disfagia sideropénica, cirrosis hepática, situaciones de inmunosupresión (drogas y síndrome de inmunodeficiencia adquirida), epidermolisis ampollar, xeroderma pigmentosum, disqueratosis congénita, liquen plano y lupus eritematoso (11-17) (tabla I).
Tabla I. Principales lesiones y estados precancerosos de la mucosa oral. | |
| Lesiones precancerosas | Estados precancerosos |
| * Leucoplasia | * Liquen plano oral |
| * Eritroleucoplasia | * Lupus eritematoso |
| * Sífilis | |
| * Disfagia sideropénica | |
| * Fibrosis oral submucosa | |
La leucoplasia y la eritroplasia son las dos lesiones precancerosas por excelencia de la mucosa oral, generalmente aceptadas por la mayoría de los autores. Estas lesiones también pueden ser denominadas lesiones preneoplásicas, lesiones precursoras iniciales o lesiones cancerizables. En la actualidad se incluyen otras entidades, como la queilitis actínica, lupus eritematoso y liquen plano.
LEUCOPLASIA
Una leucoplasia es un parche o placa blanca que no puede ser caracterizada clínica o histopatológicamente como ninguna otra enfermedad. Adicionalmente, el texto original acompañante a esta definición resaltó la ausencia de connotaciones histopatológicas y en consecuencia, el término sólo debe ser utilizado en sentido puramente clínico (11, 18, 19).
Siempre se debe tener en cuenta que en ocasiones, lesiones blancas que parecen leucoplasias con aspecto de benignidad, al hacer el estudio histopatológico se demuestra que corresponden a un carcinoma espinocelular. La confusión también puede ser en sentido contrario, lesiones con imágenes clínicas que nos parecen carcinomas, en realidad, son simples leucoplasias benignas sin signos de malignidad. Por ello se insiste en la necesidad de realizar biopsias ante cualquier lesión leucoplásica por anodina o benigna que parezca (20) (Figs. 1, 2).
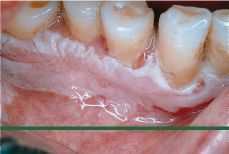
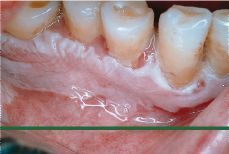
Figura 1.Leucoplasia homogénea en encía en una mujer no fumadora de 70 años de edad.
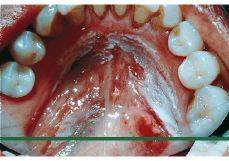
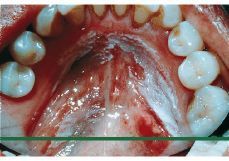
Figura 2.Leucoplasia localizada en el suelo de la boca en una mujer fumadora de 52 años de edad.
La incidencia según los autores varia entre un 0,2-8,1% del total de las lesiones orales y entre un 10-15% de las lesiones blancas orales y aunque con predominio en el sexo masculino (18).
Se han mencionado múltiples factores etiológicos en el desarrollo de la leucoplasia de mucosa oral humana, unos con clara relación como el tabaco y otros con escasa o dudosa relación. En un porcentaje de casos no pueden hallarse factores relacionados y en estos casos hablamos de leucoplasias idiopáticas (21).
El tabaco ha sido implicado como factor principal en la producción de leucoplasia, al fumarlo o al masticarlo. Actuaría por diversos mecanismos: mecánicos, físicos, químicos, por acción directa, o indirecta, modificando la microbiota local o alterando la red capilar papilar. El 50% aproximadamente, de todas la leucoplasias orales, se hallan asociadas al hábito tabáquico, y de ellas algo más del 50% desaparecen al año de abandonar el tabaco. El tipo de tabaco, la forma de utilización y la asociación con otros hábitos parecen factores determinantes. Así, existe mayor prevalencia en fumadores y bebedores (15, 22-27). El alcohol, puede comportarse como un irritante de la mucosa facilitando la acción de otros factores. Los factores mecánicos de tipo traumático crónico son capaces de originar lesiones blancas.
Existe muchas veces presencia de cándida, en especial cándida álbicans, en un importante numero de leucoplasias y se las ha relacionado con las formas clínicas de leucoplasias no homogéneas del tipo nodular o eritroleucoplasia, así como con fenómenos de displasia epitelial y una mayor tendencia a la transformación maligna. Es difícil conocer si la cándida es un factor sobreañadido o el origen principal de una determinada leucoplasia. Algunos virus, especialmente del grupo del papiloma humano (HPV), se han relacionado en la aparición de lesiones precancerosas (28).
Desconocemos si existen factores genéticos implicados. Factores de carácter local como la morfología de la mucosa en un determinado territorio y tal vez la composición de la microbiota en una determinada área, deberán tenerse en cuenta. Conocemos que las leucoplasias del suelo de la boca tienen más tendencia a la transformación maligna. Factores de carácter general como determinadas enfermedades o estados inflamatorios crónicos se han relacionado con mayor frecuencia de leucoplasias, como la sífilis o la anemia sideropénica.
Todas las leucoplasias se inician probablemente en la edad adulta de una forma anodina y en relación fundamentalmente con factores ambientales. Comienzan con máculas blanquecinas asintomáticas y si no son descubiertas en una exploración de rutina pueden pasar desapercibidas durante años. La acción continuada en el tiempo de los factores externos y las infecciones (cándida, HPV) harán que algunas leucoplasias pierdan el carácter homogéneo. Aparecerán áreas eritematosas con atrofia epitelial y fenómenos displásicos, así como nódulos, o bien crecimientos exofíticos.
La leucoplasia puede aparecer en cualquier localización de la mucosa oral, pero la más frecuente es en la mucosa yugal (50%) y dentro de ella en las áreas retrocomisurales, que son afectadas de forma bilateral y simétrica, de forma triangular y con vértice posterior. Por orden de incidencia le sigue el paladar duro debido al humo de la pipa y se conoce con el nombre de uranitis glandular o estomatitis del fumador. En la lengua la región con mayor frecuencia afectada es el dorso en su mitad anterior; unas veces se afecta toda la superficie, mientras que otras, se presentan sobre los bordes o parte media. También es frecuente localizarla en el labio, donde la lesión invade la totalidad o parte. El resto de las localizaciones orales presenta una incidencia similar y muy por debajo de las anteriores (20).
Según el aspecto clínico, las leucoplasias han sido clasificadas de muy diversas maneras. Una clasificación (11) propone que se dividan en homogéneas y no homogéneas.
Las homogéneas son lesiones predominantemente blancas en una mucosa normal. La superficie es uniforme y suave y la apariencia delgada. A veces superficialmente se encuentra cuarteada, con surcos superficiales, arrugada u ondulada. Suelen corresponder a formas histológicas sin displasia, y no se hallan por lo general infectadas por cándida.
Las no homogéneas de superficie irregular. Se dividen en tres formas:
Eritroleucoplasia: leucoplasia erosiva con áreas blancas y áreas rojas.
Nodular: con excrecencias ligeras, redondeadas, rojas y/o blancas. Éstas y las eritroleucoplasias, frecuentemente se hallan infectadas por cándida, con displasia ocasional.
Exofítica o verrugosa. Con proyecciones redondeadas o desflecadas. Puede tener carácter proliferativo progresivo y también progresar a carcinoma verrugoso. Con el tiempo pueden convertirse en carcinomas infiltrantes de células escamosas (21, 22, 29).
El tejido subyacente a una leucoplasia es elástico y no doloroso a la presión. Si encontramos fondo indurado y dolor a la compresión del tejido ha de sospechar una transformación maligna. Las leucoplasias homogéneas son asintomáticas y a lo sumo el paciente suele apreciar con la lengua una rugosidad cuando la mácula se convierte en placa.
Las leucoplasias no homogéneas producen ocasionalmente ardor o escozor cuando la lesión se pone en contacto con alimentos ácidos o salados.
ERITROPLASIA
La eritroplasia o eritroplaquia se define haciendo referencia a lesiones de la mucosa oral que aparecen como placas rojas, aterciopeladas, de bordes irregulares aunque bien definidos, que no pueden ser caracterizadas clínica o histopatológicamente como a ninguna otra enfermedad. Su epidemiología y patogénesis son desconocidas, y es mucho menos frecuente que la leucoplasia. Sin embargo no es infrecuente hallar áreas de eritroplasia junto con áreas de leucoplasia (eritroleucoplasia). Suele ser una lesión asintomática que aparece en varones de edad que consumen cigarrillos. Pueden encontrarse en el suelo de la boca, superficies lateral y ventral de la lengua, paladar blando y mucosa yugal. Cuando nos hallemos frente a una mancha de eritroplasia aislada debemos sospechar fenómenos de displasia y posible carcinoma invasor. Por ello es importante que todas las lesiones de eritroplasia sean sometidas a biopsia para determinar la naturaleza exacta (11, 30).
QUEILITIS ACTINICA
Este proceso labial obedece a la exposición crónica y prolongada a la luz del sol, la queilitis actínica se la incluye como una lesión precancerosa. Aparece con mayor frecuencia en personas de raza blanca y piel tez pálida que desarrollan su actividad al aire libre (marineros, agricultores). La queilitis atrófica crónica representa una degeneración de los tejidos del bermellón labial, preferentemente el labio inferior, secundaria a una exposición repetitiva a la radiación solar. Se debe a la radiación UVB, estando estrechamente relacionada con la cantidad de radiación acumulada y el grado de pigmentación mucocutánea del individuo.
Se manifiesta por un borramiento del límite cutáneo-mucoso labial, descamación y pérdida de la turgencia labial. Al principio el labio aparece seco y con descamación. Después el epitelio se engruesa de forma visible formando unas placas de aspecto blanco-grisáceo, con fisuras y arrugas radiales. En casos avanzados hay un borramiento del límite cutáneo con perdida de la elasticidad. Histológicamente existen áreas atróficas alternando con áreas hiperplásicas, con para u ortoqueratosis. Se pueden ver una gran variedad de cambios displásicos, incluso en una misma lesión, desde una ligera atipia a un carcinoma in situ. La submucosa presenta una característica degeneración basófila del colágeno y la aparición de telangiectasias. El riesgo de malignización de la queilitis actínica es elevado, ya que en 1-3% de los casos degenera en carcinoma epidermoide, por lo que requiere un estrecho seguimiento (15, 31).
LUPUS ERITEMATOSO
El lupus eritematoso es una enfermedad inflamatoria del tejido conectivo producida por la aparición de múltiples autoanticuerpos e inmunocomplejos capaces de originar lesiones en uno o varios órganos diana. Cuando sólo afecta la piel o la mucosa, se le denomina lupus eritematoso discoide (LED).
Las lesiones orales se dan en un 15-25% de los casos de lupus eritematoso discoide (LED). Se localizan preferentemente en la semimucosa del labio inferior, aunque pueden asentar a nivel de la mucosa oral. Se estima que una lesión discoide puede transformarse en maligna en 0,1-4,2% de los casos (15).
LIQUEN PLANO
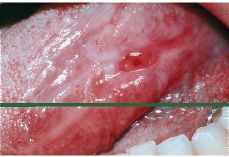
El liquen plano es una enfermedad mucocutánea crónica de etiología desconocida que, de acuerdo a los conocimientos actuales, representa una respuesta inmune mediada por células, respecto a determinados cambios antigénicos inducidos en el epitelio de piel y mucosas (Fig. 3). El liquen plano oral (LPO) se presenta en varias formas clínicas: reticular y atrófico-erosiva, y existen diversas opiniones sobre su potencial de malignización (9, 11, 26, 32). Los líquenes más peligrosos son aquellos que se presentan como formas atróficas, erosivas, en placas, o que asocian zonas eritroplásicas, especialmente si se localizan en la cara dorsal de la lengua. Debido a que el resto de las lesiones y estados precancerosos son menos frecuentes en nuestro medio, se obvia en el presente artículo una descripción minuciosa de sus características clínicas y potencial maligno.
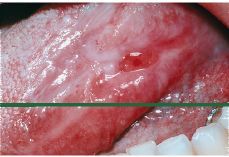
Figura 3.Liquen plano oral, atrófico-erosivo en margen lingual.
PAUTAS DIAGNOSTICAS EN EL PRECANCER ORAL
El paciente anciano, además de la atención tradicional, requiere un enfoque especial respecto a enfermos más jóvenes. Ello se debe no sólo a la existencia de patologías de especial relevancia, sino también a la comentada pluripatología.
El modelo tradicional de aproximación clínica al paciente, tanto adulto como anciano, consiste en recoger información sobre su queja principal, conocer la evolución de la enfermedad actual y los antecedentes médicos, revisar los diferentes órganos y sistemas, realizar una exploración física e indicar diversas pruebas complementarias.
Es necesaria una aproximación clínica al anciano que tenga en cuenta todos estos factores y que se base en el conocimiento de los cambios que acompañan al envejecimiento y de las características de la presentación de la enfermedad en la vejez, así como en el estudio de todos aquellos factores que pueden intervenir en el origen y evolución de la enfermedad, incluyendo factores físicos, mentales y sociales (1-3).
De esta forma, frente a un modelo clásico de aproximación «biomédica», los múltiples e interrelacionados problemas del anciano requieren una aproximación «biopsicológica», en la que a la evaluación clínica tradicional se añade la evaluación de las distintas áreas que conforman al individuo.
Anamnesis
En el anciano requiere una modificación de la relación habitual entre el médico y el paciente adulto y determinados aspectos de la historia clínica adquieren una mayor relevancia. Toda enfermedad en el viejo alcanza su verdadera dimensión cuando se considera en su contexto funcional, mental y social; cualquier patología puede presentar un impacto en estas esferas y éstas, a su vez, influyen en el curso clínico de la enfermedad.
Los problemas en la obtención de la historia pueden ser mejorados utilizando un lenguaje lento y en tonos graves y hablando al paciente frente a frente, para que pueda apreciar nuestros gestos y los movimientos de los labios. Deben eliminarse los ruidos de fondo y procurar una estancia bien iluminada. Las alteraciones en la memoria y en otras funciones cognitivas pueden resultar en una historia clínica imprecisa e incompleta. Por ello, otras fuentes de información (familiares, vecinos, cuidadores) pueden aportar una mayor precisión a la historia. Incluso pacientes con un deterioro cognitivo leve o moderado son capaces de referir sus síntomas y la respuesta al tratamiento, por lo que su información no debe ser ignorada.
El anciano con frecuencia no refiere una queja única; la coexistencia de varias enfermedades favorece la aparición de numerosos síntomas inespecíficos, inconexos y fluctuantes y, en ocasiones, su presencia no es debida a una única enfermedad, sino a varias.
A diferencia del joven, el anciano suele presentar antecedentes médicos que pueden ser de máxima utilidad para valorar adecuadamente la sintomatología presente del anciano. Es preciso recoger información acerca del consumo de tabaco, alcohol y otras drogas.
Exploración física
Ninguna prueba diagnostica supera a la exploración física en la obtención de información sobre las diferentes enfermedades, por lo tanto, no debe escatimarse tiempo ni esfuerzo en su realización.
El diagnóstico inicial es fundamentalmente clínico. El establecimiento temprano de la lesión es tan importante que implica un cambio radical en las posibilidades de curación. El retraso en el diagnóstico implicará la aplicación de técnicas mucho más mutilantes. En muchos casos, la sospecha clínica de malignidad está basada en los hallazgos de una exploración exhaustiva. Es frecuente que el carcinoma surja de un área preexistente de leucoplasia y muestre un comportamiento indolente.
El diagnóstico de una leucoplasia se basa en dos tipos de criterios: criterios clínicos para determinar si es homogénea y criterios histopatológicos para determinar si presenta o no displasia. Ambos criterios son condición imprescindible que define la leucoplasia. El diagnóstico clínico de leucoplasia homogénea no excluye la biopsia, que resulta imprescindible para descartar otras entidades. No olvidemos que bajo lesiones clínicas banales puede hallarse un carcinoma invasor. En muchas ocasiones será preciso incluso tomar biopsia de dos o más áreas si el juicio clínico así lo indica.
Exámenes complementarios
La realización de pruebas tendentes a la detección precoz de la enfermedad (métodos de despistaje o «screening») debe estar presidida por una serie de principios, han de tener una precisión, sensibilidad y especificidad reconocida.
Métodos citológicos (33-36)
La utilización de las tinciones con azul de toluidina y lugol se describen para el diagnóstico precoz del cáncer bucal como métodos citológicos y, por tanto, quedan englobadas en la sistemática de su prevención.
Lo ideal en cuanto a la prevención del cáncer bucal, como en todas las enfermedades, comprendería las actividades en el ámbito de prevención primaria, pero dado los recursos tan limitados con que desafortunadamente contamos en la actualidad en la protección específica del cáncer bucal, será en el ámbito de la prevención secundaria, diagnóstico y tratamiento precoz, donde deberemos poner y mantener nuestra atención.
Prueba del azul de toluidina. El azul de toluidina es un colorante acidofílico y metacromático que pertenece al grupo de las tiacidas. Su característica principal es que tiñe selectivamente componentes ácidos de los tejidos, tales como sulfatos, carboxilatos y radicales fosfato, principalmente los incorporados en el DNA y RNA de las células. Por ello, el azul de toluidina se utiliza para hacer tinciones nucleares «in vivo»; la prueba se basa en que las células displásicas y anaplásicas contienen cuantitativamente mayor cantidad de ácidos nucléicos y, por tanto, retienen la tinción.
La composición de la solución es la siguiente: azul de toluidina, ácido acético, alcohol al 100%, agua destilada. La técnica de aplicación consiste en aplicar en primer lugar ácido acético al l% durante 30 segundos, a continuación se aplica azul de toluidina al 1 o 2% durante un minuto, y, finalmente se vuelve a aplicar ácido acético al l% durante 30 segundos. Una tinción es considerada positiva si adquiere una coloración azul oscuro, tanto si se tiñe la totalidad de la lesión como si sólo lo hace una parte de la misma. Por lo tanto, la prueba de tinción con azul de toluidina se puede utilizar como ayuda en el diagnóstico de lesiones premalignas y malignas de la cavidad bucal.
Tinción con yoduro de lugol. El yoduro de lugol es una tinción utilizada por su afinidad por el glucógeno de las células epiteliales, esto da como resultado una tinción de color verde-marrón. La técnica se basa, por tanto, en que las células que contengan más glucógeno retendrán la tinción, y aquellas con menor contenido en glucógeno no la retendrán. Las células epiteliales normales contienen gran cantidad de glucógeno, sin embargo las células carcinomatosas contienen muy poco glucógeno, no solamente en las líneas celulares más superficiales sino en la profundidad y, por tanto, la reacción con el yoduro de lugol no se producirá o será muy tenue, lo cual nos dará una zona no teñida tras la aplicación de la solución. La composición de la solución es la siguiente: yoduro de lugol, yoduro de potasio, agua destilada. La técnica de aplicación consiste en aplicar primeramente ácido acético al l% durante 20 segundos, posteriormente se aplica la solución de lugol al 2% durante 20 segundos y, finalmente, se vuelve a aplicar ácido acético al l% durante 20 segundos.
Debido a las características de ambas tinciones, azul de toluidina y lugol, para diferenciar células neoplásicas de células normales de la mucosa bucal una opción interesante sería la combinación extemporánea de ambas. El uso de ambas tinciones supone un incremento en la especificidad. El azul de toluidina es útil por su elevada sensibilidad, pero tiene una especificidad baja debido a los falsos positivos que genera. Por el contrario, el lugol tiene una mayor especificidad y una menor sensibilidad. Por tanto, el uso de ambas tinciones parece que mejora los resultados.
No obstante, existe una clara controversia sobre el uso de las pruebas de tinción en el diagnóstico precoz del cáncer bucal.
Biopsia
Aunque el diagnóstico de las lesiones precancerosas se efectúa sobre una base clínica es imperativo confirmar esta sospecha por medio de una biopsia. Debe tenerse en cuenta que en ningún caso se considera estas pruebas como sustitutos de la biopsia en el diagnóstico definitivo. Las biopsias deben incluir junto con tejido enfermo una porción de tejido periférico adyacente normal. Es importante elegir el sitio adecuado para la toma de la muestra. En la mayoría de los casos, la valoración de las lesiones bien desarrolladas nos proporciona más información que las incipientes o en estado de involución (26).
Para llevar a cabo la biopsia, lo primero debemos realizar una buena analgesia evitándose la anestesia intralesional, ya que puede ocasionar distorsión de los tejidos. En la práctica la técnica anestésica más usada es la infiltrativa. Se puede realizar la biopsia bien mediante bisturí convencional o bien mediante el punch o sacabocados (seleccionar el punch de 1 a 3 mm de diámetro mayor que el diámetro de la lesión).
En el estudio histopatológico de la leucoplasia podemos distinguir dos tipos (tabla II):
Tabla II. Leucoplasia oral. Clasificación histológica. | |
| Sin displasia | Displasia |
| Hiperqueratosis (orto/para) | * Leve |
| Acantosis | * Moderada |
| Papilomatosis | * Severa |
| Escaso infiltrado en corion | |
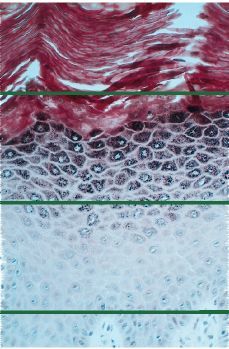
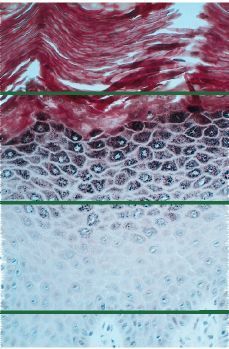
Leucoplasias sin displasia epitelial. Representan el 80-90% de todas las leucoplasias y en ellas se encuentran fenómenos de hiperqueratosis prácticamente en el 100% de los casos. Se halla también acantosis y papilomatosis. En este tipo de leucoplasia el infiltrado inflamatorio en el corión o es escaso o inexistente. Suelen corresponder a formas clínicas homogéneas, y poseen poca capacidad de malignización (Fig. 4).
Figura 4.Imagen histológica de una leucoplasia oral sin displasia epitelial corte de HE.
Leucoplasias con displasia epitelial. Representan el 10-20% de todas las leucoplasias. El término displasia implica desorden de la arquitectura epitelial normal.
Hablamos de displasia leve, moderada o severa para referirnos a un desorden de la arquitectura epitelial normal que afecta respectivamente a estratos profundos del epitelio, a estrato profundos y medianos, o a la totalidad del epitelio. En este último caso hablamos también de carcinoma in situ o intraepitelial no invasor. La elección del término y la categoría de la lesión se basa en la interpretación y cuantificación de los rasgos atípicos. Se considera que el diagnóstico de carcinoma in situ excluye, por definición, el de leucoplasia.
Para estudios epidemiológicos y de seguimiento, es interesante la denominada clasificación LCP, basada en una numeración según tamaño, tipo clínico y tipo histológico. Según estos parámetros se establecen tres estadios, en relación con la severidad de la lesión (21) (tabla III).
Tabla III. Clasificación y estadios de las leucoplasias orales (21). | |
| «L» (tamaño). | 1) < 2 cm; 2) 2-4 cm; 3) > 4 cm. |
| «C» (tipo clínico). | 1) L homogénea; 2) L. no homogénea; X) no especificado. |
| «P» (tipo histológico). | 1) sin displasia; 2) displasia leve; 3) displasia moderada. 4) displasia severa; X) no especificado. |
| Estadio 1: cualquier L C1 P1 P2. | |
| Estadio 2: cualquier L C2 P1 P2. | |
| Estadio 3: cualquier L cualquier C P3 P4. | |
Los porcentajes de malignización de una leucoplasia varían según series, autores, países y épocas. En general podemos decir que la leucoplasia es considerada por la mayoría de los autores como la lesión precancerosa por excelencia y es posible que preceda a un gran porcentaje de carcinomas de células escamosas, ya que cuando éstos son diagnosticados es raro el caso en que no encontramos áreas de leucoplasia en regiones próximas al tumor.
Sabemos que entre el 1 y el 17%, aproximadamente, de todas las leucoplasias, se van a transformar en carcinomas invasores (11). Existen algunos factores pronósticos indicativos de un mayor riesgo de transformación (7, 10, 37).
El mayor riesgo se da en la mujer, por encima de los 50 años, las localizadas en el suelo de la boca o en la cara ventral de la lengua y con un tamaño mayor de un centímetro. Las leucoplasias no homogéneas se transforman en un 26% frente a un 2% las homogéneas. El tipo histológico es otro factor pronóstico, las leucoplasias con signos de displasia tienen mucho mayor riesgo que aquellas que no presentan displasia. Pueden llegar a transformarse más del 40%. Tal vez sea éste el factor pronóstico indicativo más importante. La perpetuación de hábitos tóxicos como el tabaco y alcohol aumentan el riesgo. A mayor tiempo de evolución, mayor riesgo, así como, la existencia de una enfermedad subyacente y en general cualquier condición precancerosa (tabla IV).
Tabla IV. Principales factores que condicionan la transformación maligna de una leucoplasia. |
| * Largo tiempo de evolución. |
| * Mayores de 70 años. |
| * Mujeres. |
| * Localización suelo boca o cara ventral lengua. |
| * Tamaño: > 1 cm. |
| * Tipo clínico: no homogénea. |
| * Displasia epitelial. |
Tratamiento
El tratamiento que debe seguirse ante un paciente con leucoplasia oral se inicia por combatir los posibles factores etiológicos implicados en su génesis. Si en la exploración hemos encontrado factores irritativos de tipo mecánico (protésicos o dentarios) debemos eliminarlos de forma conservadora, es decir, tallando, puliendo, redondeando piezas dentales lesivas. Si después de un mes la lesión no mejora, haremos la exodoncia o eliminaremos la prótesis. Si la prótesis origina componentes electrogalvánicas es aconsejable suprimirla (18-20).
Siempre suprimir hábitos tóxicos como el tabaco y el alcohol, así como alimentos demasiado calientes, salados, ácidos o traumáticos. Si no se cumple esta condición la leucoplasia seguirá su curso, y las medidas terapéuticas no alcanzarán buenos resultados. Debemos investigar los posibles factores etiopatogénicos de tipo sistémico: serología luética, anemia ferropénica, etc.
En las lesiones retrocomisurales de tipo moteado o nodular debemos pensar en cándidas, bien como agente etiológico primario o bien como microorganismos que producen una sobreinfección de la lesión; iniciaremos el tratamiento con antifúngicos durante dos o tres semanas, bien con fármacos en forma de enjuagues o tabletas. Si la lesión no ha desaparecido o mejorado en el plazo de un mes, es recomendable la toma de una biopsia representativa de toda la lesión, de cuyo resultado va a depender nuestra posterior actitud terapéutica. Si la lesión es muy pequeña, la biopsia suele ser de tipo excisional, debemos tranquilizar al paciente e indicarle que comunique cualquier recurrencia aparente, además haremos una vigilancia mediante citas anuales o bianuales específicas para ello. Si no aparecen signos de displasia epitelial y la leucoplasia es tan amplia que no ha sido eliminada en la muestra de biopsia, empezaremos por realizar un tratamiento con vitamina A en dosis de 500.000 u. i. diarias durante 30-45 días. Hay que tener en cuenta la posible toxicidad hepática al ser una vitamina liposoluble; por eso, actualmente son más empleados sus análogos naturales o artificiales conocidos como retinoides, como son el ácido 13 cis-retinoico o el etretinate por vía oral en dosis de 1 mg/kg de peso/día durante dos meses (tabla V).
| Tabla V. Pautas a seguir ante una lesión precancerosa. | |
| Control factores generales | Control sobre lesión |
| Tabaco | Tratamiento tópico |
| Enfermedad | (ácido retinoico) |
| Traumatismos | Tratamiento sistémico |
| Infecciones | Eliminación (láser o cirugía) |
Por lo tanto y resumiendo, el tratamiento sobre la lesión se realizará:
a) Tratamiento sistémico. Derivados de la vitamina A y vitamina E por vía oral.
b) Tratamiento tópico con ácido retinoico al 0,1% en orabase o bien pincelaciones de sulfato de bleomicina en dimetilsulfóxido al 1%, durante dos semanas.
c) Eliminación de la lesión mediante cirugía, láser CO2 o crioterapia (38-42).
AGRADECIMIENTOS
Deseamos agradecer la colaboración iconográfica al Prof. Ambrosio Bermejo Fenoll, catedrático de Medicina Bucal de la Universidad de Murcia.
BIBLIOGRAFIA
1.Berkey DB, Berg RL, Ettinger A, Mersel J, Man J. El paciente odontológico anciano. El reto de la toma de decisiones clínicas. Arch Odontoestomatol 1996;12:590-604.
2.Subirá C, Cuenca E. Gerodontologia: revisión de la literatura. Arch Odontoestomatol 1991;7:342-56.
3.López Dóriga Bonnardeaux P, Guillén Llera F. Aproximación clínica al paciente geriátrico. Técnicas de valoración geriátrica. Evaluación clínica, funcional, mental y social. Monografía de actualización geriátrica. Madrid: Smithkline & Beecham 1996:5-18.
4.Velasco Ortega E. Fisiopatología del envejecimiento en la cavidad oral En: Gerodontologia estado actual y perspectivas de futuro. Valencia: Ed Promolibro; 1997. p. 35-54.
5.Velasco Ortega E. Envejecimiento oral. En: Bullón P, Velasco E, eds. Odontoestomatología Geriátrica Madrid. Smithkline & Beecham; 1996. p. 159-73.
6.Silverman Jr. Precanceous lesions and oral cancer in the elderly. En: Baum BJ, ed. Clinic in geriatric medicine. Philadelphia: Saunders; 1992. p. 529-41.
7.Bagán Sebastián JV. Lesiones y estados precancerosos de la mucosa oral. En: Bagán JV, Ceballos A, Bermejo A, Aguirre JM, Peñarrocha M, eds. Medicina Oral. Barcelona: Masson SA; 1995. p. 166-76.
8.Aguirre Urízar JM, Echebarría Goikouria MA, Martínez-Conde Llamosas R. El odontólogo/estomatólogo frente al precáncer oral. Rev Act Odontoestomatol Esp 1994;44:47-64.
9.González Moles MA. Lesiones precancerosas de la mucosa oral. RCOE 1997;8:599-617.
10.Thomas JE, Bender BS. What to look after you say «open wide». A guide to examination of the oral cavity. Postgrad Med 1993;93:109-15.
11.Pindborg JJ. y grupo «Exbrayat». Precáncer y cáncer oral. Barcelona: Iltr Cons Gral Col Odontoestomatol. España; 1995.
12.Martínez-Sauquillo Marqués JM, Martínez Sahuquillo A. El cancer oral en el paciente geriátrico (II): Enfoque diagnóstico y terapéutico En: Bullón P, Velasco E, eds. Odontoestomatología Geriátrica Madrid: Smithkline & Beecham; 1996. p. 307-17.
13.Pindborg JJ. Cáncer y precáncer bucal. Buenos Aires: Editorial Médica Panamericana SA; 1981.
14.Bermejo Fenoll A. Medicina Bucal Madrid: Síntesis 1998:247-58.
15.Martínez-Sauquillo Marqués A. Bullón Fernández P. El cáncer oral en el paciente geriátrico (I): Epidemiología y etiología. Precáncer oral. En: Bullón P, Velasco E, eds. Odontoestomatología Geriátrica. Madrid: Smithkline & Beecham; 1996. p. 291-306.
16.García Pola Vallejo MJ, García Martín JM, González García M, Talenti Arnáiz P. Lesiones precancerosas (leucoplasia, liquen plano) en el paciente geriátrico. Atenc Prim 1997;20:40-4.
17.Bascones A, Cerero R, Esparza G, Llanes F. Lesiones precancerosas de la cavidad oral. Arch Odontoestomatol 1992;8:491-9.
18.Iriarte Ortab JI, Caubet Biayna J, Rychler H. Leucoplasia bucal. Med Clin (Barc) 1996;106:387-95.
19.Bagán JV, Vera F, Militan MAL, Peñarrocha M, Silvestre FJ, Sánchez JM. Leucoplasia oral: estudio clínico-patológico de 110 casos. Arch Odontoestomatol 1993;9:127-38.
20.Alvarez Lorenzo M, Gándara Rey JM, Gándara Vila A, Blanco Carrión A, García García A, Blanco Fondevilla J. Estudio de la incidencia y localización de la leucoplasia bucal. Arch Odontoestomatol 1997;13: 543-54.
21.Axéll T, Pindborg JJ, Smith CJ, van der Waal I and an International Collaborative Group on Oral White Lesions. Oral white lesions with special reference to precancerous and tobacco-related lesions: conclusions of an international symposium held in Uppsala, Sweden, May 18-21 1994. J Oral Pathol Med 1996;25:49-54.
22.Hansen LS, Olson JA, Silverman S. Proliferative verrucous leukoplakia. A long-term study of thirty patients. Oral Surg 1985;60:285-98.
23.Velasco Ortega E, Vigo Martínez M, Valencia Alejandre S, Martínez Sahuquillo Marques A, Bullón P. Leucoplasia oral en pacientes psiquiátricos. Valoración clínica de un grupo de riesgo. Arch Odontoestomatol 1997;13:647-51.
24.Sciubba JJ. Oral leucoplakia. Crit Rev Oral Biol Med 1995;6:147-60.
25.Martínez JM, Gutiérrez MT. Leucoplasia oral. A propósito de 184 casos. Arch Odontoestomatol 1989;4:490-7.
26.Bertoin P, Baudet-Pommel M, Zattara H, Gourmet R. Lésions precancéreuses et cancéreuses de la muqueuse buccale. París: Masson; 1995.
27.Szpirglas H. Detection des cancers buccaux et conception actuelle des etats precancereux. Rev Pract 1995;7:831-7.
28.González Moles MA, Ruiz Ávila I, Giner Martínez M, Ceballos A. Consideraciones sobre las implicaciones pronósticas de los papilomavirus humanos en leucoplasias orales. Avanc Odontoestomatol 1993;9: 473-6.
29.Zakzeweska J, Lopes V, Seight P, Hopper C. Proliferative verrucous leukoplakia. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996; 82:396-401.
30.Shap JP, Eversole L, Wysocki G. Patología Oral y Maxilofacial Contemporánea. Madrid: Harcourt Brace 1998:164-73.
31.Milián Masanet A. Patología de los labios. En: Bagán JV, Ceballos A, Bermejo A, Aguirre JM, Peñarrocha M. Medicina Oral. Barcelona: Masson SA; 1995. p. 161-5.
32.Cerero-Lapiedra R, García-Núñez JA, García-Pola MJ. Liquen plano oral. RCOE 1997;8:643-60.
33.Alaejos Algarra C, Berini Aytes L, Gay Escoda C. Valoración de los métodos de tinción con azul de toluidina y lugol en el diagnóstico precoz del cáncer bucal. Avances Odontoestomatol 1996;12:511-7.
34.Epstein JB, Scully C, Spinelli. Toluidine blue and lugol´s iodine in the assement of oral malignant disease and lesions at risk of malignacy. J Oral Pathol Med 1992;21:160-3.
35.Van der Waal I. Diagnóstico y tratamiento de lesiones precancerosas. FDI World 1995;2:6-9.
36.Warnakulasuriya K, Jhonson NW. Sensitivity and specifity of Oral Scan toluide blue mothrinse in the dection of oral cancer and precancer. J Oral Pathol Med 1996;2:97-103.
37.García Pola Vallejo MJ, López Arranz JS. Criterios clínicos para calcular el riesgo de malignización de la lesión leucoplásica. Avances Odontoestomatol 1991;7:89-102.
38.Martínez JM, Peris RM, Baca R, Blanco L, del Canto Pingarron J. Cirugía laser CO2 en la eliminación de leucoplasias de la cavidad oral. Rev Eur Odontoestomatol 1993;6:321-8.
39.Bagán Sebastián JV, Cardona F, Carbonell E, Jiménez Y, Milián A. El láser CO2 en el tratamiento de las leucoplasias orales. Oris 1994;3: 55-60.
40.Al-Droy HAL Oral leukoplakia and cryotherapy. Br J Dent 1983;155: 124-5.
41.Horch HH, Gerlach KL, Schaefere. CO2 laser surgery of oral premalignant lesions. Int J Oral Maxillofac Surg 1986;15:19-24.
42.Betlejewski S, Winiarski P, Winiarska L. The use of CO2 laser in the treatment of leucoplakia of the oral cavity. Otolaryngol Pol 1997;51: 109-12.
INFORMACIONES DEL EXTRANJERO
Convocatoria del premio OISS para trabajos de investigación o Difusión Relacionados con «Los Servicios Sociales para las personas mayores»
La Organización Iberoamericana de Seguridad Social (OISS) convoca el Premio OISS «Los servicios sociales para las personas mayores».
El premio será de cinco mil dólares americanos (US$ 5.000) y no podrá ser dividido.
La OISS podrá otorgar, además uno o más accésits de mil dólares americanos (US$ 1.000) en función de la calidad de los trabajos presentados y a propuesta del Jurado constituido al efecto.
Información:
Secretaría General de la OISS
Velázquez, 105-1.ª planta
28006 Madrid (España)
Teléfono: 915 61 17 47/19 55
Fax: 915 64 56 33
E-mail: sec.general@oiss.org