El concepto de «vulnerabilidad neuronal selectiva» se refiere a la diferente sensibilidad de las poblaciones neuronales del sistema nervioso frente a diversos procesos que causan daño o muerte celular y que conllevan la neurodegeneración. Dado que el estrés oxidativo desempeña un papel crucial en el proceso fisiológico de envejecimiento y este se invoca como un mecanismo etiopatogénico y/o fisiopatológico de la neurodegeneración, en el presente trabajo se propone que las bases moleculares de la vulnerabilidad neuronal selectiva están relacionadas con las adaptaciones celulares al estrés oxidativo.
Material y métodosCon esta idea, se ha procedido a la selección de 5 regiones diferentes del sistema nervioso central de individuos sanos (n=7) para: i) evaluar el perfil en ácidos grasos de los lípidos de membrana mediante métodos cromatográficos; ii) determinar la susceptibilidad de membrana a la peroxidación lipídica, y iii) reconocer mecanismos implicados en su regulación.
ResultadosLos resultados muestran diferencias significativas interregionales en el perfil de ácidos grasos, básicamente debidas al contenido de monoinsaturados y poliinsaturados con más de 3 dobles enlaces; que dichos cambios, a su vez, inducen diferencias significativas en sus susceptibilidades a la peroxidación, y que dichas diferencias se pueden adscribir a la actividad desaturasa.
ConclusionesAsí pues, la aproximación comparativa interregional parece confirmar la idea del grado de insaturación de una membrana celular como característica clave de la vulnerabilidad neuronal selectiva.
The concept of ‘selective neuronal vulnerability’ refers to the differential sensitivity of neuronal populations in the nervous system to stresses that cause cell damage and lead to neurodegeneration. Because oxidative stress play a causal role in the physiological aging process, and it is often invoked as an aetiopathogenic and/or pathophysiological mechanism for neurodegeneration, in the present work we propose that the molecular bases of selective neuronal vulnerability is linked with cell adaptations related to oxidative stress.
Material and methodsThe grey substance of 5 different regions from healthy human subjects (n=7) were selected: i) to evaluate their membrane fatty acid profile by chromatographic methods, ii) to determine their membrane susceptibility to peroxidation, and iii) to recognise potential mechanisms involved in its regulation.
ResultsThe results showed significant inter-regional differences in the fatty acid profile, basically due to the content of mono- and highly polyunsaturated fatty acids; changes that, in turn, induce significant differences in theirs susceptibilities to peroxidation, as well as differences that can be ascribed to the desaturase activity.
ConclusionThus, the cross-regional comparative approach seems to confirm the idea that the level of cell membrane unsaturation may be a key trait associated with selective neuronal vulnerability.
Alrededor de 100 mil millones de neuronas conforman el sistema nervioso central (SNC) del hombre, y dirigen una gran variedad de funciones motoras, sensoriales, reguladoras y conductuales. Esta amplia multiplicidad funcional es el producto de los eventos moleculares que ocurren en las células nerviosas y, en particular, en las neuronas. La gran diversidad existente entre poblaciones neuronales es buen indicador de que aunque todas las neuronas contienen el mismo código genético en su genoma, cada población neuronal expresa su propio perfil génico y determina qué partes del genoma son activas y a qué nivel1,2. Mientras que la diversidad estructural y funcional de las neuronas está bien documentada, lo que está menos estudiado es la diversidad de respuestas y adaptaciones neuronales al estrés y factores adversos durante el proceso de envejecimiento o como resultado de las enfermedades neurodegenerativas.
En este escenario de diversidad celular emerge el concepto de vulnerabilidad neuronal selectiva que se refiere a la diferente sensibilidad de las poblaciones neuronales en el SNC frente a los factores que causan daño o muerte celular y conducen a la neurodegeneración1,2. El hecho de que regiones específicas del sistema nervioso exhiban diferentes vulnerabilidades a diversas enfermedades neurodegenerativas es un reflejo tanto de la especificidad etiológica de cada enfermedad como de la heterogeneidad de las respuestas neuronales frente a los procesos de daño celular asociados con cada patología1,3.
La generación fisiológica de especies reactivas de oxígeno (ROS; del inglés, reactive oxygen species) desempeña un papel clave en la función y plasticidad neuronal4, y está involucrada en los mecanismos básicos del envejecimiento del SNC4,5, mientras que una producción excesiva de ellas se ha invocado como un mecanismo etiopatogénico y/o fisiopatológico de la neurodegeneración3–5. El resultado del desequilibrio entre la producción de ROS y la detoxificación de las mismas mediante reacciones enzimáticas y no enzimáticas es el estrés oxidativo, y la lesión oxidativa que se deriva de este estrés es perjudicial para las células nerviosas porque las ROS pueden modificar químicamente (dañar) a lípidos, proteínas y ácidos nucleicos y comprometer, así, las funciones celulares y su supervivencia3. Por tanto, es muy importante definir la vulnerabilidad de las diferentes poblaciones neuronales en términos de susceptibilidad al estrés oxidativo en condiciones fisiológicas para poder mejorar nuestro conocimiento sobre cómo esta vulnerabilidad particular de la célula nerviosa puede causar pérdidas neuronales selectivas en el sistema nervioso.
Las membranas biológicas son estructuras dinámicas que generalmente consisten en una bicapa de moléculas anfipáticas las cuales están unidas mediante enlaces no covalentes6. En las células nerviosas, los fosfolípidos son los lípidos de membrana predominantes, análogamente a lo que sucede en otros tipos celulares del organismo. La susceptibilidad de los fosfolípidos de membrana frente a las alteraciones oxidativas es debida a 2 características inherentes, las propiedades físico-químicas de la membrana y la reactividad química de los ácidos grasos que la componen6,7. La primera propiedad está relacionada con el hecho de que el oxígeno y los radicales libres son más solubles en el fluido de la bicapa lipídica que en solución acuosa. Por tanto, las membranas contienen una fase orgánica interior en la cual el oxígeno tiende a concentrarse. Así, estas diferencias en solubilidad son importantes cuando se considera la disponibilidad del oxígeno/radicales libres para reacciones químicas dentro de los sistemas vivos: las regiones orgánicas contienen más radicales libres que las regiones acuosas y, consecuentemente, las membranas lipídicas se vuelven dianas principales del daño oxidativo. La segunda propiedad se refiere a que los ácidos grasos poliinsaturados (AGPI) son extremadamente sensibles a la oxidación. Cada fosfolípido de membrana contiene un residuo de ácido graso insaturado (AGI) esterificado en la posición 2 del glicerol. La mayoría de estos son poliinsaturados y la presencia de un grupo metilo entre 2 dobles enlaces hace que el ácido graso sea más sensible al daño inducido por las ROS, aumentando exponencialmente su sensibilidad a la oxidación en función del número de dobles enlaces por molécula de ácido graso8,9. Consecuentemente, la alta concentración de AGPI en los fosfolípidos no solamente hace que sean las principales dianas para las reacciones con agentes oxidantes sino que también posibilitan el hecho de participar en reacciones en cadena mediadas por radicales.
Aunque los ácidos grasos aparentemente tienen una forma simple, su longitud de cadena y el grado de insaturación son claves para realizar sus funciones. En consecuencia, la adecuada elongación y desaturación de los ácidos grasos es esencial para el mantenimiento y la homeostasis de los lípidos y una correcta función celular, con consecuencias devastadoras en caso de haber una disfunción10. En las células eucariotas, los ácidos grasos se sintetizan en el citosol mediante la enzima sintetasa de ácidos grasos, o pueden derivar de la dieta y ser desaturados y elongados a cadenas largas (C16, C18) o muy largas (≥C20) mediante enzimas específicas ubicadas en mitocondrias, peroxisomas y microsomas (fig. 1). Los AGPI son una serie de ácidos grasos con más de un doble enlace carbono-carbono. Basándonos en la localización del primer doble enlace, contando desde el grupo metilo final de la cadena, se pueden dividir en 2 clases, los n-3 y los n-6 (fig. 1).
Biosíntesis de ácidos grasos de cadena larga y muy larga en mamíferos. Los ácidos grasos saturados de cadena larga y los ácidos grasos insaturados de las series n-10, n-7 y n -9 pueden sintetizarse a partir del ácido palmítico (16:0) producido por la enzima sintetasa de ácidos grasos (FAS). Los ácidos grasos de cadena larga de las series n-6 y n-3 solo pueden sintetizarse a partir de precursores obtenidos de la dieta.
La peroxidación de los lípidos genera hidroperóxidos, así como también endoperóxidos, que se fragmentan y producen un amplio rango de intermediarios reactivos de entre 3 y 9 átomos de carbono, recogidos bajo la etiqueta de especies carbonilo (o carbonílicas) reactivas. Los más reactivos son los aldehídos alfa,beta-insaturados (4-hidroxi-2-nonenal y acroleína), dialdehídos (malondialdehído y glioxal), y cetoaldehídos (4-oxo-trans-2-nonenal e isocetales)7,11. Estos compuestos carbonilo se generan de manera ubicua en los sistemas biológicos y tienen propiedades únicas en comparación con los radicales libres. Así, comparados con las ROS (o incluso con otras especies reactivas fisiológicas derivadas del nitrógeno o del cloro), los aldehídos reactivos tienen una vida media mucho mayor (de minutos a horas en lugar de microsegundos a nanosegundos para muchos radicales libres). Además, las estructuras aldehídicas no están cargadas, hecho que les permite una migración relativamente fácil a través de las membranas y del medio citosólico hidrofílico, extendiendo así la distancia de migración desde el punto de su producción. Así pues, basándonos únicamente en estas características, estos compuestos carbonilo pueden ser mucho más destructivos que las ROS y pueden tener dianas tanto dentro como fuera de las membranas. Los compuestos con grupo/s carbonilo reaccionan con grupos nucleofílicos de macromoléculas como proteínas, ADN y aminofosfolípidos, dando lugar a una modificación química, no-enzimática e irreversible que origina una gran variedad de aductos y entrecruzamientos globalmente denominados productos avanzados de lipoxidación12–14. Las especies reactivas carbonílicas que se generan durante las reacciones de peroxidación lipídica exhiben un amplio espectro de efectos moleculares y biológicos, que van desde el daño estructural y funcional a proteínas, ADN y fosfolípidos hasta la activación y/o alteración de las vías de señalización antioxidante.
Los ácidos grasos son moléculas esenciales para la vida, tanto como fuente principal de energía como componentes estructurales y dinámicos de las membranas celulares. Además, desempeñan un papel crucial en el mantenimiento de la función neurológica. El balance de ácidos grasos n-3 y n-6 es importante para la homeostasis y el desarrollo normal del ciclo vital de todos los tejidos, pero especialmente del cerebro. Además, el cerebro es uno de los órganos más enriquecidos en ácidos grasos de cadena larga e insaturados, especialmente con el ácido docosahexaenoico (ADH, 22:6n-3)15,16. Este elevado contenido de AGPI en general, y de ADH en particular, se considera que tiene un papel clave en la fisiología de la membrana neuronal y ha sido determinante en la evolución del sistema nervioso17.
En este escenario, en el presente trabajo se ha procedido a determinar el perfil en ácidos grasos de la sustancia gris de diferentes regiones del SNC de humanos adultos sanos mediante técnicas de cromatografía de gases (CG), evaluándose potenciales diferencias en la susceptibilidad a la peroxidación lipídica, así como posibles mecanismos responsables de las mismas.
Material y métodosMuestras humanasLa selección de casos que se han examinado en el presente trabajo corresponde a una serie consecutiva de donaciones que tenían en común: i) ausencia de síntomas y signos neurológicos; ii) ausencia de déficits funcionales renales o hepáticos; y iii) ausencia de evidencia de estado agónico prolongado. En el momento de la autopsia, uno de los hemisferios cerebrales fue fijado en formalina, mientras que la otra mitad fue cortada en secciones coronales de 1cm de grosor, congelado en hielo seco y almacenado a −80°C hasta el momento de uso.
Para los estudios morfológicos diagnósticos con el objeto de descartar procesos neuropatológicos, los cerebros fueron fijados por inmersión en formol al 4% tamponado durante 2 o 3 semanas. El estudio neuropatológico se llevó a cabo en secciones de las cortezas: frontal (área 8), motora primaria, sensorial primaria, parietal, temporal superior, temporal inferior, cingular anterior, insular anterior, visual primaria y asociativa; corteza entorrinal e hipocampo; caudado, putamen y palido; tálamo medial y posterior; subtálamo; núcleo de Meynert; amígdala; mesencéfalo (2 niveles), protuberancia y bulbo raquídeo; y corteza cerebelar y núcleo dentado. El tejido fue incluido en parafina. Posteriormente, secciones de 5μm de grosor fueron teñidas con hematoxilina y eosina, y con Klüver-Barrera, o procesadas para inmunohistoquímica según el método de estreptavidina LSAB (Dako, Dakopats). Después de la incubación con metanol y suero normal, las secciones fueron incubadas con uno de los anticuerpos (Ac) primarios a 4°C toda la noche. Los Ac utilizados fueron: Ac contra «proteína glial fibrilar acídica» (Dako, dilución 1:250); Ac contra los aminoácidos 1-14 del «beta-amiloide» humano (Boehringer; dilución 1:50); Ac contra «ubicuitina» (Dako; dilución 1:200); el Ac contra «alfa-sinucleína» (Dako, Glostrup, Dinamarca; dilución 1:100); y los Ac policlonales de conejo fosfoespecíficos para Tau Thr181, Ser199, Ser202, Ser214, Ser231, Ser262, Ser396 y Ser422 (todos ellos de Millipore Corporation [Billerica, MA, EE. UU.], y a una dilución 1:100). La reacción peroxidasa se visualizó con diaminobenzidina al 0,05% y peróxido de hidrógeno al 0,01%. Los casos con ausencia de lesiones neuropatológicas (incluyendo las vasculares, hipóxicas, inflamatorias y degenerativas) fueron considerados como controles.
El presente estudio se ha llevado a cabo con individuos adultos sanos (n=7), todos ellos del sexo masculino, y con un promedio de edad de 54,1±1,9 años. En todos los casos el tiempo posmortem fue inferior a 4h. Para el análisis se seleccionó la sustancia gris de las siguientes regiones: corteza frontal, hipocampo, sustancia negra, bulbo raquídeo y médula espinal. Las muestras se obtuvieron del banco de tejidos nerviosos del Instituto de Neuropatología del Hospital de Bellvitge conforme a las normas éticas del Comité de Experimentación Humana de la institución y con la Asociación Médica Mundial y la declaración de Helsinki.
Procesamiento de las muestrasLas muestras (aproximadamente entre 50-150mg) fueron homogeneizadas a 4°C en tampón que preservara de forma especial las muestras evitando su oxidación artefactual. La composición del tampón fue la siguiente: 10mM Hepes; 1μM 2,6-di-terc-butil-4-metilfenol; 1mM ácido dietilenotriaminopentaacético; 1mM ácido fítico; 0,5μg/ml leupeptina; 0,5μg/ml aprotinina; 0,7μg/ml pepstatina; 40μg/ml fluoruro de fenilmetanosulfonio; y 1,1mM ácido etilendiamintetraacético, ajustado a un pH de 7,4. El homogenado fue posteriormente centrifugado a 750×g durante 5min a 4°C para eliminar los restos tisulares. Los homogenados se congelaron inmediatamente a −80°C para su posterior análisis.
Análisis del perfil en ácidos grasosLos ácidos grasos presentes en los lípidos totales de las diferentes áreas seleccionadas fueron analizados como ésteres metílicos mediante CG siguiendo métodos previamente descritos18. Los lípidos totales fueron extraídos con cloroformo: metanol (2:1 v/v) en presencia de un 0,01% de hidroxitolueno butilado. La fase de cloroformo fue separada y evaporada con nitrógeno, procediéndose a la transesterificación de los ácidos grasos del extracto lipídico por incubación con 2,5ml de 5% HCl metanólico durante 90min a 75°C. Los ésteres metílicos de ácidos grasos resultantes fueron extraídos añadiendo 2,5ml de n-pentano y 1ml de una solución de NaCl saturada. La fase de n-pentano fue separada, evaporada en nitrógeno, redisuelta en 50μl de disulfuro de carbono, y utilizando 2μl para el análisis de CG. La separación de los diferentes ésteres metílicos de ácidos grasos se llevó a cabo mediante una columna capilar DB-WAX (30m×0,25mm×0,20μm) en un GC System 7890A equipado con un Series Injector 7683B y un detector FID (Agilent Technologies, Barcelona, España). El puerto de inyección se mantuvo a 220°C y el detector a 250°C; la rampa de temperatura utilizada fue 2min a 100°C, después 10°C/min hasta 200°C, después 5°C/min hasta 240°C, manteniéndose a esta temperatura durante 10min más. La identificación de los ésteres metílicos de ácidos grasos se realizó por comparación con estándares auténticos (Larodan Fine Chemicals, Malmö, Suecia). Los resultados se expresan como mol%.
Cálculos de índicesA partir de la composición en ácidos grasos, se procedió al cálculo de los siguientes índices8,18: ácidos grasos saturados (AGS), AGI, ácidos grasos monoinsaturados (AGMI), AGPI, AGPI de las series n-3 y n-6 (AGPI n-3 y AGPI n-6), y promedio de longitud de cadena (PLC)=[(Σ%TotalC14×14)+(Σ%TotalC16×16)+(Σ%TotalC18×18)+(Σ%TotalC20×20)+(Σ%TotalC22×22)+(Σ%TotalC24×24)]/100. La densidad de dobles enlaces en la membrana se calculó mediante el índice de dobles enlaces (IDE)=[(1×Σmol% monoenoicos)+(2×Σmol% dienoicos)+(3×Σmol% trienoicos)+(4×Σmol% tetraenoicos)+(5×Σmol% pentaenoicos)+(6×Σmol% hexaenoicos)]. La susceptibilidad de la membrana a la peroxidación se calculó mediante el índice de peroxidabilidad (IP)=[(0,025×Σmol% monoenoicos)+(1×Σmol% dienoicos)+(2×Σmol% trienoicos)+(4×Σmol% tetraenoicos)+(6×Σmol% pentaenoicos)+(8×Σmol% hexaenoicos)]. Las diferentes actividades desaturasa fueron estimadas a partir de la ratio producto específico/sustrato9: para Δ5 desaturasa: ratio 20:4n-6/20:3n-6; para Δ6 desaturasa: ratio 22:6n-3/18:3n-3.
EstadísticaTodos los cálculos estadísticos se llevaron a cabo utilizando el programa SPSS (SPSS Inc., Chicago, IL, EE. UU.). Los datos fueron analizados mediante «one way ANOVA» para la comparación intergrupos; y el estadístico DMS para las comparaciones múltiples post-hoc. El nivel mínimo de significación estadística se estableció para p<0,05 en todos los análisis.
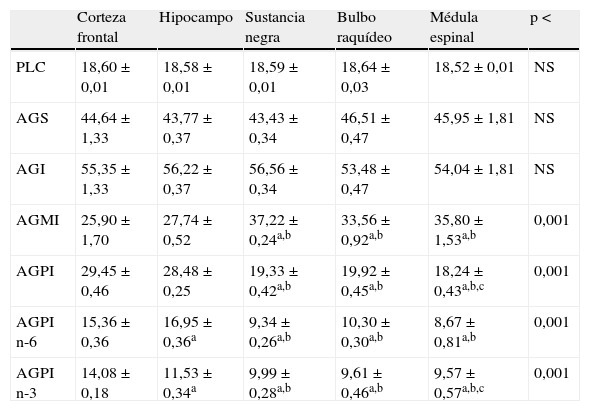
ResultadosLa composición en ácidos grasos de los lípidos extraídos de las diferentes regiones analizadas del SNC constata que sus membranas biológicas mantienen un mismo PLC (18 átomos de carbono), así como una relación también muy similar de AGS y AGI (ratio ∼40:60) (tabla 1). Sin embargo, un análisis más detallado del tipo de AGI pone de manifiesto la existencia de diferencias significativas interregionales (tabla 1). Asumiendo la premisa de que las diferentes regiones analizadas tienen un patrón que sigue el eje cráneo-caudal, se observa que existe un cambio progresivo y contrapuesto en el contenido de AGMI y AGPI. Así, el contenido más elevado en AGMI se da en la médula espinal, siendo este mínimo en la corteza frontal (con un valor un 30% inferior al mostrado por la médula espinal). Por el contrario, el contenido más elevado de AGPI se da en la corteza frontal y muestra su contenido mínimo en la médula espinal, que muestra una reducción del 40%. Estas diferencias en el contenido en AGPI se deben a cambios que afectan tanto a los AGPI de la serie n-3 como los de la serie n-6, ambos en el mismo sentido, aunque la magnitud del cambio es superior para los AGPI n-6 (40%) que para los AGPI n-3 (30%).
Parámetros derivados de la composición en ácidos grasos del sistema nervioso central humano: una aproximación comparada interregional
| Corteza frontal | Hipocampo | Sustancia negra | Bulbo raquídeo | Médula espinal | p< | |
| PLC | 18,60±0,01 | 18,58±0,01 | 18,59±0,01 | 18,64±0,03 | 18,52±0,01 | NS |
| AGS | 44,64±1,33 | 43,77±0,37 | 43,43±0,34 | 46,51±0,47 | 45,95±1,81 | NS |
| AGI | 55,35±1,33 | 56,22±0,37 | 56,56±0,34 | 53,48±0,47 | 54,04±1,81 | NS |
| AGMI | 25,90±1,70 | 27,74±0,52 | 37,22±0,24a,b | 33,56±0,92a,b | 35,80±1,53a,b | 0,001 |
| AGPI | 29,45±0,46 | 28,48±0,25 | 19,33±0,42a,b | 19,92±0,45a,b | 18,24±0,43a,b,c | 0,001 |
| AGPI n-6 | 15,36±0,36 | 16,95±0,36a | 9,34±0,26a,b | 10,30±0,30a,b | 8,67±0,81a,b | 0,001 |
| AGPI n-3 | 14,08±0,18 | 11,53±0,34a | 9,99±0,28a,b | 9,61±0,46a,b | 9,57±0,57a,b,c | 0,001 |
AGI: ácidos grasos insaturados; AGMI: acidos grasos monoinsaturados; AGPI n-6 y n-3: ácidos grasos poliinsaturados de las series n-3 y n-6; AGS: ácidos grasos saturados; PLC: promedio de longitud de cadena; NS: no significativo.
Valores: media±EEM. N×grupo=7.
Las diferencias significativas de las comparaciones múltiples se expresan como: a diferencias respecto a corteza frontal con una significación p<0,001; b diferencias respecto a hipocampo con una significación p<0,001; y c diferencias respecto a bulbo raquídeo con una significación p<0,01.
Estos cambios en los índices globales de composición en ácidos grasos, y en particular en el contenido relativo de los diferentes tipos de AGI, se reflejan de forma significativa en el IDE y el IP (fig. 2). Así, la máxima densidad de dobles enlaces en la membrana se da en la corteza frontal, observándose una gradual disminución de la misma hasta su menor valor a nivel de la médula espinal, lo que representa una reducción del 30%. Análogamente, la susceptibilidad de la membrana a la peroxidación lipídica (IP) muestra su grado más elevado a nivel de la corteza frontal, y disminuye progresivamente hasta la médula espinal donde de nuevo alcanza un valor del 40%.
Diferencias interregionales en el índice de dobles enlaces (IDE, izquierda) e índice de peroxidabilidad (IP, derecha) en el sistema nervioso central humano. Los valores representados son medias±EEM para una n=7. La comparación intergrupos muestra diferencias significativas para ambos índices: p<0,001. Las diferencias significativas de las comparaciones múltiples se expresan como: a, diferencias respecto a corteza frontal con una significación p<0,001; b, diferencias respecto a hipocampo con una significación p<0,001; c, diferencias respecto a sustancia negra con una significación p<0,05; y d, diferencias respecto a bulbo raquídeo con una significación p<0,05.
En términos de ácidos grasos específicos, se observan importantes diferencias significativas interregionales (tabla 2). Entre estos cambios cabría destacar los que experimentan el 18:1n-9, y cuyas variaciones se reflejan en el contenido global de AGMI así como los cambios en los ácidos araquidónico (AA, 20:4n-6) y ADH que, por su peso porcentual, condicionan en gran medida los cambios reflejados en el contenido de AGPI de las series n-6 y n-3, así como en los IDE e IP.
Perfíl en ácidos grasos (mol%) del sistema nervioso central humano: una aproximación comparada interregional
| Corteza frontal | Hipocampo | Sustancia negra | Bulbo raquídeo | Médula espinal | p< | |
| 14:0 | 0,51±0,04 | 0,42±0,05 | 0,54±0,04 | 0,50±0,04 | 0,48±0,05 | NS |
| 16:0 | 21,13±0,51 | 19,54±0,27a,b | 12,68±0,39a,b | 13,57±0,38a,b | 14,75±0,25a,b,c | 0,001 |
| 16:1n-7 | 0,98±0,12 | 0,89±0,10 | 1,68±0,18a,b | 1,21±0,03 | 0,94±0,06c | 0,004 |
| 18:0 | 21,35±1,23 | 21,89±0,20 | 24,61±0,27 | 25,64±0,61 | 22,07±1,72 | NS |
| 18:1n-9 | 23,78±1,51 | 26,12±0,50 | 33,57±0,19a,b | 30,13±0,87a,b | 33,51±1,43a,b | 0,001 |
| 18:2n-6 | 0,77±0,12 | 0,59±0,04 | 0,33±0,06 | 0,56±0,01 | 0,96±0,61 | NS |
| 18:3n-3 | 0,14±0,01 | 0,23±0,02a | 0,17±0,01 | 0,23±0,01 | 0,34±0,05a,b,c,d | 0,002 |
| 20:0 | 1,25±0,23 | 1,44±0,09 | 4,95±0,12a,b | 5,58±0,23a,b | 7,62±0,53a,b,c,d | 0,001 |
| 20:1n-9 | 0,19±0,04 | 0,37±0,01a | 0,22±0,02 | 0,45±0,02a,c | 0,75±0,09ab,c,d | 0,001 |
| 20:2n-6 | 0,23±0,01 | 0,23±0,02 | 0,23±0,03 | 0,31±0,06 | 0,28±0,01 | NS |
| 20:3n-6 | 0,63±0,07 | 0,90±0,10 | 0,61±0,02 | 0,99±0,03 | 0,87±0,16 | NS |
| 20:4n-6 | 8,28±0,19 | 8,05±0,24 | 3,70±0,29a,b | 3,95±0,33a,b | 3,13±0,09a,b,d | 0,001 |
| 22:4n-6 | 4,77±0,14 | 6,24±0,20a | 4,32±0,15b | 4,07±0,08a,b | 3,16±0,17a,b,c,d | 0,001 |
| 22:5n-6 | 0,67±0,09 | 0,92±0,08a | 0,12±0,01a,b | 0,40±0,02a,b | 0,24±0,04a,b | 0,001 |
| 22:5n-3 | 0,26±0,03 | 0,33±0,02 | 0,06±0,01 | 0,09±0,01 | 0,38±0,14c,d | 0,055 |
| 22:6n-3 | 13,68±0,17 | 10,97±0,31a | 9,74±0,28a | 9,28±0,45a,b | 8,84±0,71a,b | 0,001 |
| 24:0 | 0,38±0,06 | 0,45±0,04 | 0,64±0,06a | 1,19±0,22a,b,c | 1,00±0,08a,b,c | 0,001 |
| 24:1n-9 | 0,93±0,23 | 0,33±0,04a | 1,73±0,18a,b | 1,75±0,11a,b | 0,59±0,10c,d | 0,001 |
NS: no significativo.
Valores: media±EEM. N×grupo=7.
Las diferencias significativas de las comparaciones múltiples se expresan como:a diferencias respecto a corteza frontal con una significación p<0,01;b diferencias respecto a hipocampo con una significación p<0,001;c diferencias respecto a sustancia negra con una significación p<0,01;d, diferencias respecto a bulbo raquídeo con una significación p<0,05.
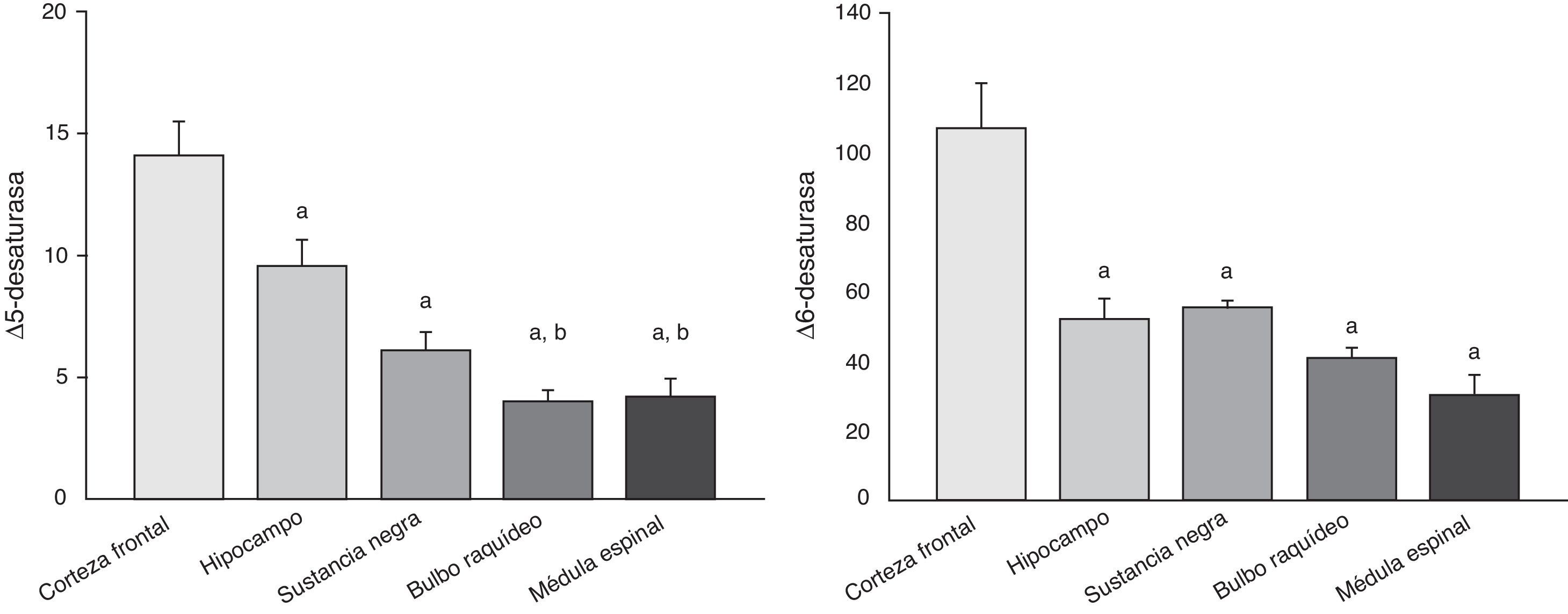
Los mecanismos responsables de inducir y mantener estas diferencias específicas interregionales en los perfiles de ácidos grasos podrían estar relacionados, en principio, con las vías de biosíntesis de ácidos grasos y, en particular, con las actividades elongasa y desaturasa. Dado que no se evidencian diferencias interregionales en el PLC, no cabe esperar, a priori, diferencias relevantes en la actividad elongasa, por lo que hemos centrado nuestro estudio en las activades desaturasa. Así, las estimaciones de las actividades delta-5 y delta-6 desaturasa (fig. 3) muestran diferencias significativas, siendo estas actividades máximas a nivel de corteza frontal y mínimas a nivel de médula espinal, donde presentan una reducción de actividades equivalente a aproximadamente un 70% (tanto para delta-5, como para delta-6) respecto a las actividades presentes en la corteza frontal.
Diferencias interregionales para las estimaciones de las actividades Δ-5 (izquierda) y Δ-6 (derecha) desaturasas en el sistema nervioso central humano. Los valores representados son medias±EEM para una n=7. La comparación intergrupos muestra diferencias significativas para ambos índices: p<0,001. Las diferencias significativas de las comparaciones múltiples se expresan como: a, diferencias respecto a corteza frontal con una significación p<0,001; y b, diferencias respecto a hipocampo con una significación p<0,05.
Todas las células del SNC se encuentran afectadas por el proceso de envejecimiento, como se puede constatar por el declive con el tiempo de las funciones sensoriales, motoras y cognitivas. Además, con la edad aumenta la probabilidad de desarrollar un desorden neurodegenerativo (enfermedad de Alzheimer, o Parkinson, entre muchas otras), manifestándose estas especialmente durante las décadas de los sesenta, setenta y ochenta1. Existe, no obstante, una considerable variabilidad entre individuos en su aparente velocidad de envejecimiento, en los sistemas neuronales más afectados y en cómo sus déficits relacionados con la edad se ven compensados. Pero, ¿por qué en la enfermedad de Alzheimer se afecta el hipocampo, en la de Parkinson la sustancia negra y en la esclerosis lateral amiotrófica la médula espinal? ¿Por qué ciertas poblaciones neuronales se afectan antes que otras? A pesar de los avances recientes en el conocimiento de la biología molecular y la fisiopatología de los desórdenes neurodegenerativos, el problema de la vulnerabilidad neuronal selectiva ha demostrado no estar todavía resuelto.
La idea de que el estrés oxidativo de origen mitocondrial está causalmente relacionado con el proceso básico de envejecimiento disfruta hoy en día de un amplio, aunque no unánime, abanico de evidencias científicas19–21. Además, sus efectos perjudiciales se manifiestan mejor en tejidos posmitóticos, como es el caso del SNC, porque las células se encuentran dañadas irreversiblemente o se pierden y no se pueden reemplazar mediante mitosis de las que están intactas. Como el proceso de envejecimiento constituye un factor de riesgo en muchas enfermedades neurodegenerativas, y las modificaciones oxidativas desempeñan un papel clave en este proceso, se puede postular que estas enfermedades se asocian con un incremento del daño oxidativo3.
Las células del SNC se afectan por y en respuesta a la edad mucho más que las células de los otros órganos sistémicos. Así, las células del cerebro experimentan un incremento del estrés oxidativo (elevada oxidación lipídica, acumulación de proteínas dañadas y lesiones en los ácidos nucleicos), y una alteración en la homeostasis energética3,22. Estos cambios durante el envejecimiento normal se encuentran exacerbados en poblaciones neuronales vulnerables en los desórdenes neurodegenerativos18,23–29. Por tanto, que un individuo desarrolle un desorden neurodegenerativo durante el envejecimiento está determinado tanto por factores genéticos como ambientales, los cuales frenan o facilitan los mecanismos celulares y moleculares del envejecimiento. Las alteraciones moleculares que son cualitativamente similares a las que ocurren en el SNC durante el envejecimiento normal resultan estar amplificadas en las poblaciones neuronales vulnerables por los procesos relacionados con las enfermedades, los cuales dan como resultado su disfunción y muerte. Por ejemplo, durante el envejecimiento normal hay un incremento progresivo de las cantidades de proteínas, lípidos y bases nitrogenadas del ADN oxidadas en cerebro. Las modificaciones específicas de las proteínas durante el envejecimiento incluyen la carbonilación, la nitración y la formación de productos avanzados de lipoxidación. Estas modificaciones de los componentes celulares se encuentran dramáticamente incrementadas en las neuronas vulnerables en la enfermedad de Alzheimer, en la de Parkinson y en la esclerosis lateral amiotrófica, entre otras enfermedades neurodegenerativas18,23–29.
En este contexto, y desde una aproximación de fisiología comparada interregional, emerge una propiedad característica que hace que este tejido sea especialmente sensible a la modificación oxidativa: la insaturación de membrana. Como ya se ha mencionado anteriormente, la susceptibilidad de las membranas biológicas a las alteraciones oxidativas se relaciona con 2 hechos inherentes, las propiedades físico-químicas de la bicapa lipídica y la reactividad química de los ácidos grasos que componen la membrana. Pero, ¿existen diferencias entre regiones en el sistema nervioso? Los resultados del presente estudio muestran que este es el caso. Así, las tablas 1 y 2 muestran la composición en ácidos grasos de 5 regiones diferentes del SNC humano. Los resultados son concluyentes: a pesar de mantenerse un PLC de alrededor de 18 átomos de carbono y una relación de saturados:insaturados prácticamente idéntica (40:60), existe una diferencia entre regiones con respecto a los diferentes tipos de AGI, la cual afecta especialmente a los AGMI y AGPI que parecen estar inversamente relacionados. En otras palabras, cuanto más elevada es la presencia de AGMI para una región dada, menor es el contenido en AGPI. El significado de esta distribución diferencial no está elucidada, pero es evidente que determina una susceptibilidad diferencial al daño oxidativo. Así pues, a partir de las evidencias precedentes podemos deducir que la insaturación de membrana es una característica clave capaz de definir una vulnerabilidad neuronal selectiva.
Esto significa que las cadenas de AGS y AGMI son esencialmente resistentes a la peroxidación mientras que los AGPI son fácilmente oxidables. Además, a mayor grado de insaturación del AGPI, más propenso será a la lesión peroxidativa. De hecho, Holman9 determinó empíricamente las susceptibilidades relativas de las diferentes cadenas de ácidos grasos: el ADH, el AGPI más insaturado con 6 dobles enlaces, es extremadamente susceptible al ataque peroxidativo y es 8 veces más propenso a la peroxidación que el ácido linoleico (AL, 18:2n-6) que tiene solo 2 dobles enlaces. Es más, el ADH es 320 veces más susceptible a la peroxidación que el monoinsaturado ácido oleico (AO, 18:1n-9)8.
Combinando la susceptibilidad relativa de los diferentes ácidos grasos con la composición en ácidos grasos de los lípidos de membrana es posible calcular un IP (una medida de la susceptibilidad a la peroxidación) para una membrana particular. El IP de una membrana no es lo mismo que su índice de insaturación (o bien «IDE») que es una medida de la densidad de dobles enlaces en la membrana. Por ejemplo, una membrana constituida únicamente por AGMI tendría un índice de insaturación de 100 y un IP de 2,5, mientras que una membrana constituida en un 95% por AGS y un 5% de ADH tendría un índice de insaturación de 30 y un IP de 40. Esto significa que a pesar de que la membrana que contiene un 5% de ADH tiene solo un 30% de densidad de dobles enlaces de la membrana monoinsaturada, es, en cambio, 16 veces más susceptible a la lesión peroxidativa. En este contexto, los resultados obtenidos en el presente estudio muestran de forma clara la existencia de diferencias interregionales muy importantes en el IP en el SNC humano, y que estas diferencias se pueden asignar a cambios significativos en el contenido de AGMI y AGPI que, a su vez, se pueden atribuir mayoritariamente a cambios en la composición de 3 ácidos grasos específicos: AO, AA, y ADH.
Así pues, las diferencias interregionales observadas del IP se deben a cambios en el tipo de AGI que participa en la composición de membrana. De hecho, existe una redistribución sistemática entre los tipos de AGPI presentes de ácidos grasos altamente insaturados a otros con un menor grado de insaturación y que es región-específico. Sorprendentemente, los cambios muestran un gradiente que sigue, considerando la organización estructural del SNC en vertebrados, un eje cráneo-caudal y cuyo significado es desconocido. Por otro lado, entre los mecanismos responsables de generar y mantener dichas diferencias en el perfil de ácidos grasos cabe destacar la actividad de las enzimas desaturasa (delta-5 y delta-6) que desempeñan un papel clave en la vía de biosíntesis de AGPI, tanto los de la serie n-6 como los de la n-3. Las estimaciones de dichas actividades desaturasa obtenidas en el presente trabajo permiten atribuir los cambios de composición en ácidos grasos a las diferencias interregionales en las actividades de las mismas. Así, los mecanismos subyacentes a la regulación de la insaturación de membrana podrían explicar las diferencias en composición de ácidos grasos de membrana y, a su vez, el IP; sugiriéndose un mecanismo de regulación región-específico que se expresa de forma diferencial en un eje cráneo-caudal probablemente asociado al proceso de desarrollo e incluso a la evolución del SNC.
En resumen, el grado de insaturación de membrana es una característica clave capaz de definir la vulnerabilidad neuronal selectiva. En este contexto, es plausible postular que la insaturación de membrana podría ser un factor determinante clave en la tasa de envejecimiento para diferentes regiones del SNC, y en la aparición y desarrollo de enfermedades neurodegenerativas (por ejemplo,, enfermedad de Alzheimer, enfermedad de Parkinson, o esclerosis lateral amiotrófica) durante las décadas de los sesenta, setenta y ochenta. Curiosamente, esta propiedad está también causalmente relacionada con el proceso de envejecimiento y la tasa de envejecimiento de las especies animales7,19,20.
FinanciaciónEste estudio ha sido financiado por las subvenciones BFU2009-11879/BFI del Ministerio español de Ciencia e Innovación; RD12/0043/0018 de la Red Temática de Investigación Cooperativa en Envejecimiento y Fragilidad (RETICEF) del Instituto Carlos III, y 2009SGR735 de la Generalitat de Catalunya. El trabajo también fue apoyado por una beca de formación de personal investigador de la Generalitat de Catalunya concedida a Rosanna Cabré.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen las sugerencias de los revisores anónimos que han mejorado el contenido del presente artículo.
Este trabajo ha recibido el premio ‘Salgado Alba’ 2012 al mejor póster del Área Biológica presentado durante el 54° Congreso Nacional de la Sociedad Española de Geriatría y Gerontología, celebrado en Santiago de Compostela del 6 al 8 de junio de 2012.