La sociedad actual favorece un modo de vida con mayor actividad nocturna, disminución de las horas de sueño y, en ocasiones, desplazamientos horarios (tales como jet lag o trabajo a turnos) que generan cronodisrupción (CD), la cual puede conducir a un envejecimiento prematuro. La CD se define como una alteración relevante del orden temporal interno de los ritmos circadianos bioquímicos, fisiológicos y de comportamiento. Estudios epidemiológicos muestran una relación entre la CD y el aumento en la incidencia de síndrome metabólico, enfermedades cardiovasculares, deterioro cognitivo, trastornos afectivos, alteraciones del sueño, algunos tipos de cáncer y envejecimiento acelerado. La CD puede ser el resultado de alteraciones en los distintos componentes del sistema circadiano (marcapasos central y osciladores periféricos, entradas al reloj, principalmente debidas a defectos de la visión, y salidas del marcapasos y osciladores). La exposición a diferentes sincronizadores (luz, actividad física y social, alimentación) de manera regular robustece el funcionamiento del sistema circadiano mediante la cronopotenciación, que puede atenuar la CD asociada al envejecimiento.
Modern life leads to a more active nocturnal lifestyle, reduced sleep hours and sometimes abrupt shifts across time zones (such as jet lag and shift work) that generate chronodisruption (CD) which can result in premature ageing. CD is defined as a significant disturbance of the internal temporal order of biochemical, physiological and behavioural circadian rhythms. Epidemiological studies show that CD induced by shift work, chronic jet lag, social jet lag and excessive exposure of bright light at night is associated with an increased incidence of metabolic syndrome, cardiovascular disease, cognitive and affective impairment, sleep disorders, some cancers and premature ageing. CD may be the result of disturbances in different components of the circadian system (central pacemaker and peripheral oscillators, inputs to central clock, mainly due to visual deficiencies, and output signals from the pacemaker and oscillators). Exposure to different synchronizers (light, meal times, physical and social activities) with a regular pattern results in a chronoenhacement that can prevent age-related CD.
La creciente demanda de servicios, que no se limitan a las horas laborales tradicionales, ha conducido a la denominada «sociedad de las 24 horas». En ella, alrededor del 20% de la población urbana trabaja fuera del horario habitual de 8 a 17h1, determinando que la actividad diaria se desarrolle en las horas de la noche, lo que genera efectos negativos para la salud, así como la aparición de un fenómeno relativamente nuevo, denominado cronodisrupción (CD) que puede conducir a un envejecimiento prematuro.
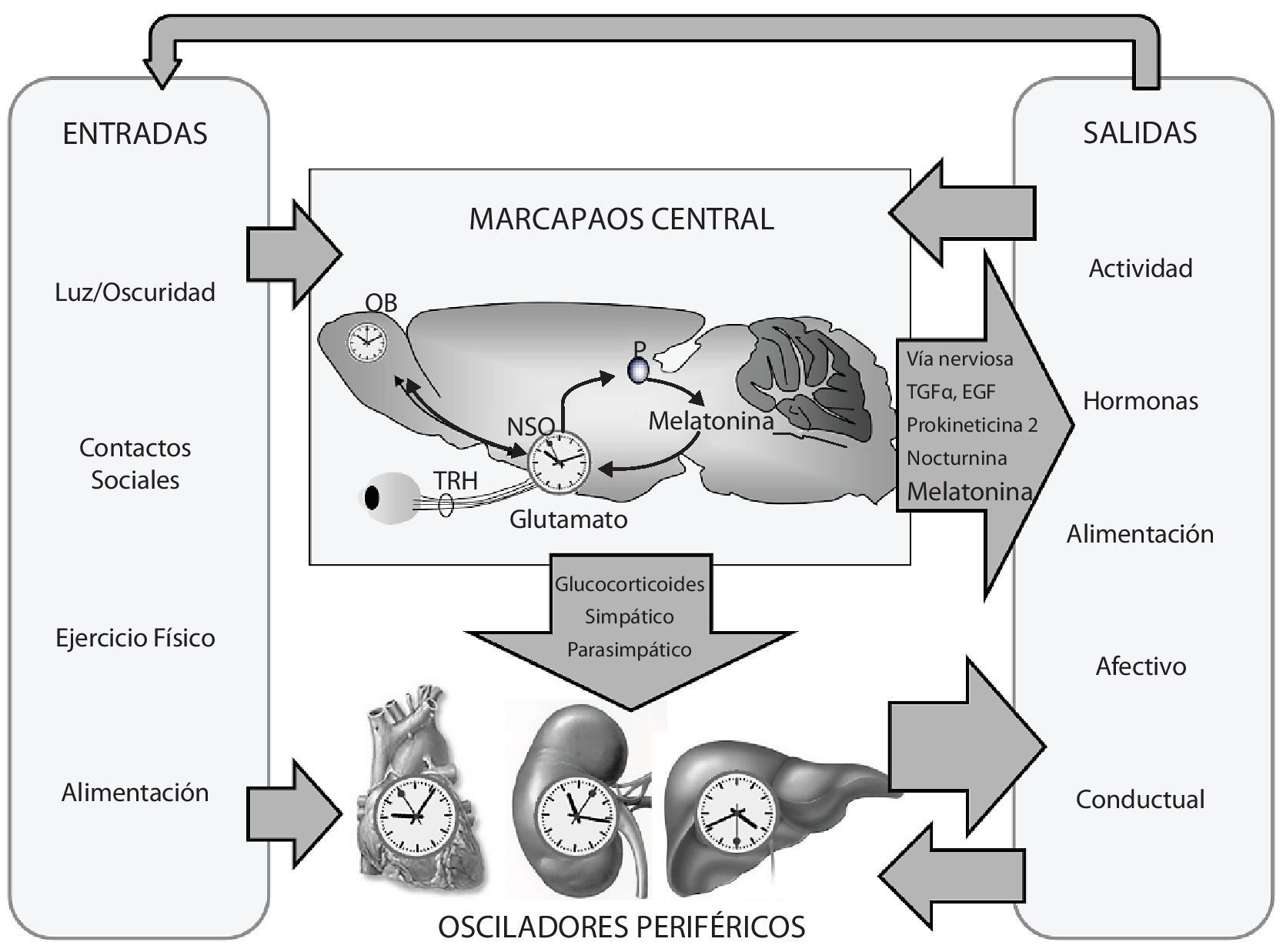
La CD se ha definido como una alteración relevante del funcionamiento del sistema circadiano; es decir, del orden temporal interno de los ritmos circadianos bioquímicos, fisiológicos y de comportamiento. Se considera también como la ruptura de la relación de fase normal entre los ritmos circadianos internos y los ciclos de 24-h del medio ambiente2. El sistema circadiano (fig. 1) está compuesto por un marcapasos central cuya sede se encuentra, en el caso de los mamíferos, en los núcleos supraquiasmáticos (NSQ) del hipotálamo. Este reloj central es un oscilador en sí mismo y posee un periodo endógeno de algo más de 24 horas en humanos. Para poner en hora este marcapasos son necesarias una serie de entradas periódicas de información de entre las cuales el ciclo de luz-oscuridad es la más importante3. Del mismo modo, existen multitud de salidas que informan de la actividad del marcapasos central al resto del organismo. Esta vía de información se lleva a cabo a través de distintos mecanismos nerviosos y humorales entre los que destaca la hormona melatonina4. Entre las salidas de información del marcapasos sobresalen algunos ritmos manifiestos como el ritmo de actividad-reposo, el ritmo en la secreción de distintas hormonas o el ritmo de temperatura corporal, entre otros. El marcapasos central no es el único reloj que posee el organismo puesto que además, subordinados a él, existen multitud de osciladores periféricos. De especial importancia son los osciladores hepático y cardiaco, que a su vez pueden sincronizarse a señales externas, tales como el horario de alimentación o el ejercicio físico, respectivamente. En condiciones normales, estos osciladores están subordinados a la dirección del marcapasos central pero la pérdida de sincronización entre ellos puede conducir a CD5.
Organización del sistema circadiano. Modificado de Garaulet M, et al.2.
En cada una de las células del organismo existe un reloj molecular basado en una serie de bucles de retroalimentación positiva y negativa que dan lugar a ritmos de expresión génica. Éste es un sistema muy complejo que sigue desenmarañándose en la actualidad. Hasta el momento, los genes reloj más estudiados son Per1, Per2, Per3, Cry1, Cry2, Bmal1, RevErbα y Clock6.
La CD puede detectarse a partir de los registros de variables rítmicas controladas por el NSQ (tales como la temperatura corporal, la secreción hormonal, la alternancia actividad-reposo, etc.). Ésta se manifiesta como una reducción de la amplitud de los ritmos, una pérdida total de la ritmicidad, una inestabilidad de fase entre diferentes días, un retraso o un avance de fase extremos, periodos diferentes de 24 horas, o incluso como una inversión de fase de los ritmos circadianos, como se observa en los trabajadores nocturnos.
Actualmente existe una discordancia cada vez mayor entre los hábitos personales y los sincronizadores naturales ambientales tales como el ciclo de luz-oscuridad, pues las personas desarrollan más actividad nocturna como consecuencia de su dedicación al trabajo o su participación en actividades de ocio7,8. Estos cambios se asocian a una disminución paralela en el tiempo dedicado a dormir, que ha pasado de 9 horas a principios del siglo xx a 7 horas cien años más tarde. Se estima que entre el 20-25% de la población trabaja a turnos y la proporción va en aumento. Estudios epidemiológicos muestran una relación estadísticamente significativa entre la CD y el aumento en la incidencia de síndrome metabólico9, enfermedades cardiovasculares2, deterioro cognitivo10, trastornos afectivos11, alteraciones del sueño, algunos tipos de cáncer12 y envejecimiento13.
Parece ser que la exposición a luz brillante en horas nocturnas podría ser en parte responsable de algunas de estas patologías14. La luz brillante, sobre todo la parte azul del espectro, produce un efecto inmediato en el funcionamiento del reloj biológico: la supresión del ritmo de melatonina, que sólo se produce y libera durante la noche15. Esta hormona se sintetiza en la glándula pineal, siendo una de sus funciones la de difundir la señal sincronizadora del reloj biológico (localizado en el NSQ) hacia el resto del organismo16. Además, también posee efectos antioxidantes, oncostáticos e inmunomoduladores17.
Precisamente uno de los efectos indeseados del trabajo a turnos rotatorio, turnos nocturnos, o simplemente de la exposición a luz brillante en el periodo de noche subjetiva (como en el caso de pacientes hospitalizados en unidades de cuidados intensivos) es la pérdida o la alteración del ritmo de melatonina18. De esta manera, aunque no se puede establecer una consecuencia directa, el efecto protector de esta hormona desaparece y se favorece la aparición de ciertos tipos de cáncer y trastornos relacionados con un mayor estrés oxidativo19.
Por todo ello y teniendo en cuenta estos datos previos, en 2007 la Agencia Internacional de Investigación del Cáncer (IARC, OMS) clasificó el «trabajo a turnos que implica trastornos circadianos» como potencialmente cancerígeno.
Efectos de la cronodisrupción en la saludCronodisrupción y cáncerAlgunos estudios muestran que el deterioro de ritmos circadianos de actividad-reposo en modelos de roedores acelera el crecimiento tumoral, mientras que la restauración de la función circadiana normal aumenta los beneficios de la quimioterapia20. Además, varios modelos de ratón demuestran los efectos supresores tumorales de la expresión normal de los genes reloj Per1 y Per2 en la proliferación del cáncer de colon21.
En humanos, lo poco que se sabe confirma los datos preclínicos que relacionan la función circadiana alterada con la progresión tumoral acelerada. Hrushesky22 en 1985 documentó por primera vez la existencia de patrones anormales circadianos en pacientes con cáncer. Sin embargo, han sido los trabajos de Lévi los que más información han aportado en este sentido23–27. Así, este grupo ha mostrado que la existencia de un ritmo circadiano atenuado de cortisol en pacientes con cáncer metastásico de mama es un indicador independiente de su supervivencia28.
El cáncer de colon es uno de los más comunes y letales cánceres humanos en el mundo desarrollado. Los individuos sometidos a situaciones cronodisruptoras, tales como la exposición a luz nocturna brillante y los turnos rotatorios, tienen un 50% más de riesgo de desarrollar cáncer de colon que aquellos que trabajan sólo durante el día29.
Del mismo modo, existen estudios epidemiológicos que relacionan el jet lag crónico en tripulaciones de vuelos transmeridianos con el mayor riesgo de aparición (entre un 40 y un 70% más) de cáncer de mama en mujeres y próstata en hombres30,31.
Cronodisrupción y metabolismoEl horario de alimentación se considera uno de los sincronizadores más importantes para poner en hora los osciladores periféricos, por lo que los horarios inusuales de comidas pueden contribuir a la aparición de CD32. El síndrome del comedor nocturno representa un ejemplo de CD forzada por el desplazamiento de gran parte de la ingesta calórica hacia horas intempestivas. Típicamente estas personas muestran anorexia durante la mañana e hiperfagia e insomnio durante la noche33.
Además, muchos estudios epidemiológicos muestran que la CD inducida por trabajo a turnos, la privación de sueño o el retraso del horario de comidas hacia horas nocturnas, está asociada con un alto riesgo de desarrollo de obesidad y varias características del síndrome metabólico (como son la hipertensión, la tolerancia disminuida a la glucosa, la resistencia a insulina, y la dislipidemia aterogénica)9.
Cronodisrupción y envejecimiento prematuroAl igual que otros procesos fisiológicos, el funcionamiento del reloj circadiano cambia con la edad: se reduce la amplitud de los ritmos, aumenta su fragmentación, se acorta el periodo, y aumenta la tendencia a la desincronización. Estos cambios son probablemente debidos a alteraciones en la organización y actividad del NSQ34, pero también al deterioro en la calidad de las entradas sincronizadoras. En el NSQ de roedores se altera la expresión de los genes reloj Clock y Bmal1, pero no la de Per1 y Per235–37. Es probable que el acortamiento de los telómeros, la actividad reducida del factor de transcripción CREB y los cambios en cascada en la ruta MAP quinasas, que acompañan a la senescencia celular, sean responsables de la expresión atenuada de los genes circadianos38. La alteración de la expresión/actividad BMAL1 y PERs, contribuyen, a su vez, al desarrollo de patologías relacionadas con la edad39.
En el estudio de la conexión funcional entre la perturbación de los ritmos circadianos y el envejecimiento en los mamíferos se han utilizado manipulaciones de los ciclos de luz/oscuridad y la ablación quirúrgica del NSQ. Por ejemplo, desplazamientos semanales de 12 horas en el ciclo de luz-oscuridad reducen significativamente la esperanza de vida media de hamsters aquejados de miocardiopatía, lo que sugiere que la alteración de los ritmos circadianos podría incrementar aún más el desarrollo de afecciones previas40 y la disrupción no invasiva de la ritmicidad circadiana en el hámster dorado disminuyó la longevidad41.
La información acerca de los mecanismos celulares subyacentes en relación con el envejecimiento y los efectos adversos de la CD es muy escasa. Sin embargo, el reciente reconocimiento de que las alteraciones metabólicas (diabetes, resistencia a la insulina, síndrome metabólico) están asociados a la CD9, junto con la relación conocida entre varias rutas relacionadas con el metabolismo intracelular (PI3K/Akt/mTOR, la AMPK, etc.) y el envejecimiento42,43 sugieren claramente la posibilidad de que la CD actúe a través de la modificación de estos sistemas de señalización. Dado que la acumulación de daño oxidativo es una característica del envejecimiento relacionado con la CD39, la mitocondria es un candidato obvio como objetivo para un posible tratamiento, ya que es la principal fuente de especies reactivas de oxígeno y el orgánulo central del metabolismo44. El envejecimiento se asocia a una acumulación de daño mitocondrial, debido en parte a una disminución progresiva de la autofagia en mitocondrias alteradas (mitofagia). Curiosamente, algunas proteínas clave en el control de la autofagia son parte de vías sensibles a nutrientes, tales como SIRT1, Akt, mTOR o PGC1α42.
Alteraciones que pueden producir cronodisrupciónLa CD puede producirse como consecuencia de alteraciones en uno o varios de los tres niveles de organización del sistema circadiano descritos anteriormente:
Alteración de las entradas al relojEste hecho suele ocurrir por la debilidad de los zeitgebers o sincronizadores, asociada por ejemplo, a la escasa exposición a la luz ambiental, a la exposición a ciclos de luz-oscuridad anómalos (luz nocturna, trabajo a turnos, etc.), o a alteraciones en la función visual. Se ha demostrado que la exposición a luz brillante durante la noche produce una serie de efectos negativos sobre el sistema circadiano, conduciendo finalmente a CD14. Así, la luz nocturna, por ejemplo, supone una reducción en el nivel de secreción de melatonina, hormona encargada de la regulación de distintos procesos fisiológicos, principalmente, del ritmo sueño-vigilia16. Por otro lado, la prolongación del período de actividad durante la noche supone una reducción del tiempo destinado al sueño, hecho que a su vez también contribuye a la disrupción del sistema circadiano45.
Pero en el nivel de entradas también hemos de tratar el problema contrario: el de aquellas personas que no reciben información de la luz a causa de alteraciones visuales. La eficacia de la luz como sincronizador depende de la claridad óptica del ojo (córnea, cristalino, humor acuoso y vítreo) y la integridad neuronal de las vías visuales (retina, nervio óptico y corteza visual). La alteración funcional de estas estructuras conlleva pérdida de visión y alteración en los ritmos circadianos. En el año 2002, David M. Berson46 descubrió una función hasta entonces desconocida de un subgrupo de células ganglionares de la retina (CGR) que contenían melanopsina como fotopigmento y que estaban directamente conectadas con el NSQ. Estas CGR presentan una máxima sensibilidad a la luz azul (464-484nm) y son las que más influyen en la sincronización del sistema circadiano47.
Este hallazgo tiene importantes consecuencias aplicadas, por ejemplo, en relación con las personas ciegas. Estas pueden agruparse en dos categorías, de acuerdo con su fotorrecepción circadiana:
- A)
Personas invidentes con una patología visual incompatible con la fotorrecepción circadiana: lesión en el nervio óptico, enucleación, o degeneración retiniana que afecte, además de conos y bastones, a las CGR con melanopsina. En este caso un posible tratamiento para la CD que probablemente sufrirán estos pacientes sería el tratamiento con melatonina exógena48.
- B)
Personas sin visión consciente, pero con una afección visual compatible con la fotorrecepción circadiana: conservan la integridad de las vías nerviosas, y se mantienen las CGR con melanopsina, responsables de esta visión circadiana. Muchas personas con este tipo de patología tienden a no exponerse a la luz durante el día debido a que no lo consideran necesario por carecer de visión consciente. Sin embargo, estas personas serían susceptibles de recibir un tratamiento no farmacológico para la mejora de sus ritmos circadianos, simplemente exponiéndose a la luz brillante durante el día.
Con la edad se produce una disminución de la funcionalidad del NSQ, demostrada mediante determinaciones del volumen, del número de neuronas que expresan arginina vasopresina y alteraciones en la expresión de varios genes clave en la maquinaria del reloj molecular circadiano, entre los que se incluyen Clock, Bmal137, Per1, Per2, Cry1 y Cry249. Además, el número y la densidad de neuronas que expresan el receptor de melatonina MT1 en el NSQ disminuyen en sujetos ancianos comparados con controles jóvenes50. En animales, se han llevado a cabo ensayos de lesión del NSQ, conduciendo estas lesiones a la pérdida de los ritmos circadianos en el animal. Estos efectos revierten cuando se trasplanta el NSQ de un animal joven a un animal viejo. Este último adquiere entonces los ritmos propios de un animal joven51. Así, está totalmente establecido que el daño o deterioro del NSQ se traduce directamente en una disrupción de los ritmos endógenos generados por él.
Defectos en las salidas del relojLa producción nocturna de melatonina por parte de la glándula pineal, una de las principales vías de comunicación química del NSQ con el resto del organismo, disminuye drásticamente con la edad, constituyendo un buen marcador de envejecimiento del sistema circadiano52. Los hábitos nocturnos y la consiguiente exposición a luz durante la noche también disminuyen los niveles de melatonina, debido a la inhibición de su secreción por parte de ésta53.
El ritmo de actividad-reposo, otra salida del reloj, está estrechamente relacionado con la aparición de CD, como se observa en los modelos animales de trabajo a turnos. En humanos, se ha visto que con el envejecimiento, ligado a la aparición de CD (y viceversa), el ritmo de actividad-reposo comienza a fragmentarse y a atenuarse3,54.
Algunas de las salidas del reloj (sueño-vigilia, actividad física, horarios de alimentación) pueden ser modificadas voluntariamente en humanos, pasando a actuar también como entradas al reloj. Por ello, la mera modificación de los hábitos de vida puede tener un efecto en el funcionamiento del reloj central y del sistema circadiano en general.
Modelos animales empleados para el estudio de la CDEl estudio de la CD y los mecanismos que subyacen a ella se ha llevado a cabo principalmente utilizando modelos animales. Es fácil simular en laboratorio situaciones que induzcan desórdenes circadianos como el jet lag, trastorno que causa cambios hormonales, fisiológicos y comportamentales en el hombre como consecuencia de viajar en avión a través de distintos usos horarios55. Este trastorno es de especial interés debido a la rápida desincronización y a la necesidad de encarrilar posteriormente al nuevo ciclo luz-oscuridad, lo que puede requerir de 5 a 10 días56. En el laboratorio podemos simular este proceso produciendo cambios agudos o crónicos en el ciclo de luz-oscuridad al que están sometidos los animales.
También se han desarrollado modelos animales en los que se simula el trabajo a turnos sometiendo al animal a continuos cambios de fase en el ciclo luz-oscuridad. Además, recientemente se han diseñado dispositivos que permiten forzar al animal a ≪trabajar≫ durante su fase de reposo, alojándolo en una rueda que gira de manera automática, obligándolo así a caminar sobre ella durante esta fase57.
Otros modelos incluyen otras variables, como los que implican la manipulación del horario de alimentación58. Mediante ellos se ha podido establecer la existencia de un oscilador encarrilado por el horario de comidas, que puede ser independiente del NSQ cuando el horario de alimentación propio de la especie estudiada no coincide con su fotoperiodo. Además, este tipo de modelo ha permitido demostrar la relación existente entre determinados desórdenes metabólicos (obesidad, síndrome metabólico, etc.) y la CD, ya que cuando los animales son alimentados durante su fase de reposo, tienden a ganar más peso que cuando su horario de alimentación coincide con su fase de actividad59.
También se han desarrollado modelos de CD a partir de dietas con distinto contenido calórico. Por ejemplo, sometiendo a los animales en condiciones ambientales constantes, por un lado, a una dieta alta en grasas y por otro lado, a una dieta baja en grasas, se comprobó que el primer grupo desarrollaba cambios en sus ritmos circadianos: extensión del periodo, reducción de la amplitud del ritmo de alimentación, y alteraciones en la expresión de genes reloj60.
Por otro lado, los animales modificados genéticamente van cobrando importancia en investigación en cronobiología. Así, se han desarrollado cepas con los distintos genes reloj (Clock, Bmal1, Per1, Per2, Cry1, Cry2) mutados o delecionados. En todos los casos se han encontrado alteraciones fisiológicas asociadas a la CD que provoca la falta de función de estos genes61. Entre ellas cabe destacar el modelo de envejecimiento acelerado que se consigue mediante el silenciamiento del gen Bmal1 o la inducción de obesidad en ratones con el gen Clock inactivado.
CronopotenciaciónExisten formas de evitar en la medida de lo posible esta CD, y puesto que reparar directamente la maquinaria del reloj es complicado y hoy día no disponemos de herramientas terapéuticas eficaces, nos centraremos en la actuación sobre los sincronizadores de los ritmos y sobre las salidas del reloj:
Exposición a la luz brillante durante el día y a la oscuridad durante la nocheComo se ha dicho anteriormente, el ciclo luz-oscuridad es el principal sincronizador del sistema circadiano. Así, numerosos estudios han mostrado que la exposición a luz brillante durante el día puede mejorar sustancialmente la situación en distintas patologías en las que se ve afectado el sistema circadiano54. Por ejemplo, pacientes afectados por depresión estacional62–64 o enfermedad de Alzheimer65–67 mejoran tras una semana de exposición a la luz diurna (2.500 lux–2 horas; 10.000 lux–30 minutos). Además, la exposición a luz brillante diurna también produce una mejora en la secreción nocturna de melatonina en ancianos insomnes68 y en ancianos sanos69. En las regiones templadas cercanas a los trópicos, como ocurre a orillas del Mediterráneo, basta con salir a la calle para conseguir los beneficios sincronizadores de la luz, pero en otras zonas, o debido a dificultades de movilidad de los individuos, la exposición a la luz se compromete. Para estos casos, existen pantallas de luz brillante de unos 10.000 lux que mimetizan los efectos de la luz natural (luminoterapia)70.
Sin embargo, debemos evitar en lo posible la exposición a luz brillante durante la noche, ya que, como se ha señalado anteriormente, ésta tiene efectos indeseables sobre el sistema circadiano, contribuyendo a la aparición de CD45. En aquellos casos en los que sea imprescindible la iluminación nocturna, esta debe ser pobre en el espectro azul y enriquecida en tonos cálidos.
Ejercicio físico regular y moderadoEl ejercicio físico, realizado de manera regular, actúa como sincronizador del sistema circadiano y potencia la robustez de los ritmos manifiestos71,72. A sus efectos generales sobre la mejora del estado de ánimo y metabolismo habría que añadir su capacidad para reducir la latencia y mejorar la profundidad del sueño. Además, si este ejercicio se realiza en exteriores y en compañía, su capacidad sincronizadora se potencia al combinarse con otros sincronizadores como son la luz brillante y los contactos sociales.
Horario regular de comidasLa hora de alimentación es un potente sincronizador, sobre todo para los osciladores periféricos, como el hígado y tejido adiposo. Así, comer todos los días a las mismas horas posee importantes efectos sincronizadores73.
Contactos socialesSon también un potente sincronizador del sistema circadiano. Estos contactos se hacen más esporádicos tras la jubilación y pierden su carácter periódico; por ello, la búsqueda de actividades organizadas que supongan la realización de contactos con otras personas puede ser un buen modo de conseguirlos74.
Consumo de melatoninaPor último, en algunos países, se ha extendido el consumo de melatonina. Aunque su papel sincronizador de los ritmos no se pone en duda75,76, sus efectos son muy dependientes de la hora en la que se administra, y en algunos casos su uso puede estar contraindicado, por lo que no es recomendable hacer uso de esta hormona sin la correspondiente supervisión médica77,78.
ConclusionesPor todo lo indicado, llevar un estilo de vida regular en cuanto a ritmos de actividad-reposo, exposición a la luz durante el día, horario de comidas y contactos sociales, unido a una alimentación equilibrada, y a una calidad de sueño aceptable es fundamental para evitar el desarrollo de CD y consecuentemente poder tener un envejecimiento más saludable.
FinanciaciónEste trabajo ha sido financiado por: Instituto de Salud Carlos III (RETICEF, D06/0013/0019, RD06/0013/0003, Ministerio de Educación y Ciencia (BFU2010-21945-C02-01), y la Fundación Séneca (12005/PI/09). Becas MEC AP2008-2850 y AP2009-1051.
A J.A. Madrid por las sugerencias y revisión final del manuscrito.